Исследование влияния антимикробных соединений пряностей на молочнокислый процесс
Автор: Закрепина Е.Н., Носкова В.И.
Журнал: Молочнохозяйственный вестник @vestnik-molochnoe
Рубрика: Технические науки
Статья в выпуске: 3 (59), 2025 года.
Бесплатный доступ
В статье приводятся результаты исследования динамики молочнокислого процесса при культивировании консорциума микроорганизмов йогуртовой закваски в присутствии экстрактов пряностей. Пряности в натуральном виде и их экстракты применяются в технологии молочных продуктов в качестве пищевых консервантов и пищевкусовых компонентов. Антимикробные свойства пряностей по отношению к условно-патогенным и патогенным микроорганизмам изучены, поэтому актуальным является изучение влияния антимикробных свойств пряностей на метаболические процессы различных видов молочнокислых микроорганизмов с целью выявления возможного торможения молочнокислого процесса. Для оценки активности обменных процессов у микроорганизмов в процессе ферментации образцов определяли электрохимические показатели.
Антимикробные свойства, пряности, фитохимические соединения, активная кислотность, титруемая кислотность, удельная электропроводность
Короткий адрес: https://sciup.org/149149264
IDR: 149149264 | УДК: 637.14.32 | DOI: 10.52231/2225-4269_2025_3_113
Текст научной статьи Исследование влияния антимикробных соединений пряностей на молочнокислый процесс
В технологии производства кисломолочных продуктов производные растительного сырья используются в качестве источников фитохимических веществ. Данные соединения проявляют антимикробные и антиокислительные свойства, а также придают молочным продуктам определенные органолептические свойства, поэтому применяются в пищевых технологиях в качестве натуральных консервантов и пищевкусовых компонентов [1].
Продукты переработки ароматического растительного сырья классифицируют как пряности, ароматические семена и травянистые растения [1, 2]. Пряности в натуральном виде и их экстракты чаще применяются в технологии молочных продуктов жидкой и пастообразной консистенции, например кисломолочных и сывороточных напитков. При производстве структурированных молочных продуктов, таких как творожные, плавленые и сычужные сыры используют в основном ароматические семена.
К пряностям относят душистый, черный, белый и стручковый перец, кассию, корицу, гвоздику, имбирь, мускатные цвет и орех, куркуму [3].
На качественный и количественный состав биологически активных веществ в растении значительное влияние оказывают его генетическое происхождениеиусловияпроизрастания,крометого,немаловажнуюроль имеют способы извлечения этих веществ из растительного сырья. Так, нативные экстракты, не подвергшиеся термообработке и воздействию процессов разделения и очистки, имеют более высокую биологическую активность за счет действия всего комплекса физиологически активных веществ растения [3, 4].
Антимикробная активность соединений из растительного сырья зависит в основном от способа получения пряностей (экстракция, сушка) и вида микроорганизмов. Соединениями, способными ингибировать микрофлору, являются терпены, алкалоиды, полифенольные соединения, а также флавоноиды, кумарины, фенольные кислоты, дубильные вещества [4, 5].
Антимикробные молекулы растений делятся на несколько классов в зависимости от их химической структуры и свойств: эфирные масла, фенольные соединения, алкалоиды, сапонины и пептиды [6]. Основные фитохимические антимикробные соединения пряностей представлены в таблице 1.
Таблица 1 – Основные фитохимические антимикробные соединения изучаемых пряностей [3–8]
|
Наименование пряности |
Основные фитохимические антимикробные соединения |
|
Куркума ( Curcuma longa ) |
Куркумен, куркуминоиды, фарнезен, фарнезол |
|
Имбирь обыкнове́нный ( Zīngiber officināle ) |
Куркумен, куркуминоиды, фарнезен, фарнезол, гингерол, шогаол |
|
Паприка ( Capsicumannuum ) |
Капсаицин, стероидные сапонины |
|
Гвоздика ( Syzygium aromaticum ) |
Эвгенол, галловая кислота, кариофиллен |
|
Корица ( Cinnamomum verum ) |
Полифенол, кумарин, эвгенол |
|
Бадьян ( Illicium verum) |
Анетол, кверцетин, кемпферол, рутин |
|
Кардамон ( Elettaria cardamomum ) |
Терпинеол и терпинилацетат лимонен, ментон, β-фелландрен, мирцен, сабинен |
|
Перец душистый ( Pimenta officinalis L. ) . |
Эвгенол, 1,8-цинеол, пинены, пара-цимен, лимонен, сесквитерпены и их производные |
|
Перец черный (Piper nigrum L. ) |
Терпены, α- и β-пинен, мирцен, α-фелландрен, лимонен, линалоол |
Флавоноиды синтезируются растениями в ответ на микробную инфекцию. По данным [9], такие флавоноиды, как апигенин, галангин, флавоновые и флавонолгликозиды, изофлавоны, флаваноны и халконы, обладают достаточно выраженной антибактериальной активностью по отношению к условно-патогенным микроорганизмам.
Количество антимикробных соединений может варьироваться в достаточно широком диапазоне. Среднее содержание фенолов (галловой кислоты) и общее содержание флавоноидов (катехина) на 100 г сырья для основных видов пряностей представлено в таблице 2 [1].
Таблица 2 – Содержание основных фитохимических соединений некоторых пряностей [1, 7]
|
Наименование пряности |
Содержание фитохимических соединений, мг/100г сырья фенолов (галловой флавоноидов кислоты) (катехина) |
|
|
Перец черный (Piper nigrum L. ) |
от 11,9 до 654 |
109 |
|
Гвоздика ( Syzygium aromaticum ) |
974 |
321 |
|
Бадьян ( Illicium verum) лат. |
819 |
277 |
|
Перец розовый ( Schinus molle L. ) |
932 |
108 |
В биотехнологии кисломолочных напитков для ферментирования молочных смесей традиционно применяются молочнокислые микроорганизмы, скорость развития которых и накопление молочной кислоты являются основными показателями, характеризующими молочнокислый процесс [10]. Биозащитный потенциал лактобактерий определяется скоростью их развития и продуцированием различных метаболитов [11], таких как молочная кислота, перекись водорода, супероксидиддисмутаза, бактериоцины и др. Данные метаболиты подавляют развитие посторонней микрофлоры, тем самым обеспечивая биозащиту готовой продукции [11]. Поэтому при разработке технологий производства кисломолочных продуктов необходимо создавать условия для наиболее активного протекания молочнокислого процесса.
Микроорганизмы образуют сложные биоценозы, при которых каждый из них находится в отношении стимулирования или угнетения со стороны других [12]. Так как антимикробные свойства пряностей по отношению к условно-патогенным и патогенным микроорганизмам достаточно изучены и доказаны [13], то актуальным является изучение влияния антимикробных свойств пряностей, применяемых при производстве молочных продуктов, на метаболические процессы различных видов молочнокислых микроорганизмов с целью выявления возможного торможения молочнокислого процесса [14].
Актуальность исследований. Изучение влияния антимикробных свойств экстрактов пряностей на консорциум микроорганизмов закваски при культивировании их в молочных средах как основы для производства кисломолочных напитков является актуальным направлением в биотехнологии.
Цель исследования – изучение антимикробных свойств пряностей, применяемых в технологиях производства молочных продуктов по отношению к заквасочной микрофлоре.
Практическая значимость состоит в возможности использовать результаты исследований при разработке технологии кисломолочных напитков с применением производных растительного сырья как источников фитохимических соединений в качестве натуральных консервантов.
Методика и методы исследования
Опыты проводили с водно-этанольными экстрактами пряностей, приготовленных из воздушно-сухого растительного сырья. Экстракцию осуществляли 70%-ным этиловым спиртом при соотношении сырья и экстрагента 1:5 настаиванием в течение 3 суток при комнатной температуре [15]. Применяли экстракты корицы, паприки и смеси пряностей для напитков. В состав смеси пряностей входят: имбирь, корица, бадьян, кардамон, перец душистый, гвоздика, перец черный. Выбор концентраций экстрактов пряностей для эксперимента обусловлен данными рецептур пищевых продуктов.
В стерильное обезжиренное молоко вносили производственную закваску для йогурта в количестве 2%. Рекомендуемая доза внесения производственной закваски составляет 3–5% [16, 17]. Количество закваски снижено в экспериментальных целях для изучения динамики молочнокислого процесса в присутствии пряностей с целью увеличения времени сквашивания. В качестве стартовых культур использовали бактериальный концентрат БК-Углич-СТБ производства «Экспериментальной биофабрики ВНИИМС», состоящий из Streptococcus thermophilus (вязкий) (StST) и Lactobacillus delbrueckii subsp. bulgari-cus (LbDB) в соотношении Тс:Пб=4:1 [18].
Далее в заквашенные образцы вносили экстракты пряностей по 0,5 мл и термостатировали при температуре 40±2 °С, оптимальной для развития йогуртовой закваски. В качестве контрольного использовали образец без внесения экстрактов пряностей.
Характер и скорость молочнокислого процесса изучали по изменению электрохимических показателей среды при культивировании молочнокислых микроорганизмов [18]. Определяли показатели, характеризующие интенсивность протекания молочнокислого процесса: активную кислотность (рН, ед.) по ГОСТ 32892-2014, титруемую кислотность (К, °Т) по ГОСТ Р 54669-2011, удельную электропроводность (УЭП, мСм/с) – кондуктометром-солемером «Эксперт-002-7» через равные промежутки времени до достижения титруемой кислотности 60 °Т (энергию кислотообразования, Эк, час), а затем измеряли эти же показатели до достижения требуемого значения титруемой кислотности для йогурта (75–80) °Т и предельной кислотности сквашенных сгустков.
Повторность опытов трехкратная. Для обработки экспериментальных данных применяли методы вариационной статистики «MicrosoftExcel».
Результаты исследований
К молочнокислым бактериям относят группу микроорганизмов, способных трансформировать углеводы до молочной кислоты как конечного продукта метаболизма, поэтому данный показатель является важным диагностическим признаком [16, 17].
Исследуемый консорциум микроорганизмов состоит из термофильного стрептококка и болгарской палочки. Streptococcus thermophilus – это отдельный вид стрептококков, способных в отличие от лактококков расти при повышенных температурах – 45°C. К основным биохимическим свойствам термофильного стрептококка относятся:
– способность сбраживать ограниченное количество углеводов (лактозу, фруктозу, сахарозу и глюкозу);
– не гидролизует аргинин;
– не ферментирует галактозу во время метаболизма лактозы;
– низкая протеолитическая активностью (является ауксотрофным по отношению к глутамину , цистеину, метионину и гистидину) [19].
Продуктыжизнедеятельности Streptococcus thermophilus оказывают позитивное воздействие на организм человека благодаря биосинтезу короткоцепочечных жирных кислот, конъюгированной линолевой кислоты, конъюгированной линоленовой кислоты; экзополисахаридов; γ-аминомасляной кислоты и других соединений [19].
При ферментации молока болгарской палочкой образуются внеклеточные полимеры-полисахариды, являющиеся углевод-белковыми комплексами, в состав углеводной части которых входят глюкоза, галактоза, рамноза, белковой части – ряд аминокислот, обеспечивающих вязкость и предотвращающих синерезис сквашенного продукта. Многим видам лактобацилл для развития необходимы витамины, например, для роста Lactobacillus bulgaricus требуется никотиновая кислота (В5), пантотенат (В3) и рибофлавин (В2) [20].
В таблицах 3, 4 и на рисунке 1 приведены электрохимические характеристики контрольного и модельных образцов, характеризующие интенсивность протекания молочнокислого процесса.
Таблица 3 – Результаты исследования электрохимических характеристик для контрольного образца и модельного образца с экстрактом корицы
|
Экспозиция, час |
Активная кислотность, ед. рН |
Удельная электропроводность, мСм/с |
||
|
Контроль |
Корица |
Контроль |
Корица |
|
|
Фон |
6,48±0,1 |
6,51±0,1 |
4,57±0,1 |
4,56±0,1 |
|
1 |
6,38±0,1 |
6,42±0,1 |
4,96±0,1 |
4,94±0,1 |
|
2 |
5,93±0,1 |
5,94±0,1 |
5,70±0,1 |
5,88±0,1 |
|
3 |
5,65±0,1 |
5,64±0,1 |
6,34±0,1 |
6,45±0,1 |
|
4 |
5,24±0,1 |
5,27±0,1 |
6,96±0,1 |
6,98±0,1 |
|
5 |
4,92±0,1 |
4,98±0,1 |
7,54±0,1 |
7,65±0,1 |
|
6 |
4,43±0,1 |
4,57±0,1 |
7,57±0,1 |
7,74±0,1 |
|
7 |
4,09±0,1 |
4,10±0,1 |
7,58±0,1 |
7,73±0,1 |
|
8 |
3,98±0,1 |
3,97±0,1 |
7,60±0,1 |
7,78±0,1 |
Таблица 4 – Результаты исследования электрохимических характеристик для модельных образцов с экстрактом паприки и экстрактом смеси пряностей
Активная кислотность, Удельная
Экспозиция, ед. рН электропроводность, мСм/с час Паприка Смесь Паприка Смесь
|
Фон |
6,47±0,1 |
6,45±0,1 |
4,58±0,1 |
4,61±0,1 |
|
1 |
6,35±0,1 |
6,31±0,1 |
4,98±0,1 |
4,97±0,1 |
|
2 |
5,92±0,1 |
5,92±0,1 |
5,90±0,1 |
5,83±0,1 |
|
3 |
5,65±0,1 |
5,66±0,1 |
6,50±0,1 |
6,41±0,1 |
|
4 |
5,36±0,1 |
5,30±0,1 |
7,04±0,1 |
7,00±0,1 |
|
5 |
4,89±0,1 |
4,93±0,1 |
7,58±0,1 |
7,64±0,1 |
|
6 |
4,44±0,1 |
4,57±0,1 |
7,61±0,1 |
7,70±0,1 |
|
7 |
4,05±0,1 |
4,10±0,1 |
7,74±0,1 |
7,74±0,1 |
|
8 |
3,99±0,1 |
3,91±0,1 |
7,80±0,1 |
7,84±0,1 |
Основными характеристиками молочнокислых микроорганизмов, применяемых в молочной отрасли, являются предельная кислотность, энергия кислотообразования и органолептические свойства сгустка [21, 22].
Как видно из данных (рисунок 1), динамика показателей у всех модельных образцов соотносится с контролем. Исследование динамики титруемой кислотности показало, что требуемое значение данного параметра (80 °Т) было достигнуто во всех образцах через 6 ч сквашивания. Несколько интенсивнее по сравнению с контро- лем молочнокислый процесс развивался в образцах с внесением экстрактов паприки и смеси пряностей – 85 °Т. Таким образом, β-галактозидазная активность консорциума заквасочных микроорганизмов не подавляется при внесении экстрактов изучаемых видов пряностей.
Значения предельной кислотности (см. рисунок ) для образцов составили: 120 °Т - контрольный образец, 122 °Т - модельный образец с экстрактом корицы, 123 °Т - модельный образец с экстрактом паприки и 125 °Т - модельный образец с экстрактом смеси пряностей для напитков, что соотносится со значением предельной кислотности для йогурта по литературным данным, которое должно находиться в
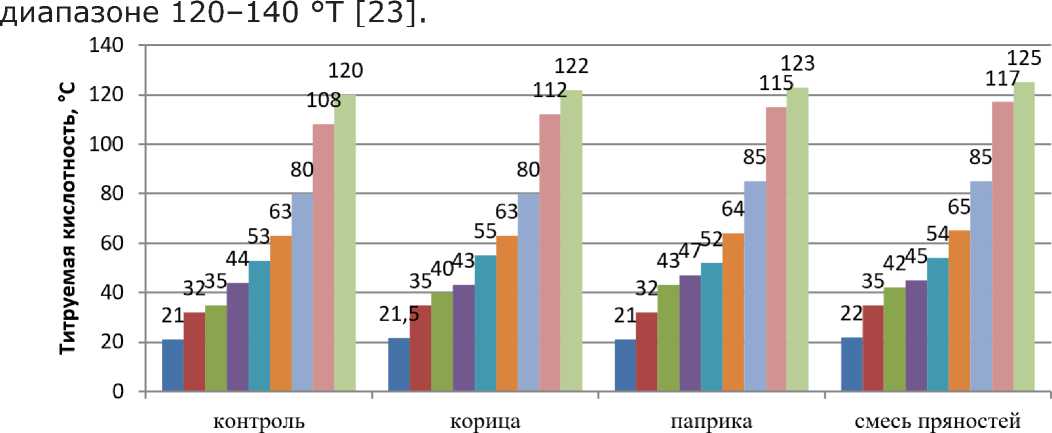
■ 0 час ■ 1 час ■ 2 час ■ 3 час ■ 4 час ■ 5 час ■ 6 час ■ 7 час ■ 8 час
Рисунок 1 – Динамика титруемой кислотности модельных образцов в процессе сквашивания
От показателя «активная кислотность» зависят: стабильность полидисперсной системы молока (термоустойчивость белков), условия роста микрофлоры, скорость образования метаболитов бактерий, активность ферментов. Данный параметр влияет на клеточный транспорт веществ, а также на скорость протекания ферментативных реакций, поэтому даже незначительные изменения рН значимо влияют на скорость роста микробных клеток [18].
Микроорганизмы также могут менять эти характеристики в процессе метаболизма для создания наиболее оптимальных условий для своего развития. На начальном этапе сквашивания активная кислотность всех образцов снижалась незначительно вследствие большой буферной емкости системы. Скорость снижения активной кислотности в первый час сквашивания составила, ед. рН: для контрольного образца – 0,10; для модельных образцов с экстрактами корицы – 0,09; паприки – 0,12; смеси пряностей – 0,14.
Далее эти показатели неуклонно снижались и практически не зависели от вида экстракта. Средняя скорость снижения активной кислотности во всех образцах была от 0,37 до 0,39 ед. рН в период от момента окончания индукционного периода до достижения значений 4,1-4,05 ед. рН, соответствующих титруемой кислотности образцов 108–117°Т. Далее наблюдали значительное снижение скорости кислотообразования и замедление молочнокислого процесса, снижение активной кислотности в единицу времени составило, ед. рН: для контрольного образца – 0,11; для модельных образцов с экстрактами корицы - 0,13; паприки - 0,06; смеси пряностей - 0,19, то есть молочная кислота подавляет рост молочнокислых бактерий.
Оценка скорости молочнокислого процесса по титруемой кислотности для окрашенных образцов молочных продуктов, например с добавлением таких пряностей как куркума, корица, паприка, имеет достаточно высокую погрешность, так как точка эквивалентности определяется визуально по изменению окраски смеси продукта с индикатором. В этих случаях необходимо применять автоматическое титрование с определением точки эквивалентности по величине рН. Также для оценки скорости молочнокислого процесса, в том числе и для окрашенных и непрозрачных сред, возможно применение кондуктометрического анализа, характеризуемого высокой точностью. Поэтому проводили измерения удельной электропроводимости (УЭП) модельных образцов в процессе сквашивания [24].
Удельная электропроводность раствора зависит от концентрации растворенных в нем низкомолекулярных веществ, УЭП молока обусловлена количеством катионов и анионов солей. Так как содержание минеральных солей в нормальном молоке колеблется в узком диапазоне 0,65-0,8%, то УЭП молока - величина постоянная [24]. В молоке присутствуют заряженные коллоидные частицы, скорость движения которых в электрическом поле зависит от отношения суммарного заряда частицы к массе. К ним относятся мицеллы казеина, а также сывороточные белки и глобулы молочного жира. В силу больших размеров и меняющегося заряда коллоидные частицы передвигаются медленно и несколько тормозят подвижность ионов, т. е. практически уменьшают электропроводность молока. Электропроводность повышается при нарастании кислотности молока, поэтому исследование динамики УЭП в процессе сквашивания образцов характеризует условия роста молочнокислых микроорганизмов [24].
Исследование динамики УЭП показало, что с увеличением количества молочной кислоты (нарастание титруемой кислотности) УЭП всех образцов увеличивается в среднем на 0,50–0,60 мСм/с до значений 7,54 мСм/с – контрольный образец, 7,65 мСм/с – образец с экстрактом корицы, 7,58 мСм/с – образец с экстрактом паприки и
7,64 мСм/с – образец с экстрактом смеси пряностей для напитков. На конечных этапах сквашивания при кислотности 80–85 °Т и выше наблюдали незначительное увеличение УЭП во всех исследуемых образцах в диапазоне 0,06-0,19 мСм/с, что связано с накоплением молочной кислоты, которая является сильным электролитом. При увеличении концентрации электролита межионное взаимодействие возрастает, что приводит к снижению скорости движения ионов и уменьшению удельной электропроводности раствора. При значении рН 4,6 образуется гелевая структура молока за счет потери устойчивости казеиновых мицелл, также повышается вязкость и усиливаются межионные взаимодействия коллоидных частиц, что также приводит к снижению электропроводности на конечном этапе сквашивания [18, 24].
Заключение
Исходя из результатов исследования, можно заключить, что экстракты корицы, паприки и смеси пряностей для напитков в исследуемых дозировках не оказывают негативного влияния на тестируемые штаммы Streptococcus thermophilus и Lactobacillus delbrueckii subsp. Bulgaricus . Таким образом, при выборе тех или иных видов пряностей в качестве пищевкусовых добавок, необходимо учитывать рекомендуемые нормативы.
Можно предположить, что отсутствие негативного влияния антимикробных веществ пряностей на молочнокислые микроорганизмы обусловлено особенностями метаболизма данных бактерий [25], например антибактериальные флавоноиды могут воздействовать на множество клеточных мишеней путем образования комплексов с белками за счет неспецифических свойств, таких как водородные связи и гидрофобные свойства, а также за счет образования ковалентных связей, то есть способ их антимикробного действия может быть связан с их способностью инактивировать микробные адгезины, ферменты, транспортные белки клеточной оболочки и так далее. Липофильные флавоноиды также могут разрушать микробные мембраны [9].
Патогенные и условно-патогенные микроорганизмы предпочитают слабощелочные и щелочные среды, а молочнокислые растут в кислых средах с низкими значениями рН от 3,5 до 4,2 единиц. В кислой и щелочной среде данные процессы протекают по-разному.
Исследование антимикробных свойств вкусо-ароматических натуральных добавок и подбор оптимальных доз и комбинаций противомикробных препаратов для разработки технологий новых видов молочных продуктов и продления сроков годности пищевых продуктов является перспективным направлением.


