Изучение специфической фармакологической активности последовательности пептидного ингибитора RAS-ГТфазы в условиях in vitro
Автор: Кулинич Т.М., Иванов А.В., Большакова О.Б., Горбаренко А.В., Боженко В.К.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Молекулярная медицина
Статья в выпуске: 4 т.22, 2022 года.
Бесплатный доступ
Рак легкого (РЛ) является одним из наиболее распространенных злокачественных новообразований у населения земного шара. С начала ХХ века заболеваемость РЛ возросла в несколько десятков раз, причем ее рост особенно выражен в промышленно развитых странах. Заболеваемость подтипом рака легкого - аденокарциономой легкого - в России составляет 22 случая на 100 тыс. населения. Рост заболеваемости совпадает с ростом смертности. Поиск новых эффективных методов лечения рака легкого является актуальной клинической задачей.В представленной статье показаны результаты исследования эффективности последовательности пептидного ингибитора Ras-ГТФaзы (K26K) на клеточных линиях аденокарциномы легкого и немелкоклеточного рака легкого, проведённые in vitro. В ходе проделанной работы было показано, что исследуемое лекарственное средство обладает выраженной цитотоксической активностью, что определяется увеличением количества мертвых клеток и снижением количества живых клеток в культурах используемых линий, и является потенциальным противоопухолевым препаратом.
Онкология, рак легкого, иммунотерапия, пептидная последовательность
Короткий адрес: https://sciup.org/149142264
IDR: 149142264
Текст научной статьи Изучение специфической фармакологической активности последовательности пептидного ингибитора RAS-ГТфазы в условиях in vitro
Поиск новых эффективных методов лечения рака легкого является актуальной клинической задачей [1,4]. В течение последних лет все чаще стали применяться лекарственные препараты направленного действия («таргетные» препараты), которые могут воздействовать на этапы процессов передачи сигналов от лиганд-рецепторных взаимодействий внутри клетки, до процессов, происходящих непосредственно внутри клеточного ядра. Вот почему вопрос изучения белков, которые участвуют в сигнальных каскадах внутри клетки, важен для познания молекулярных механизмов патогенеза различных заболеваний и обнаружения новых молекулярных мишеней, с целью ориентированного воздействия на последние [2].
Распространенное повсеместно семейство белков ras участвует в регулировании различных аспектов клеточной морфологии, пролиферации и дифференцировке. Данные белки являются протоонкогенами и их мутации ведут к злокачественному перерождению клеток [10].
Ras – самый распространенный онкоген опухолей человека, на который не действует ни один из зарегистрированных препаратов. Мутации Ras , приводящие к гиперактивации сигнального пути MAPK/ERK, встречаются в 25% всех опухолей человека. В случае немелкоклеточного рака легкого мутация гена KRAS наблюдается в 20–25% случаев, что делает таргетную терапию против других биомишеней неэффективной [8,11,13].
Мутации генов Ras, кодирующих малые ГТФазы, приводят к тому, что Ras-киназа постоянно находится в комплексе с GTP [5,7]. Обладающий высокой афинностью двойной комплекс Rаs-GТР, связывая Rаf-киназу, образует тройной активный комплекс Rаs-Rаf-GТР. Этот комплекс, фосфолирируя МEК-киназу, передает сигнал далее по каскаду киназ. Связываясь с активным комплексом Rаs-GТР по сайту связывания Rаf-киназы, исследуемый пептидный ингибитор (потенциальное лекарственное средство), препятствуя образованию активного тройного комплекса Rаs-Rаf-GТР, ингибирует сигнальный путь МАРК/ЕRК [6,9, 12].
Целью данной работы являлось изучение in vitro специфической фармакологической активности лекарственного средства на основе пептидного ингибитора Ras-ГТФазы для лечения немелкоклеточного рака легкого.
Материалы и методы
Эффективность последовательности пептидного ингибитора Rаs-ГTФазы (K26К) проводили in vitro, культуры клеточных линий А549 (аденокарцинома легкого), Н1299 и Н460 (немелкоклеточный рак легкого) выбрали в качестве моделей злокачественных заболеваний.
Исследование проводилось путем оценки цитостатического и цитотоксического эффектов последовательности пептидного ингибитора Ras-ГТФазы с помощью методов: МТТ-тест; ЛДГ-тест; исследование специфической цитотоксичности пептидных ингибиторов Rаs-ГTФазы методом проточной цитофлуориметрии (двойная окраска СГПА-SE/PI и двойная окраска AnnexinV-PI, позволяющая оценить уровень апоптоза); оценка пролиферации в реальном времени (система iCELLigence).
Исследование эффективности последовательности пептидного ингибитора Rаs-ГTФaзы было проведено в соответствии с Федеральным законом от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств»; Национальным стандартом Российской Федерации ГОСТ Р 53434-2009 «Принципы надлежащей лабораторной практики»; Методическими рекомендациями по проведению доклинических исследований лекарственных средств; Приказом Министерства здравоохранения и социального развития Российской Федерации № 708н от 23.08.2010 [3].
Результаты и обсуждение
На культурах клеток А549, Н1299 и Н460 была поставлена серия экспериментов по изучению цитотоксического воздействия последовательности пептидного ингибитора Ras-ГТФазы. Цитотоксический эффект оценивался несколькими методами.
В первую очередь были проведены эксперименты, в которых определяли количество жизнеспособных клеток, оставшихся в культурах после добавления последовательности К26К в разных концентрациях (от 2 до 40 мкМ). Результаты оценивали с помощью колориметрического теста для оценки метаболической активности клеток (МТТ-теста). Время инкубации исследуемых клеточных культур с пептидным ингибитором Ras-ГТФазы, составляло 24 и 48 часов.
На основании проведенных исследований противоопухолевого эффекта лекарственного средства К26К методом МТТ было показано, что последовательность обладает выраженым цитотоксическим действием относительно исследуемых клеточных линий (А549, Н460 и Н1299). При этом, низкие концентрации 2 и 5 мкМ вызвали обратимый эффект, а концентрации выше 10 мкМ обладали стойким цитотоксичским действием. Можно сделать вывод, что эффект пропорционален концентрации лекарственного средства. Стоит отметить, что культура Н1299 оказалась наиболее чувствительна к воздействию, так как именно для нее наблюдался наиболее выраженный цитотоксический эффект при инкубации с препаратом (Рис. 1).
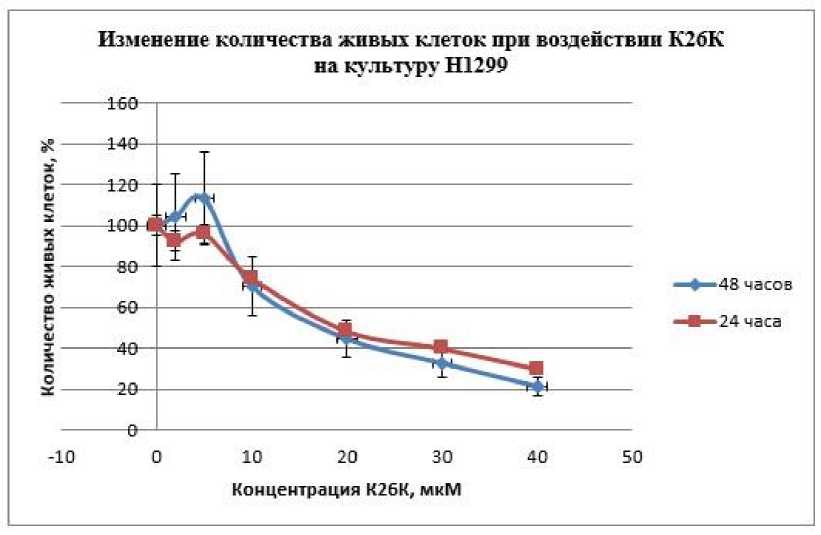
Рис. 1. Изменение количества живых клеток при воздействии на культуру Н1299 последовательности К26К в различных концентрациях при инкубации 24 и 48 часов.
Также была проведена оценка уровня ЛДГ после 24-часовой и 48-часовой инкубации культур клеток (А549, Н1299 и Н460) с пептидным ингибитором Ras-ГТФазы (К26К) в концентрациях 2, 5, 10, 20 и 40 мкМ. Показано, что исследуемое лекарственное средство на основе пептидной последовательности ингибитора Ras-ГТФазы – К26К, обладает выраженным цитотоксическим эффектом относительно клеток рака легкого человека. Цитотоксический эффект линейно зависит от концентрации К26К, внесенного в культуральную среду и, в меньшей степени, зависит от времени инкубации.
При исследовании эффективности пептидной последовательности ингибитора Ras-ГТФазы – К26К в отношении клеток линий рака легкого человека и сравнении эффектов с цитотоксическими эффектами 5-фторурацила и этопозида в равных концентрациях, методом проточной цитофлуориметрии с двойной окраской CFDA-SE/PI, было показано, что последовательность К26К оказывает стойкий цитотоксический эффект, сопоставимый с цитотоксическим эффектом выбранных для сравнения стандартных противоопухолевых препаратов. Данный эффект выражается в увеличении количества PI-положительных частиц (мертвые клетки) и снижении клеток, положительных по CFDA-SE. На рисунке 2 представлен эффект трех исследуемых лекарственных средств и показано, что уровень PI-положительных частиц возрастает в зависимости от увеличения концентрации К26К, и для линии Н1299 цитотоксический эффект К26К превосходит эффекты 5-фторурацила и этопозида.
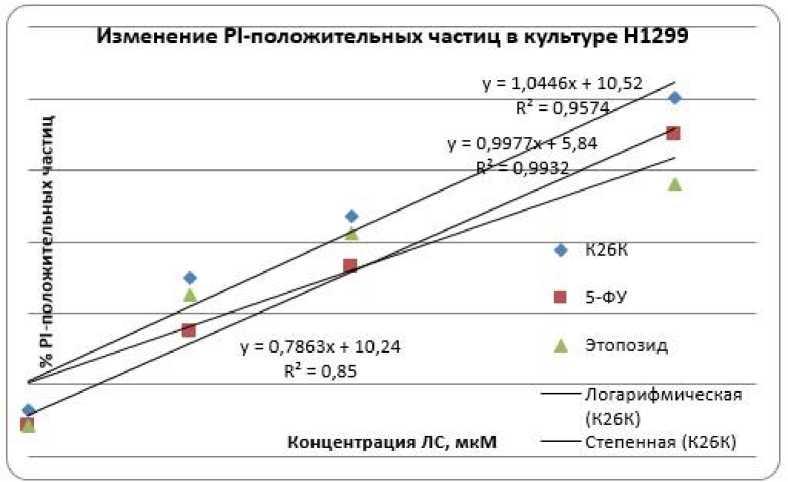
Рис. 2. Сравнение цитотоксического эффекта К26К (ЛС), 5-фторурацила и этопозида на культуру клеток Н1299. Окраска CFDA-SE/PI, зависимость изменения количества PI-положительных частиц от концентрации ЛС, время инкубации 24 часа.
Методом проточной цитофлуориметрии, окраска Annexin V-FITС/PI, проведено исследование изменения уровней апоптоза и некроза при воздействии на культуры А549, Н460 и Н1299 пептидного ингибитора Ras-ГТФазы. Показано, что зависимости уровней апоптоза и некроза для клеточных линий А549 и Н460 при воздействии на них последовательности К26К, имеют схожий вид. Уровень апоптоза при воздействии лекарственного средства К26К в концентрации 40 мкМ и времени инкубации 24 часа возрастает до 35% в культуре А549 и до 40% в культуре Н460, а уровни некроза до 32% и 31%, соответственно, а также кривые имеют схожий вид. Стоит отметить, что эффект воздействия лекарственного средства на клеточную линию H1299 имеет принципиальные особенности, так как значение индуцированного апоптоза было значительно больше уровня некроза.
Количество клеток, вступивших в апоптоз (ранний + поздний апоптоз) при воздействии ЛС К26К в концентрации 10 мкМ в среднем составило 27,7%, при увеличении концентрации до 20 мкМ – 38% и при концентрации 40 мкМ составило 45%. Выполненное с помощью метода проточной цитофлуориметрии с применением двойной окраски (PI/Annехin V-FIТС) исследование видов гибели клеток (некроз и апоптоз) показало: пептидная последовательность ингибитора RАS-ГTФазы обладает выраженной специфической противоопухолевой активностью по отношению к культурам клеток немелкоклеточного рака легких.
Этот эффект, в большей степени благодаря апоптозу, характеризуется индукцией гибели клеток. Молекулярно-генетические особенности клеточной линии обуславливают уровень индуцированного внесением в культуральную среду лекарственного средства апоптоза.
Динамическое исследование влияния последовательности ингибитора RАS-ГТФaзы на клеточный рост проводили с применением прибора RТСA iСЕLLIgеnсе. Основным принципом данной методики является измерение импеданса приповерхностного слоя на дне культуральных лунок. В данном случае количество клеток в лунке пропорционально величине импеданса.
С применением метода клеточного анализа iCELLIgence было проведено исследование цитостатического воздействия последовательности фрагмента ингибитора Ras-ГТФазы – К26К на клетки культур А549, Н1299 и Н460.
Для каждой клеточной линии было поставлено по пять экспериментов по исследованию концентраций ЛС К26К в диапазоне 2 – 40 мкМ. При проведении экспериментов клетки вносились на планшет в количестве 20 000 на лунку, инкубировались 3 часа для начального закрепления на дне планшета, а затем к культуральной среде добавлялось исследуемое вещество в различных концентрациях. На рисунке 3 представлен пример графиков клеточного роста для культуры А549.
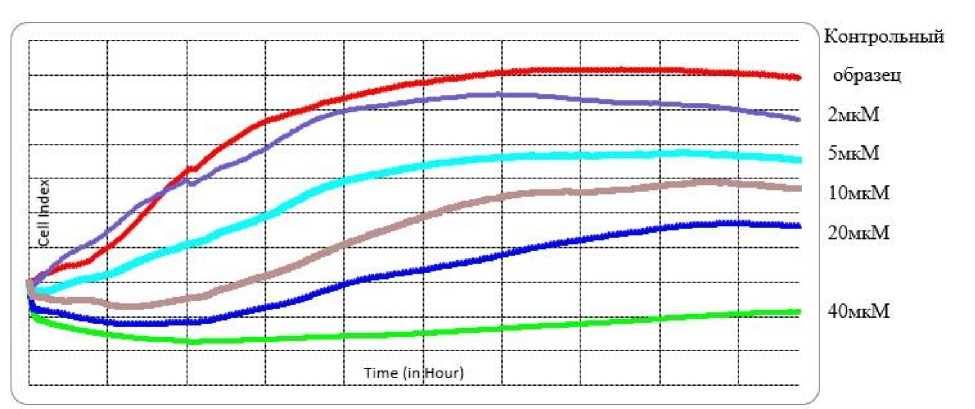
Рис. 3. Исследование воздействия лекарственного средства ингибитора Ras-ГТФазы – К26Кв концентрациях 2 - 40 мкМ на культуру А549 методом клеточного анализа iCELLIgence.
По результатам исследования цитостатический эффект препарата К26К по отношению к клеткам линии A549 имеет четкую зависимость от концентрации.
Было показано, что при добавлении ЛС в концентрации 2 мкM в 1,2 раза снижается показатель клеточного индекса (по сравнению с контрольным образцом), при концентрации 5 мкM – в 1,6 раза, при 10 мкM – в 2,14 раза, а при 20 мкM – в 4 раза. Стоит отметить, что при введении лекарственного средства в концентрации 40 мкM наблюдали полную остановку пролиферации, клеточный индекс снижался до отрицательных значений, т.е. клеток становилось меньше, чем было взято изначально.
Цитостатический эффект, имеющий концентрационную зависимость, также был обнаружен при воздействии ЛС на клеточную линию Н460. Эффект определялся снижением пролиферативной активности и имел зависимость от концентрации. Так, при воздействии лекарственного средства в концентрации 5 мкM отмечалось снижение клеточного индекса в
-
1,3 раза, при концентрации 10 мкM – в 1,5 раза, а при концентрациях 20 мкM и 40 мкM – в 2,4 и 4 раза соответственно, в сравнении с контрольными образцами.
Цитостатический эффект лекарственного средства K26К, исследованный с помощью метода «пролиферации в реальном времени» с применением iСЕLLIgеnсе на клеточной линии Н1299, оказался более слабым, чем для культуры А549 и Н460. При воздействии лекарственного средства на клетки Н1299 в концентрации 5 мкM значение клеточного индекса снижалось в 1,1 раза, при концентрации 10 мкM – в 1,5 раза, при 20 мкM – в 1,6 раза, а при воздействии ЛС в концентрации 40 мкM – в 2,5 раза.
Полученный низкий цитостатический эффект для клеток Н1299 вполне согласуется с результатами о высоком цитотоксическом эффекте лекарственного средства К26К в отношении данной клеточной линии. Клетки с высокой пролиферативной активностью более восприимчивы к проапоптотическому воздействию лекарственного средства К26K, как ингибитора RАS-ГTФфзы, в то время, как клетки, избежавшие взаимодействия с ним, продолжают делиться и размножаться.
С помощью программного обеспечения клеточного анализатора iCELLIgence были получены результаты времени удвоения культуры при воздействии на клетки лекарственного средства К26К. Для линии клеток А549 было показано, что при концентрации К26К 40 мкМ время удвоения клеточной популяции возрастает до 18,4 часа, в контроле время удвоения культуры составляло 8,3 часа. Для культуры клеток Н460 при концентрации К26К 20 мкМ, задержка времени удвоения пролиферации составила 1,8 раза, при увеличении концентрации К26К до 40 мкМ – 2,1 раза.
Рассчитанное время удвоения популяции для клеток культуры Н1299 составило 18,3 часа при концентрации К26K 20 мкM, однако, увеличение концентрации до 40 мкМ не привело к дальнейшей задержке пролиферации и составило 18,4 часа.
Заключение
При исследовании противоопухолевого эффекта последовательности пептидного ингибитора Ras-ГТФазы – К26К в отношении культур клеток рака легкого человека A549, Н1299 и Н460 было показано, что исследуемое лекарственное средство является потенциальным противоопухолевым препаратом. Оно обладает выраженной цитотоксической активностью, определяющейся в увеличении количества мертвых клеток и снижении количества живых клеток в культурах исследуемых линий. Исследуемое лекарственное средство индуцирует апоптоз в клетках рака легкого человека, причем данный эффект зависит от типа клеточной линии. Цитотоксический и проапоптотический эффекты имеют прямую концентрационную зависимость. Цитостатический эффект лекарственного средства К26К, определяющейся в снижении пролиферативной активности клеток при внесении К26К в культуральную среду, также имеет концентрационную зависимость и различен для разного типа клеток.
Список литературы Изучение специфической фармакологической активности последовательности пептидного ингибитора RAS-ГТфазы в условиях in vitro
- Давыдов М.И. Аксель Е.М. Злокачественные новообразования в России и странах СНГ в 2001 г. М. 2003.
- Кулинич Т.М., Шишкин А.М., Иванов А.В. и др. Изучение противоопухолевых свойств пептидной конструкции, включающей интернализуемую последовательность и ингибитор Ras-ГТФазы, в отношении клеток линий рака толстой кишки (НТ29) и рака яичника (OAW-42, OVCAR-3). Вестник Российского научного центра рентгенорадиологии. 2021. Т. 21. № 4. С. 100-120.
- Миронов А.Н. (ред.). Руководство по проведению доклинических исследований лекарственных средств (иммунобиологические лекарственные препараты). Часть вторая. М.: Гриф и К. 2013. 536 с.
- Давыдов М.И., Аксель Е.М. Заболеваемость злокачественными новообразованиями населения России и стран СНГ в 2004 г. Вестник РОНЦ им. НН Блохина РАМН. 2006. Т. 17 № 3-1. С. 45-77.
- Ahmadian M.R., Stege P., Scheffzek K., Wittinghofer A. Confirmation of the arginine-finger hypothesis for the GAP-stimulated GTP-hydrolysis reaction of Ras. Nat Struct Biol. 1997. V. 4. No. 9. P. 686-689. DOI: 10.1038/nsb0997-686.
- Abraham S.J., Nolet R.P., Calvert R.J., et al. The hypervariable region of K-Ras4B is responsible for its specific interactions with calmodulin. Biochemistry. 2009. V. 48. No. 32. P. 7575-7583. DOI: 10.1021/bi900769j.
- Khrenova M.G., Bulavko E.S., Mulashkin F.D., Nemukhin A.V. Mechanism of Guanosine Triphosphate Hydrolysis by the Visual Proteins Arl3-RP2: Free Energy Reaction Profiles Computed with Ab Initio Type QM/MM Potentials. Molecules. 2021. V. 26. No. 13. Article ID 3998. DOI: 10.3390/molecules26133998.
- Khwaja A., Rodriguez-Viciana P., Wennström S., et al. Matrix adhesion and Ras transformation both activate a phosphoinositide 3-OH kinase and protein kinase B/Akt cellular survival pathway. EMBO J. 1997. V. 16. No. 10. P. 2783-2793. DOI: 10.1093/emboj/16.10.2783.
- Lu S., Banerjee A., Jang H., et al. GTP Binding and Oncogenic Mutations May Attenuate Hypervariable Region (HVR)-Catalytic Domain Interactions in Small GTPase K-Ras4B, Exposing the Effector Binding Site. J Biol Chem. 2015. V. 290. No. 48. P. 28887-28900. DOI: 10.1074/jbc.M115.664755.
- Marcus K., Mattos C. Direct Attack on RAS: Intramolecular Communication and MutationSpecific Effects. Clin Cancer Res. 2015. V. 21. No. 8. P. 1810-1818. DOI: 10.1158/1078- 0432.CCR-14-2148.
- Marte B.M., Rodriguez-Viciana P., Wennström S., et al. R-Ras can activate the phosphoinositide 3-kinase but not the MAP kinase arm of the Ras effector pathways. Curr Biol. 1997. V. 7. No. 3. Article ID 197. DOI: 10.1016/s0960-9822(06)00028-5.
- Nussinov R., Tsai C.J., Mattos C. 'Pathway drug cocktail': targeting Ras signaling based on structural pathways. Trends Mol Med. 2013. V. 19. No. 11. P. 695-704. DOI: 10.1016/j.molmed.2013.07.009.
- Takai Y, Sasaki T, Matozaki T. Small GTP-binding proteins. Physiol Rev. 2001. V. 81. No. 1. P. 153-208. DOI: 10.1152/physrev.2001.81.1.153.


