KI-67и сурвивин (Birc5) как биомаркеры прогрессии и рецидивирования мышечно-неинвазивного рака мочевого пузыря
Автор: Павлов А.Ю., Дзидзария А.Г., Боженко В.К., Гафанов Р.А., Мирзаханов Р.И., Узденов Р.А., Солодкий В.А.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Урология
Статья в выпуске: 2 т.22, 2022 года.
Бесплатный доступ
Очень часто прогноз пациентов с мышечно-неинвазивным раком мочевого пузыря не совпадает с нашими ожиданиями построенными на основе клинико-морфологических признаках агрессивности опухоли. Причиной данных расхождений может является молекулярно-генетическая гетерогенность опухоли, определяющая механизмы прогрессии и рецидивирования. До настоящего времени в рутинной практике при выборе метода лечения неинвазивного рака мочевого пузыря, вида адъювантного лечения (вид, схема и сроки) не учитываются данные молекулярно-генетического разнообразия ткани опухоли. Мы исследовали маркеры активности пролиферации в ткани рака мочевого пузыря для прогнозирования рецидивирования при мышечно неинвазивном раке.
Ki-67, birc5, молекулярно-генетические маркёры, уротелиальный рак, мышечно-неинвазивный рак
Короткий адрес: https://sciup.org/149141311
IDR: 149141311
Текст научной статьи KI-67и сурвивин (Birc5) как биомаркеры прогрессии и рецидивирования мышечно-неинвазивного рака мочевого пузыря
Mirzakhanov Ramil Irecovich – postgraduate student; ORCID:
По последним литературным данным, мышечно-неинвазивная форма уротелиального рака характеризуется очень большой мутационной нагрузкой по частоте сравнимой с частотой при меланоме [1]. Современные лечебно-диагностические алгоритмы в различных направлениях онкологии все больше и глубже сопряжены с пониманием молекулярногенетического профиля опухолевой ткани. Только генетически-детерминированная персонификация позволяет значительно повышать качество проводимого лечения.
Большая часть первичных опухолей мочевого пузыря обладают низкой степенью злокачественности, ограничены слизистой оболочкой и часто рецидивируют после трансуретральных резекций. Однако до 30% мышечно-неинвазивных видов рака мочевого пузыря (МНИРМП) демонстрирует прогрессию заболевания до инвазивной стадии или переход в более высокую степень морфологической злокачественности [2].
Хорошо известные факторы риска рецидива РМП включают количество и размер опухолевых поражений, наличие сопутствующей карциномы in situ (CIS), количество рецидивов, стадию T в соответствии с классификацией TNM, гистопатологическую степень опухоли, пол и возраст. [3] На основе выбранных факторов риска были разработаны прогностические таблицы для определения риска повторного развития НМИРМП; однако, как показали более поздние анализы, они переоценивают риск рецидива у некоторых групп пациентов. Добавление новых элементов в существующие факторы риска рецидивирования может повысить точность и, в то же время, увеличить возможности использования прогностических моделей.
По данным зарубежной литературы, отмечена корреляция между экспрессией Ki-67 и стадией РМП, а также со степенью злокачественности опухоли. Ряд авторов показали, что наличие высокой экспрессии Ki-67 коррелирует с плохим прогнозом [4,5].
Также многие зарубежные исследователи показали, что химиорезистентность РМП индуцируется сверхэкспрессией набора генов, связанных с ингибированием апоптоза [6]. Среди этих генов сурвивин привлекает большое внимание как один из наиболее актуальных. Это ингибитор белка апоптоза (IAP), участвующего во многих клеточных реакциях на стресс, представленный в различных субклеточных компартментах. Сурвивин почти не обнаруживается в здоровых взрослых клетках, в то время как гиперэкспрессируется в фетальной и опухолевой ткани [7,8]. Четко доказана его связь с развитием самых разных видов рака, таких как карциномы толстой кишки, рак молочной железы, ретинобластомы, саркомы и лейкемии [7, 9,10,11].
В соответствии с вышеизложенным, целью нашего исследования является подтверждение прогностической ценности Ki-67 и сурвивина (BIRC5) в рецидивировании и агрессивности мышечно-неинвазивного рака мочевого пузыря в исследуемых группах.
Материалы и методы исследования.
В исследование вошло 234 пациента, получавших специализированное лечение на базе ФГБУ РНЦРР с 2017 по 2020 годы. Пациенты были разделены на три группы, группа первичных пациентов (n=83) с первичным мышечно-неинвазивным раком мочевого пузыря, пациенты после специализированного лечения мышечно-неинвазивного рака мочевого пузыря (n=81) и пациенты без уротелиального рак (МКБ, ДГПЖ, рак иной локализации). (n=70).
Лечение первой исследовательской группы пациентов было выполнено согласно клиническим протоколам РНЦРР МЗ РФ, подразумевающим забор биопсии из опухоли и неизмененной ткани мочевого пузыря с использованием эндоскопической фотодинамической диагностики с одновременной трансуретральной резекцией (ТУР) стенки мочевого пузыря с опухолью, а также проведение внутрипузырной химиотерапии препаратами доксорубицин или митомицин, далее контрольные цистоскопии выполнялись каждые три месяца в течение года.
У всех пациентов произведено определение уровня экспрессии мРНК генов методом полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР). [14]
В последующем произведен сравнительный анализ транскрипции генов:
-
1. В ткани опухоли в зависимости от клинико-морфологических характеристик заболевания, результатов лечения.
-
2. В морфологически-неизмененной ткани мочевого пузыря у пациентов с МНИРМП.
-
3. В ткани мочевого пузыря у пациентов с пролеченным МНИРМП, находящихся под динамическим наблюдением.
-
4. В ткани мочевого пузыря у пациентов с гиперплазией предстательной железы, аденомой предстательной железы, раком предстательной железы и другими онкологическими заболеваниями.
Морфологическое изучение материала проводилось в соответствии с Международной гистологической классификацией опухолей мочевого пузыря Всемирной Организации Здравоохранения (ВОЗ).
Уровень мРНК определяли методом ОТ-ПЦР наборами фирмы ООО «ДНК технология» Россия согласно инструкции.
Статистическую обработку результатов исследования проводили в программе StatSoft STATISTICA 12.0 с использованием методов непараметрического анализа.
Расчет безрецидивной выживаемости выполнялся точным методом Kaplan-Maier, сравнение кривых выживаемости выполнялся методом Cox и Log-Rank.
Данные были проверены на нормальное распределение. Параметрические тесты использованы в соответствующих случаях. Значения P <0,05 считались статистически достоверными
Результаты исследования.
Возраст в нашем исследование колебался от 20 лет до 91 года. При сравнении групп по возрастному составу выявлено, что в 1 группу вошли более возрастные пациенты, различия достоверны.
Таблица 1. Распределение пациентов по возрастам в группах.
|
Группы |
Средний возраст (лет) |
Кол-во больных |
Ошибка |
Возраст мин |
Возраст макс |
|
1 |
66,3 |
83 |
1,24 |
29,0 |
91,0 |
|
2 |
60,8* |
81 |
1,42 |
22,0 |
91,0 |
|
3 |
58,4** |
70 |
1,99 |
20,0 |
89,0 |
|
Всего |
62,0 |
234 |
0,91 |
20,0 |
91,0 |
*- р=0,03; ** - р=0,002
Таблица 2. Распределение пациентов в зависимости от степени дифференцировки опухоли.
|
Группы |
Степень дифференцировки |
Всего |
||
|
G1 |
G2 |
G3 |
||
|
1 |
47 (56,6%) |
2 (2,4%) |
34 (41%) |
83 |
|
2 |
38 (46,9%) |
3 (3,7%) |
40 (49,3%) |
81 |
|
Всего |
85 |
5 |
74 |
166 |
Мы не получили достоверных различий в распределении по фактору дифференцировки рака в 1 и 2 группах. (р>0,05).
При лечении пациентов картина в мочевом пузыре оценивалась по параметрам оценки относящихся к факторам прогноза течения заболевания (количество очагов, размер первичной опухоли). Данные представлены в таблице 3.
Таблица 3.
|
Группа |
Количество очагов |
Всего |
|||
|
1 |
2-7 |
≥8 |
|||
|
1 |
71 (85,5%) |
11 (13,3%) |
1 (1,2%) |
83 |
|
|
2 |
49 (60,5%) |
19 (23,5%) |
13 (16%) |
81 |
|
|
Всего |
120 |
30 |
14 |
164 |
|
|
Группа |
Размер первичной опухоли |
Всего |
|||
|
< 3см |
≥ 3см |
||||
|
1 |
58 (69,9%) |
25 (30,1%) |
83 |
||
|
2 |
44 (54,4%) |
37 (45,6%) |
81 |
||
|
Всего |
102 |
62 |
164 |
||
В 1 группе большее количество больных с единичным очагом, различия достоверные (p <0,05). При сравнении по размерам первичной опухоли определена тенденция к большему количеству пациентов с размером первичной опухоли <3 см. Первая группа - 58 человек (69,9%) и 44 во второй (54,4%), однако различия недостоверные (p >0,05).
Таблица 4.
|
Группы |
Курение |
Всего |
|
Есть |
Нет |
||
|
1 |
46 (55,4%) |
37 (44,6%) |
83 |
|
2 |
33 (40,7%) |
48 (59,3%) |
81 |
|
3 |
13 (18,6%) |
57 (81,4%) |
70 |
|
Всего |
92 |
142 |
234 |
По нашим данным в опухолевой ткани мышечно-неинвазивного РМП и в слизистой оболочке мочевого пузыря без опухолевого роста (рак в анамнезе). Получено достоверное повышение в опухолевой ткани экспрессии ряда маркеров пролиферации. Первым исследованным нами маркером являлся Ki-67 (p <0,02).
При изучении опухолевых биомаркеров в качестве центральной характеристики брали медиану, в качестве меры разброса – квартили и применяли непараметрические методы анализа (например, критерий Краскела – Уоллиса, медианный тест). В таблице 5 представлены данные Ki-67 по медианам и квартилям.
Таблица 5. Данные измерения Ki-67 по группам
|
Группы |
Кол-во пациентов |
Мин. значение |
Макс. значение |
Q25 |
Медиана |
Q75 |
|
1 |
83 |
0 |
608,9 |
0 |
39,4 |
128,0 |
|
2 |
81 |
0 |
222,9 |
0 |
2* |
7,2 |
|
3 |
70 |
0 |
247,3 |
0 |
77** |
22,6 |
|
Всего |
234 |
0 |
608,9 |
0 |
6,5 |
36,8 |
*- p <0,03; **-p <0,01
В 1 группе значение медианы равно 39,4, во 2 группе – 2, в 3 группе -7,7, полученные различия статистически значимы (p <0,05). По уровню экспрессии Ki-67 было разделение на 2 подгруппы.
Таблица 6. Распределение по уровню экспрессии Ki-67
|
Группы |
Ki-67 |
Всего |
|
|
Низкий |
Высокий |
||
|
1 |
24 (28,9%) |
59 (71,1%) |
83 |
|
2 |
44 (54,3%) |
37 (45,7%) |
81 |
|
3 |
22 (31,4%) |
48 (68,6%) |
70 |
|
Всего |
90 |
144 |
234 |
*- р <0,0001
Нами определена тенденция к повышению количества образцов ткани с низким уровнем белка Ki-67 во 2 группе. 24 (28,9%) в первой, во 2 группе –54,3% и 31,4% в третьей. Данные по средним значениям среди повышенных значений показателя Ki-67 представлены в таблице 7. В группе 1 медиана 76,1 (во 2– 10,6, в 3– 14,7), различия достоверны (p <0,0001).
Таблица 7. Данные изменения высокого уровня Ki-67 по группам.
|
Группы |
Мин значение |
Макс значение |
Q25 |
Медиана |
Q75 |
|
1 |
59 |
2,6 |
32 |
76,1 |
157,6 |
|
2 |
37 |
1,7 |
3,9 |
10,6* |
26,9 |
|
3 |
48 |
1,0 |
7,6 |
14,7* |
29,9 |
|
Всего |
144 |
1,0 |
7,9 |
25,5 |
80,3 |
*- р <0,0001
Boxplot by Group
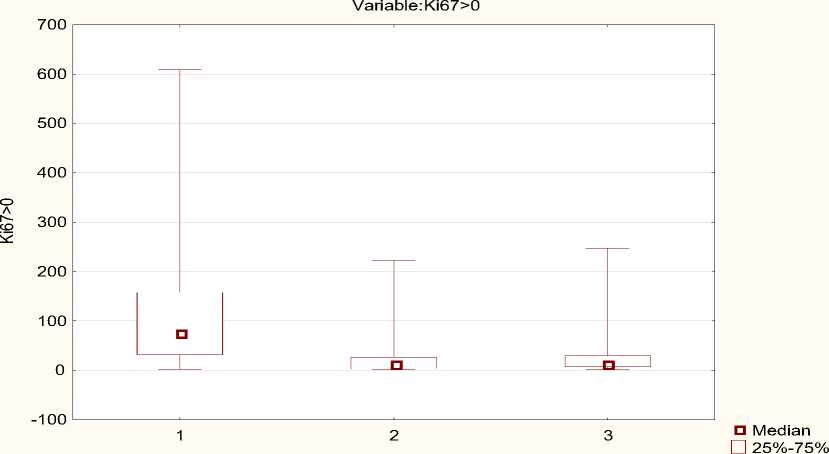
I Min-Max группы
Рисунок 1. Изменения медианы Ki-67 по группам
Из приведенных выше данных можно сделать вывод о достоверном повышении Ki-67 в группе 1, площадь под кривой составила 0,81±0,04.
Рисунок 2
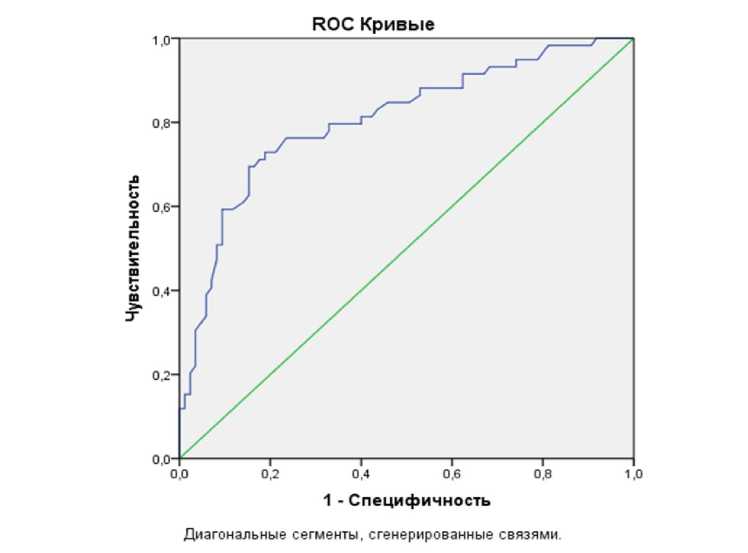
Рисунок 2. ROC-кривые при экспрессии Ki-67
Расчеты показателей чувствительности (т.е. вероятность наличия рака) и показателя специфичности (т.е. пациент находится в ремиссии или мочевой пузырь без онкологии) представлены в таблице 8.
Таблица 8. Данные чувствительности и специфичности показателя Ki-67
|
Группы |
Ki-67 |
Всего |
|
|
<30 |
≥30 |
||
|
1 |
14 (23,7%) * |
45 (76,3%) * |
59 |
|
2 |
29 (78,4%) * |
8 (21,6%) |
37 |
|
3 |
36 (75%) * |
12 (25%) |
48 |
|
Всего |
79 |
65 |
144 |
*- p <0,0001
При сравнении групп по уровню Ki-67 в зависимости от характеристик опухоли, возраста, пола и клинических проявлений заболевания проявилась тенденция к повышению уровня данного показателя при наличии гематурии, при размерах опухоли ≥ 3, при появлении отделенных метастазов (полученные различия недостоверны). Таблица 9
Таблица 9. Зависимость экспрессии Ki-67 от клинических и анамнестических факторов
|
Гематурия |
Ki-67 |
р |
|||
|
Кол-во пациентов |
Q25 |
Медиана |
Q75 |
||
|
Есть |
34 |
39,4 |
106,6 |
157,6 |
Р=0,09 |
|
Нет |
25 |
25,1 |
50,2 |
115,4 |
|
|
Всего |
59 |
32,0 |
76,1 |
157,6 |
|
|
Размер опухоли |
|||||
|
<3см |
45 |
24,3 |
71,0 |
132,5 |
Р=0,08 |
|
≥3см |
14 |
87,4 |
144,7 |
215,3 |
|
|
Всего |
59 |
32,0 |
76,1 |
157,6 |
|
|
Курение в анамнезе |
|||||
|
Есть |
53 |
32,0 |
93,7 |
215,6 |
|
|
Нет |
26 |
32,0 |
60,6 |
128,0 |
Р=0,17 |
|
Всего |
59 |
32,0 |
76,1 |
157,6 |
|
Анализ безрецидивной выживаемости
На рисунке 3 представлен график безрецидивной выживаемости (БРВ) в зависимости от уровня экспрессии Ki-67. При Ki-67 < 35 о.е. - медиана БРВ составила 13 месяцев, 1летняя БРВ - 57,7 ± 8,1%, 2-х летняя - 39,8 ± 9,4% (р=0,02).
Больные раком мочевого пузыря (Kaplan-Meier) р=0,02
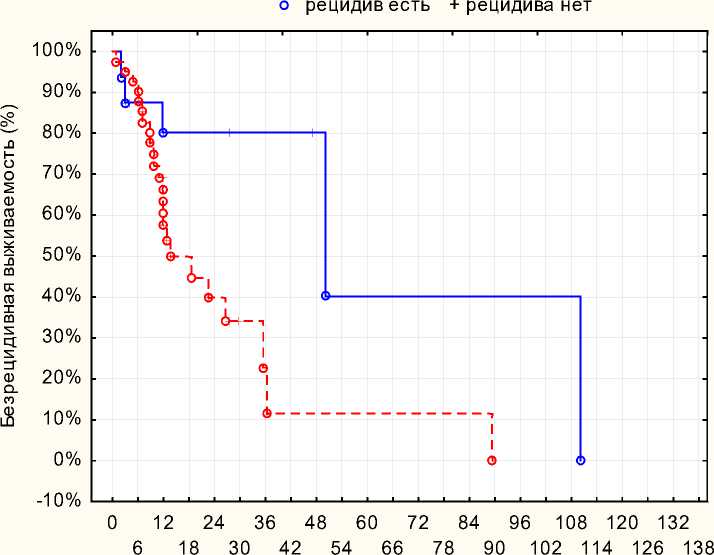
Ki-67 < 35
Сроки наблюдения от начала лечения, мес. Ki-67 > 35
Рисунок 3. Безрецидивная выживаемость в зависимости от уровня экспрессии Ki67
Нами проведен многофакторный анализ сочетания BIRC5 и Ki-67 с безрецидивной выживаемостью.
Распределение пациентов с учетом уровня экспрессии белков относительно пороговых значений выглядело следующим образом: у 11-ти больных при BIRC5 ≤ 60 + Ki-67 ≤ 35, т.е. уровни экспрессии ниже пороговых значений, медиана БРВ составила 40,7 месяцев, при 1-2-3-хлетней безрецидивной выживаемости – 80,2 ± 10,3%, 5-тилетняя БРВ – 40,1 ± 28,8%.
При повышении уровня экспрессии хотя бы одного из белков выше пороговых значений медиана БРВ – 18,7 месяцев. Эти данные представлены на рисунке 33, здесь пациенты разделены на 2 группы, в 1-ую вошли больные с низким уровнем экспрессии обоих онкомаркеров, во 2-ую - все остальные пациенты: BIRC5 высокий + Ki67 низкий; BIRC5 высокий + Ki-67 высокий; BIRC5 низкий + Ki-67 высокий.
При BIRC5 >60 + Ki-67> 35, т.е. имеет место высокий уровень экспрессии белков, медиана безрецидивной выживаемости 12,7 месяцев, 1-летняя БРВ – 54,2 ± 9,5%, 3-х летняя – 19,2 ± 14,5%.
Медиана безрецидивной выживаемости в 1 группе составила 40,7 мес., во 2 – 13,7 мес. (р=0,024), 1-летняя БРВ – 55,1 ± 8,5%. Таким образом в каждом втором случае прогнозируется рецидив через 12 месяцев. Рисунок 4.
Больные раком мочевого пузыря (Kaplan-Meier)
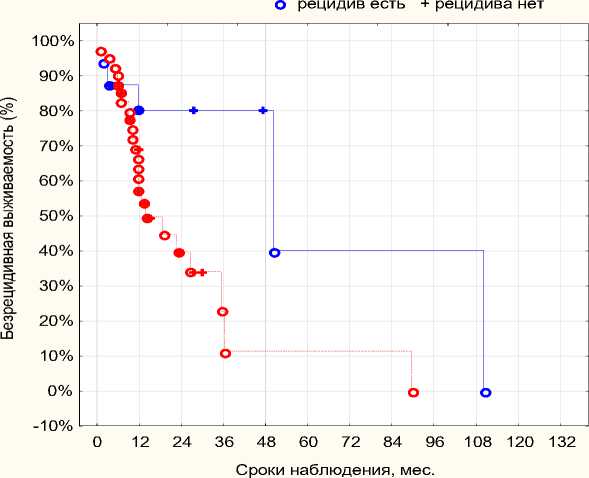
Рисунок 4. Безрецидивная выживаемость BIRC5 + Ki67
Обсуждение.
Ki-67 – это ядерный белок, связанный с транскрипцией рибосомной РНК и является маркером клеточной пролиферации [12]. Ki-67 гиперэкспрессируется в активно растущих опухолевых клетках и указывает на плохой прогноз заболевания.
Сурвивин, также известный как BIRC5 (baculoviral inhibitor of apoptosis repeat – containing 5) – металлопротеин, относится к семейству ингибиторов апоптоза. Его функцией считается блокирование процессов апоптоза. Ингибирует Bax- и Fas-зависимые сигнальные пути. Сурвивин экспрессируется в раковых стволовых клетках [13].
Выводы.
Таким образом, нами определена прогностическая роль и значимость Ki-67 и сочетания Ki-67 + BIRC5. С учетом приемлемой для медицинских исследований информативностью (>75%) по данным нашей работы Ki-67 и BIRC5 можно считать биомаркером агрессивности мышечно-неинвазивного РМП.
Список литературы KI-67и сурвивин (Birc5) как биомаркеры прогрессии и рецидивирования мышечно-неинвазивного рака мочевого пузыря
- Seitz A.K., Christensen, L.L., Christensen, E. et al. Profiling of long non-coding RNAs identifies LINC00958 and LINC01296 as candidate oncogenes in bladder cancer. Sci Rep. 2017. V. 7. No. 1. P. 395. https://doi.org/10.1038/s41598-017-00327-0.
- Lee B.H. "Comprehensive transcriptional analysis of early-stage urothelial carcinoma." Hedegaard J, Lamy P et al. Cancer Cell. 2017 Jul 11;30(1):27-42,Urologic Oncology: Seminars and Original Investigations, Volume 35, Issue 9, 2017, Pages 576-577, ISSN 10781439.
- Ding W, Gou Y, Sun C, et al. Ki-67 is an independent indicator in non-muscle invasive bladder cancer (NMIBC); combination of EORTC risk scores and Ki-67 expression could improve the risk stratification of NMIBC. Urol Oncol. 2014;32:42.e13-9
- Stec R Cierniak S, Lubas A, Brzoskowska U, Syrylo T, Zielinski H, Semeniuk-Wojtas A. Intensity of Nuclear Staining for Ki-67, p53 and Survivin as a New Prognostic Factor in Non-muscle Invasive Bladder Cancer. Pathol Oncol Res. 2020;26:1211-1219.
- Semeniuk-Wojtas A, Lubas A, Cierniak S, et al. Selected protein expression in a new prognostic model for patients with non-muscle-invasive bladder cancer. J Cancer Res Clin Oncol. 2020;146:2099-2108
- Yang F., Huang W., Li Y., Liu S., Jin M., Wang Y., Jia L., Gao Z. Anti-tumor effects in mice induced by survivin-targeted siRNA delivered through polysaccharide nanoparticles. Biomaterials. 2013;34:5689-5699. doi: 10.1016/j.biomaterials.2013.03.047
- Ferrario A., Luna M., Rucker N., Wong S., Lederman A., Kim J., Gomer C. Targeting Survivin Enhances Chemosensitivity in Retinoblastoma Cells and Orthotopic Tumors. PLoS ONE. 2016; 11:e0153011. doi: 10.1371/journal.pone.0153011
- Groner B., Weiss A. Targeting survivin in cancer: Novel drug development approaches. BioDrugs. 2013;28:27-39. doi: 10.1007/s40259-013-0058-x
- Chen L., Liang L., Yan X., Liu N., Gong L., Pan S., Lin F., Zhang Q., Zhao H., Zheng F. Survivin Status Affects Prognosis and Chemosensitivity in Epithelial Ovarian Cancer. Int. J. Gynecol. Cancer. 2013;23:256-263. doi: 10.1097/IGC.0b013e31827ad2b8
- Stauber R.H., Mann W., Knauer S. Nuclear and Cytoplasmic Survivin: Molecular Mechanism, Prognostic, and Therapeutic Potential. Cancer Res. 2007;67:5999-6002. doi: 10.1158/0008-5472.CAN-07-0494
- Paduano F., Villa R., Pennati M., Folini M., Binda M., Daidone M.G., Zaffaroni N. Silencing of survivin gene by small interfering RNAs produces supra-additive growth suppression in combination with 17-allylamino-17-demethoxygeldanamycin in human prostate cancer cells. Mol. Ther. 2006;5:179-186. doi: 10.1158/1535-7163.MCT-05-0132.
- Bullwinkel J, Baron-Luhr B, Ludemann A, Wohlenberg C, Gerdes J, Scholzen T. Ki-67 protein is associated with ribosomal RNA transcription in quiescent and proliferating cells. J Cell Physiol 2006;206:624-35
- Слепов Е.В., Башмакова Е.Е., Панамарев Н.С. и др. Белок сурвивин как перспективный маркер диагностики и лечения злокачественных новообразований. Эффективная фармакотерапия. 2021. Т. 17. № 2. С. 58-63. DOI 10.33978/2307-3586-2021-17-2-58-63. - EDN UBJKSU.
- Солодкий В.А., Станоевич У., Боженко В.К., Захаренко М.В., и др. Скрининг колоректального рака: прошлое, настоящее, будущее., 2020 г.


