Клинический случай макроглобулинемии Вальденстрема, дебютировавший гемолитической анемией
Автор: Сафуанова Г.Ш., Акобиров Ш.К., Латыпова А.А., Царева Е.Г., Роженькова Т.Ю., Валиахметова Ч.Х.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Случай из практики
Статья в выпуске: 2 т.21, 2025 года.
Бесплатный доступ
Диагноз макроглобулинемии Вальденстрема не прост. Многообразие клинико-морфологических проявлений, протекающих с моноклональной макроглобулинемией, настолько велико, что диагностика заболевания может иметь определенные трудности, особенно на ранних этапах. Из первичных клинических проявлений, обусловленных циркуляцией макроглобулина в крови, можно назвать повышение вязкости и геморрагический синдром. Гемолитический компонент встречается лишь в 5% случаев и до сих пор недостаточно изучен. Представлен клинический случай макроглобулинемии Вальденстрема, дебютировавший тяжелой гемолитической анемией, не поддающейся терапии, а основное заболевание протекало с нетипичной клинической картиной и лабораторными данными. Лишь углубленное дополнительное исследование позволило установить правильный диагноз, добиться улучшения всех показателей на основе назначенного патогенетического лечения.
Макроглобулинемия Вальденстрема, аутоиммунная гемолитическая анемия, клинический случай, трудность диагностики, проба Кумбса, иммунофенотипирование, иммуногистохимия
Короткий адрес: https://sciup.org/170209412
IDR: 170209412
Текст научной статьи Клинический случай макроглобулинемии Вальденстрема, дебютировавший гемолитической анемией
Макроглобулинемия Вальденстрема (МВ) – довольно редкая патология, в соответствии с классификацией опухолей гемопоэтической и лимфоидной тканей ВОЗ (2022) представляет собой заболевание, сочетающее поражение костного мозга лимфоплазмоцитарной лимфомой (ЛПЛ) и секрецию моноклонального иммуноглобулина М (IgM). Диагностика МВ, особенно в дебюте заболевания, может вызвать затруднения, так как с иммунной активностью патологического IgM некоторые авторы связывают развитие тромбоцитопении, аутоиммунной гемолитической анемии, холодовой гемолиз и другую нетипичную симптоматику болезни [1]. Данный macroglobulinemia is presented, which debuted with severe hemolytic anemia that is not amenable to therapy, and the underlying disease proceeded with an atypical clinical picture and laboratory data. Only an in-depth additional study made it possible to establish the correct diagnosis and achieve an improvement in all indicators based on the prescribed pathogenetic treatment.
клинический случай интересен тем, что у пациента с рецидивирующим кризовым течением гемолитической анемии (ГА), плохо поддающейся лечению, в последующем установлен диагноз лимфопролиферативного заболевания – макроглобулинемия Вальденстрема с гемолитическим компонентом. А назначенная патогенетическая терапия привела к стабилизации клинико-лабораторных показателей и улучшению состояния больного. Течение МВ отличается чрезвычайным разнообразием, поэтому описания клинических наблюдений вызывают повышенный практический интерес.
Цель работы — представить некоторые особенности проявления и дебюта МВ, с целью ранней на- стороженности на развитие лимфопролиферативного заболевания, дифференциальной диагностики и назначения раннего эффективного специфического лечения пациентов.
Клиническое наблюдение
Пациентка С , 68 лет (1955 г . р .) , в мае 2023 г. обратилась к участковому терапевту с жалобами на слабость, головокружение, головную боль, одышку, утомляемость, боль по всему телу, шум в голове, бледность и желтушность кожных покровов.
Из анамнеза известно, что с 2018 г. наблюдается по поводу артериальной гипертензии (АГ). В 2020 г. трижды перенесла коронавирусную инфекцию, осложнившуюся пневмонией, получала стационарное лечение в Республиканской клинической инфекционной больнице Республики Башкортостан.
В мае 2023 г. больная была госпитализирована в терапевтическое отделение ГБУЗ РБ Дюртюлинская ЦРБ с диагнозом: анемия неуточненного генеза. В анализах наблюдалась нормоцитарная анемия средней степени тяжести. На УЗИ (от 25.05.2023) выявлено незначительное увеличение селезенки до 143
х 70мм, однородной структуры. Диффузные изменения поджелудочной железы. Для уточнения диагноза была направлена на консультацию к гематологу в РКБ им Г.Г. Куватова.
За период 21.05.2023 г. по 20.12.2023 г. неоднократно госпитализировалась в гематологическое отделение с диагнозом аутоиммунная гемолитическая анемия (АИГА), тяжелое течение, гемолитический криз. Диагноз был установлен на основании жалоб, нормоцитарной анемии тяжёлой степени, гипербилирубинемии за счет непрямого билирубина, положительной пробы Кумбса (прямая, непрямая), повышения активности ЛДГ в сыворотке в 2–5 раз (таблица 1-2), данные миелограммы и другие лабораторные и инструментальные исследования приведены ниже. Получала переливание отмытых эритроцитов по подбору, глюкокортикостероиды (ГКС) по схеме 1-2 мг/кг в сутки, с последующим снижением дозы согласно стандарту лечения АГА, с кратковременным эффектом.
Таблица 1
Общий анализ крови в динамике
|
Показатель |
11.04.2023 |
27.09.2023 |
20.11.2023 |
15.01.2024 |
18.03.2024 |
31.07.2024 |
|
Лейкоциты, × 109/л |
7,5 |
7,2 |
6,1 |
7,4 |
2,9 |
2,4 |
|
Эритроциты, × 1012/л |
3,79 |
1,73 |
2,13 |
1,72 |
2,96 |
3,29 |
|
Гемоглобин, г/л |
119 |
59 |
72 |
64 |
100 |
111 |
|
Тромбоциты, × 109/л |
160 |
208 |
187 |
164 |
126 |
101 |
|
Сегментоядерные нейтрофилы, % |
39,6 |
55,9 |
53,5 |
38,4 |
41,6 |
56,1 |
|
Палочкоядерные нейтрофилы, % |
3 |
4 |
3,3 |
2,8 |
1,2 |
1,3 |
|
Лимфоциты, % |
48,8 |
28 |
28 |
2,9 |
27,4 |
26 |
|
Моноциты, % |
7,4 |
8 |
4,0 |
17 |
18,2 |
11 |
|
СОЭ, мм/ч |
46 |
48 |
73 |
46 |
12 |
|
|
MCV |
86,7 |
103,4 |
102,4 |
107,1 |
96,1 |
91,6 |
|
MCHC |
360 |
330,0 |
330,0 |
350 |
28,5 |
33,6 |
Прямая проба Кумбса (11.04.2023) – обнаружено грамма от 11.06.2024 г.: фибринорген 3,14г/л, ПТИ 4+, непрямая проба Кумбса – 3+, β2-микроглобулин 88,7%, ПТВ 11сек., МНО 1,06, АЧТВ 38,6 сек.
сыворотки крови от 11.06.2024 г. – 2,8 мг/л. Коагуло-
Таблица 2 Биохимический анализ крови в динамике
|
Показатель |
25.05.2023 |
27.09.2023 |
15.01.2024 |
15.03.2024 |
11.06.2024 |
Референсное значение |
|
Общий белок, г/л |
69,2 |
64,20 |
66,49 |
63,90 |
71,64 |
66–83 |
|
Глюкоза, ммоль/л |
5,97 |
4,61 |
5,55 |
3,42 |
3,96 |
4,1–5,9 |
|
Креатинин, мкмоль/л |
75 |
107,1 |
221,1 |
98,4 |
98,9 |
58–96 |
|
Мочевина, ммоль/л |
10,5 |
6,20 |
7,35 |
8,60 |
8,06 |
1,8–6,4 |
|
Мочевая кислота, мкмоль/л |
- |
445,5 |
596,4 |
270 |
154–357 |
|
ЛДГ, МЕ/л |
- |
561 |
665 |
302 |
25–247 |
|
|
Щелочная фосфатаза ЕД/л |
71,7 |
76 |
70 |
88 |
67,24 |
30-120 |
|
Билирубин общий мкмоль/л |
35,06 |
61,90 |
57 |
27,5 |
20,55 |
5-21 |
|
АСТ Ед/л |
27,87 |
34,4 |
38 |
28,8 |
24,53 |
0-31 |
|
АЛТ Ед/л |
14,56 |
17,1 |
70 |
20,5 |
17,81 |
0-35 |
|
Калий (К) ммоль/л |
3,89 |
4,07 |
4,33 |
4,59 |
3,5-5,1 |
|
|
Кальций (Сa) ммоль/л |
2,28 |
2,34 |
2,2 |
2,15-2,55 |
Миелограмма (от 20.06.2023): лейко-эритробластическое отношение 1:1,7, индекс созревания нейтрофилов 0,4, нормобласты оксифильные 26,5, нор-мобласты полихроматофильные 31,5, нормобласты базофильные 5,0, эозинофилы сегментоядерные 4,0, нейтрофилы сегментоядерные 7,5, нейтрофилы палочкоядерные 6,5, нейтрофильные метамиелоциты 2,5, нейтрофильные миелоциты 3,0, плазматические клетки 0, мегакариоциты 18,0, мегакариоцитарный росток сохранен, миелоидный росток сужен. Раздражение эритроидного ростка, тип кроветворения нор-мобластический.
АИГА принято делить на 4 варианта: АИГА с тепловыми агглютининами (70-80% случаев), болезнь холодовых агглютининов первичная (БХА), АИГА смешанного типа (Ig G+C3), пароксизмальная холодовая гемоглобинурия (анемия Donath-Landsteiner). Поскольку возможности исследования компонентов комплемента на поверхности эритроцитов не было, рабочим диагнозом была АИГА с тепловыми агглютининами. Однако, учитывая возраст, спленомегалию, незначительный эффект от лечения, отсутствие каких-либо специфических признаков онкогемато-логического заболевания, для дифференциальной диагностики с лимфопролиферативными заболеваниями, вторичной АИГА, проведено иммунофеноти-пирование (ИФТ) клеток крови и костного мозга (от 20.06.2023). Выявлен лимфоцитарный тип иммунограммы за счет высокого содержания В-лимфоцитов с иммунофенотипом CD45+hi CD19+hi CD20+hi CD22+hi CD79b+hi CD79a+ FMC7+hi CD5- CD23- CD10-CD38- CD138-. легкие цепи иммуноглобулинов не выявлены. Т-клеточное звено характеризуется низким содержанием CD3+CD4+Т-лимфоцитов. Заключение: не исключается В-клеточная лимфома CD5-. По данному иммунофенотипу можно было думать о ЛПЛ, лимфоме маргинальной зоны (ЛМЗ), БХА-ассоциированномм ЛПЗ костного мозга. Фенотип CD10- исключает ФЛ, CD5- ХЛЛ и МКЛ.
Учитывая прогрессирование заболевания и недостаточную эффективность лечения, усиление болей в позвоночнике, пациентку направили на протонноэмиссионную томографию (ПЭТ КТ) (07.11.2023). Заключение: спленомегалия без патологической фиксации РФП. Достоверных ПЭТ/КТ данных о наличии неопластического процесса с гиперфиксацией РФП на момент исследования не получено.
За период 20.12.2023 г. по 19.03.2024 г. состоя- ние пациентки с отрицательной динамикой: снижение уровня гемоглобина до 56 г/л, эритроцитов до 1,45×109/л, нарастающая слабость, головные боли, утомляемость, пастозность нижних конечностей. С учетом появившейся боли в левой половине грудной клетки и левом подреберье, усиливающихся при движении и смене положения, пациентку направили на рентгенографию ребер и позвоночника. Были выявлены R-признаки патологического перелома бокового отрезка 8 ребра слева, полисегментарного остеохондроза грудного и поясничного отделов позвоночника. Не исключается плазмоцитома тела Th 12, L4 позвонков, компрессионный перелом Th 12 позвонка. Заключение: исключить миеломную болезнь.
С учетом неоднозначности полученных ранее результатов: плазматических клеток в миелограмме до 10%, отсутствие гиперпротеинэмии, М градиента, CD38 и CD138 не выявлены, проведена повторная трепанобиопсия с пересмотром в НМИЦ гематологии (от 09.01.2024). Заключение: костный мозг с участками повышенной клеточности за счёт расширения эритроидного ростка. Мегакариоциты расположены неравномерно, обычной морфологии. Гранулоцитарный росток представлен элементами разной степени зрелости. Интерстициально рассеяны мелкие лимфоидные клетки, определяются плазматические клетки (вне зон сосудов), в строме видны зёрна гемосидерина. при просмотре сканов ИГХ-препаратов: ИГХ-реакция носит преимущественно слабый характер экспрессии (условия декальцинации?). В-клетки (CD20+) и Т-клетки (CD3+) немногочисленны. Вместе с тем отсутствуют реакции с антителами к CD138. Заключение: по клинико-лабораторным данным морфологическая картина подозрительна по принадлежности к минимальному поражению при ма-кроглобулинемии Вальденстрема/лимфоплазмоци-тарной лимфоме. Рекомендуется исследование на наличие mut MYD88, однако оно не было выполнено по техническим причинам.
Проведено иммунохимическое исследование белков сыворотки и мочи (от 17.01.2024). Электрофоретические исследование белков сыворотки крови: альбумин 59,4%, глобулины альфа1 – 6,7+++, аль-фа2 – 8,6, бета – 8,6, гама – 16,7. М-градиент в гама2 зоне образован парапротеином Мк и составляет 4 г/л (Рисунок 1). Количественное исследование белков сыворотки крови: общий белок 64 г/л, IgG 92 МЕ/ мл, IgA 28 МЕ/мл, IgM 808 МЕ/мл, криоглобулины
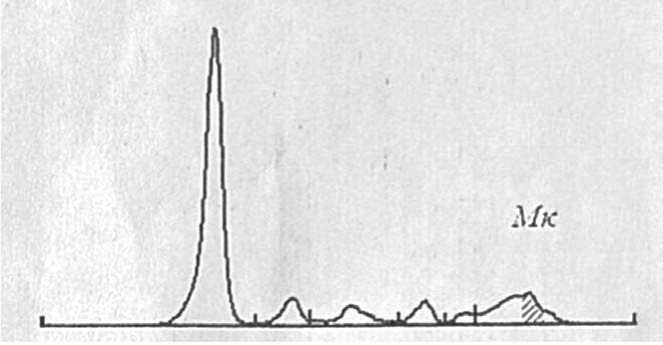
Рисунок 1. Электрофорез белков сыворотки крови
отсутствуют. Электрофоретические признаки воспалительной диспротеинемии. Белок Бен Джонса не выявлен. Заключение: моноклональная секреция Мк (4,0 г/л). Вторичная гипогаммаглобулинемия. В динамике анализ на Ig M: 5,1 г/л (от 22.12.2024), 8,0 г/л (от 12.01.2024).
По УЗИ в течение года без особой динамики (от 18.03.2024): УЗ–признаки диффузных изменений печени по типу жирового гепатоза, поджелудочной железы. Гепатоспленомегалия (печень: правая/д – 148×100, левая/д – 113×65). Добавочная долька селезенки (24×22мм), однако к концу проводимой терапии органомегалия не выявлялась.
Учитывая результаты лабораторных и инструментальных исследований, клиническое течение заболевания был пересмотрен диагноз.
Основное заболевание: С 88.0 Макроглобулинемия Вальденстрема/Лимфоплазмоцитарная лимфома M kappa. Низкий риск.
Осложнения: Остеодеструктивный процесс (патологический перелом бокового отрезка 8 ребра слева, компрессионный перелом Th 12 позвонка). Хронический болевой синдром. Оценка боли по ВАШ 0-1 балл. Вторичная АИГА, не исключается БХА.
Назначено лечение по схеме BR (Бендамустин, Ритуксимаб). Рост 165 см, вес 85 кг; площадь поверхности тела ППТ: 1,97 м2. Проведено 6 курсов BR с положительной динамикой клинических проявлений: боли практически не беспокоят, меньше слабость, пациентка активна, самостоятельно себя обслуживает, улучшился аппетит, купировалась желтуха, анемический, гемолитический синдромы, новых проявлений заболевания нет. По лабораторным данным: эритроциты повысились с 1,73 до 3,37× 1012/л , Нв с 57 до 111 г/л, нормализовались СОЭ от 73 до 46-12мм/ч, билирубин с 61 до 12 мкмоль/л, ЛДГ с 665 до 208 МЕ/л, мочевая кислота с 596 до 270 мкмоль/л (таблица 1-2), уровень IgM сыворотки снизился на 90%. По данным УЗИ в динамике наблюдается уменьшение размеров селезенки: 143×70мм – 132×65мм. У пациентки констатирован очень хороший частичный ответ, продолжает динамическое наблюдение у гематолога.
Обсуждение
Заболеваемость МВ встречается от 2 до 5 случаев на 1 млн населения в год, что составляет около 2% от всех гемобластозов. Этот показатель имеет максимальное значение на шестом – седьмом десятилетии жизни с медианой возраста пациентов 63 года, и реже встречается у пациентов моложе 40 лет [1, 4]. Соотношение мужчин: женщин – 3,2:1 [4]. Классическое определение ЛПЛ/МВ по ВОЗ подразумевает инфильтрацию костного мозга ЛПЛ не менее 10% исследованного объема ткани с секрецией IgM. Однако МВ часто диагностировать непросто в связи с возможным латентным течением, многообразием клинико-морфологических изменений и в редких случаях с клинической картиной схожей с гемолитической анемией [3]. В литературе очень мало описаний ЛПЛ/МВ с АИГА с тепловыми агглютининами, чаще всего развивается вторичная БХА. Причем 90% случаев БХА – это антитела изотипа IgM kappa. Данный клинический случай МВ показывает, что заболевание иногда может протекать не типично: дебютировать с гемолитической анемии, без протеинемии, при нормальных показателях электролитов, со скудной инфильтрацией ЛПЛ костного мозга, отсутствием CD138 позитивных клеток, что затруднило и отсрочило постановку диагноза МВ с начала обращения пациентки, а проводимое лечение глюкокортикостероидами по поводу АИГА было недостаточно эффективным. Только появление в дальнейшем боли в области груди, усиливающейся при смене положения тела, данных рентгенографии грудной клетки и позвоночника, где был выявлен перелом бокового отрезка 8 ребра слева, компрессионный перелом Th 12 позвонка, нацелили на дальнейший диагностический поиск. Повторная трепанобиопсия костного мозга с пересмотром в НМИЦ гематологии, позволила заподозрить минимальное поражение при макроглобулинемии Вальденстрема/лимфоплазмоцитарной лимфоме. Европейский консорциум по МВ опубликовал в 2023 году обзор, где снят порог инфильтрации костного мозга ЛПЛ в 10% [9]. В последние годы опубликованы важные достижения в понимании биологии МВ, что привело к увеличению набора инструментов для дифференциальной диагностики. Используя секвенирование всего генома, Треон и др. [10] идентифицировали MYD88 L265P как высокорецидивирующую (~95%) соматическую мутацию у пациентов с МВ. В дальнейшем было подтверждено, что MYD88 L265P присутствует у >90% МВ, тогда как она отсутствует у пациентов с множественной миеломой (MM) (включая изотип IgM) и реже встречается при лимфоме маргинальной зоны (ЛМЗ) с плазмацитарной дифференцировкой или хроническом лимфоцитарном лейкозе (ХЛЛ) [9]. Таким образом, оценка MYD88 L265P считается решающей для различения МВ и других ЛПЗ с перекрывающимися клиническими признаками, однако в рутинной клинической практике такое исследование доступно не всем, еще недостаточно стандартизировано для обеспечения окончательного диагноза. Диагностические критерии МВ по-прежнему требуют гистологической оценки биопсии для постановки диагноза [1].
Проведенное нами в дальнейшем иммуногистохимическое исследование белков сыворотки и мочи, электрофоретическое исследование, выявление моноклональной секреции Мк, вторичной гипогам-маглобулинемии позволили установить окончательный диагноз макроглобулинемии Вальденстрема и провести патогенетичское лечение по схеме BR (6 курсов на момент описания) с выраженным положительным клинико-лабораторным эффектом как по болевому синдрому, так и по проявлениям гемолиза, улучшению показателей красной крови до легкой степени анемии и нормализации остальных показателей общего анализа и биохимии. Получен очень хороший частичный ответ. Пациент продолжает наблюдение у гематолога без специфического лечения. Оптимальным иммунохимиотерапевтическим методом лечения в настоящее время является режим BR. Однако, учитывая современные рекомендации по лечению МВ, в последующем, в терапии рецидива, возможно назначение эффективных таргетных препаратов, например, ингибиторов брутонкиназы или иных схем лечения. Ибрутиниб демонстрирует также высокую эффективность в первой линии терапии МВ, а в сочетании с ретуксимабом, по данным исследования INNOVAT, беспрогрессивная выживаемость пациентов еще выше [7, 8, 9].
Заключение . Представленный клинический случай макроглобулинемии Вальденстрема, дебютировавший с гемолитической анемии, еще раз обращает внимание практикующих врачей на тот факт, что клиника лимфопролиферативных заболеваний может проявляться признаками выраженного гемолиза, и необходимо учитывать это в диагностическом поиске для ранней диагностики МВ, подборе соответствующей патогенетической терапии, для успешного раннего лечения основного заболевания.
Потенциальные конфликты интересов .
Aвторы заявляют об отсутствии конфликтов интересов.
Источники финансирования . Исследование не имело спонсорской поддержки.
Вклад авторов . Все авторы подтверждают соответствие своего авторства, согласно международным критериям ICMJE. При этом наибольший вклад распределен следующим образом. Концепция и дизайн: Г.Ш. Сафуанова. Сбор и обработка данных: Г.Ш. Сафуа-нова, Ш.К. Акобиров. Предоставление материалов исследования: А.А. Латыпова, Е.Г. Царёва, Т.Ю. Рожень-кова, Ч.Х. Валиахметова. Анализ и интерпретация данных: все авторы. Подготовка рукописи: все авторы. Окончательное одобрение рукописи: Г.Ш. Сафуа-нова
Согласие на публикацию . От пациента получено письменное информированное согласие на публикацию.
Этическое одобрение . Не требуется.


