Клинический случай плеоморфной саркомы молочной железы
Автор: Петровский В.Ю., Троценко С.Д., Шерстнева Т.В., Большакова С.А., Жданова О.В., Измайлов Т.Р.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Клинические наблюдения
Статья в выпуске: 4 т.20, 2020 года.
Бесплатный доступ
В статье рассмотрено комбинированное лечение редкого случая плеоморфной саркомы молочной железы у женщины 49 лет. Описанный случай показывает сложности постановки диагноза и возможности современного комбинированного лечения по условно-радикальной программе лечения у больной с плеоморфной саркомой молочной железы с применением современных хирургических подходов и режимов фракционирования облучения. Использование такого подхода позволило получить хорошие непосредственные результаты лечения при минимальных осложнениях и без ухудшения качества жизни. В ряде случаев возможно и полное излечение пациентов со злокачественными опухолями при неблагоприятных гистологических формах, в частности таких, как плеоморфная саркома молочной железы.
Плеоморфная саркома, молочная железа, лучевая терапия, комбинированное лечение
Короткий адрес: https://sciup.org/149132153
IDR: 149132153
Текст научной статьи Клинический случай плеоморфной саркомы молочной железы
В последние десятилетия отмечается рост заболеваемости рака молочной железы в России и мире [1]. Саркома молочной железы – это редкий тип новообразований, возникающий из мезенхимальной ткани молочной железы, которая включает в себя широкий спектр гистологических подтипов, происходящих из различных клеточных линий, такие как фиброзная, жировая, эндотелиальная и мышечная ткани. На долю саркомы молочной железы приходится от 0,2% до 1% всех злокачественных новообразований молочной железы и менее 5% всех сарком мягких тканей, ежегодная заболеваемость составляет 4,6 новых случая на миллион женщин [2, 3, 7 – 9, 10, 12, 15 – 18, 21]. Впервые саркома молочной железы описана О'Брайеном и Стаутом в 1964 году как саркома мягких тканей, состоящая из фибробластоподобных и гистиоцитоподобных клеток, смешанных с плеоморфными гигантскими и воспалительными клетками [4]. На 2017 год в мире было зарегистрировано только 65 случаев плеоморфной саркомы молочной железы [4]. Первичные формы выявляются у женщин в основном в среднем возрасте, медиана возрастной заболеваемости составляет 40 лет [9, 12, 16].
Первичная саркома молочной железы возникает из мезенхимальной ткани молочной железы. Предрасполагающие факторы для саркомы не имеют известной этиологии. Как и с другими саркомами мягких тканей, существуют генетические предпосылки, которые связаны с более высоким риском развития сарком молочной железы, включая синдром Ли-Фраумени, семейный аденоматозный полипоз и нейрофиброматоз [14, 20]. Так, первичная саркома молочной железы включает в себя злокачественную фиброзную гистиоцитому, фибросаркому, стромальную саркому, веретенообразную саркому, липосаркому, лейомиосаркому, остеосаркому, хондросаркому, лимфомы, злокачественные листовидные (филлоидные) оухоли и рабдомиосаркомы, из которых наиболее распространенными подтипами являются ангиосаркома, злокачественная фиброзная гистиоцитома и стромальная саркома. Среди первичных сарком молочной железы доля ангиосарком, описанных в литературе, колеблется от 41% до 92% [19]. Smith с соавторами сообщают, что саркома молочной железы может сопровождаться остеоидными кальцификациями в 21% случаев и указывают на разницу в морфологии, контрастирующую с микрокальцификациями, наблюдаемыми при протоковых карциномах [22].
Биопсия необходима для подтверждения диагноза саркомы и должна быть выполнена путем получения множественных биопсий (по крайней мере четыре) с использованием иглы 16G или больше. Тонкоигольная аспирация не рекомендуется, так как она не дает достаточного количества материала ткани для гистопатологической оценки и окончательного диагноза [22]. Постановка правильного диагноза и своевременность начала лечения очень важны при данной патологии, так как это очень агрессивная опухоль с высокой частотой рецидивов и отдаленных метастазов [3, 9]. Исследование предполагаемой саркомы молочной железы включает в себя проведение маммографии, УЗИ молочной железы, биопсии и магнитно-резонансной томографии молочной железы (МРТ) после подтверждения гистологического диагноза [22].
Дифференциальный диагноз опухолей молочной железы широк и включает инвазивную карциному молочной железы, воспалительный рак молочной железы, лимфому молочной железы, листовидная (филлоидная) опухоль, метапластическую карциному и саркому (особенно лейомиосаркому и рабдомиосаркому), метастазирующую из другого первичного очага. Саркомы, происходящие из грудной клетки, также могут проникать в молочную железу [4, 22, 23].
Саркома молочной железы отличается от метапластических карцином (карциносарком). Так, метапластические карциномы характеризуются наличием как веретенообразных, так и эпителиальных клеточных компонентов, и положительно окрашиваются на кератин и/или р63. Карциносаркомы ведут себя более похоже на эпителиальные опухоли с более высокой частотой метастазов в лимфоузел (34%) по сравнению с саркомой молочной железы [22].
Стадирование по TNM системе саркомы молочной железы проводится в соответствии с восьмым изданием системы Американского Объединенного Комитета по Раку (AJCC). ТNМ система не является специфичной для саркомы и была принята из классификации ТNМ саркомы конечностей. T1 характеризуют первичные опухоли от 5 см или меньше в наибольшем измерении, Т2 – от 5 см до 10 см в наибольшем измерении, Т3 – от 10 см до 15 см в наибольшем измерении, Т4 – более 15 см в наибольшем измерении. Поверхностные опухоли, не вовлекающие фасцию, определяются как Та, а глубокие опухоли, вовлекающие фасцию или под фасцией, как Тб. Позитивные лимфатические узлы встречаются редко при саркоме молочной железы, но если они положительны, то заболевание относят к N1 (стадия III), которое имеет более неблагоприятный прогноз. Любой отдаленный метастаз характеризуется как М1 (стадия IV). Степень, размер опухоли и гистологический подтип являются важными прогностическими факторами. По данным наиболее широко используемой классификационной системы Французской федерации онкологических центров (FNCLCC) класс опухоли устанавливается на основании дифференцировки, митотической активности и наличии некроза [22]. Степень злокачественности сарком мягких тканей по этому методу определяется по сумме следующих трех показателей. Первый показатель дифференцировка опухоли: 1 балл – саркомы близкие по строению к нормальной ткани, например, высокодифференцированная липосаркома; 2 балла – саркомы, у которых возможно определение гистологического типа, например, бифазная синовиальная саркома; 3 балла – эмбриональные саркомы, недифференцированные саркомы и саркомы неопределенного типа. Второй показатель – количество митозов: 1 балл – 0–9 в 10 полях (поле 0,1734 мм2); 2 балла – 10–19 в 10 полях; 3 балла – более 20 в 10 полях. Третий показатель – количество некротизированных опухолевых клеток: 0 баллов – нет некрозов; 2 балла – некроз менее 50% опухолевых клеток; 3 балла – некроз более 50% опухолевых клеток. Общая сумма всех трех показателей, составляющая 2–3 балла соответствует G1, 4–5 баллов – G2 и свыше 6 баллов – G3.
Метастазирование в региональные лимфатические узлы составляет менее 5%, и сообщается только при некоторых гистологических подтипах сарком (эпителиоидные, синовиальные, ангиосаркомы, рабдомиосаркомы), где частота метастазирования в лимфатические узлы может достигать 20–36%, а гематогенное распространение чаще в легкие, костный мозг и печень [ 12, 13, 16, 18].
Оптимальное лечение саркомы молочной железы осуществляется мультидисциплинарной рабочей группой, и пациенты должны лечиться согласно рекомендациям, относящимся к саркомам мягких тканей [17]. Нет окончательного консенсуса относительно лечения сарком молочной железы. Из-за редкости и гетерогенности сарком молочной железы не существует никаких рекомендаций или опубликованных рандомизированных исследований, подтверждающих какую-либо конкретную стратегию лечения. Однако существует общее мнение, что хирургическое иссечение с адекватными краями, свободными от раковых клеток, всегда должно быть первым этапом лечения. Стандартным хирургическим лечением является мастэктомия, которая должна включать в себя иссечение обеих основных грудных мышц, чтобы уменьшить частоту локальных рецидивов [2, 5, 6, 9, 15, 16]. Метастазы в регионарные лимфатические узлы является редкостью при саркомах молочной железы, и хирургия выполняется почти всегда с адекватным (Ro) резекционным краем [9, 12, 14–16].
Использование лучевой терапии или химиотерапии в адъювантном режиме, как правило, ограничивается случаями с высоким риском развития локального рецидива [2, 9, 11, 18].
Sarcoma Meta-Analysis Collaboration (SMAC) обновила данные мета-анализа по оценке роли адьювантной химиотерапии (АПХТ) при мягкотканых саркомах в 2008 г. [24]. На сегодняшний день он содержит результаты 18 рандомизированных исследований по 1953 пациентам с резектабельными мягкоткаными саркомами за период 1973 – 2002 гг.
В 5-ти из 18-ти исследований использовалась схема доксорубицин + ифосфамид, в остальных – проводилась монотерапия доксорубицином или использовалась комбинация доксорубицина с другими препаратами. Отмечено достоверное уменьшение уровня местных рецидивов (р=0,03) и отдаленного метастазирования (p=0,0001) [24]. В последнем метаанализе было отмечено увеличение общей выживаемости (ОВ) у пациентов, пролеченных по схеме доксорубицин + ифосфамид. Следует отметить, что в этот мета-анализ не вошли данные большого исследования EORTC 62931 [25] по адьювантной химиотерапии мягкотканных сарком, в котором увеличения ОВ продемонстрировано не было.
В настоящее время среди клиницистов существует консенсус по адъювантной химиотерапии мякготканных сарком, где рекомендуется взвесить все за и против проведения адъювантной химиотерапии. Необходимо оценить физикальный статус и сопутствующие заболевания пациента, локализацию, размер и гистологический подтип опухоли, а также потенциальный риск от введения цитостатиков, возможную токсичность и влияние на качество жизни пациента. Адъювантную химиотерапию рекомендуется проводить пациентам, у которых выявлена опухоль низкой степени дифференцировки, при размере опухоли > 5 см, имеет место рецидив заболевания или признаки регионарного метастазирования [8, 9, 24]. В случае принятия решения в пользу проведения химиотерапии рекомендуется использовать комбинацию доксорубицин + ифосфамид + месна, которая является схемой номер один по имеющимся на сегодняшний день стандартам лечения [26].
Проведение химиотерапии перед хирургическим лечением наиболее широко используется при местно-распространенном раке молочной железы. Данная тактика основывается на результатах большого количества проспективных, рандомизированных, клинических исследований, где четко было продемонстрировано, что более раннее системное лечение микрометастазов рака молочной железы увеличивает выживаемость [27]. Имеющиеся на сегодняшний день данные по мягкотканным саркомам не показывают успешных результатов при проведении неоадъювантной химиотерапии (НАПХТ) [9, 15, 16]. В некоторых исследованиях было продемонстрировано уменьшение размеров опухоли, однако уровень эффективности достаточно низкий – 20–40% [18, 28]. В связи с этим необходимо продолжать исследования для получения ответа на вопрос целесообразности проведения НАПХТ при мягкотканных саркомах.
Также нет единого мнения относительно применения адъювантной лучевой терапии. Польза в улучшении безрецидивной выживаемости не ясна до настоящего времени [2, 9, 16]. Некоторые исследователи приходят к выводу, что локорегиональная частота рецидивов уменьшается, как это было показано в анализе Johnstone Р.А. с соавторами, который включал 10 пациентов с неметастатическими первичными саркомами молочной железы, которые получали лечение в виде мастэктомии и адъювантной лучевой терапии [15]. Имеются данные о преимуществе адъювантной лучевой терапии при больших (> 5 см), высокодифференцированных опухолях или у пациентов с положительными хирургическими краями в снижении частоты локорегионарных рецидивов, но влияние на общую выживаемость остается неопределенным [17, 19]. Исследования показали, что 5-летняя выживаемость без прогрессирования находится в диапазоне от 44 до 66% и 5-летняя общая выживаемость составляет от 49 до 67%. Саркомы молочной железы обычно имеют плохой прогноз, с высоким риском рецидива, 80% из которых развиваются в течение первых 2 лет после постановки диагноза [8, 14, 18 –20].
Клинический пример
Пациентка Ш. 1971 г.р. Со слов пациентки в марте 2019 года в НМХЦ им.
Пирогова выявлено образование до 6 см в правой молочной железе (УЗИ, маммография). По результатам гистологического исследования установлен диагноз филлоидной опухоли. От хирургического лечения пациентка отказалась, потом к врачам не обращалась. С декабря 2019 отмечает рост образования (Рис. 1).
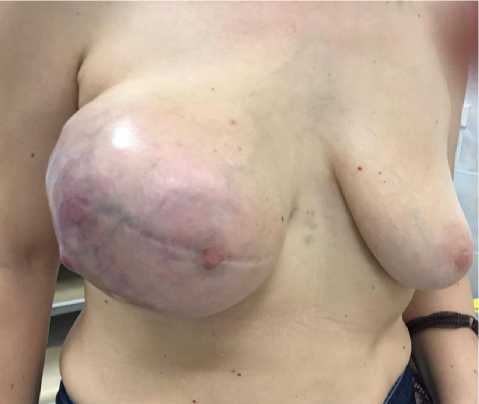
Рис 1. Внешний вид молочной железы до операции.
Больная провела контрольные обследования – УЗИ молочных желез, маммографическое исследование (Рис. 2) . На маммограмах правой молочной железы в кранео-каудальной и латеро-медиальной проекциях на фоне фиброзной мастопатии определяется объемное образование гомогенной структуры размерами 14,5 см х 10,0 см, занимающее практически все квадранты молочной железы, отмечается неоднородность нижне-внутреннего контура видимого образования. Аксиллярные лимфоузлы не определяются.
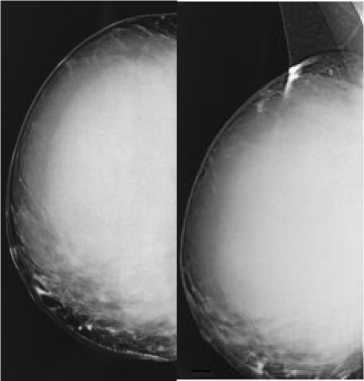
Рис. 2. Маммограммы правой молочной железы.
По данным контрольного обследования отмечено увеличение размеров данного новообразования, проведена контрольная аспирационная cor-биопсия.
При гистологическом исследовании (пересмотр в двух лечебных учреждениях г. Москвы) – картина низкодифференцированной злокачественной опухоли, возможно саркомы. При УЗИ молочных желез от 22.04.2020 – правая молочная железа практически полностью представлена солидным образованием с вертикальным диаметром до 8 см. По данным ПЭТ-КТ от 16.06.2020 (Рис. 3, 4) – объемное метаболически активное образование правой молочной железы 126 х 114 х 153 мм (SUVmax – 30.81).
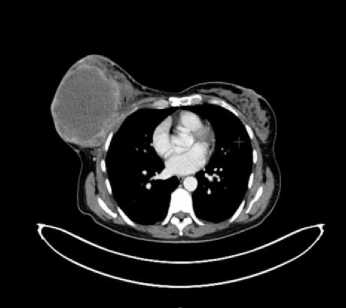
Рис 3. ПЭТ /КТ аксиальный скан. ПЭТ/КТ образования правой молочной железы
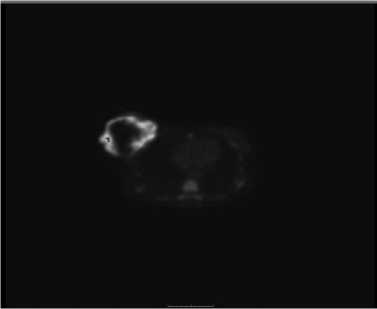
Рис. 4. Объемное образование правой молочной железы с гиперметаболизмом глюкозы.
Больная дала согласие на хирургическое лечение. Пациентке 08.07.2020 выполнено хирургическое лечение в объеме модифицированной мастэктомии справа с пластическим закрытием дефекта передней грудной стенки (Рис. 5).
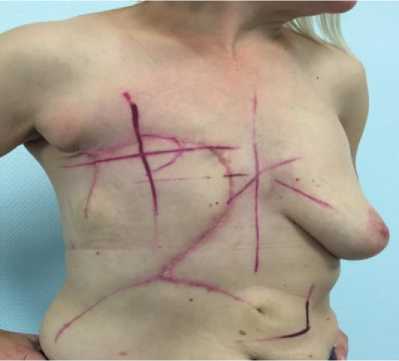
Рис 5. Внешний вид ложа молочной железы после операции.
При гистологическом и ИГХ исследовании – недифференцированная плеоморфная саркома, в 27 из 27 лимфоузлов без опухолевого роста. Установлен диагноз – недифференцированная плеоморфная саркома правой молочной железы рT4NоMоRo, G3, Cd117+, panCK(-), Er (-), Pr (-), Her2(-). III B стадия.
Пациентка была проконсультирована радиотерапевтом, рекомендован курс конформной в 3D режиме постоперационной дистанционной лучевой терапии на ложе правой молочной железы до СОД 50 Гр-экв. Проведен консилиум в составе врача- радиотерапевта, онколога-химиотерапевта, хирурга. Больная поступила для проведения конформной дистанционной лучевой терапии. При визуальном осмотре постоперационный рубец без признаков воспаления и уплотнений (Рис. 5). При пальпации регионарные лимфатические узлы без особенностей, периферических отеков нет. Контрольное УЗИ мягких тканей грудной клетки / регионарных лимфатических узлов, КТ ОГК – без признаков прогрессирования. Больной проведен постоперационный курс конформной лучевой терапии на ложе молочной железы / грудной клетки справа с захватом зон субклинического распространения под контролем портальной визуализации РОД 2.5 Гр до СОД 50 Гр-экв. (Рис. 6 – 8). Лечение перенесла удовлетворительно. При завершении лучевой терапии явления лучевого эпидерматита 1 ст. по RTOG, не требующие специального лечения, общий статус соматически без отрицательной динамики по ECOG (1 ст.). При выписке и контрольном обследовании – ремиссия заболевания.
Рис.6. КТ топометрический скан.
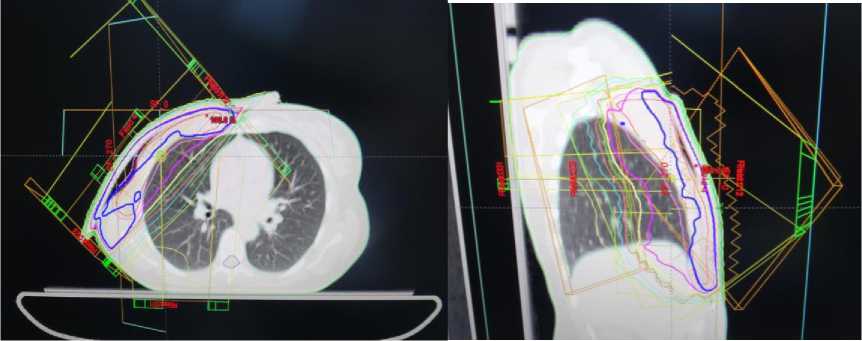
Рис.7. Дозиметрический план лучевого лечения.
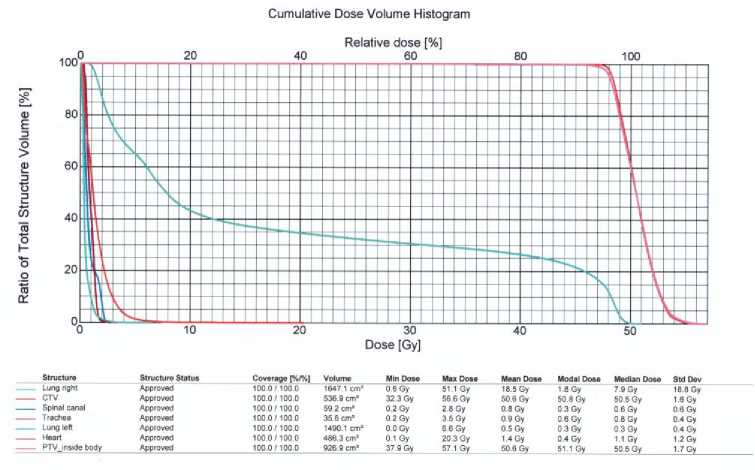
Рис. 8. Гистограмма облучения грудной стенки справа.
Заключение
Рассмотренный клинический случай показывает, что возможно проведение комбинированного лечения у больных с плеоморфной саркомой молочной железы с применением достаточно эффективных режимов фракционирования и с хорошими непосредственными результатами лечения, минимальной лучевой токсичностью и без ухудшения качества жизни.
Список литературы Клинический случай плеоморфной саркомы молочной железы
- Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2018 году. М.: МНИОИ им. П.А. Герцена филиал ФГБУ «НМИЦ радиологии» Минздрава России. 2019. С. 236.
- Самойлов А.С., Удалов Ю.Д., Восканян С.Э. и др. Хирургическое лечение рецидивной липосаркомы верхней конечности. Исследования и практика в медицине. 2020. Т. 7. № 1. С. 66-74.
- O’Brien J.E., Stout A.P. Malignant fibrous xanthomas. Cancer. 1964. V. 17. P. 1445-1455.
- Bansal A., Kaur M., Dalal V. Pleomorphic sarcoma of breast: a report of two cases and review of literature. Acta Med Iran. 2017. V. 55. No. 4. P. 272-276.
- Qiu S.Q., Wei X.L., Huang W.H., et al. Diagnostic and therapeutic strategy and the most efficient prognostic factors of breast malignant fibrous histiocytoma. Sci Rep. 2013. V. 3. Article ID 2529.
- Pollard S.G., Marks P.V., Temple L.N., Thompson H.H. Breast sarcoma. A clinicopathologic review of 25 cases. Cancer. 1990. V. 66. No. 5. P. 941-944.
- Ramalho I., Campos S., Rebelo T., Dias M.F. A scary onset of a rare and aggressive type of primary breast sarcoma: a case report. Case Rep Oncol. 2016. V. 9. No. 3. P. 796-801.
- Al-Benna S., Poggemann K., Steinau H.U., Steinstraesser L. Diagnosis and management of primary breast sarcoma. Breast Cancer Res Treat. 2010. V. 22. No. 3. P 619-626.
- Im C., Li N., Moon W., et al. Breast sarcoma. A case report and review of literature. Int J Surg Case Rep. 2016. V. 24. P. 203-205.
- Nizri E., Merimsky O., Lahat G. Optimal management of sarcomas of the breast: an update. Expert Rev Anticancer Ther. 2014. V. 14. No. 6. P. 705-710.
- Rai M.P., Mannelli V.K., Kandola S., Marinas E.B. Pleomorphic sarcoma of the breast. BMJ Case Rep. 2017. 2017: bcr2017223106. doi: 10.1136/bcr-2017-223106.
- Vergel J.C., Osorio A.M., Garcia Mora M., et al. Breast Sarcomas: Experience of a Reference Center in Colombia. Cureus. 2019. V. 11. No. 7. e5078.
- Duncan M.A., Lautner M.A. Sarcomas of the breast. Surg Clin North Am. 2018. V. 98. No. 4. P. 869-876.
- Lim S.Z., Ong K.W., Tan B.K., et al. Sarcoma of the breast: an update on a rare entity. J Clin Pathol. 2016. V. 69. No. 5. P. 373-381.
- Johnstone P.A., Pierce L.J., Merino M.J., et al. Primary soft tissue sarcomas of the breast: local-regional control with post-operative radiotherapy. Int J Radiat Oncol Biol Phys. 1993. V. 27. No. 3. P. 671-675.
- Shafi A.A, AlHarthi B., Riaz M.M., AlBagir A. Gaint phyllodes tumour with axillary and interpectoral lymph node metastasis; A rare presentation. Int J Surg Case Rep. 2020. V. 66. P. 350-355. 167
- Yin M., Mackley H.B., Drabick J.J., Harvey H.A. Primary female breast sarcoma: clinicopathological features, treatment and prognosis. Sci Rep. 2016. V. 6. Article ID 31497.
- Ramalho I., Campos S., Rebelo T., Figueiredo Dias M. A Scary Onset of a Rare and Aggressive Type of Primary Breast Sarcoma: A Case Report. Case Rep Oncol. 2016. V. 9. No. 3. P. 796-801.
- Miyazaki C., Shiozawa M., Koike R., et al. Neoadjuvant chemotherapy for primary sarcoma of the breast: a case report. Journal of Medical Case Reports. 2019. V. 13. No. 1. Article ID 289.
- Lahat G., Lazar A., Lev D. Sarcoma epidemiology and etiology: potential environmental and genetic factors. Surg Clin North Am. 2008. V. 88. No. 3. P. 451-481.
- Terrier P., Terrier-Lacombe M.J., Mouriesse H., et al. Primary breast sarcoma: a review of 33 cases with immunohistochemistry and prognostic factors. Breast Cancer Res Treat. 1989. V. 13. No. 1. P. 39-48. doi: 10.1007/BF01806549.
- Raghavan D, Ahluwalia M.S., Blanke C.D., et al (eds.). Textbook of Uncommon Cancer, 5th Edition. 2017. Wiley-Blackwell. 1296 p. ISBN: 978-1-119-19620-4.
- Gervais M.K., Burtenshaw S.M., Maxwell J., et al. Clinical outcomes in breast angiosarcoma patients: A rare tumor with unique challenges. J Surg Oncol. 2017. V. 116. No. 8. P. 1056-1061.
- Pervaiz N., Cotterjohn N., Farrokhyer F., et al. A systemic meta-analysis of randomized controlled trials of adjuvant chemotherapy for localized resectable soft-tissue sarcoma. Cancer. 2008. V. 113. No. 3. P. 573-581.
- Noll P.J., Reichardt P., Le Cesne A., et al. Adjuvant chemotherapy with doxorubicin, ifosfamide and lenograstim for resected soft-tissue sarcoma (EORTC 62931): a multicenter randomized controlled trial. Lancet Oncol. 2012. V. 13. No. 10. P. 1045-1054.
- Von Mehren M., Randali R.L., Benjamin R.S., et al. Soft tissue sarcoma, version 2.2016, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw. 2016. V. 14. No. 6. P. 758-786.
- Bousquet G., Confavreux C., Magne N., et al. Outcome and prognostic factors in breast sarcoma: a multicenter study from the rare cancer network. Radiother Oncol. 2007. V. 85. No. 3. P. 355-361.
- DeVita V.T., Lawrence T.S., Rosenberg S.A. DeVita, Hellmann and Rosenberg’s Cancer: Principles & Practice Oncology 11th edition. Walter Kluwer, Philadelphia. 2019. 4361 p.


