Клиническое течение гормонопозитивного Her2/neu-негативного рака молочной железы у носительниц мутаций в гене BRCA2 в сравнении с BRCA1
Автор: Михайлов С.И., Занозина Е.А., Джабраилова Д.Ш., Онофрийчук И.М., Шаталов П.А., Запиров Г.М., Сарибекян Э.К., Максимов К.В., Аблицова Н.В., Хугаева Ф.С., Дуадзе И.С., Ефанов В.В., Замалдинов Н.Д., Золотухина А.С., Лисицина Э.А., Гехт Г.А., Зикиряходжаев А.Д.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Молекулярная медицина
Статья в выпуске: 4 т.25, 2025 года.
Бесплатный доступ
Цель исследования: сравнительный анализ клинического течения гормонопозитивного Her2/neu-негативного рака молочной железы, ассоциированного с мутациями в генах BRCA1 и BRCA2. Материалы и методы. Проведен анализ данных 474 пациенток с герминальными мутациями в генах BRCA1/2, охватывающий все молекулярно-биологические подтипы рака молочной железы. В исследуемую когорту включены 100 больных раком молочной железы I–IIВ стадии с гормонпозитивным, HER2/neu-негативным подтипом, которые были разделены на две группы: основную — 50 пациенток с мутацией в гене BRCA2 и контрольную — 50 пациенток с мутацией в гене BRCA1. Оценивались частота отдаленных, локальных и регионарных рецидивов, смертность от рака молочной железы, а также совокупный показатель любого неблагоприятного события. Результаты. В группе BRCA2 наблюдались более высокие показатели неблагоприятных событий по сравнению с BRCA1: отдаленные рецидивы: 8% против 2% (RR 4,00; 95% ДИ 0,46–34,7; p=0,36); локальные рецидивы: 10% против 6% (RR 1,67; 95% ДИ 0,42–6,63; p=0,72); регионарные рецидивы: 8% против 0% (RR 9,00; 95% ДИ 0,50–162; p=0,12); смерть от рака молочной железы: 6% против 2% (RR 3,00; 95% ДИ 0,32–28,1; p=0,62). Неблагоприятные события отмечены у 32% пациентов в группе BRCA2 по сравнению с 10% в группе BRCA1 (RR 3,20; 95% ДИ 1,27–8,06; p=0,015). Заключение. Несмотря на благоприятный гормоноположительный профиль, у пациенток с мутацией в гене BRCA2 выявлены более высокие риски прогрессирования, рецидивов и смертности по сравнению с пациентками с мутацией в гене BRCA1.
BRCA1, BRCA2, молекулярная генетика, рак молочной железы, ДНК, гормонопозитивный, прогрессирование, рецидив, метастазы, выживаемость
Короткий адрес: https://sciup.org/149150005
IDR: 149150005 | DOI: 10.24412/1999-7264-2025-4-172-186
Текст научной статьи Клиническое течение гормонопозитивного Her2/neu-негативного рака молочной железы у носительниц мутаций в гене BRCA2 в сравнении с BRCA1
Рак молочной железы (РМЖ) представляет собой одну из самых серьезных и актуальных проблем для женщин во всем мире. Он занимает лидирующие позиции как по заболеваемости, так и по уровню смертности, оставаясь одной из ключевых задач современной медицины и общества. Несмотря на значительные успехи в области ранней диагностики, скрининговых программ и совершенствования методов лечения, многие случаи РМЖ по-прежнему связаны не только с внешними факторами риска, но и с наследственной предрасположенностью, которая, в свою очередь, тесно связана с нарушениями в системе поддержания геномной стабильности [1]. Особое внимание в этой группе уделяется молекулярно-генетическим нарушениям, среди которых особое место занимают мутации в гене BRCA2 . Эти мутации имеют высокую клиническую значимость и оказывают значительное влияние на течение заболевания, что делает их объектом пристального изучения.
Ген BRCA2 выполняет фундаментальную роль в механизмах репарации двунитевых разрывов ДНК, обеспечивая генетическую целостность и контроль над клеточным делением. Патогенные варианты этого гена, приводящие к его функциональной недостаточности, запускают каскад молекулярных нарушений, способствующих активации канцерогенеза, неконтролируемому делению клеток и прогрессирующему накоплению мутаций в геноме [2].
Одной из ключевых особенностей BRCA2 -ассоциированных форм РМЖ выступает специфика их молекулярного и биологического профиля. В отличие от опухолей на фоне мутаций в гене BRCA1 , которые, как правило, характеризуются трижды негативным фенотипом, новообразования, обусловленные мутациями в гене BRCA2 , в основном относятся к гормонозависимым (HR+) вариантам. В то же время современные исследования демонстрируют сложную сеть регуляторного взаимодействия между эстрогеновой системой и функцией гена BRCA2 , что определяет не только гистологический облик опухолей, но и варьирует спектр их биологической агрессивности, чувствительности к лечебным вмешательствам и вероятности развития рецидивов [3,4].
Несмотря на стереотипное представление о более благоприятном течении и прогнозе для HR+ опухолей, у носительниц патогенных вариантов BRCA2 фиксируется более высокая частота рецидивирования и прогрессирования заболевания, зачастую превышающая аналогичные показатели даже в группе пациентов с BRCA1 -ассоциированным раком. Эти наблюдения заставляют пересматривать устоявшиеся подходы к стратификации риска и персонализации тактики ведения пациенток с BRCA2 -ассоциированным РМЖ, акцентируя необходимость углубленного молекулярного и клинического анализа в каждом конкретном случае и подчеркивая значение дальнейших исследований для повышения эффективности и прогностической точности современной онкологии.
BRCA2: молекулярная функция и онкологическая значимость
Ген BRCA2 играет ключевую роль в обеспечении стабильности генома и регуляции сложных процессов восстановления ДНК. Он является одним из важнейших онкосупрессоров в организме. Ген BRCA2 расположен на длинном плече 13-й хромосомы (13q12.3). Продукт его экспрессии представляет собой крупный белок, состоящий из более чем трёх тысяч аминокислот, обладающий множеством функциональных особенностей. Белок BRCA2 содержит несколько доменов, которые позволяют ему взаимодействовать с молекулами ДНК и многочисленными белковыми партнёрами [5,6].
Основная функция гена BRCA2 заключается в обеспечении точной и эффективной репарации двунитевых разрывов ДНК с помощью гомологичной рекомбинации — механизма, который позволяет клетке восстанавливать целостность наследственного материала с высокой точностью, минимизируя вероятность ошибок.
Работа гена BRCA2 зависит от множества белковых партнеров. Особенно важным из них является PALB2 (Partner And Localizer of BRCA2) — центральный координирующий белок в пути гомологичной рекомбинации. Он обеспечивает физическое и функциональное взаимодействие между BRCA1 и BRCA2 , что напрямую влияет на эффективность и точность восстановления двунитевых разрывов ДНК. Ключевая роль PALB2 в отношении BRCA2 заключается в его локализации и стабилизации в ядре. C-концевой WD40-домен PALB2 напрямую связывается с BRCA2 , закрепляет его в хроматине и направляет к участкам повреждений. Затем BRCA2 загружает рекомбиназный белок RAD51 на одноцепочечную ДНК, что способствует восстановлению целостности ДНК. Если в организме не хватает PALB2, то BRCA2 теряет свою стабильность в ядре, с трудом формирует репарационные комплексы и не может эффективно инициировать сборку RAD51. В результате нарушаются процессы гомологичной рекомбинации, что, в свою очередь, приводит к повышенной хромосомной нестабильности. Помимо своей основной функции «моста», PALB2 играет важную роль в регуляции выбора пути репарации. Он взаимодействует с факторами ремоделирования хроматина и модуляторами транскрипции, а также регулирует связи BRCA2 с другими партнёрами, такими как EMSY и DSS1 [7,8].
Если функция гена BRCA2 теряется или становится менее эффективной, это значительно нарушает процесс гомологичной рекомбинации. В таких случаях клетка вынуждена использовать менее точные механизмы восстановления, такие как негомологичное соединение концов (NHEJ). Однако этот механизм сопряжён с высоким риском ошибок и приводит к дополнительному накоплению генетических повреждений [9]. Подобная геномная нестабильность, наряду с нарушениями в клеточном цикле, создаёт предпосылки для развития и прогрессирования новообразований [10].
Патогенные варианты гена BRCA2 связаны с повышенным риском развития различных видов рака. У женщин, имеющих такие варианты, вероятность развития рака молочной железы (РМЖ) составляет от 40% до 69% на протяжении жизни. Кроме того, у них повышается риск возникновения эпителиального рака яичников (включая рак маточных труб и первичный перитонеальный рак), который в целом достигает примерно 11–27% за всю жизнь. У мужчин с мутациями в гене BRCA2 также наблюдается повышенный риск развития РМЖ, составляющий примерно 5–10%. Для рака предстательной железы у мужчин с мутациями кумулятивный риск составляет около 20–30%, при этом опухоли у них возникают раньше и протекают более агрессивно по сравнению с общей популяцией. У обоих полов существует повышенный риск развития рака поджелудочной железы, который оценивается примерно в 5–10% за жизнь. Риск возникновения меланомы кожи у носителей мутаций в гене BRCA2 умеренно повышен. Ориентировочные оценки для кожной меланомы составляют 3–5%, однако эти данные могут существенно различаться в зависимости от популяции и исследования. Некоторые исследования, основанные на наблюдениях, предполагают умеренное увеличение риска развития опухолей в верхних отделах желудочно-кишечного тракта у носителей гена BRCA2 . Однако точные цифры и общая картина остаются неясными и зависят от таких факторов, как этническая принадлежность, семейный анамнез и дизайн исследования. У носителей BRCA2 мутаций наблюдается умеренный риск развития меланомы кожи, который, по предварительным оценкам, составляет от 3 до 5%. Кроме того, некоторые исследования предполагают умеренное увеличение риска возникновения опухолей в других отделах желудочно-кишечного тракта [11–13].
В исследовании, проведённом Cole и его коллегами, было установлено, что к 80 годам у людей с мутациями в генах BRCA1 и BRCA2 риск развития рака молочной железы и рака яичников составляет 93% и 25% соответственно. Таким образом, BRCA2 не только выполняет функцию защиты генетического материала, но и является важным показателем индивидуального онкологического риска. Это делает выявление изменений в его работе ключевым аспектом диагностики и лечения онкологических заболеваний.
Взаимодействие BRCA2 с эстрогеновой регуляцией
У пациентов с мутациями в гене BRCA2 часто развиваются гормонозависимые формы рака молочной железы (РМЖ). Большинство опухолей у таких пациентов содержат рецепторы эстрогенов и/или прогестерона. Преимущественное возникновение гормонозависимых форм РМЖ у женщин с мутациями в BRCA2 связано с тесными молекулярными взаимодействиями между эстрогенами и системой восстановления ДНК. Эстрадиол (E2), связываясь с ядерным рецептором эстрогенов альфа-типа (ERα), не только стимулирует рост клеток молочной железы, но и непосредственно регулирует активность BRCA2 — гена, отвечающего за стабильность генома. Этот процесс происходит следующим образом: эстрадиол образует комплекс с транскрипционным фактором SP1, который присоединяется к промоторам генов, включая BRCA2 . В результате усиливается транскрипция этих генов через эпигенетические механизмы, такие как ацетилирование гистонов, что облегчает доступ к ДНК для транскрипционного аппарата [15,16].
Интересно, но эта связь не является односторонней. Ген BRCA2 также способен косвенно регулировать уровень эстрогенов в тканях, воздействуя на экспрессию гена CYP19 . Этот ген кодирует ароматазу — фермент, который превращает андрогены в эстрогены [17, 18]. Таким образом, BRCA2 играет важную роль в поддержании гормонального баланса в клетке (Рис. 1).
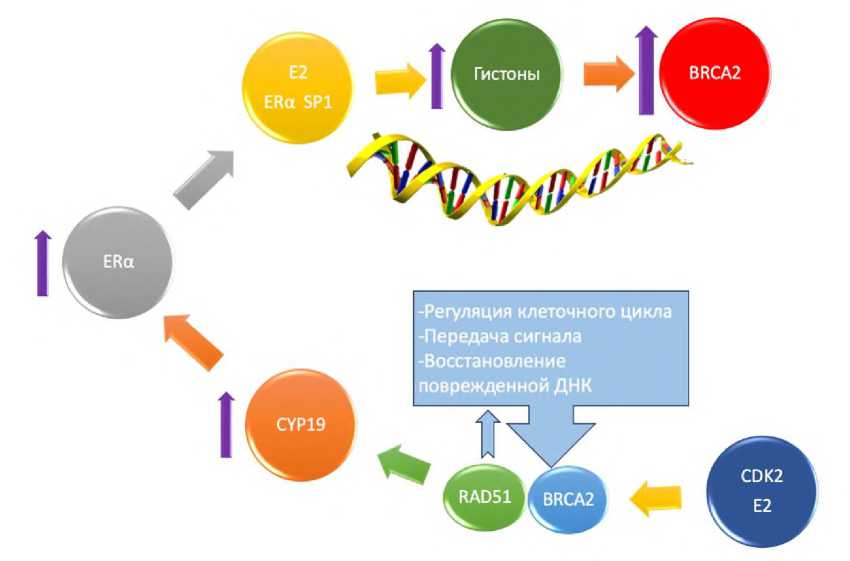
Рис. 1. Механизм взаимодействия между эстрогеновой регуляцией и геном BRCA2 .
Эта взаимозависимость создает сбалансированную регуляторную систему: эстрогены способствуют активации BRCA2 и, как следствие, репарации ДНК, а функциональный BRCA2 , в свою очередь, регулирует локальную выработку эстрогенов. Это частично объясняет высокий процент HR+ РМЖ среди женщин с мутациями в гене BRCA2 , что подчеркивает важность молекулярного взаимодействия между гормональной регуляцией и механизмами поддержания целостности генома [19,20].
Учитывая новые данные о сложных отношениях между гормональной регуляцией и процессами репарации ДНК, вопрос о прогностическом значении гормонального статуса у больных РМЖ с мутациями в гене BRCA2 становится особенно актуальным. Традиционно положительный гормональный статус рассматривался как благоприятный фактор, связанный с лучшими долгосрочными результатами. Однако все больше исследований ставят под сомнение этот подход для пациенток с опухолями, связанными с мутациями в гене BRCA2.
В метаанализе, проведённом Olafsdottir с коллегами, изучались особенности развития рака молочной железы (РМЖ) у 608 женщин, которые являются носительницами патогенных вариантов гена BRCA2 . Результаты исследования показали, что наличие положительного статуса по гормонозависимому раку (HR-позитивный) связано с менее благоприятным прогнозом. Особенно важно отметить, что в этой группе пациенток подмышечные лимфатические узлы поражались значительно чаще — у 59% против 34% при HR-негативных опухолях (p < 0,001).
Несмотря на то, что РМЖ у носительниц мутаций в BRCA2 является гормонозависимым заболеванием, частота рецидивов у них выше, а чувствительность к гормональной терапии не всегда приводит к улучшению прогноза. Эти данные свидетельствуют о необходимости пересмотра традиционных представлений о раке молочной железы и подчёркивают значимость индивидуального, молекулярноориентированного подхода к оценке прогноза и выбору терапии для данной категории больных.
Цель исследования: провести сравнительный анализ особенностей клинического течения гормонозависимых форм рака молочной железы (РМЖ), которые не экспрессируют ген Her2/neu, у пациентов с мутациями в генах BRCA1 / BRCA2 .
Материалы и методы
В период с 2013 по 2024 год в Московском научно-исследовательском онкологическом институте имени П.А. Герцена было проведено лечение 474 пациенток с РМЖ, у которых были выявлены мутации в генах BRCA1 и BRCA2 . Эти мутации были обнаружены в результате молекулярно-генетического тестирования с помощью полимеразной цепной реакции (ПЦР) или секвенирования следующего поколения (NGS – Next-Generation Sequencing). Из этих пациенток 110 имели мутации в гене BRCA2 , а 364 — в гене BRCA1 .
На первом этапе исследования была сформирована выборка пациенток с I–IIB стадией РМЖ. В результате было выделено 70 пациенток с мутацией в гене BRCA2 и 274 пациентки с мутацией в гене BRCA1 , что позволило провести более детальный анализ на данных стадиях заболевания.
Среди 274 пациентов с раком молочной железы (РМЖ), имеющих мутацию в гене BRCA1 , подавляющее большинство (81%) показали отрицательный рецепторный статус, в то время как положительный статус был обнаружен лишь у 19%. В частности, в группе с положительным рецепторным статусом (HR+) BRCA1 : к люминальному типу А относились 12 пациенток (4%); к люминальному типу B Her2/neu-негативному — 40 пациенток (15%). В группе пациенток с мутацией в гене BRCA2 была обнаружена противоположная тенденция: только у 20% опухоль не экспрессировала рецепторы, тогда как у 80% был выявлен положительный статус. В рамках этой группы HR+ к люминальному типу А относилось 11%, а большинство — 69% — относилось к люминальному типу B Her2/neu-негативному типу (Табл. 1).
Табл. 1. Распределение пациенток в зависимости от рецепторного статуса опухоли
|
Рецепторный статус |
BRCA1 n (%) |
BRCA2 n(%) |
|
Отрицательный (HR-) |
222 (81%) |
14 (20%) |
|
Положительный (HR+) |
52 (19%) |
56 (80%) |
|
Всего |
274 (100%) |
70 (100%) |
В окончательный анализ были включены исключительно пациентки с гормонозависимыми Her2/neu отрицательными опухолями. В ходе анализа были сформированы две финальные когорты больных РМЖ I–IIВ стадии гормонопозитивным Her2/neu-негативным подтипом: основная группа, включающая 50 больных с наличием 177
мутации в гене BRCA2 и контрольная группа, состоящая из 50 больных с мутацией в гене BRCA1.
Средний возраст пациентов с мутацией в гене BRCA2 составил 48 лет, а с мутацией в гене BRCA1 — 43 года. В группе пациентов с мутацией BRCA1 наиболее распространённой была I стадия заболевания (46,4%). В группе с мутацией BRCA2 чаще всего диагностировалась стадия IIA — её обнаруживали у 42% пациентов (Табл. 2).
Табл. 2. Распределение стадий РМЖ у пациенток с мутациями BRCA1 и BRCA2
|
Стадия |
HR+ BRCA1 n (%) |
HR+ BRCA2 n (%) |
|
I |
23 (46,4%) |
16 (32%) |
|
IIA |
19 (37,5%) |
21 (42%) |
|
IIB |
8 (16,1%) |
13 (26%) |
|
Всего |
50 (100%) |
50 (100%) |
Всем пациенткам проводилось комбинированное лечение в соответствии с актуальными международными и национальными рекомендациями, включавшее лекарственную терапию, хирургическое вмешательство и лучевую терапию. Лекарственная терапия состояла из стандартных схем химиотерапии на основе антрациклинов, алкилирующих агентов и таксанов, а также гормонотерапии (тамоксифен или ингибиторы ароматазы).
Среди пациенток с мутацией BRCA2 27 человек (54%) прошли курс неоадъювантной химиотерапии. У 7 из этих пациенток (26%) был достигнут полный лечебный патоморфоз, в то время как у 20 (74%) — частичный ответ на лечение. 14 человек (28%) из этой группы были назначены адъювантные препараты. В группе с мутацией BRCA1 неоадъювантная химиотерапия была проведена 20 пациенткам (40%). Полный лечебный патоморфоз был зафиксирован у 17 из них (85%), а частичный ответ — у 3 (15%). 15 человек (30%) из этой группы получили адъювантные препараты. Адъювантная гормонотерапия в группе BRCA2 включала тамоксифен для 31 пациентки (62%) и ингибиторы ароматазы для 19 (38%). В группе BRCA1 соотношение было следующим: тамоксифен — 35 (70%), ингибиторы ароматазы — 17 (30%). Хирургическое лечение у пациенток с мутацией BRCA2 включало кожесохранную или подкожную мастэктомию с реконструкцией экспандером или имплантом у 40 из 52 пациенток (≈76,9%). Радикальная мастэктомия была проведена 11 из 52 (≈21,2%), а онкопластическая резекция — только 1 из 52 пациенток (≈1,9%). В группе BRCA1 у 48 из 50 (96%) пациенток была проведена кожесберегающая или подкожная мастэктомия с реконструкцией, а у 2 из 50 (4%) — онкопластическая резекция.
Большинство пациенток получали лучевую терапию. Среди пациенток с мутацией BRCA2 этот вид лечения был назначен 38 пациенткам (80%), а с мутацией BRCA1 — 41 пациентке (82%).
В исследовании также была изучена частота выполнения профилактической сальпингоовариэктомии у пациенток с мутациями в генах BRCA1 и BRCA2 . Среди женщин с мутацией в гене BRCA1 эта операция была проведена у 32 (64%) человек, а у тех, у кого мутация в гене BRCA2 — у 27 (54%). Что касается профилактической мастэктомии, то её провели у 40 (80%) пациенток с мутацией BRCA1 и у 30 (60%) с мутацией BRCA2 . Важно отметить, что женщины с мутацией в гене BRCA2 значительно реже соглашались на эту операцию. Возможно, это связано с меньшей обеспокоенностью по поводу риска развития контралатерального рака молочной железы (Табл. 3).
Табл. 3. Частота выполнения профилактических операций при мутациях BRCA1 и BRCA2
|
Вид профилактической операции |
BRCA1 n(%) |
BRCA2 n(%) |
|
Профилактическая сальпингоовариэктомия |
32 (64%) |
27 (54%) |
|
Профилактическая мастэктомия |
40 (80%) |
30 (60%) |
В нашем исследовании мы сравнили частоту неблагоприятных исходов у пациентов с мутациями в генах BRCA1 и BRCA2 . Наблюдение за пациентками длилось от 12 до 204
месяцев, при этом средний срок наблюдения составил 36 месяцев. Мы оценивали частоту отдаленных, локальных и регионарных рецидивов, смертность от РМЖ, а также общий показатель любых неблагоприятных событий.
Для каждой конечной точки был рассчитан относительный риск (RR) с двусторонним 95% доверительным интервалом (ДИ) и p-значение по точному тесту Фишера. Из-за небольшого количества событий и нулевых частот использовались консервативные методы и поправки к оценкам риска. RR определялся как отношение кумулятивных рисков в группах BRCA2 и BRCA1 . Доверительные интервалы для RR были получены с помощью приближенного метода Вальда на лог-шкале. В случае нулевых ячеек применялась коррекция Холдейна–Энскомба, которая заключалась в добавлении 0,5 ко всем четырем ячейкам таблицы 2×2 для повышения устойчивости оценки и стандартной ошибки. Статистическую значимость различий между пропорциями оценивали с помощью точного двустороннего теста Фишера. Для композитного исхода дополнительно использовался %2-тест без поправки на непрерывность, который служил ориентиром. Уровень статистической значимости принимался равным p<0,05, все тесты были двусторонними.
Результаты
Неблагоприятные события происходили значительно чаще у пациенток с мутацией BRCA2 . Частота отдаленных рецидивов составила 8% (4 из 50) в группе BRCA2 и 2% (1 из 50) в BRCA1 группе. Относительный риск (RR) для группы BRCA2 был 4,00 (95% доверительный интервал [ДИ]: 0,46–34,7; p=0,36). Анализ структуры событий показал, что в группе BRCA2 преобладали отдаленные метастазы в кости (3 случая) и печень (1 случай). В группе BRCA1 был зарегистрирован только один случай прогрессирования с поражением головного мозга. Локальные рецидивы были зафиксированы у 10% (5 из 50) пациенток в группе BRCA2 и у 6% (3 из 50) в группе BRCA1 . Относительный риск для BRCA2 составил 1,67 (95% ДИ: 0,42–6,63; p=0,72). Регионарные рецидивы наблюдались у 8% пациентов с мутацией BRCA2 (4 из 50) и не были зафиксированы в группе с мутацией BRCA1 (0 из 50). Относительный риск для носителей мутации BRCA2 был 9,00 (95% ДИ: 0,50-162; p=0,12). Смертность от РМЖ была выше в группе BRCA2 и составила 6% (3 из 50) против 2% (1 из 50) для BRCA1 . Относительный риск для носителей мутации BRCA2 был 3,00 (95% ДИ: 0,3228,1; p=0,62). Результаты представлены в таблице 4.
Табл. 4. Неблагоприятные исходы по группам BRCA1 и BRCA2
|
Исход |
BRCA1 n/N (%) |
BRCA2 n/N (%) |
RR [95% ДИ] |
P |
|
Отдаленные метастазы |
1/50 (2%) |
4/50 (8%) |
4,00 [0,46; 34,7] |
0,36 |
|
Локальный рецидив |
3/50 (6%) |
5/50 (10%) |
1,67 [0,42; 6,63] |
0,72 |
|
Регионарный рецидив |
0/50 (0%) |
4/50 (8%) |
9,00 [0,50; 162] |
0,12 |
|
Смерть от РМЖ |
1/50 (2%) |
3/50 (6%) |
3,00 [0,32; 28,1] |
0,62 |
Частота неблагоприятных исходов, включающих отдалённые, локальные или регионарные рецидивы, а также смерть, составила 32% (16 из 50) в группе BRCA2 против 10% (5 из 50) в группе BRCA1 . Относительный риск составил 3,20 (95% ДИ 1,27-8,06; p=0,015), что свидетельствует о статистически значимом повышении риска неблагоприятных событий у носителей мутаций BRCA2 по сравнению с BRCA1 (Рис. 2).
16 14
6 4
2 0
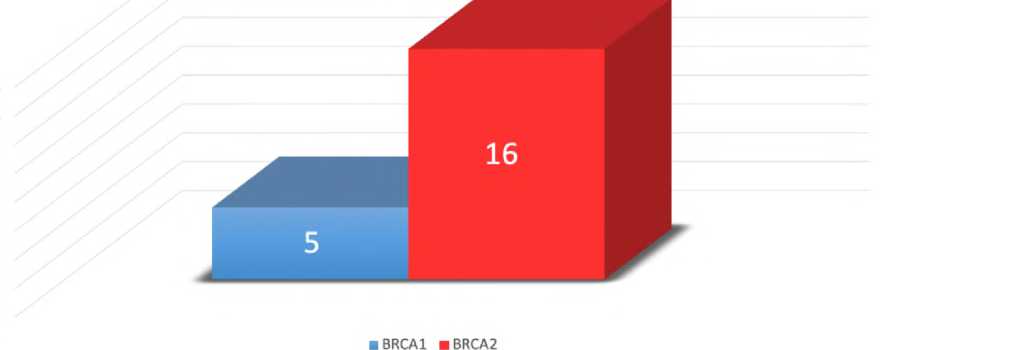
Рис. 2. Неблагоприятное событие: BRCA2 мутация - 32% (16/50), BRCA1 мутация - 10% (5/50); RR = 3,20; 95% ДИ: 1,27-8,06.
При анализе полученных результатов следует учитывать, что число событий было небольшим, а объём выборки — ограниченным. Из-за этого доверительные интервалы получились довольно широкими. Тем не менее, общий риск неблагоприятного исхода оказался статистически значимо выше в группе BRCA2 по сравнению с BRCA1 . В дальнейшем, когда будет набрано достаточное количество пациенток, мы планируем увеличить объём выборки и оценить ближайшие онкологические результаты. Это будет включать общую выживаемость, безрецидивную выживаемость и выживаемость без прогрессирования заболевания после начала лечения. Эти параметры помогут более объективно выявить возможные различия в прогнозе между сравниваемыми группами.
Обсуждение
По результатам нашего промежуточного исследования в группе пациенток с мутацией в гене BRCA2 отмечено явное преобладание гормонально-позитивных подтипов опухолей (до 80%). Однако, несмотря на традиционно более благоприятный прогноз при положительном рецепторном статусе, в этой группе не наблюдается ожидаемого улучшения отдалённых результатов: фиксируются более высокие показатели прогрессирования, большая частота рецидивов и повышенная смертность по сравнению с пациентками, имеющими мутацию в гене BRCA1 [22-24].
В большом проспективном исследовании, проведённом в Португалии под руководством Antunes, приняли участие 1077 пациенток, которые являются носителями мутаций в генах BRCA1 и BRCA2 . Результаты исследования показали, что у женщин с мутациями в гене BRCA2, если опухоль имеет положительный статус по отношению к гормонам (HR+), значительно чаще возникают регионарные рецидивы и наблюдается более быстрое прогрессирование заболевания по сравнению с женщинами, у которых есть мутации в гене BRCA1 [25].
В 2024 году под руководством Arecco и его коллег было проведено многоцентровое международное ретроспективное исследование. В нём анализировались клинические характеристики и результаты лечения 4709 пациентов с РМЖ, у которых были выявлены патогенные варианты в генах BRCA1 и BRCA2 . Медиана наблюдения составила 7,9 года. Оказалось, что в группе пациентов с гормоночувствительным раком (HR+) рецидивы заболевания у женщин с мутацией в гене BRCA2 встречались значительно чаще — в 13,1% случаев (P < 0,05).
Эти данные указывают на необходимость более пристального клинического внимания к данной категории пациенток и подчёркивают важность молекулярно‑генетического тестирования с последующей персонализацией терапии с учётом не только гормонального статуса, но и BRCA‑статуса [27,28].
Женщины с мутацией в гене BRCA2 находятся в группе высокого риска развития РМЖ. Им требуется более тщательное наблюдение и лечение. Для таких пациенток могут быть показаны профилактические операции, такие как двусторонняя риск-редуцирующая мастэктомия и сальпинго-оофорэктомия. Эти вмешательства значительно улучшают общую выживаемость.
В международном исследовании, проведенном в 2024 году под руководством Lambertini, приняли участие более 5000 женщин моложе 40 лет с мутацией в генах BRCA , у которых был диагностирован РМЖ. Результаты исследования показали, что риск-редуцирующие мастэктомии и овариэктомии значительно снижают риск смерти: на 35% и 42% соответственно [29].
Внедрение индивидуализированного подхода и разработка специализированных протоколов ведения женщин с BRCA2 ‑ассоциированным РМЖ представляются ключевыми шагами для повышения эффективности терапии и снижения риска прогрессирования заболевания в долгосрочной перспективе [30].
Вклад авторов. Михайлов С.И.: написание исходного текста, сбор и обработка информации, первичный анализ материала, концепция исследования; Зикиряходжаев А.Д.: научное руководство, концепция исследования, развитие методологии, итоговые выводы; Джабраилова Д.Ш.: научное руководство, правка исходного текста, написание исходного текста; Онофрийчук И.М.: обработка информации; итоговые выводы; Запиров Г.М.: правка исходного текста; обработка информации; Шаталов П.А.: научное руководство, концепция исследования, развитие методологии, итоговые выводы; Сарибекян Э.К.: развитие методологии, итоговые выводы; Максимов К.В.: обработка информации; Аблицова Н.В.: обработка информации; Хугаева Ф.С.: написание исходного текста;
Дуадзе И.С.: обработка информации; Гехт Г.А.: обработка информации; Занозина Е.А.: обработка информации; Замалдинов Н.Д.: сбор и обработка информации; Золотухина А.С.: обработка информации; Лисицина Э.А.: написание исходного текста; Запиров Г.М.: обработка информации. Все авторы прочитали и согласились с версией рукописи, представленной для публикации.
Финансирование. Это исследование не получило внешнего финансирования.
Декларация по этике. Не применимо.


