Комплексное исследование адаптогенного и инсектицидного потенциала экстракта листьев аронии Мичурина (×Sorbaronia mitschurinii) на модели Drosophila melanogaster
Автор: Платонова Е.Ю., Голубев Д.А., Земская Н.В., Тимушева Н.С., Пакшина Н.Р., Михайлова Д.В., Патов С.А., Шапошников М.В., Москалев А.А.
Журнал: Принципы экологии @ecopri
Рубрика: Оригинальные исследования
Статья в выпуске: 3 (57), 2025 года.
Бесплатный доступ
Плоды аронии, представленной видами Aronia melanocarpa и ×Sorbaronia mitschurinii, широко распространены по всему миру как источник широкого спектра биологически активных веществ, макро- и микромолекул. Данных об исследовании листьев существует мало, особенно об их возможном токсическом влиянии на жизнеспособность модельных организмов. Мы провели анализ состава экстракта листьев аронии Мичурина, который показал наличие в нем флавоноидов и фенольных соединений, включая галловую кислоту, рутин (рутозид, витамин P), изокверцетин и кемпферол. Добавление в пищу экстракта листьев на протяжении всей жизни, на 1-2-й и 4-5-й неделях жизни, привело к сокращению продолжительности жизни особей обоих полов Drosophila melanogaster. Экстракт листьев не оказал статистически значимого воздействия на функциональную целостность кишечного барьера особей обоих полов плодовых мушек. Также не наблюдалось никаких неблагоприятных эффектов на двигательную активность дрозофил. Исследование показало, что предварительное кормление экстрактом в составе питательной среды привело к 15%-ному увеличению медианного уровня выживаемости самцов в условиях голодания в молодом возрасте и 6%-ному увеличению выживаемости самок в тех же условиях во взрослом возрасте. Однако в условиях гипертермии предварительная обработка экстрактом снизила выживаемость самцов в возрасте 10 суток (на 12 %) и 33 суток (на 20 %), а также снизилась выживаемость самок в возрасте 33 суток (на 12 %). Кроме того, экстракт листьев аронии Мичурина снижал экспрессию генов, связанных с липидным обменом (lip3) и инсулиновым сигналингом (ilp5) у обоих полов Drosophila melanogaster, что может свидетельствовать о влиянии экстракта на энергетический гомеостаз и сигнальный путь инсулина в организме. Дальнейшие исследования биологических эффектов экстракта листьев аронии Мичурина могут способствовать разработке натурального инсектицида, не оказывающего пагубного воздействия на окружающую среду.
Экстракт листьев аронии Мичурина, стрессоустойчивость, растительные инсектициды, адаптация, Drosophila melanogaster
Короткий адрес: https://sciup.org/147252001
IDR: 147252001 | УДК: 57.017.6, 57.017.8, 57.042 | DOI: 10.15393/j1.art.2025.16242
Текст научной статьи Комплексное исследование адаптогенного и инсектицидного потенциала экстракта листьев аронии Мичурина (×Sorbaronia mitschurinii) на модели Drosophila melanogaster
Плодовые растения, являясь ключевым трофическим ресурсом, играют неотъемлемую роль в сложной сети химических взаимодействий и передачи энергии, характеризующей биосферу Земли. Как первичные продуценты, они формируют множество трофических связей в пищевых цепях (Foster, Bhatti, 2006; Krishna, Mohan, 2017; Zhao et al., 2022). При этом их плоды (ягоды) и листья выполняют различные, но взаимодополняющие экологические функции. Ягоды служат высокоэнергетическим кормом для птиц и млекопитающих (Hertel et al., 2016; Hupp et al., 2015; Ripple et al., 2015), а листья – основой питания для множества насекомых и других организмов (Dhaouadi et al., 2023; Hikal et al., 2017). Листья могут содержать эфирные масла, алкалоиды, танины, терпеноиды и другие соединения, которые проявляют репеллентные, инсектицидные и антифидантные свойства. Было показано, что эти соединения активируют обонятельные и другие рецепторы, подавляют развитие насекомых и вызывают бесплодие у насекомых, питающихся этими растениями (Dhaouadi et al., 2023; Hikal et al., 2017; Rizzo et al., 2020), что является естественным защитным механизмом растений от вредителей. Растения вырабатывают защитные стратегии в процессе эволюции, чтобы выживать в условиях, когда насекомые могут представлять угрозу их целостности и размножению (Hikal et al., 2017). Кроме того, ягоды и листья могут быть источником аттрактантов, привлекающих хищников, питающихся вредителями, что помогает поддерживать равновесие в природе за счет взаимодействия различных компонентов экосистемы (Cantwell-Jones et al., 2022; Hikal et al., 2017).
Плоды и листья растений рода Aronia ( Aronia melanocarpa и ×Sorbaronia mitschurinii ) содержат широкий спектр полифенольных соединений, включая простые фенолы, фенольные кислоты, флавоноиды и антоцианы. Экспериментальные исследования in vitro и in vivo подтверждают биологическую активность фитохимических компонентов Aronia на различных модельных объектах: клеточных культурах, нематодах Caenorhabditis elegans , мухах
Drosophila melanogaster и лабораторных крысах Rattus norvegicus (Platonova et al., 2021).
Плодовая мушка Drosophila melanogaster является подходящей моделью для исследования эффектов экстрактов ягод и листьев аронии ( Aronia melanocarpa ) на состояние организма (Ferlemi, Lamari, 2016; Wang, Lin, 2000). Преимуществом плодовой мушки в исследованиях с использованием фитохимикатов является ее низкая стоимость содержания и короткая продолжительность жизни, кроме того, около 60 % генов плодовой мушки являются ортологами млекопитающих, что предполагает (Platonova et al., 2021) ожидаемый эффект на другие модельные организмы (Lopez-Ortiz et al., 2023; Staats et al., 2018).
Согласно данным проведенного нами систематического анализа литературы, биологические эффекты экстрактов плодов аронии изучены более детально по сравнению с действием экстрактов, полученных из вегетативных органов (стеблей и листьев) этого растения (Platonova et al., 2021).
Листья аронии (Aronia melanocarpa) содержат большое количество фенольных кислот, которые могут оказывать инсектицидное действие на плодовых мух (Cvetanović et al., 2018; Kulling, Rawel, 2008; Leri et al., 2020). В то же время содержащиеся в листьях биологически активные соединения, включая полифенолы (такие как фенольные кислоты, флавоноиды, стильбены, лигнаны, танины) (Proshkina et al., 2024) и терпеноиды (Proshkina et al., 2020), могут проявлять геропротекторный потенциал. Краткое описание геропротекторных свойств данных соединений можно найти в базе данных геропротекторов (Moskalev et al., 2015).
Несмотря на это, биологическое действие экстрактов листьев изучено недостаточно, особенно в контексте их антагонистических эффектов – как потенциальных геропротекторов и природных инсектицидов. На основании имеющихся данных мы поставили цель: исследовать баланс между адаптогенными и токсическими свойствами экстракта листьев аронии Мичурина ( ×Sorbaronia mitschurinii ), определяющий его потенциал как геропротектора и экоинсектицида в искусственно воссозданной экосистеме – «вторичные метаболиты растений – плодовые мушки».
Материалы
Растительный материал
Сбор растительного материала осуществлялся в летний период (август 2020 г.) в Ботаническом саду (Научная коллекция живых растений, № 507428) при Институте биологии Коми научного центра УрО РАН (Сыктывкар, Россия). Листья подвергались сушке в темном проветриваемом помещении при отсутствии прямого солнечного света, после чего упаковывались в крафт-бумагу для последующего приготовления экстракта.
Методы
Экстракция фенольных компонентов из листьев
Экстрагирование проходило в несколько этапов: измельчение и отбор образцов, обезжиривание сырья, микроволновая экстракция флавоноидов, в результате чего получали этилацетатную фракцию с примесью хлорофилла, для дальнейших исследований. Подробное описание методики экстракции фенольных компонентов из листьев проводилось в соответствии с методикой, ранее опубликованной в работе (Платонова и др., 2025).
Высокоэффективная жидкостная хроматография – масс-спектрометрия (ВЭЖХ – МС)
Образцы экстракта листьев аронии Мичурина анализировали на системе ВЭЖХ Thermo Finnigan Surveyor, оснащенной диодно-матричным детектором (200–600 нм) и масс-селективным детектором (Thermo Fisher Scientific Inc., США). Детектирование проводили при длине волны 323 нм, скорости потока элюента 1 мл/мин, времени анализа 40 мин в изократическом режиме. В качестве элюента использовали раствор ацетонитрила и 10 % муравьиной кислоты (7:93, об./об.) в воде. Использовали хроматографическую колонку 4 × 250 мм с сорбентом Diasorb-130-C16T (размер частиц 7 мкм). Для пробоподготовки 1 мг экстракта растворяли в 10 мл деионизированной воды, после чего наносили на подготовленный картридж с сорбентом Hypersep C18. Картриджи промывали 1 мл элюента, затем 10 мл деионизированной воды. Масс-спектры получали на жидкостном хроматографе Thermo Finnigan LCQ Fleet (Thermo Fisher Scientific Inc., США) в сочетании с ионизацией электрораспылением при кинетической энергии 40 эВ. Сое- динения, выделенные из экстракта в чистом виде, использовали в качестве стандартов для ВЭЖХ-МС, а также для количественного анализа. Структура этих соединений была подтверждена методами ИК-, УФ- и ЯМР-спектроскопии, а также молекулярными ионами в МС.
Условия разведения мух
Эксперименты проводили на линии дикого типа Canton-S D. melanogaster (#64349, Bloomington, США). Мух выращивали и содержали при температуре 25 °C и относительной влажности 60 % при цикле свет/тем-нота 12 ч : 12 ч в камере постоянного климата Binder KBF720-ICH (Binder, Германия). Подробное описание методики и состава питательной среды соответствует ранее опубликованной работе (Платонова и др., 2025).
Возраст дрозофил и обработка экстрактом листьев
Процедура кормления дрозофил экстрактом листьев проводилась в соответствии с ранее описанной методикой (Platonova et al., 2022). Использовали 96 % этанольный экстракт листьев аронии Мичурина (SLE) в следующих концентрациях: 0.01, 0.1, 1.0 и 5.0 мг/мл. Контрольная группа получала 96 % этанол. Экстракт добавлялся в пищу дрозофилам в различные периоды жизни: в течение всей жизни имаго, в первые две недели после вылупления (1–2 недели) и в период четвертой – пятой недели жизни имаго (4–5 недель).
Анализ продолжительности жизни
Анализ продолжительности жизни проводился аналогично экспериментам с использованием методики, описанной в предыдущем исследовании (Platonova et al., 2022). Самцов и самок содержали раздельно, 30 особей в пробирке, по 5 пробирок на каждый вариант, по 150 мух на каждую экспериментальную группу. Количество мертвых мух подсчитывали ежедневно, а оставшихся живых мух переносили в пробирки со свежей средой дважды в неделю. На основе полученных данных строили кривые выживаемости и рассчитывали медианную и максимальную продолжительность жизни. Эксперименты проводили в трех биологических повторностях.
Анализ двигательной активности
Двигательную активность количественно оценивали с помощью монитора двигатель- ной активности (LAM25, TriKinetics Inc., USA) в соответствии с ранее описанной методикой (Platonova et al., 2022). Экспериментальные мухи содержались на питательной среде с SLE в концентрациях 0.01, 0.1, 1 и 5 мг/ мл. Кроме того, анализ проводился с использованием различных режимов питания: в течение всей жизни, 1–2-я недели и 4–5-я недели жизни.
Анализ стрессоустойчивости
Перед анализом стрессоустойчивости мухи содержались на среде с добавлением различных концентраций SLE. Мухи подвергались воздействию стресс-факторов в возрасте 10 и 33 суток. Питательная среда и условия содержания дрозофил в экспериментах по изучению устойчивости к неблагоприятным условиям окружающей среды (гипертермия, голодание и окислительный стресс) были ранее описаны в (Platonova et al., 2022). Для оценки устойчивости к стрессу использовали монитор активности дрозофил (DAM2, Trikinetics, США), где индивидуальное содержание особей осуществлялось в стеклянных капиллярах диаметром 5 мм, как указано в предыдущих исследованиях (Platonova et al., 2022). В каждом варианте эксперимента анализировали по 32 особи каждого пола. Все эксперименты проводились в 2–3 повторностях.
Анализ целостности кишечника
Анализ целостности кишечника проводили как в исследовании (Platonova et al., 2022) с использованием теста «Smurf» (Rera et al., 2012). Предварительно мух содержали на питательной среде с добавлением SLE, анализ проводили в возрасте 6 и 8 недель. Контрольные и экспериментальные когорты находились в течение 16 часов на питательной среде, содержащей 2.5 % (масса / объем) пищевого красителя Brilliant Blue FCF (Roha Dyechem Ltd., Мумбаи, Индия), после чего были подсчитаны мухи, окрашенные в синий цвет (мухи «смурф») с нарушенной целостностью кишечника. Самцы и недевственные самки были проанализированы отдельно. Эксперимент повторяли дважды, на каждый вариант эксперимента использовали по 70–100 особей в каждой повторности.
Анализ уровня потребления экстракта
Для оценки уровня потребления пищи с добавлением экстрактов листьев в концентрациях 0.01, 0.1, 1.0 и 5.0 мг/мл плодовыми мушками использовали метод, описанный в статье (Wu et al., 2020). Исследование проводилось в возрасте 15 и 35 суток. Для эксперимента использовали цилиндрические пробирки с отверстиями для циркуляции воздуха, снабженные крышкой с отверстием для установки емкости с питательной средой объемом 70 мкл. В течение 24 часов мухи содержались на питательной среде, подкрашенной 0.5 % красителем бриллиантовый синий FCF (Roha Dyechem Ltd., Индия). При этом экскременты мух скапливались на внутренних стенках пробирки. Через сутки питательную среду меняли на среду без красителя и оставляли на ней мух на 3 часа для высвобождения красителя из организма. Через 3 часа мух извлекали из пробирки, отверстия заклеивали скотчем, а экскременты растворяли в 3 мл дистиллированной воды. Затем измеряли оптическую плотность смыва при 629 нм с помощью спектрофотометра Picodrop Pico200 (Picodrop, Великобритания). Количество окрашенных экскрементов мух рассчитывали с помощью стандартной калибровочной кривой, построенной путем серийного разведения эквивалентного количества синего красителя в воде. Для каждого варианта эксперимента использовали 5 цилиндрических пробирок по 10 особей в каждой. Самцов и самок анализировали отдельно.
Количественная ПЦР с обратной транскрипцией
Уровни экспрессии генов определялись с помощью анализа полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР). Мухи содержались на питательной среде с SLE (5 мг/мл) в течение 14 дней и дважды в неделю переносились во флаконы со свежей средой. Для каждого экспериментального варианта использовали 20 самцов и 10 самок. РНК выделяли с помощью набора Aurum Total RNA Mini (Bio-Rad, США) в соответствии с инструкциями производителя. Концентрацию РНК измеряли с помощью набора Quant-iT RNA Assay Kit (Invitrogen, США) в соответствии с инструкциями производителя. кДНК синтезировали с помощью набора iScript cDNA Synthesis Kit (Bio-Rad, США) из полученного раствора РНК. Реакционную смесь для ПЦР-реакции готовили на основе qPCR mix-HS SYBR (Евроген, Россия) и праймеров (табл. 1). Полимеразную цепную реакцию проводили с использованием ам-плификатора CFX96 (Bio-Rad, США) по следующей программе: 1) 95 °C в течение 30 с; 2) 95 °C в течение 10 с; 3) 60 °C в течение 30 с; 4) шаги 2–3 повторяли 40 раз и 5) шаг плавления ДНК.
Экспрессию исследуемых генов рассчитывали относительно экспрессии генов домашнего хозяйства β-tubulin и RpL32 с помощью программного обеспечения CFX Manager 3.1 (Bio-Rad, США). Эксперименты проводились в трех биологических и трех технических повторах. Для количественной оценки использовали метод дельта-дельта CT (Livak, Schmittgen, 2001).
Статистическая обработка
Для сравнения статистических различий в функциях выживания и медианной продолжительности жизни между контрольной и экспериментальной группами был использован логранговый тест (Harrington, Fleming, 1982) и модифицированный тест Колмогорова – Смирнова соответственно (Fleming et al., 1980). Тест Ванга – Эллисона использовался для оценки различий в возрасте при 90 % смертности (Wang et al., 2004). Для оценки статистической значимости различий в устойчивости к неблагоприятным факторам окружающей среды применялся точный критерий Фишера (Gao et al., 2008; Mehta et al., 1984). Для попарного сравнения индексов пищевых предпочтений использовался U-критерий Манна – Уитни (Hart, 2001). Для учета множественных сравнений была применена корректировка Бонферрони (Lee, Lee, 2018). Для сравнения различий в двигательной активности, потреблении пищи и уровнях экспрессии генов между контрольными и экспериментальными мухами использовался дисперсионный анализ (ANOVA) (Williams, 1987). Попарные сравнения post hoc проводились с использованием тестов Тьюки на достоверно значимую разницу (HSD) (Nanda et al., 2021). Статистический анализ данных проводился с использованием TIBCO Statistica, версия 13.3 (TIBCO Software, США), R, версия 2.15.1 (The R Foundation, США), Excel (Microsoft, США) и OASIS 2 (онлайн-приложение для анализа выживаемости 2) (Han et al., 2024).
Таблица 1. Список праймеров для ОТ-ПЦР
|
е гена |
Символ (FlyBase) |
Праймер 5'–3' (прямой / обратный) |
|
β-tubulin at 56D |
Tubulin |
GCAACTCCACTGCCATCC/ CCTGCTCCTCCTCGAACT |
|
Ribosomal protein L32 |
RpL32 |
GAAGCGCACCAAGCACTTCATC/ CGCCATTTGTGCGACAGCTTAG |
|
superoxide dismutase 1 |
Sod1 |
TGCACGAGTTCGGTGACAACAC/ TCCTTGCCATACGGATTGAAGTGC |
|
superoxide dismutase 2 |
Sod2 |
AGCGACACCACCAAGCTGATTC/ ATGTGGCCACCGCCATTGAAAC |
|
Catalase |
Cat |
CCCAAGAACTACTTTGCTGAGGTG/ AGGAGAACAGACGACCATGCAG |
|
Autophagy-related 1 |
Atg1 |
AGACTCTTCCTCGTGCAACTAGC/ GCTTGAGATCACGATGCACAATTC |
|
Autophagy-related 5 |
Atg5 |
CTCGTCAAGCTCAACTCCAAGG/ GTTGACCAATCCCAGCCAAAGC |
|
Heat shock protein 26 |
Hsp26 |
CAACCGCAACGACATTCACTGG/ ACGTCCATGCACACCTGGAATC |
|
Heat shock protein 68 |
Hsp68 |
TGGGCACATTCGATCTCACTGG/ TAACGTCGATCTTGGGCACTCC |
|
Insulin-like peptide 5 |
Ilp5 |
TGCCTGTCCCAATGGATTCAA/ GCCAAGTGGTCCTCATAATCG |
|
tuberous sclerosis 1 protein hamartin |
Tsc1 |
CAATAAAGCCGCCGTCATGGTG/ TACCACCCACTGCTCCTTGTTC |
|
tuberous sclerosis 2 protein hamartin |
Tsc2 |
ACGCATCGAATTGGCTAGAACG/ TGTTTAGGCCCTCAATTAGCTTCG |
|
mechanistic Target of rapamycin |
mTor |
TGTCTCGCCCAAACTGATGACG/ CCGCTGCTTGGAAGTAATCACCTG |
|
Heat shock protein 27 |
Hsp27 |
ACTGGGTCGTCGTCGTTATTCG/ CGCGCGACGTGACATTTGATTG |
|
Lipase 3 |
Lip3 |
ATTGCGGTGAGCGCATTGA/ TCAGGATGTAGTTGTCACTGGT |
|
Adipokinetic hormone |
Akh |
TCCCAAGAGCGAAGTCCTCA/ CCAGAAAGAGCTGTGCCTGA |
Результаты
Состав экстракта листьев аронии Мичурина
В результате проведенного анализа ВЭЖХ были выявлены основные пики на 5.51 мин - галловая кислота, на 13.21 мин - рутин (ру-тозид, витамин Р), на 24.51 мин - изокверцетин и на 39.65 мин – кемпферол (рис. 1).
Продолжительность жизни
С целью анализа возраст-зависимых эффектов экстракта листьев аронии Мичурина (SLE) было изучено его влияние на продолжительность жизни при трех режимах кормления: постоянном, раннем и позднем. При постоянном режиме кормления экстракт вносили в состав питательной среды, начиная с первого дня после вылупления имаго и до конца жизни (далее: на протяжении всей жизни). При раннем - исключительно в течение первых 2 недель после вылета имаго (далее: 1–2-я неделя жизни). При позднем – во взрослом возрасте на 4-5-й неделе жизни (далее: 4–5-я неделя жизни).
В результате проведенных экспериментов было показано, что употребление дрозофилами SLE на протяжении всей жизни сокращает медианную и максимальную продолжительность жизни самцов на 9 % и 10 % ( p <0.05) при концентрациях 0.01, 0.1, 1 и 5 мг/мл (рис. 2А, Б; табл. 2) соответственно. Аналогичный результат наблюдался у самок D. melanogaster : SLE снижал медианную и максимальную продолжительность жизни до 6 % ( p < 0.05) при концентрациях 0.01, 0.1, 1 и 5 мг/мл (рис. 3A, Б; табл. 2). Добавление SLE в пищу в возрасте 1–2 недель снизило медианную и максимальную продолжительность жизни самцов на 9 % и 7 % ( p < 0.0001) при концентрациях 0.01, 0.1, 1 и 5 мг/мл (рис. 2В, Г; табл. 3), но не оказало влияния на показатели продолжительности жизни самок (рис. 3В, Г; табл. 3). Добавление SLE в возрасте 4–5 недель в концентрациях 1 и 0.01 мг/мл также снизило медианную и
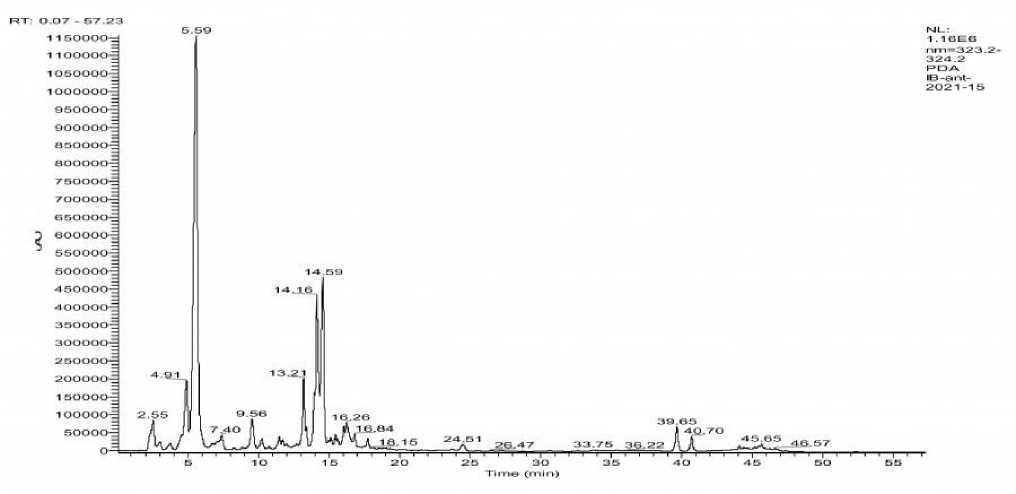
Рис. 1. Результаты высокоэффективной жидкостной хроматографии. 5.59 – галловая кислота; 13.21 – рутин (рутозид, витамин P); 24.51 – изокверцетин; 39.65 – кемпферол
Fig. 1. Results of high performance liquid chromatography. 5.59 – gallic acid; 13.21 – rutin (rutoside, vitamin P); 24.51 – isoquercetin; 39.65 – kaempferol
максимальную продолжительность жизни самцов (рис. 2Д, Е; табл. 4), у самок экстракт листьев в концентрации 0.01 мг/мл снизил медианную и максимальную продолжительность жизни (рис. 3Д, Е; табл. 4).
Двигательная активность
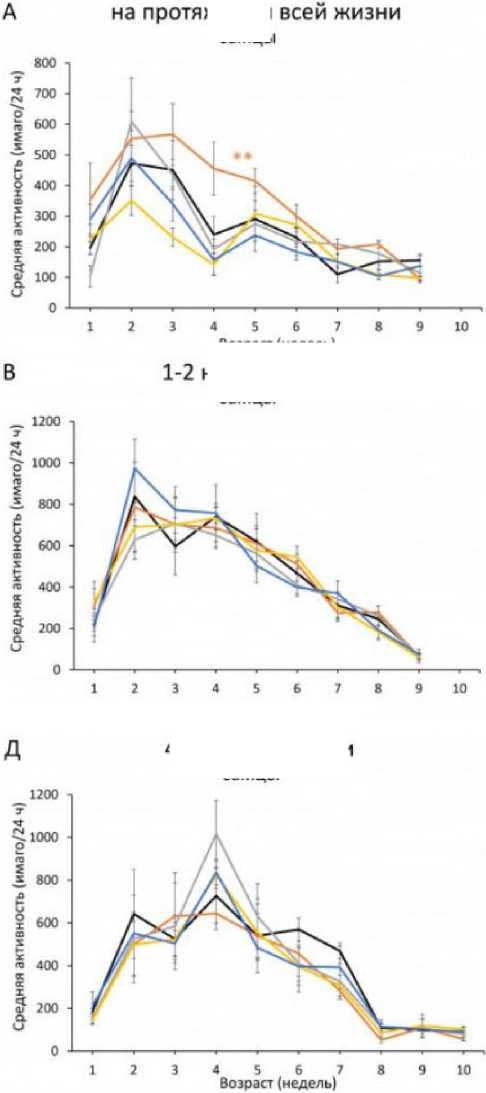
Для оценки эффектов SLE на показатели функционального старения мы изучили возрастные изменения двигательной активности у D. melanogaster при постоянном (на протяжении всей жизни), раннем (1–2-я неделя жизни) и позднем (4–5-я неделя жизни) режимах кормления экстрактом листьев.
Двухфакторный дисперсионный анализ (возраст × экстракт) выявил статистически значимое влияние ( p < 0.05) обоих факторов на двигательную активность самцов и самок при обработке SLE на протяжении всей жизни. Апостериорный анализ продемонстрировал полоспецифичные эффекты: у самцов наблюдалось увеличение активности при максимальной концентрации SLE 5 мг/мл, тогда как у самок отмечалось ее снижение при низких концентрациях SLE 0.01–0.1 мг/ мл по сравнению с контролем (рис. 4).
При анализе режимов с кратковременным кормлением экстрактом было установлено отсутствие значимого эффекта (p > 0.05) SLE на двигательную активность при раннем введении в течение первых двух недель жизни имаго (рис. 4В, Г). Однако при позднем введении (4–5-я неделя жизни) выявлены достоверные различия (p < 0.05): у самцов значимым оказался только возрастной фактор, в то время как у самок влияние оказывали как возраст, так и экстракт (рис. 4Д, Е).
Устойчивость дрозофил к неблагоприятным факторам окружающей среды
На основании результатов исследования влияния экстракта листьев аронии Мичурина на продолжительность жизни для экспериментов по оценке стрессоустойчивости была отобрана концентрация 5 мг/мл. Эта концентрация показала наиболее значительный долгосрочный отрицательный эффект на продолжительность жизни и была использована для проверки нашей гипотезы о том, что SLE может оказывать краткосрочный горметический эффект на устойчивость к стрессу.
Введение SLE в концентрации 5 мг/мл в питательную среду приводило к увеличению медианного времени выживаемости 10-суточных самцов на 15 % ( p < 0.05), а максимального времени выживаемости - на 11% ( p < 0.05) в условиях голодания, но снижало медианное время выживания при воздействии гипертермией на 12 % ( p < 0.0001) (рис. 5A) и не оказывало статистически значимого влияния при воздействии индуктором окислительного стресса паракватом (рис. 5А, табл. 5). У самок в возрасте 10 суток
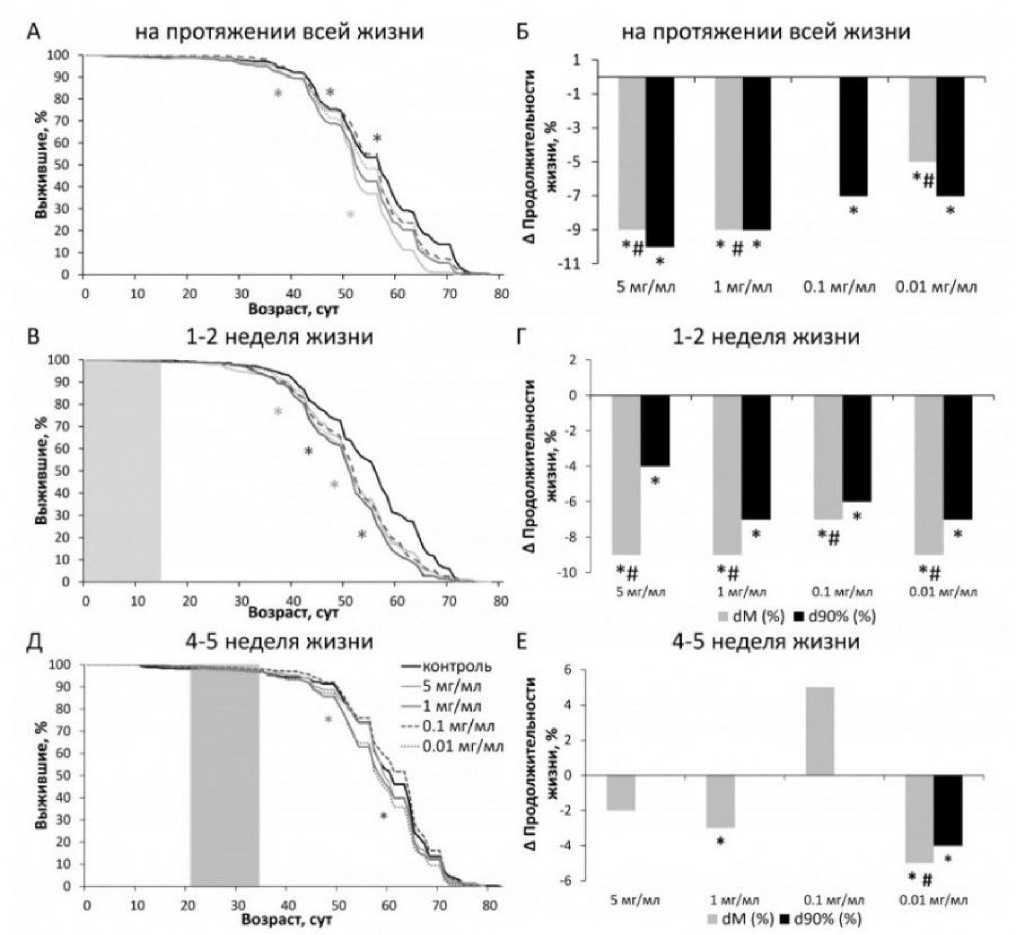
Рис. 2. Влияние SLE на продолжительность жизни самцов D. melanogaster при кормлении в разном возрасте: в течение всей жизни (A, Б), в первые 2 недели после вылупления имаго (В, Г), на 4–5-й неделе жизни (Д, Е). Кривые выживания (A, В, Д), изменение медианной (dM) и максимальной (d90%) продолжительности жизни (Б, Г, Е). Серый фон показывает возраст обработки SLE. * p < 0.05
Fig. 2. Effect of SLE on lifespan of D. melanogaster males fed at different ages: throughout life (A, Б), in the first 2 weeks after adult emergence (В, Г), at 4–5 weeks of age (Д, E). Survival curves (A, В, Д), change in median (dM) and maximum (d90%) lifespan (Б, Г, E). Gray background shows the age of SLE treatment. * p < 0.05
предварительная обработка SLE в концентрации 5 мг/мл не оказала влияния на устойчивость к воздействию стресс-факторов (рис. 5Б, табл. 5).
В возрасте 33 суток при воздействии гипертермией снизилась медианная выживаемость самцов на 20 % ( p < 0.05) и на 12 % у самок ( p < 0.05) (рис. 5В; табл. 6). При голодании увеличилась медианная выживаемость самок на 6 % ( p < 0.05) (рис. 7Г; табл. 6), но не было показано статистически значимого влияния воздействия параквата на выживаемость особей обоих полов.
Целостность кишечного барьера
Влияние SLE на целостность кишечного барьера у самцов и самок D. melanogaster в возрасте 6 и 8 недель оценивали с помощью «Smurf»-теста с последующим двухфакторным дисперсионным анализом (см. табл. 7). У самцов влияние возраста оказалось погранично значимым ( F = 3.48, p = 0.062), а эффект экстракта и взаимодействие (возраст × экстракт) не достигли статистической значимости (соответственно F = 1.30, p = 0.269 и F = 0.21, p = 0.935). У самок влияние возраста также было близко к порогу значимости
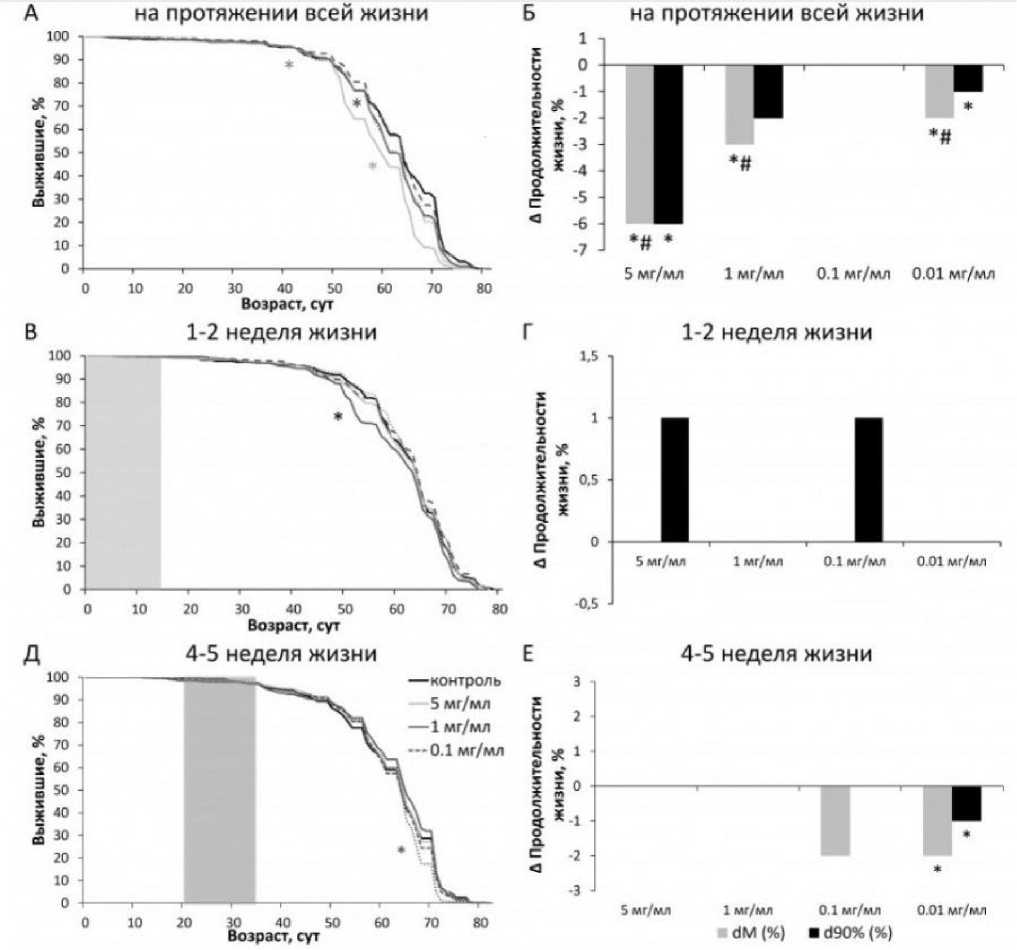
Рис. 3. Влияние SLE на продолжительность жизни самок D. melanogaster при кормлении в разном возрасте: в течение всей жизни (A, Б), в первые 2 недели после вылупления имаго (В, Г), на 4–5-й неделе жизни (Д, Е). Кривые выживания (A, В, Д), изменение медианной (dM) и максимальной (d90%) продолжительности жизни (Б, Г, Е). Серый фон показывает возраст обработки SLE. * p < 0.05
Fig. 3. Effect of SLE on lifespan of D. melanogaster females fed at different ages: throughout life (A, Б), in the first 2 weeks after hatching (В, Г), at 4–5 weeks of age (Д, E). Survival curves (A, В, Д), change in median (dM) and maximum (d90%) lifespan (Б, Г, E). Gray background shows the age of SLE treatment. * p < 0.05
( F = 3.30, p = 0.069), тогда как ни концентрация экстракта ( F = 0.19, p = 0.946), ни взаимодействие факторов ( F = 0.19, p = 0.942) не показали значимого влияния. Полученные результаты демонстрируют сходную картину возрастных изменений у обоих полов при отсутствии достоверного влияния SLE и его взаимодействия с возрастом на проявление фенотипа «Smurf».
Влияние SLE на потребление пищи
Влияние SLE на уровень потребление пищи оценивали у самцов и самок D. melanogaster в возрасте 15 и 35 суток. Концентрация SLE в питательной среде составила 0.01, 0.1, 1 и 5 мг/мл. Двухфакторный дисперсионный анализ выявил статистически значимое влияние (p < 0.05) как концентрации экстракта, так и возраста особей на уровни потребления пищи у обоих полов (рис. 6, табл. 11). У самцов было увеличено потребление питательной среды с экстрактом в концентрации 0.1 мг/мл в возрасте 15 суток (в 2 раза) и 35 суток по сравнению с контролем. У самок также наблюдалось статистически значимое
Таблица 2. Влияние SLE, применяемого в течение всей жизни, на продолжительность жизни D. melanogaster
|
Вариант (мг/мл) |
Пол |
M (сут) |
dM (%) |
Тест Мантеля – Кокса |
Тест Гехана – Бреслоу – Вилкоксона |
90 % (сут) |
d90% (%) |
Тест Ванг – Аллисона |
N |
|
Контроль |
$ |
57 |
n/a |
n/a |
n/a |
71 |
n/a |
n/a |
472 |
|
0.01 |
$ |
54 |
-5 |
p < 0.0001 |
p < 0.05 |
66 |
-7 |
p < 0.0001 |
469 |
|
0.1 |
$ |
57 |
0 |
p < 0.05 |
p > 0.05 |
66 |
-7 |
p < 0.05 |
457 |
|
1 |
$ |
52 |
-9 |
p < 0.0001 |
p < 0.0001 |
65 |
-9 |
p < 0.0001 |
475 |
|
5 |
$ |
52 |
-9 |
p < 0.0001 |
p < 0.0001 |
64 |
-10 |
p < 0.001 |
478 |
|
Контроль |
$ |
64 |
n/a |
n/a |
n/a |
72 |
n/a |
n/a |
468 |
|
0.01 |
$ |
63 |
-2 |
p < 0.0001 |
p < 0.01 |
71 |
-1 |
p < 0.0001 |
479 |
|
0.1 |
$ |
64 |
0 |
p > 0.05 |
p > 0.05 |
72 |
-1 |
p > 0.05 |
464 |
|
1 |
$ |
62 |
-3 |
p < 0.01 |
p < 0.05 |
71 |
0 |
p > 0.05 |
482 |
|
5 |
$ |
60 |
-6 |
p < 0.0001 |
p < 0.0001 |
68 |
-6 |
p > 0.05 |
470 |
Примечание здесь и в табл. 3, 4. M – медианная продолжительность жизни, 90 % – возраст смертности 90 % выборки (максимальная продолжительность жизни), dM (%) – разница в медианной продолжительности жизни, d90% (%) - разница в возрасте 90 % смертности, N - количество мух, $ - самцы, $ - самки, n/a - не применимо.
Таблица 3. Влияние SLE, применяемого в возрасте 1–2 недель на продолжительность жизни D. melanogaster
Возраст (недель)
Возраст (недель)
неделя жизни самцы
Б
_ 4$0
Я «00
£ 350
1 300
1250 | 200
В 150 к £ 100 ■
X 50
О
Г
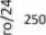
2 Л 200
С
$ 150
09 X
СО 100 а
5 50
о
4-5 неделя жизни самцы
на протяжении всей жизни самки

123456789 10
Возраст (недель)
1-2 неделя жизни самки
—контроль
—5 мг/мл
1 мг/мл

123456789 10
Возраст (недель)
Е
450 у
Я 400 -
О 350 -
5 300 - s 200 ■ х
В 150 ■
? 100 •
4-5 неделя жизни самки
^—контроль — 5 мг/мл — 1 мг/мл
0.1 мг/мл
— 0.01 мг/мл

О —■------.-------------.------г-----.------------г------------—
123456789 10
Возраст (недель)
Рис. 4. Влияние SLE на возрастные изменения двигательной активности самцов (А, В, Д) и самок (Б, Г, Е) в зависимости от концентрации экстракта. Добавление SLE проводилось на протяжении всей жизни имаго (А, Б), в течение первых двух недель (В, Г) и на 4–5-й неделе (Д, Е) жизни имаго. * p < 0.05, ** p < 0.01, *** p < 0.001, статистический анализ проводился с использованием двухфакторного дисперсионного анализа с последующими апостериорными тестами Тьюки HSD для попарных сравнений
Fig. 4. Effect of SLE on age-related changes in motor activity of males (A, B, Д) and females (Б, Г, E) depending on the concentration of the extract. SLE was added throughout the life of the imago (A, Б), during the first two weeks (B, Г) and at 4–5 weeks (Д, E) of the life of the imago. * p < 0.05, ** p < 0.01, *** p < 0.001, statistical analysis was performed using two-way ANOVA followed by Tukey's HSD post hoc tests for pairwise comparisons
Таблица 5. Результаты двухфакторного дисперсионного анализа локомоторной активности с учетом возраста мух и кормления SLE. Добавление SLE проводилось на протяжении всей жизни имаго
|
Фактор |
SS |
DF |
MS |
F |
p |
|
Самцы |
|||||
|
Экстракт |
59561441.77 |
4 |
14890360.44 |
9.102 |
7.80E-07 |
|
Возраст |
333716377 |
8 |
41714547.13 |
25.499 |
8.20E-28 |
|
Экстракт × Возраст |
49369494.8 |
32 |
1542796.71 |
0.943 |
0.5596 |
|
Ошибка |
368081509.1 |
225 |
1635917.82 |
||
|
Итого |
810728822.7 |
269 |
|||
|
Самки |
|||||
|
Экстракт |
7420935.66 |
4 |
1855233.92 |
12.668 |
2.10E-09 |
|
Возраст |
193758000.7 |
9 |
21528666.75 |
147.001 |
1.60E-94 |
|
Экстракт × Возраст |
4022897.72 |
36 |
111747.16 |
0.763 |
0.8343 |
|
Ошибка |
36613096.3 |
250 |
146452.39 |
||
|
Итого |
241814930.4 |
299 |
|||
Примечание здесь и в табл. 6, 7, 10, 11, 12. SS - сумма квадратов, DF - степени свободы, MS - средние квадраты. Результат теста Фишера: F – F -значение и p – p -значение.
увеличение потребления пищи в 3 раза с SLE в концентрациях 0.1 и 1 мг/мл в возрасте 15 суток. В зрелом возрасте (35 сут) у самок увеличилось потребление пищи в 4 раза с добавлением экстракта в концентрации 1 мг/ мл (см. рис. 6) по сравнению с контрольными мухами.
Влияние SLE на экспрессию генов
Для исследования влияния экстракта листьев аронии Мичурина на механизмы жизнеспособности и стресс-ответа у D. melanogaster были оценены уровни экспрессии генов с помощью qRT-PCR. Исследовали экспрессию генов, ассоциированных с ключевыми процессами старения, включая регуляцию энергетического баланса ( akh ),
аутофагию ( atgl и atg5 ), защиту от окислительного стресса ( cat, sod1 и sod2 ), реакцию на тепловой шок ( hsp26, hsp27 и hsp68 ), сигнализацию инсулина ( ilp5 ), липидный метаболизм ( lip3 ), а также рост и метаболизм клеток ( mTor, tsc1 и tsc2 ).
Большинство проанализированных генов не показали значительных изменений ( p > 0.05) в экспрессии в ответ на добавление SLE. Однако обработка экстрактом повлияла на экспрессию нескольких конкретных генов.
Двухфакторный дисперсионный анализ (экстракт х ген) с последующими множественными попарными сравнениями с использованием апостериорного теста Тьюки
Таблица 6. Результаты двухфакторного дисперсионного анализа локомоторной активности с учетом возраста мух и обработки SLE. Добавление SLE проводилось в течение первых двух недель жизни имаго
|
Фактор |
SS |
DF |
MS |
F |
p |
|
Самцы |
|||||
|
Экстракт |
12387314 |
4 |
3096828 |
0.680 |
0.6066 |
|
Возраст |
1388525317 |
9 |
154280591 |
33.872 |
0.00000 |
|
Экстракт × Возраст |
109232167 |
36 |
3034227 |
0.666 |
0.9264 |
|
Ошибка |
910972542 |
200 |
4554863 |
||
|
Итого |
2421117340 |
249 |
|||
|
Самки |
|||||
|
Экстракт |
1083712 |
4 |
270928 |
2.068 |
0.08640 |
|
Возраст |
84909908 |
9 |
9434434 |
72.000 |
0.00000 |
|
Экстракт × Возраст |
11235182 |
36 |
312088 |
2.382 |
0.00010 |
|
Ошибка |
26206591 |
200 |
131033 |
||
|
Итого |
123435393 |
249 |
|||
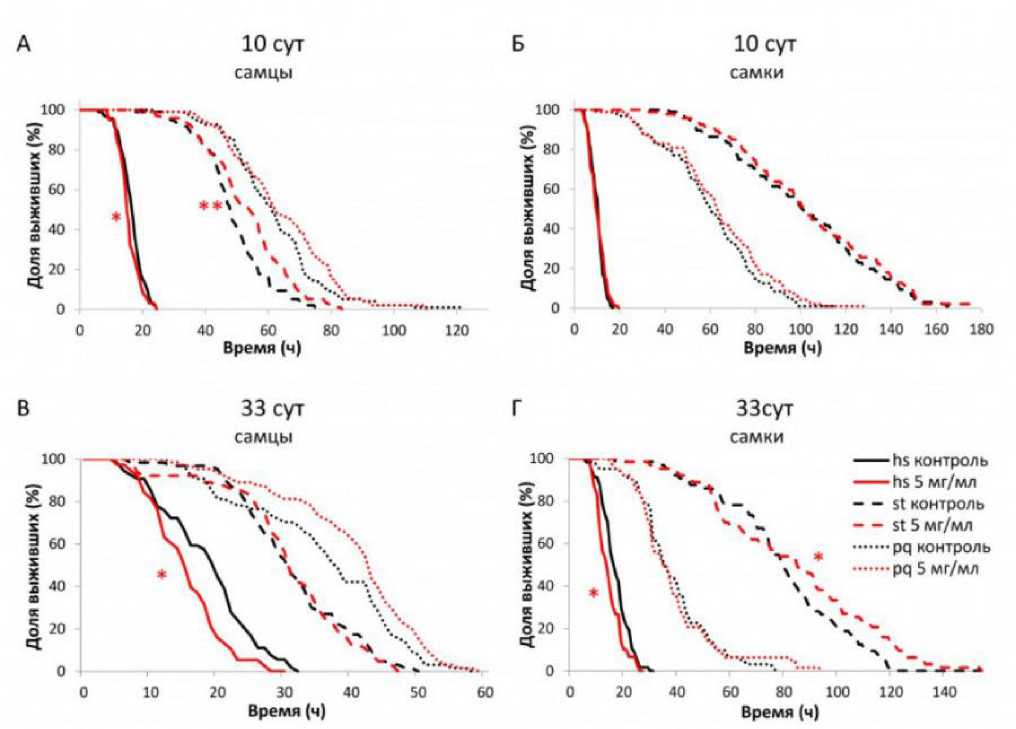
Рис. 5. Влияние SLE в концентрации 5 мг/мл на устойчивость самцов (А, В) и самок (Б, Г) в возрасте 10 суток (А, Б) и 33 суток (В, Г) к гипертермии (hs), голоданию (st) и параквату (pq). * p < 0.05, ** p < 0.01, *** p < 0.001
Fig. 5. The effect of SLE at a concentration of 5 mg/ml on the resistance of males (A, B) and females (Б, Г) at the age of 10 days (A, Б) and 33 days (В, Г) to hyperthermia (hs), starvation (st) and paraquat (pq). * p < 0.05, ** p < 0.01, *** p < 0.001
Таблица 8. Влияние SLE (5 мг/мл) на устойчивость самцов и самок в возрасте 10 суток к гипертермии, голоданию и параквату
|
Вариант |
Стресс-фактор |
Пол |
50 % (ч) |
d50% (%) |
WA |
90 % (ч) |
d90% (%) |
WA |
LRbf |
N |
|
контроль |
гипертермия |
^ |
17 |
n/a |
n/a |
22 |
n/a |
n/a |
n/a |
93 |
|
SLE (5 мг/мл) |
гипертермия |
^ |
15 |
-11.8 |
0.0006 |
20 |
-9.1 |
0.1972 |
0.0418 |
96 |
|
контроль |
голодание |
^ |
48 |
n/a |
n/a |
63 |
n/a |
n/a |
n/a |
96 |
|
SLE (5 мг/мл) |
голодание |
^ |
55 |
14.6 |
0.0485 |
70 |
11.1 |
0.0862 |
0.0029 |
96 |
|
контроль |
паракват |
^ |
62 |
n/a |
n/a |
79 |
n/a |
n/a |
n/a |
96 |
|
SLE (5 мг/мл) |
паракват |
^ |
63 |
1.6 |
0.7743 |
83 |
5.1 |
0.3769 |
0.1664 |
95 |
|
контроль |
гипертермия |
? |
11 |
n/a |
n/a |
14 |
n/a |
n/a |
n/a |
95 |
|
SLE (5 мг/мл) |
гипертермия |
? |
10 |
-9.1 |
0.9754 |
15 |
7.1 |
0.7529 |
0.5102 |
96 |
|
контроль |
голодание |
? |
102 |
n/a |
n/a |
144 |
n/a |
n/a |
n/a |
96 |
|
SLE (5 мг/мл) |
голодание |
? |
102 |
0.0 |
0.8164 |
148 |
2.8 |
0.8083 |
0.5049 |
94 |
|
контроль |
паракват |
? |
61 |
n/a |
n/a |
88 |
n/a |
n/a |
n/a |
96 |
|
SLE (5 мг/мл) |
паракват |
? |
63 |
3.3 |
0.5984 |
93 |
5.7 |
0.3564 |
0.2053 |
94 |
Примечание здесь и в табл. 9. n/a - не применимо; в - самцы; $ - самки; 50 % - медианное значение выживаемости, d50% (%) – разница в медианном значении выживаемости, 90 % – максимальное значение выживаемости, d90% (%) – разница в максимальном значении выживаемости, WA – тест Ванга – Аллисона, LRbf – логранговый тест с поправкой Бонферрони для множественных сравнений, N – количество мух.
Таблица 9. Влияние SLE (5 мг/мл) на устойчивость самцов и самок в возрасте 33 суток к гипертермии, голоданию и параквату
|
Вариант |
Стресс фактор |
Пол |
50 % (ч) |
d50% (%) |
WA |
90 % (ч) |
d90% (%) |
WA |
LRbf |
N |
|
контроль |
гипертермия |
в |
20 |
n/a |
n/a |
28 |
n/a |
n/a |
n/a |
54 |
|
SLE (5 мг/мл) |
гипертермия |
в |
16 |
-20 |
0.015 |
28 |
0 |
0.3938 |
0.005 |
38 |
|
контроль |
голодание |
в |
31 |
n/a |
n/a |
43 |
n/a |
n/a |
n/a |
63 |
|
SLE (5 мг/мл) |
голодание |
в |
31 |
0 |
0.9831 |
43 |
0 |
0.9398 |
0.8193 |
64 |
|
контроль |
паракват |
в |
38 |
n/a |
n/a |
49 |
n/a |
n/a |
n/a |
64 |
|
SLE (5 мг/мл) |
паракват |
в |
43 |
13.1 |
0.175 |
52 |
6.1 |
0.101 |
0.053 |
64 |
|
контроль |
гипертермия |
$ |
16 |
n/a |
n/a |
23 |
n/a |
n/a |
n/a |
57 |
|
SLE (5 мг/мл) |
гипертермия |
$ |
13 |
-11.8 |
0.0923 |
19 |
-11.4 |
0.7331 |
0.0482 |
30 |
|
контроль |
голодание |
$ |
80 |
n/a |
n/a |
112 |
n/a |
n/a |
n/a |
64 |
|
SLE (5 мг/мл) |
голодание |
$ |
85 |
6.25 |
0.2575 |
123 |
9.8 |
0.0356 |
0.0438 |
63 |
|
контроль |
паракват |
$ |
35 |
n/a |
n/a |
55 |
n/a |
n/a |
n/a |
62 |
|
SLE (5 мг/мл) |
паракват |
$ |
35 |
0 |
0.9341 |
55 |
0 |
0.9999 |
0.9929 |
63 |
Таблица 10. Результаты двухфакторного дисперсионного анализа влияния возраста и SLE на частоту фенотипа «Smurf» у самцов и самок D. melanogaster
|
Пол |
Фактор |
SS |
DF |
MS |
F |
p |
|
Самцы |
Возраст |
0.0421 |
1 |
0.0421 |
3.48 |
0.062 |
|
Экстракт |
0.0627 |
4 |
0.0157 |
1.30 |
0.269 |
|
|
Возраст × Экстракт |
0.0100 |
4 |
0.0025 |
0.21 |
0.935 |
|
|
Ошибка |
25.5672 |
2117 |
0.0121 |
|||
|
Самки |
Возраст |
0.2109 |
1 |
0.2109 |
3.30 |
0.069 |
|
Экстракт |
0.0474 |
4 |
0.0119 |
0.19 |
0.946 |
|
|
Возраст × Экстракт |
0.0495 |
4 |
0.0124 |
0.19 |
0.942 |
|
|
Ошибка |
128.2603 |
2007 |
0.0639 |
HSD показал, что экспрессия ilp5 и lip3 была снижена ( p < 0.05) у самок после добавления SLE в концентрации 5 мг/мл. У самцов также наблюдали снижение экспрессии lip3 ( p < 0.05) (рис. 7). Эти результаты свидетельствуют о влиянии SLE на экспрессию генов, связанных с метаболизмом липидов ( lip3 ), у обоих полов и на сигнализацию инсулина ( ilp5 ) у самок.
Обсуждение
В данной работе мы исследовали влияние этанолового экстракта листьев аронии Мичурина на адаптивную способность обоих полов D. melanogaster как в оптимальных, так и в стрессовых условиях. Исследуемый нами экстракт листьев продемонстрировал токсическое воздействие на продолжительность жизни обоих полов D. melanogaster при применении в разном возрасте и концентрациях (0.01, 0.1, 1 и 5 мг/мл), причем наиболее значительное сокращение продолжительности жизни наблюдалось при более высоких концентрациях.
Согласно опубликованным исследованиям, общее содержание фенолов в экстракте листьев Aronia melanocarpa составляет 131.5 мг эквивалентов хлорогеновой кислоты/г экстракта (ванилиновая кислота, кофейная кислота, феруловая кислота, рутин, розмариновая кислота, кверцетин, лю-теолин, нарингенин, кемпферол) (Cvetanović et al., 2018), а общее количество флавоноидов – 88.6 мг эквивалента рутина/г экс-
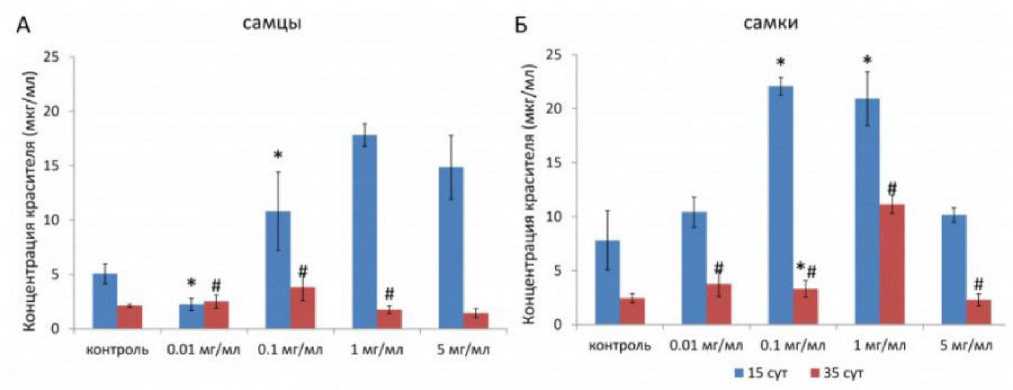
Рис. 6. Влияние SLE на уровень потребления пищи у самцов (А) и самок (Б) в зависимости от возраста особи и концентрации экстракта. Показаны различия между контролем и опытом в зависимости от концентрации экстракта (* p < 0.05) и возраста обработки экстрактом (# p < 0.05). Статистическая обработка проводилась с помощью двухфакторного дисперсионного анализа с последующими post-hoc тестами Тьюки HSD для попарных сравнений
Fig. 6. Effect of SLE on food consumption in males (A) and females (Б) depending on the age of the individual and the extract concentration. Differences between the control and the experiment depending on the extract concentration (* p < 0.05) and the age of treatment with the extract (# p < 0.05) are shown. Statistical processing was performed using two-way analysis of variance followed by Tukey's HSD post-hoc tests for pairwise comparisons
Таблица 11. Результаты дисперсионного анализа потребления пищи в зависимости от возраста мух и кормления SLE
■ контроль ■ 5 мг/мл
Рис. 7. Влияние SLE на уровень экспрессии генов, связанных со старением, у самцов (A) и самок (Б) мух в возрасте 14 дней. Значения Ct (пороги цикла) обратно пропорциональны уровням транскриптов мРНК. Значения дельта Ct (dCt) рассчитывались как разница между значениями Ct для целевых генов и референтных генов ( в-тубулин, eEF1a2 и RpL32 ). Более высокие значения dCt соответствуют более низким уровням экспрессии. Графики представляют среднее значение трех биологических повторностей, по три технических в каждой. Планки погрешностей представляют стандартную ошибку среднего. * p < 0.05, значимость определялась с помощью двухфакторного дисперсионного анализа (ANOVA) с последующими апостериорными тестами Тьюки HSD для попарных сравнений
Fig. 7. Effect of SLE on expression levels of aging-related genes in 14-day-old male (A) and female (Б) flies. Ct values (cycle thresholds) are inversely related to mRNA transcript levels. Delta Ct (dCt) values were calculated as the difference between Ct values for target genes and reference genes (β-tubulin, eEF1α2, and RpL32). Higher dCt values correspond to lower expression levels. Graphs represent the average of three biological replicates, three technical replicates each. Error bars represent standard error of the average. * p < 0.05, significance was determined by two-way ANOVA followed by Tukey HSD post hoc tests for pairwise comparisons
Таблица 12. Результаты двухфакторного дисперсионного анализа эффектов SLE на уровень экспрессии генов, связанных со старением
Ранее биодоступность полифенолов из плодов и листьев аронии (Aronia melanocarpa) изучалась in vitro с использованием моделей пищеварительных жидкостей человека: имитированной слюнной, желудочной и кишечной сред на основе стандартных электролитных растворов (Minekus et al., 2014; Saracila et al., 2024). Результаты показали, что полифенолы из листьев аронии демонстрируют наибольшую биодоступность в желудочной фазе, тогда как полифенолы из плодов активнее высвобождаются в кишечной фазе (Saracila et al., 2024).
Для дальнейшего изучения физиологических эффектов листьев аронии мы провели эксперимент на Drosophila melanogaster. Установлено, что добавление экстракта (0.1 и 1 мг/мл) вызвало повышение потребление питательной среды как у молодых (15 суток), так и у зрелых (35 суток) особей обоего пола, что свидетельствует о его пищевой привлекательности для мух. При этом экстракт листьев аронии, несмотря на стимуляцию потребления пищи, не нарушает целостность кишечного барьера даже при длительном воздействии (6 и 8 недель). Также важно отметить, что исследуемый экстракт не оказывал статистически значимого влияния на двигательную активность D. melanogaster ни в одном из возрастных периодов, что свидетельствует об отсутствии токсического воздействия на базовые двигательные функции.
Кроме того, мы исследовали воздействие влияние экстракта листьев аронии (5 мг/мл) на выживаемость плодовых мушек в неблагоприятных условиях окружающей среды (окислительный стресс, гипертермия, голодание). В нашем исследовании окислительный стресс, вызванный прооксидантом паракватом, не оказал статистически значимого воздействия на медианную и максимальную выживаемость особей обоих полов D. melanogaster в возрасте 10 и 33 суток при предварительной обработке SLE (5 мг/ мл). По всей видимости, изученный нами экстракт в данной концентрации обладает меньшей антиоксидантной активностью. Однако известны исследования, в которых листья аронии проявляют высокий антиоксидантный потенциал, при этом молодые листья обладают более высоким содержанием полифенолов и флавоноидов, чем старые листья (Cvetanović et al., 2018; Thi, Hwang, 2014), что, теоретически, может повысить устойчивость организма в неблагоприятных условиях, вызванных окислительным стрессом. Предобработка SLE в концентрации 5 мг/мл снижала медианную выживаемость в условиях гипертермии у самцов на 12 % в молодом возрасте (10 суток) и на 20 % во взрослом (33 суток), а у взрослых самок на 12 %. Также нами установлено, что экстракт листьев аронии Мичурина (5 мг/ мл), который мы исследовали, увеличил медианную выживаемость на 15 %, а максимальную выживаемость на 11 % у молодых самцов (10 сут), а у взрослых (33 сут) самок D. melanogaster на 6 % в условиях голодания. В условиях голодания, возможно, выживаемость D. melanogaster обусловлена общим снижением скорости метаболизма липидов, белков и углеводов в организме (Marron et al., 2003). Кроме того, рутин (который также присутствует в нашем экстракте) в концентрации 400 мкМ повышал устойчивость к го- лоданию, тепловому и холодовому стрессу Drosophila melanogaster, содержащихся на питательной среде с высоким содержанием жиров (Chattopadhyay, Thirumurugan, 2020).
Известно, что в условиях краткосрочного голодания увеличивается выживаемость организма, но при длительном голодании происходит максимальное использование всех внутренних ресурсов организма (Hänschke et al., 2022). Согласно исследованию, повышение уровня липазы оказывает положительное влияние на общее состояние здоровья организма, в частности за счет усиления обменных процессов и улучшения общего состояния здоровья (Chandra et al., 2020). Как было установлено в наших предыдущих исследованиях, динамика общего содержания липидов в контрольной линии w/w и долгоживущих мутантных мухах E(z)/w имела сходную тенденцию к постепенному увеличению до возраста 100 суток с последующим снижением по мере старения и приближения к концу жизни (Shaposhnikov et al., 2022). Lea Hänschke et al. продемонстрировали, что lip3 играет важную роль в липидном обмене веществ и значительно активируется в ответ на нехватку питательных веществ и у старых мух (Hänschke et al., 2022). Более того, обнаружено, что самцы-мутанты lip3 проявляют повышенную чувствительность к голоданию, но при этом демонстрируют увеличение продолжительности жизни, что подчеркивает существование потенциальных половых различий в регуляции липидного метаболизма и реакции на стресс (Hänschke et al., 2022). Кроме того, изменение липидного обмена приводит к изменениям в липидных профилях, которые могут увеличить риск возрастных заболеваний и повлиять на общее состояние здоровья. Многочисленные исследования свидетельствуют, что экстракты листьев содержат биологически активные соединения, способные модулировать липидный метаболизм и влиять на липидный профиль в различных биологических системах (Angiolillo et al., 2021; Simões et al., 2022).
Ilp5 – инсулиноподобный пептид, за счет которого вырабатывается инсулин клетками в мозге человека, у дрозофилы он обнаружен после личиночной стадии и является одним из главных регуляторов липидного обмена (Toprak, 2020). У Drosophila melanogaster жировое тело играет ключевую роль в энергетическом обмене, выполняя функцию депо триглицеридов, а также участвуя в их метаболизме и регуляции обмена глюкозы (Chatterjee, Perrimon, 2021).
Поддержание жизнедеятельности взрослых особей Drosophila melanogaster в условиях голодания обеспечивается секреторными клетками эноцитами, которые метаболизируют липиды, поступающие из жирового тела (Chatterjee, Perrimon, 2021). Вероятно, благодаря активации этих механизмов организм плодовой мушки адаптируется и приобретает устойчивость к условиям голодания.
В нашем исследовании экстракт листьев аронии Мичурина (5 мг/мл) статистически значимо снижал экспрессию генов метаболизма липидов ( lip3 ) у особей обоих полов, а также снижал экспрессию сигнализации инсулина ( ilp5 ) у самок Drosophila melanogaster в возрасте 14 суток. Эти результаты сопоставимы с полученными нами негативными эффектами на продолжительность жизни особей обоих полов при применении экстракта на протяжении всей жизни (5 мг/мл). Вероятно, необходимо дальнейшее изучение влияния экстракта листьев аронии в концентрациях 0.01, 0.1 и 1 мг/мл на адаптацию особей обоих полов Drosophila melanogaster к неблагоприятным условиям окружающей среды, сопоставимых с исследованиями на продолжительность жизни.
Таким образом, изучение экологических функций растений позволяет понять взаимодействия между различными видами в экосистемах, а также рассмотреть перспективы разработок более безопасных и экологически устойчивых методов борьбы с вредителями (Rajput et al., 2023).
В данном исследовании мы всесторонне изучили воздействие экстракта листьев аронии Мичурина, рассматривая его через призму двух взаимосвязанных аспектов. В экологическом контексте мы оценили влияние данного биотического фактора на модельный организм D. melanogaster , что позволило проанализировать взаимодействие растительных метаболитов с насекомыми в искусственно созданной экосистеме. С физиологической точки зрения мы исследовали адаптационный потенциал и показатели жизнеспособности плодовых мушек при воздействии экстракта в различных стрессовых условиях, что дает возможность понять механизмы физиологического ответа на данный фитокомпонент.
Заключение
В настоящем исследовании мы изучили краткосрочные и долгосрочные эффекты экстракта листьев аронии Мичурина ×Sorbaronia mitschurinii на жизнеспособность D. melanogaster . Мы обнаружили, что в краткосрочной перспективе самая высокая концентрация экстракта листьев оказывала адаптивное действие на дрозофилу в неблагоприятных условиях окружающей среды (гипертермия и голодание), что может быть обусловлено активацией защитных клеточных систем через механизм гормезиса. Однако различные концентрации экстрактов листьев аронии Мичурина оказывали долгосрочное токсическое действие на мух, что приводило к сокращению продолжительности жизни у обоих полов. Отсроченное токсическое действие экстракта, по-видимому, связано с истощением защитных резервов и сопутствующим сокращением продолжительности жизни. Кроме того, изучение инсектицидных свойств растительных экстрактов может дать представление о сложной динамике взаимоотношений травоядных и растений. Эти знания необходимы для понимания экологического баланса и роли, которую различные виды играют в поддержании здоровых экосистем.
Результаты нашего исследования могут быть использованы для разработки более безопасных и экологически устойчивых методов борьбы с вредителями. Известно, что обычные химические пестициды оказывают пагубное воздействие на нецелевые организмы и окружающую среду, что приводит к таким проблемам, как загрязнение почвы и воды, потеря биоразнообразия и развитие устойчивости к пестицидам у популяций вредителей. Напротив, инсектициды растительного происхождения, как правило, более биоразлагаемы и менее вредны для полезных насекомых и других диких животных. Использование природных соединений позволяет сделать сельскохозяйственные методы более устойчивыми, тем самым снижая воздействие на окружающую среду и эффективно управляя популяциями вредителей. Применение биологически активных соединений, полученных из растений, для борьбы с вредителями может снизить токсический эффект и побочное воздействие на здоровье человека при употреблении обработанных продуктов питания.


