Кожесохранная мастэктомия с одномоментной реконструкцией при комплексном лечении рака молочной железы с отеком кожи (cT4bN0-3M0, ycT0-4bN0-3M0)
Автор: Фокина Т.Ю., Зикиряходжаев А.Д., Волченко Н.Н., Сарибекян Э.К., Хугаева Ф.С., Максимов К.В., Дуадзе И.С., Усов Ф.Н., Кодзоева Д.Б., Захарова М.А., Замалдинов Н.Д., Занозина Е.А., Каприн А.Д.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Маммология
Статья в выпуске: 4 т.25, 2025 года.
Бесплатный доступ
Цель исследования. Улучшение качества жизни путем деэскалации хирургического лечения у больных раком молочной железы с отеком кожи (сT4b). Материалы и методы. Исследование представляет собой проспективный анализ 55 пациентов стадии cT4bN0-3M0. Всем пациентам до неоадъювантной лекарственной терапии (НАЛТ) проводили биопсию кожи молочной железы в области ареолы и проекции опухоли с целью исключения наличия раковых эмболов. Далее больные были разделены на три группы: в 1 й группе (n = 7) опухолевые эмболы в коже отсутствовали до НАЛТ и была проведена кожесохранная мастэктомия с одномоментной реконструкцией экспандером; во 2 й группе (n = 27) опухолевые эмболы в коже также отсутствовали и была выполнена мастэктомия; в 3 й группе (n = 21) были обнаружены опухолевые эмболы в коже и выполнена мастэктомия. В группах проведена сравнительная характеристика по критериям: гистологическое строение и молекулярно-биологический тип злокачественного образования, степень злокачественности (G), размер опухоли до и после лекарственного лечения, степень толщины кожи до и после НАЛТ, степень клинического ответа на НАЛТ, сроки ожидания хирургического лечения. Оценивалась частота поражения кожи молочной железы раковыми эмболами, степень клинического ответа опухоли по критериям RECIST 1.1 и динамика отека кожи, возможность выполнения кожесохранной мастэктомии с одномоментной реконструкцией экспандером, качество жизни пациенток с реконструкцией и без. Результаты. В 1 й группе полный клинический ответ в молочной железе составил 71,4%, во 2 й группе – 44,4%, в 3 й группе – 42,9%. Частичный клинический ответ в молочной железе в 1 й группе составил 28,6%, во 2 й группе 55,6%, в 3 й группе 47,6%. Отсутствие ответа на лекарственное лечение было лишь в группе с обнаруженными опухолевыми эмболами в коже и составило 9,5%. В 71,4% случаев опухолевые эмболы встречались сочетано в ареоле и в проекции кожи над опухолью. Медиана времени до проведения хирургического лечения в 1 й; во 2 й и в 3 й группе составили 32,7; 34,6; 35,2 соответственно. Заключение. Отсутствие локо-регионарного метастазирования в первой группе подтверждает возможность рассмотрения вопроса о выполнении кожесохранной мастэктомии с одномоментной реконструкцией экспандером при наличии благоприятных факторов – отсутствие раковых эмболов в коже при биопсии, купирование отека, объективный эффект на НАЛТ.
Рак молочной железы с отеком, биопсия кожи молочной железы, раковые эмболы в коже, кожесохранная мастэктомия с одномоментной реконструкцией экспандером
Короткий адрес: https://sciup.org/149150009
IDR: 149150009 | DOI: 10.24412/1999-7264-2025-4-223-237
Текст научной статьи Кожесохранная мастэктомия с одномоментной реконструкцией при комплексном лечении рака молочной железы с отеком кожи (cT4bN0-3M0, ycT0-4bN0-3M0)
Рак молочной железы с отеком кожи (ОРМЖ) является наиболее агрессивной формой из злокачественных образований молочной железы. Лечение пациенток с таким диагнозом всегда носит комплексный характер и включает в себя несколько этапов: неоадъювантную лекарственную терапию (НАЛТ), хирургическое лечение и дистанционную лучевую терапию. При этом хирургический этап подразумевает удаление всей железы и регионарной клетчатки без возможности одномоментной реконструкции.
Общая 5-летняя выживаемость у пациенток с диагнозом ОРМЖ, получивших комплексное лечение, увеличилась до 70%, а 10- и 15-летняя — до 35% и 20–30% соответственно [1].
Известно, что при наличии РМЖ возможен отсев клеток рака в кожу. Чаще всего данный отсев можно обнаружить в области ареолы и в проекции опухоли на кожу.
В последние годы все чаще возникает вопрос о возможности выполнения кожесохранной мастэктомии с реконструкцией при установлении диагноза cT4b при планировании комплексного лечения. Перспектива выполнения кожесохранной мастэктомии с реконструкцией при установлении диагноза ОРМЖ напрямую зависит от наличия/отсутствия клеток рака в коже. При планировании мастэктомии данный фактор не имеет принципиального значения. Однако, при рассмотрении вопроса о реконструкции с экспандером, необходимо частичное сохранение кожи по периметру молочной железы. Нами была разработана методика диагностики наличия клеток рака в коже с гистологическим исследованием.
В 2018 году на Международном консенсусе «Программа исследований воспалительного рака молочной железы имени Моргана Уэлча» рекомендовано, кроме основных методов диагностики, рассмотреть вопрос биопсии кожи с двух участков толщиной от 2 до 8 мм из наиболее заметной области изменения цвета кожи молочной железы [2].
В исследовании, проведенном в Индии, Sharma и его коллегами были проанализированы истории болезни 111 пациенток с ОРМЖ, которые проходили лечение в период с января 2014 года по декабрь 2018 года [3]. Средний возраст пациенток на момент исследования составил 50 лет. До начала неоадъювантной полихимиотерапии (НАПХТ)
размер узлового образования в среднем достигал 7 см. После проведения патогистологического исследования средний размер образования уменьшился до 1 см. У 78 пациенток патоморфологический ответ после НАПХТ составил 50% и более, а у 43 из них — более 90%. В ходе окончательной гистопатологии у 57 (51,4%) пациенток было выявлено поражение кожи, а у 54 (48,6%) — нет. В исследовании было установлено, что у пациенток с ER-негативными опухолями и опухолями диаметром менее 1 см с большей вероятностью не наблюдалось поражения кожи (р = 0,006). Результаты этого исследования поднимают вопрос о возможности реконструктивных операций при значительном клиническом ответе при ОРМЖ.
Patel с соавторами из США провели ретроспективный анализ безрецидивной выживаемости пациенток, включенных в базу данных SEER-Medicare по неметастатическому ОРМЖ и проходивших лечение с 1991 по 2009 годы [4]. В данное исследование были включены женщины в возрасте ≥65 лет, у которых были полные данные о заболевании и проведенном лечении. Средний возраст на момент постановки диагноза составил 75,5 (диапазон 65–103) лет. В исследование были включены пациентки с различными суррогатными иммуногистохимическими подтипами, N0–N3, с проведенной тримодальной терапией, среди которых 1472 получили хирургическое лечение в объеме мастэктомии и 44 пациентки (3%) прошли одномоментную реконструкцию. Критериями отбора пациенток для одномоментной реконструкции стали более молодой возраст и низкий индекс коморбидности Чарлсона. Пациенты, перенесшие одномоментную реконструкцию молочной железы, были моложе по сравнению с теми, кто не перенес реконструкцию (в среднем 72,6 года против 75,6 лет, p = 0,008). При оценке через 1 год от окончания лечения в группе пациентов с одномоментной реконструкцией смертность от причин, связанных с РМЖ, составляла 21,1% при сравнении с группой пациентов без реконструкции — 20,9%, через 2 года показатели имели разницу — 30,7% и 32,6% соответственно. При оценке общей смертности показатели отличались значительнее: 1 год в группе с одномоментной реконструкцией 21,1%, а в группе без реконструкции — 27,9%, через 2 года показатели составили 33,1% и 43,8% соответственно. В многофакторном анализе, включающем КМЭ и значимые однофакторные показатели, КМЭ не была связана с высокой общей смертностью (ОС) (ОШ = 1,14, ДИ 0,71–1,76, p = 0,55). Независимыми предикторами ОС были возраст на момент постановки диагноза (p = 0.003), степень злокачественности опухоли (p = 0.005), отсутствие гормональных рецепторов (p < 0.001), количество пораженных лимфатических узлов (p < 0.001) и ответ на неоадъювантную химиотерапию (p = 0.006).
Низкодифференцированная/недифференцированная степень злокачественности опухоли и ER-отрицательный/PR-отрицательный статус были связаны с повышенным риском ОС. По сравнению с высокодифференцированной гистологической степенью, риск развития метастазов рака молочной железы в 3 раза выше при низкодифференцированной или недифференцированной степени злокачественности ОРМЖ (КР 3,19, ДИ 1,71–5,95, p = 0,005), а риск развития метастазов рака молочной железы в 2 раза выше при нелюминальном гормональном статусе опухоли (КР 2,01, ДИ 1,69–2,39, p = 0,0005). Таким образом, авторы пришли к выводу: поскольку продолжительность жизни населения в целом и пациентов с ОРМЖ в частности увеличивается, отказ от одномоментной реконструкции в случае инвазивного рака молочной железы с отеком кожи по историческим причинам может быть неоправданным и должен оставаться возможным вариантом при выборе объема в плане комплексного лечения [4].
В нидерландском исследовании Haarman и соавт. был проведен ретроспективный анализ историй болезни пациенток с диагнозом ОРМЖ. Сравнивалась выживаемость пациенток после проведения мастэктомии и после проведения органосохранных операций. В исследование было включено 1394 историй болезни пациенток, которые проходили комплексное лечение в 2005–2021 гг. Из них 1214 (87,1%) была выполнена мастэктомия, 180 (12,9%) — органосохранные операции. При многофакторном анализе пропорциональных рисков Кокса нет существенной разницы между мастэктомией и органосохранными 226
операциями с точки зрения общей выживаемости (ОР: 0,67, 95% ДИ 0,38-1,19, р = 0,171). В данном исследовании было показано, что органосохранные операции допустимы в плане комплексного лечения ОРМЖ [5].
С 2004 по 2015 гг. в Канаде проводилось исследование, участниками которого стали 4076 пациентов с ОРМЖ и отсутствием отдаленных метастазов. 388 (9,5%) была проведена мастэктомия с реконструкцией молочной железы и 3688 (90,5%) без неё. Средний возраст на момент постановки диагноза составил 55,1 ± 12,5 лет, средний размер опухоли составил 6,1 ± 5,0 см, у большинства пациенток были поражены регионарные лимфатические узлы (85,2%), опухоль имела высокую степень злокачественности (60,6%). Пациентки, которым была проведена немедленная реконструкция молочной железы, в среднем были моложе на момент постановки диагноза по сравнению с женщинами, которым реконструкция не проводилась (49,2 года против 55,7 лет, p < 0,0001). У этих женщин чаще был более высокий средний доход (p < 0,0001) и они чаще жили в мегаполисах (p < 0,0001). Между двумя группами не было различий в размере опухоли, её стадии, поражении регионарных лимфатических узлов, а также в статусе ER и PR. В рамках сопоставительного анализа 336 женщин, которым была выполнена немедленная реконструкция молочной железы, были сопоставлены с 1008 женщинами, которым реконструкция не проводилась. Соотношение составило 3:1. Анализ проводился на основе схожих демографических данных, характеристик опухоли и хирургического лечения. Результаты сопоставительного анализа показали, что 10-летняя выживаемость без рецидивов среди женщин, которые перенесли реконструкцию молочной железы (56,6%), и женщин, не перенесших реконструкцию (62,2%), была одинаковой (скорректированный ОР 0,96, 95% ДИ 0,79–1,16, p = 0,65). Это исследование подтвердило безопасность одномоментной реконструкции при ОПРЖ [6].
Цель исследования: у лучшение качества жизни путем деэскалации хирургического лечения у больных раком молочной железы с отеком кожи (сТ4Ь).
Материалы и методы
В период с 2023 по 2025 гг. проведено проспективное когортное контролируемое клиническое исследование на базе отделения онкологии и реконструктивно-пластической хирургии молочной железы и кожи МНИОИ им. П.А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава РФ.
Объектом исследования были 55 женщин, больных РМЖ стадии cT4bN0-3M0, которым до неоадъювантной лекарственной терапии (НАЛТ) проводилась биопсия кожи молочной железы из двух точек с целью исключения наличия раковых эмболов и рассмотрения возможности выполнения кожесохранной мастэктомии с одномоментной реконструкцией экспандером. Возраст больных от 31 до 79 лет. Средний возраст пациенток на момент хирургического лечения составил 51,4 ± 10,5 лет. Менструальный статус был сохранен у 53,6%, состояния менопаузы достигли 43,6% больных.
Общая когорта больных в зависимости от результата биопсии кожи была разделена на 2 группы: в 1-ю группу (N=34) вошли пациенты, у которых по результатам не обнаружены опухолевые эмболы до проведения НАЛТ. Во 2-ю группу (N=21) включены пациенты, у которых по результатам биопсии кожи были обнаружены опухолевые эмболы до проведения НАЛТ.
В общей сложности 55 пациенткам было выполнено 110 биопсий кожи из двух участков молочной железы. У 21 из них были обнаружены раковые клетки, что составило 38,2% от общего количества биопсий. В зависимости от локализации молочной железы, опухолевые эмболы были выявлены в следующих случаях: 71,4% — сочетано в ареоле и в области опухоли на коже, 19,1% — только в ареоле, 9,5% — только в области опухоли на коже (Табл. 1).
Табл. 1. Наличие раковых клеток в зависимости от места взятия биопсии
|
Локализация взятия биопсии кожи/ Skin Biopsy Site |
Количество (процент) выявленных опухолевых эмболов/ Number (%) of Detected Tumor Emboli |
|
Сочетание ареолы и кожи в проекции опухоли/Combination of areola and skin over the tumor |
15 (71,4%) |
|
Ареола/ Areola |
4 (19,1%) |
|
Кожа в проекции опухоли/ Skin over the tumor |
2 (9,5%) |
|
Всего/ Total: |
21 (100%) |
Мы провели сравнительный анализ клинико-морфологических характеристик пациентов с раковыми эмболами в коже и без них. Более подробные данные представлены в таблице 2. В первой группе наиболее часто встречались опухоли с тройным негативным подтипом (35,3%) и люминальным В, Her2/neu-негативным (35,3%). Люминальный В, Her2/neu-позитивный подтип составил 20,6%, а нелюминальный, Her2/neu-позитивный — 8,8%. Во второй группе наиболее часто встречались люминальные В, Her2/neu-негативные опухоли (57,1%), реже — тройной негативный (19,0%) и люминальный А (14,3%). При сравнении гистологических типов опухолей было выявлено, что инвазивный протоковый рак встречался у 28 (82,4%) пациентов из первой группы и у 17 (81%) из второй. Инвазивный дольковый рак наблюдался у 4 (11,8%) пациентов из первой группы и у 2 (9,5%) из второй. Другие формы встречались у 2 (5,9%) пациентов из первой группы и у 2 (9,5%) — из второй. В первой и второй группах преобладали умеренно дифференцированные опухоли (G2): 19 случаев (55,9%) и 14 случаев (66,7%), соответственно.
Табл. 2. Сравнительный анализ клинико-морфологических характеристик больных с наличием и отсутствием раковых эмболов в коже
|
Характеристики |
1-я группа /Group 1, n=34 2-я группа /Group 2, n=21 |
||
|
N |
% N |
% |
|
|
Биологический подтип /Biological subtype |
|||
|
Тройной негативный тип / Triple negative subtype |
12 |
35,3 4 |
19,0 |
|
Люминальный В Her2/neu негативный / Luminal B Her2/neu negative |
12 |
35,3 12 |
57,1 |
|
Люминальный В Her2/neu-позитивный / Luminal B Her2/neu positive |
7 |
20,6 1 |
4,8 |
|
Нелюминальный Her2/neu позитивный / Non-luminal Her2/neu positive |
3 |
8,8 1 |
4,8 |
|
Люминальный А/Luminal А |
0 |
0 3 |
14,3 |
|
Гистологический тип опухоли /Histological type of cancer |
|||
|
Инвазивный протоковый рак/Invasive ductal cancer |
28 |
82,4 17 |
81,0 |
|
Инвазивный дольковый рак/ Invasive lobular cancer |
4 |
11,8 |
2 |
9,5 |
|
Другие формы / Other types |
2 |
5,9 |
2 |
9,5 |
|
Степень злокачественности /Grade of malignancy |
||||
|
G1 |
0 |
0 |
0 |
0 |
|
G2 |
19 |
55,9 |
14 |
66,7 |
|
G3 |
15 |
44,1 |
7 |
33,3 |
Средний размер опухолевого узла во всех группах до начала НАЛТ, измеренный по максимальному диаметру, согласно данным ультразвукового исследования (УЗИ) и маммографии (ММГ), составил 40,1±8,1 мм. После НАЛТ, по данным УЗИ и маммографии, средний размер опухолевого узла снизился до 11,4±8,3 мм. Толщина кожи до и после НАЛТ (по данным ММГ) в первой группе составляла 5,5 мм и 2,8 мм соответственно. Во второй группе эти показатели были 13,6 мм и 4 мм. Размер узла до и после НАЛТ (по данным ММГ, в мм) в послеоперационном материале: в первой группе — 11,5 мм, во второй — 21,5 мм. Более подробные данные представлены в таблице 3.
Табл. 3. Динамика первичного узла и толщины кожи до и после НАЛТ
|
Характеристики |
1-я группа / Group 1, n=34 |
2-я группа / Group 2, n=21 |
|
Толщина кожи до НАЛТ (по ММГ в мм)/ Skin thickness before NAST (mammography, mm) |
5,5 |
13,6 |
|
Толщина кожи после НАЛТ (по ММГ в мм)/ Skin thickness after NAST (mammography, mm) |
2,8 |
4 |
|
Размер узла до НАЛТ (по ММГ в мм)/tumor size before NAST (mammography, mm) |
37,8 |
42,9 |
|
Размер узла после НАЛТ (по ММГ в мм)/ tumor size after NAST (mammography, mm) |
14,3 |
26,0 |
|
Размер узла в послеоперационном материале/Tumor Size in the Postoperative Specimen |
11,5 |
21,5 |
После НАЛТ специалисты оценивали, насколько уменьшилась опухоль по критериям RECIST 1.1, и наблюдали за состоянием отека кожи. Если после НАЛТ опухоль уменьшалась более чем на 50% от первоначального размера и отек полностью исчезал, то на следующем этапе лечения можно было проводить кожесохранную мастэктомию с одномоментной реконструкцией с помощью экспандера. После завершения лечения экспандер заменяли имплантатом.
В среднем период наблюдения составлял 11 месяцев, но он мог длиться от 12 до 27 месяцев. За это время в первой группе не было выявлено локальных и регионарных рецидивов. Однако во второй группе через четыре месяца после лечения у одной пациентки развился раковый лимфангоит.
Далее общая когорта больных в зависимости от результата биопсии кожи и объема хирургического вмешательства была разделена на 3 группы: в 1-ю группу (N=7) вошли пациентки, у которых по результатам биопсии кожи не обнаружены опухолевые эмболы до проведения НАЛТ и на втором этапе лечения выполнена кожесохранная мастэктомия с одномоментной реконструкцией экспандером. Во 2‑ю группу (N=27) включены пациенты, у которых по результатам биопсии кожи также не обнаружено опухолевых эмболов до проведения НАЛТ, но после проведения лекарственного лечения не был достигнут полный/частичный клинический ответ в молочной железе, либо сохранялись симптомы отека кожи, либо пациентка не желала реконструкцию. В данной группе была проведена мастэктомия. В 3‑ю группу (N=21) включены пациенты, у которых по результатам биопсии кожи были обнаружены опухолевые эмболы до проведения НАЛТ, в связи с чем данная группа расценивалась как онкологически неблагоприятная для проведения одномоментной реконструкции, и вне зависимости от клинического ответа на лекарственное лечение им была проведена мастэктомия. Процентное соотношение одномоментных реконструктивных операций и мастэктомий составило 12,7% и 87,3% соответственно. Дизайн исследования представлен на рисунке 1.
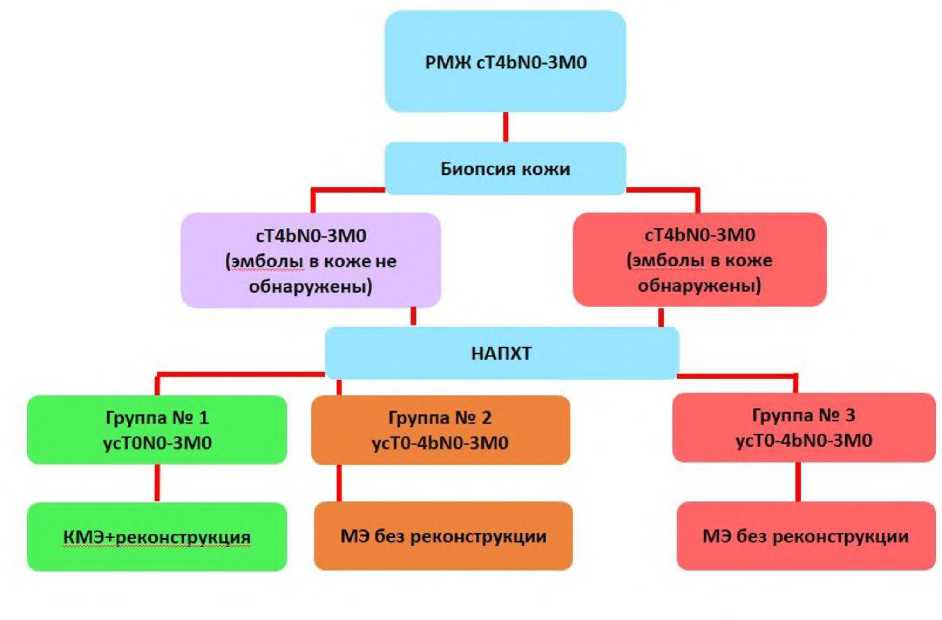
Рис. 1. Дизайн исследования.
Сравнительный анализ клинико-морфологических характеристик трех групп пациентов представлен в таблице 4. В первой группе чаще всего наблюдались опухоли с тройным негативным типом (в 57,1% случаев). Во второй группе этот тип был выявлен у 8 (29,6%) пациенток, а в третьей группе — у 4 (19,0%). Люминальный В, Her2/neu негативный подтип составил 28,6%, 37,0% и 57,1% в первой, второй и третьей группах соответственно. При сравнении гистологических типов опухоли выяснилось, что инвазивный протоковый рак встречался у всех 7 пациентов первой группы (100%), у 21 (77,8%) пациента второй группы и у 17 (81%) пациентов третьей группы. Инвазивный дольковый рак не наблюдался в первой группе, но был выявлен у 4 (14,8%) пациентов второй группы и у 2 (9,5%) пациентов третьей группы. Другие формы не были зафиксированы в первой группе, а во второй и третьей группах они наблюдались у 2 (7,4%) и 2 (9,5%), соответственно. В первой группе преобладали низкодифференцированные опухоли (G3), в то время как во второй и третьей группах чаще встречались умеренно дифференцированные опухоли (G2) (Табл. 4).
Табл. 4. Сравнительный анализ клинико-морфологических характеристик больных трех групп
|
Характеристики |
1-я группа / Group 1, n=7 |
2-я группа / Group 2, n=27 |
3-я группа / Group 3, n=21 |
|||
|
N |
% |
N |
% |
N |
% |
|
|
Биологический подтип /Biological subtype |
||||||
|
Тройной негативный тип / Triple negative subtype |
4 |
57,1 |
8 |
29,6 |
4 |
19,0 |
|
Люминальный В Her2/neu негативный / Luminal B Her2/neu negative |
2 |
28,6 |
10 |
37,0 |
12 |
57,1 |
|
Люминальный В Her2/neu позитивный / Luminal B Her2/neu positive |
1 |
14,3 |
6 |
22,2 |
1 |
4,8 |
|
Нелюминальный Her2/neu позитивный / Non-luminal Her2/neu positive |
0 |
0 |
3 |
11,2 |
1 |
4,8 |
|
Люминальный А/ Luminal А |
0 |
0 |
0 |
0 |
3 |
14,3 |
|
Степень злокачественности /Grade of malignancy |
||||||
|
G1 |
0 |
0 |
0 |
0 |
0 |
0 |
|
G2 |
3 |
42,9 |
16 |
59,3 |
14 |
66,7 |
|
G3 |
4 |
57,1 |
11 |
40,7 |
7 |
33,3 |
Средний размер опухолевого узла, измеренный по максимальному диаметру с помощью УЗИ и МРТ, во всех группах до начала НАЛТ составил 40,1±8,1 мм. После проведения НАЛТ средний размер узла уменьшился до 11,4±8,3 мм. Отек кожи, измеряемый с помощью МРТ, до начала НАЛТ в основной группе был 5 мм, а после лекарственного лечения — 1,8 мм. Во второй группе отек кожи до НАЛТ составлял 5,5 мм, а после — 3,4 мм. В третьей группе эти показатели были равны 13,6 мм и 4 мм соответственно. Размеры узла до и после НАЛТ (по данным МРТ, в миллиметрах) в послеоперационном материале: в первой группе — 32,6 мм, 0 мм и 2,4 мм соответственно; во второй группе — 37,8 мм, 14,3 мм и 11,5 мм соответственно; в третьей группе — 42,9 мм, 26,0 мм и 21,5 мм соответственно. Более детальные данные представлены в таблице 5.
Табл. 5. Динамика первичного узла и толщины кожи до и после НАЛТ в трех группах
|
Характеристики |
1-я группа / Group 1, n=7 |
2-я группа / Group 2, n=27 |
3-я группа / Group 3, n=21 |
|
Толщина кожи до НАЛТ (по ММГ в мм)/ Skin thickness before NAST (mammography, mm) |
5 |
5,5 |
13,6 |
|
Толщина кожи после |
1,8 |
3,4 |
4 |
|
НАЛТ (по ММГ в мм)/ Skin thickness after NAST (mammography, mm) |
|||
|
Размер узла до НАЛТ (по ММГ в мм)/ tumor size before NAST (mammography, mm) |
32,6 |
37,8 |
42,9 |
|
Размер узла после НАЛТ (по ММГ в мм)/ tumor size after NAST (mammography, mm) |
0 |
14,3 |
26,0 |
|
Размер узла в послеоперационном материале/ Tumor Size in the Postoperative Specimen |
2,4 |
11,5 |
21,5 |
Степень клинического ответа на НАЛТ, оцениваемая по критериям RECIST 1.1, показала, что во всех трёх группах наблюдались случаи частичного и полного клинического ответа. Однако только в третьей группе были зафиксированы два случая (9,5%) без ответа на лекарственную терапию. Ни в одной из групп не было отмечено отрицательной динамики на фоне проводимого лечения. Более подробные данные представлены в таблице 6.
Табл. 6. Характеристика степени клинического ответа на НАЛТ
|
Клинический ответ/Clinical response |
Объем хирургического лечения/ Type of Surgery Кожесохранная Мастэктомия без Мастэктомия без мастэктомия с реконструкции (не реконструкции реконструкцией обнаружены (обнаружены экспандером (не опухолевые эмболы в опухолевые эмболы в обнаружены коже)/ Mastectomy коже)/ Mastectomy опухолевые without reconstruction without reconstruction эмболы в коже)/ (no tumor emboli in the (tumor emboli in the Skin-sparing skin) (n=27) skin) (n=21) mastectomy with expander reconstruction (no tumor emboli in the skin) (n=7) |
|
сCR |
5/7 (71,4%) 12/27 (44,4%) 9/21(42,9%) |
|
cPR |
2/7 (28,6%) 15/27 (55,6%) 10/21 (47,6%) |
|
cNR |
0/7 (0%) 0/27 (0%) 2/21 (9,5%) |
|
Отрицательная динамика/progression |
0/7 (0%) 0/27 (0%) 0/21 (0%) |
В своей диссертации на тему «Стратегия хирургического лечения местнораспространённого рака молочной железы после неоадъювантной лекарственной терапии» А.В. Петровский пришёл к выводу, что увеличение интервала между НАЛТ и операцией более 42 дней может негативно сказаться на шансах достижения полного лечебного патоморфоза (ОР 0,668, p = 0,011), особенно у пациентов с люминальным иммунофенотипом. Кроме того, увеличение интервала до хирургического лечения значительно снижает показатели безрецидивной выживаемости (р = 0,015) [7]. В нашем исследовании медиана времени до хирургического вмешательства составила 34,6 дня в 232
общей популяции. В первой группе этот показатель был равен 32,7 дня, во второй — 34,6, а в третьей — 35,2. Таким образом, большинству пациенток хирургическое лечение было проведено в сроки от 4 до 6 недель в соответствии с клиническими рекомендациями. Более детальные данные представлены в таблице 7.
Табл. 7 . Сроки ожидания операции с момента окончания НАЛТ
|
Сроки |
1-я группа / Group 1, n=7 |
2-я группа / Group 2, n=27 |
3-я группа / Group 3, n=21 |
|||
|
N |
% |
N |
% |
N |
% |
|
|
Менее 4 недель/Less than 4 weeks |
3 |
42,9 |
7 |
25,9 |
6 |
28,6 |
|
От 4 до 8 недель/From 4 to 8 weeks |
3 |
42,9 |
19 |
70,4 |
13 |
61,9 |
|
От 8 и более недель/8 weeks or more |
1 |
14,2 |
1 |
3,7 |
2 |
9,5 |
При морфологическом исследовании операционного материала во всех 55 случаях не было обнаружено опухолевых клеток в краях раны. Это свидетельствует о том, что операции были выполнены радикально, независимо от выбранного метода хирургического вмешательства: кожесохранной мастэктомии или мастэктомии. После операции всем пациентам продолжали комплексное лечение в соответствии с клиническими рекомендациями Ассоциации онкологов России (АОР). Оно включало лекарственную терапию, подобранную с учетом молекулярно-биологического типа опухоли, а также дистанционную лучевую терапию на переднюю грудную стенку со стороны поражения, сформированную молочную железу и зоны регионарного лимфооттока.
Результаты
За средний период наблюдения в 11 месяцев локо-регионарных рецидивов в 1-й и во 2-й группе не отмечено. В то время как в 3-й группе через 4 месяца после лечения развился раковый лимфангоит. Появление отдаленных метастазов диагностировано у 3 пациенток: у 1 пациентки из основной группы в подвздошную кость через 14 месяцев после окончания лечения, у 1 из 1-й контрольной группы в легкое через 8 месяцев после окончания лечения, у 1 в легкое во 2-й контрольной группе через 6 месяцев после окончания лечения. У 2 пациенток из 1-й контрольной группы за время исследования наступил летальный исход, связанный с метастазированием в легкие и головной мозг. Более подробно данные приведены в таблице 8.
Табл. 8. Отдаленные результаты лечения
|
Результаты |
1-я группа / Group 1, n=7 |
2-я группа / Group 2, n=27 |
3-я группа / Group 3, n=21 |
|||
|
N |
% |
N |
% |
N |
% |
|
|
Локо-регионарный рецидив/Locoregional recurrence |
0 |
0 |
0 |
0 |
1 |
4,8 |
|
Отдаленные метастазы/Distant metastases |
1 |
14,3 |
1 |
3,7 |
1 |
4,8 |
|
Летальный исход/Death |
0 |
0 |
2 |
7,4 |
0 |
0 |
В нашей работе для оценки качества жизни мы также использовали шкалы глобального статуса жизни и здоровья из опросника EORTC QLQ-C30 V.3, который предназначен для онкологических больных. Больные из первой группы показали хорошие результаты по всем исследуемым параметрам. Эта разница между группами оказалась статистически значимой. Результаты анализа анкеты EORTC QLQ-C30 представлены в таблице 9.
Табл. 9. Показатели глобального статуса здоровья и качества жизни исследуемых больных РМЖ после хирургического лечения (EORTC QLQ-C30)
|
Показатели |
1-группа |
2-группа |
3-группа |
Р |
|
|
М 95% ДИ |
M |
95% ДИ |
M 95% ДИ |
||
|
Статус здоровья |
87 77-91 |
73 |
65-76 |
72 63-75 |
<0,05 |
|
Качество жизни |
90 86-94 |
74 |
71-78 |
75 73-79 |
<0,05 |
Заключение
Таким образом, в рамках нашего проспективного исследования, учитывая относительно небольшую выборку пациентов и ограниченный период наблюдения, мы не можем с высокой степенью достоверности оценить окончательные результаты безрецидивной и общей выживаемости. Однако предварительный анализ, проведённый при среднем периоде наблюдения в 11 месяцев, показал отсутствие локо-регионарного метастазирования в первой группе. Это позволяет рассмотреть возможность выполнения кожесохранной мастэктомии с одномоментной реконструкцией экспандером при наличии благоприятных факторов, таких как отсутствие раковых эмболов в коже при биопсии, купирование отёка и объективный эффект на лучевую терапию. Окончательные выводы будут сделаны после накопления статистически значимого количества наблюдений.
Вклад авторов. Фокина Т.Ю.: сбор и статистическая обработка данных, написание текста, Зикиряходжаев А.Д.: научное редактирование, Волченко Н.Н.: научное редактирование, Сарибекян Э.К.: научное и техническое редактирование, Хугаева Ф.С.: научное редактирование, Максимов К.В.: научное редактирование, Дуадзе И.С.: научное редактирование, Усов Ф.Н.: научное редактирование, Кодзоева Д.Б.: оформление библиографии, Захарова М.А.: сбор и обработка данных, Замалдинов Н.Д.: сбор и обработка данных, Занозина Е.А.: сбор и обработка данных, Каприн А.Д.: концепция и дизайн исследования.
Финансирование. Это исследование не получило внешнего финансирования.
Декларация по этике . Исследование было проведено в соответствии с Хельсинкской декларацией и одобрено независимым советом по этике при МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России (выписка № 1040 из протокола № 117 от 30.08. 2024).
Заявление об информированном согласии. Информированное согласие было получено от всех субъектов, участвующих в исследовании.


