Матричная РНК как основа терапевтических средств: структурная организация, оптимизация и перспективы применения
Автор: Аминулла К.Г., Довгань Ф.Н., Гончарова О.И., Киселева Я.Ю., Кулинич Т.М., Боженко В.К.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Обзор
Статья в выпуске: 4 т.25, 2025 года.
Бесплатный доступ
РНК-терапия является инновационным и перспективным направлением современной медицины, предлагающим возможность таргетного воздействия для лечения широкого спектра заболеваний. В частности, вакцины на основе матричной рибонуклеиновой кислоты (мРНК) сочетают в себе иммунологические характеристики живых аттенуированных вакцин (эндогенная экспрессия антигенов и Т-клеточная индукция) с высоким профилем безопасности и химической определенностью инактивированных вакцин. Ключевыми преимуществами мРНК-платформы являются отсутствие риска интеграции в геном клетки-хозяина, быстрая метаболическая деградация и высокая технологическая гибкость производства, позволяющая оперативно адаптировать терапевтические средства под новые мишени. Несмотря на значительные успехи, особенно в области вакцин против инфекционных заболеваний, таких как SARS-CoV-2, широкое применение мРНК-терапии сталкивается с рядом фундаментальных проблем, включая присущую молекуле нестабильность (восприимчивость к РНКазам), сложность преодоления клеточных барьеров и потенциальную иммуногенность. Для преодоления этих ограничений и повышения терапевтической эффективности критически важно дальнейшее углубленное изучение и оптимизация структурной организации молекулы мРНК, а также разработка высокоточных систем доставки. Настоящий обзор посвящен детальному анализу организации молекулы мРНК, процессов ее разработки и производства.
Матричная (информационная) РНК (мРНК), мРНК-вакцина, противоопухолевая терапия, иммунотерапия, доставка генов, подавление генов, иммунотерапия, РНК-интерференция
Короткий адрес: https://sciup.org/149149997
IDR: 149149997 | DOI: 10.24412/1999-7264-2025-4-38-56
Текст научной статьи Матричная РНК как основа терапевтических средств: структурная организация, оптимизация и перспективы применения
На сегодняшний день РНК-терапия является инновационным и перспективным методом лечения широкого спектра заболеваний. РНК-терапия выделяется среди современных терапевтических подходов благодаря возможности целенаправленного воздействия на любой компонент клетки [1].
Вакцины на основе мРНК сочетают в себе иммунологические особенности живых аттенуированных вакцин, такие как эндогенная экспрессия антигенов и Т-клеточная индукция, а также характеристики инактивированных или субъединичных вакцин, к которым относятся определенность химического состава и безопасность [2,3]. По сравнению с вакцинами на основе ДНК, именно безопасность терапевтического применения является основным преимуществом мРНК как молекулы для создания вакцин [4]. Возможность строгого контроля нуклеотидной последовательности мРНК позволяет создавать генетические конструкты, в которых присутствуют только элементы, необходимые для экспрессии целевого белка. Кроме этого, очевидным преимуществом является отсутствие взаимодействия мРНК с геномом клетки-хозяина, что исключает потенциально нежелательную интеграцию в геном [5,6]. Также мРНК не реплицируется и подвергается естественной метаболической деградации в течение нескольких дней после внедрения в клетку-хозяина. Таким образом, перечисленные особенности мРНК позволяют рассматривать ее в качестве временного носителя информации [7].
В плане технологий, мРНК как основа для создания терапевтических средств демонстрирует высокую гибкость в производстве. Возможность закодировать и экспрессировать любой белок с помощью мРНК позволяет разрабатывать профилактические и терапевтические стратегии для лечения крайне широкого спектра заболеваний. Изменение нуклеотидной последовательности, кодирующей белок, незначительно влияет на физикохимические свойства молекулы РНК, что дает возможность производить различные белковые препараты на базе одного производства без критических изменений технологического процесса. Данное свойство РНК позволяет сократить временные и экономические затраты на производство и делает РНК крайне привлекательной основой для создания вакцин, по сравнению с другими используемыми веществами [8].
Таким образом, мРНК представляет собой многообещающий и сложный класс терапевтических молекул, обладающий значительным потенциалом [9]. Далее будут рассмотрены особенности организации самой молекулы мРНК, разработка и производство мРНК, а также клеточные процессы, в которых задействуется мРНК, и возможные модификации, направленные на улучшение характеристик молекулы.
Матричная (информационная) РНК (мРНК)
Матричная (информационная) РНК (мРНК) — это одноцепочечная молекула рибонуклеиновой кислоты, которая транскрибируется с матрицы ДНК и содержит информацию о первичной структуре (аминокислотной последовательности) белков. Успешные эксперименты введения транскрибируемой in vitro мРНК в скелетные мышцы мыши с последующим подтверждением экспрессии лекарственного белка доказали целесообразность использования мРНК-терапии [10]. Проведение успешной трансфекции мРНК, а также демонстрация дозозависимого терапевтического эффекта открыли возможность терапии с использованием мРНК [11]. Подход, основанный на использовании мРНК, теоретически позволяет получить любой белок/пептид с помощью аппарата для синтеза белка в трансфицированной клетке in vitro или in vivo . В отличие от препаратов на основе ДНК, транскрипты мРНК имеют относительно высокую эффективность трансфекции и низкую токсичность, поскольку им не нужно проникать в ядро, чтобы проявлять функциональность. Важно отметить, что мРНК не имеет риска случайного заражения или инсерционного мутагенеза. В отличие от рекомбинантных белковых препаратов, белковые терапевтические средства, генерируемые in vivo , являются аутологичными, производятся в человеческих клетках и, вероятно, проходят правильные посттрансляционные модификации и фолдинг. Более того, риск-факторы иммуногенности, связанные с процессом производства белка или нежелательными примесями из клеток или питательной среды отсутствуют у IVT (in vitro транскрибированная мРНК) мРНК [12]. Таким образом, эти преимущества мРНК, по сравнению с ДНК или белком/пептидом, обеспечивают быстрое развитие технологии и продуктов на основе мРНК, а также распространение в различных областях биомедицинской промышленности. Широкое использование мРНК-терапии позволит кардинально улучшить многие аспекты жизни человека, особенно это касается пациентов, страдающих от неизлечимых заболеваний.
Тем не менее, недостаточное знание структурных особенностей молекулы мРНК и иммуногенность значительно замедлили темпы разработки терапевтических средств на основе мРНК. мРНК представляет собой отрицательно заряженную макромолекулу, которая восприимчива к рибонуклеазам (РНКазам), гидролизующим молекулу РНК. Следовательно, мРНК довольно сложно пройти через анионную клеточную мембрану и транслировать функциональные белки в цитоплазму (<1/10000 мРНК от первоначального ввода) [13]. Кроме того, мРНК также может вызывать иммунный ответ с сопутствующей токсичностью, что значительно ограничивает разработку терапевтических средств на основе мРНК. Разработка высокоточных носителей для доставки лекарств на основе мРНК играет решающую роль в понижении иммуногенности и нестабильности, а также в преодолении клеточных барьеров. Активное использование вакцин на основе мРНК во время пандемии корановируса 2-го типа продемонстрировало значительную эффективность в терапии инфекционных заболеваний в общем и тяжелого острого респираторного синдрома (SARS-CoV-2) в частности. Эти достижения значительно ускорили процесс разработки терапевтических препаратов на основе мРНК. Ученые активно исследуют методы, которые позволят повысить их стабильность, эффективность в процессе трансляции и иммунный ответ организма. Одновременно с этим улучшение средств доставки и создание более совершенных носителей позволит реализовывать таргетную доставку к клетке-мишени. Также были разработаны многочисленные технологии для повышения терапевтической эффективности мРНК и улучшения стабильности мРНК. Таким образом, необходимо составить общую картину текущего состояния и проанализировать общие подходы к разработке лекарств на основе мРНК [14].
Разработка и производство мРНК
Разработка терапевтических средств на основе мРНК в основном включает в себя дизайн мРНК, синтез, захват мРНК, фармакодинамику, фармакокинетику, оценку безопасности in vivo и in vitro , производство и клинические испытания (Рис. 1). Дизайн и синтез мРНК представляют собой ключевые этапы в процессе создания лекарственных препаратов на основе мРНК. мРНК имеет пять функциональных областей, включая 5′-кэп, 3′ поли(А) хвост, открытую рамку считывания (ОРС) фланкирования и 3′ нетранслируемые области (НТО), элементы которых опосредуют эффективность трансляции и скорость распада мРНК [15]. Примечательно, что получение высоко биологически активной РНК обычно зависит от надежного дизайна и подготовки [16].
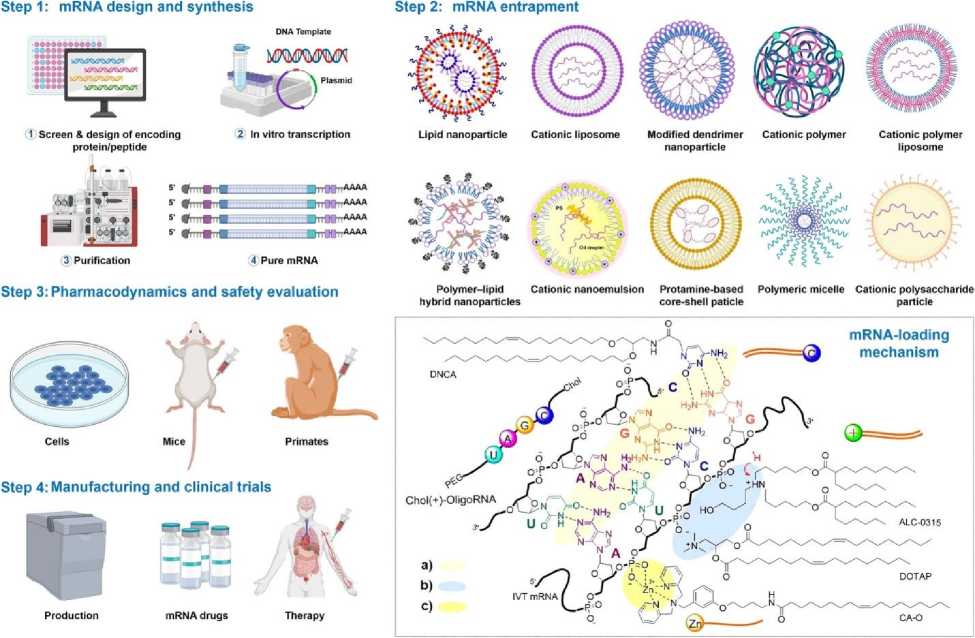
Рис. 1. Последовательность этапов производства лекарственных средств с использованием мРНК [14].
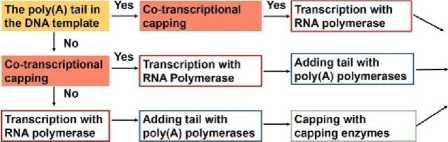
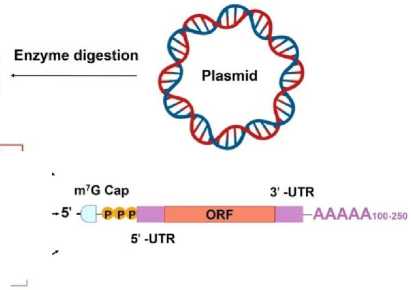
Структурные элементы мРНК мРНК синтезируется в ходе транскрипции с ДНК матрицы. У эукариот процесс транскрипции осуществляется с использованием ДНК-зависимой РНК-полимеразы. В ходе транскрипции РНК-полимераза преобразует гены в первичные транскрипты мРНК in vivo, которые обычно еще содержат некодирующие последовательности интронов, и далее удаляются, чтобы стать зрелой мРНК, путем процессинга мРНК, включая 5‘-кэппинг мРНК, модификации, сплайсинг и редактирование аденозина в инозин (A-to-I) [17]. Подготовка зрелой мРНК методом транскрипции in vitro (IVT) включает несколько этапов: получение шаблона линейной ДНК, IVT, кэппинг 5‘ и добавление поли(А)-хвоста. После переноса мРНК в клетку поли(А)-связывающий белок (PABP) связывается с поли(А)-хвостом и взаимодействует с эукариотическими факторами инициации трансляции (eIFs). Взаимодействие eIFs с 5‘-кэпом, UTR, PABP, инициаторной метионил-трансферной РНК (тРНК) и 40S рибосомальной субъединицей приводит к циркуляции мРНК и образованию комплекса инициации. После того как 40S рибосомальная субъединица сканирует кодон инициации транскрипции, происходит рекрутирование 60S рибосомальных субъединиц и освобождение eIFs для начала удлинения аминокислотной цепи [18]. Зрелая мРНК включает кодирующую область, UTR, хвосты поли(А) и 5‘-кэп, которые могут быть распознаны рибосомами и перенесены тРНК для создания белков. Как и в ДНК, генетическая информация в мРНК содержится в последовательности нуклеотидов, которые организованы в кодоны, состоящие из трех рибонуклеотидов. Соответственно, IVT мРНК проводится для завершения транскрипции РНК in vitro путем стимулирования механизма синтеза эукариотической мРНК для обеспечения экспрессии мРНК in vivo (Рис. 2). Поэтому оптимизация мРНК очень важна для успешной терапии на основе мРНК.
In vitro transcribed (IVT) mRNA
Template
ШРУУЖЯЛЯ
mRNA translation initiation in vivo
5'-m7GCap Q—f PP ORF |AAAAA15o25o
3’ -100-250 AAAAA
PAP В
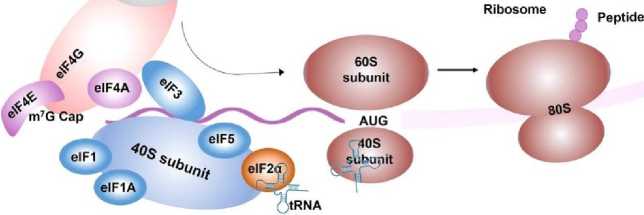
Рис. 2. Транскрибируемая in vitro (IVT) мРНК и инициация трансляции [14].
Трансляция и распад мРНК
Инициация трансляции эукариотических мРНК — это сложный и тщательно контролируемый процесс. Он включает в себя сборку комплекса из нескольких белков и РНК, который направляет рибосомы к стартовому кодону [19]. Как правило, кэп-зависимая трансляция начинается с распознавания кэпа эукариотическим фактором инициации 4F (eIF4F) и сборки преинициациаторного комплекса (PIC), который состоит из тернарного комплекса, 40S рибосомальной субъединицы, eIF1, eIF1A, eIF3 и eIF5 [20]. eIF4F состоит из eIF4A, eIF4E и eIF4G, которые способствуют рекрутированию PIC за счет взаимодействия eIF4E-cap и eIF4G-eIF3. eIF4F обеспечивает циркуляцию мРНК, взаимодействуя с 5‘-кэпом через eIF4E и PABP, который связывается с поли(А)-хвостом [21]. 40S рибосома сканирует 5'-UTR и распознает кодон инициации с помощью eIF4A для разворачивания вторичной структуры 5'-UTR, затем 40S рибосомальная субъединица сканирует кодон инициации транскрипции, рекрутируются 60S рибосомальные субъединицы, и освобождаются eIFs для начала удлинения аминокислотной цепи [22]. Затем мРНК декодируется в рибосоме для производства определенной аминокислотной. Существует баланс между процессами трансляции и распада мРНК (Рис. 3) [23]. Ранее было установлено, что структурные элементы, которые активно транслируются, также тесно связаны с распадом мРНК, особенно 5'-кэп и поли(А)-хвост [24]. 5'-кэп защищает мРНК от 5'-3' экзорибонуклеаз, а длина поли(А)-хвоста определяет 3‘-5' экзонуклеолитический распад [25]. Учитывая значимость этих функциональных элементов, многие исследования были направлены на оптимизацию структуры мРНК. Например, были разработаны различные аналоги 5‘-кэпа, изменены длины поли(А)-хвостов, выявлены уникальные участки в UTR и кодированы разнообразные функциональные пептиды или механизмы вирусной репликации в OPCs [26].
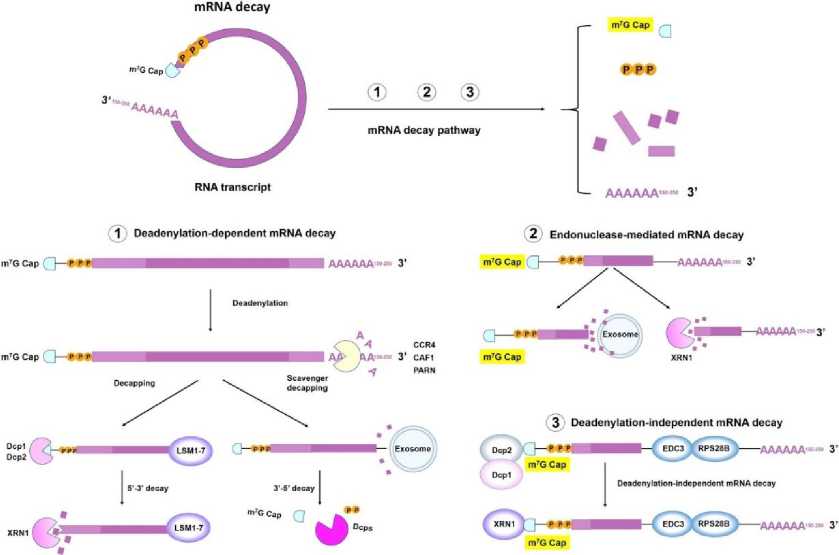
Рис. 3. Механизмы распада мРНК [14].
Дизайн мРНК
Влияние 5′-кэпа на экспрессию мРНК
5'-кэпы расположены на 5‘-конце мРНК с разной степенью метилирования [27]. 5'-кэпы (m7G ppp) содержат 7-метилгуанозин (m7G), присоединяющий следующий нуклеотид через 5‘-5‘-трифосфатный мостик (ppp) у эукариот (Рис. 4) [28]. Во время инициации трансляции кэп соединяется с eIF4E через гидрофобные катион-п взаимодействия m7G и отрицательный электростатический заряд трифосфатного мостика [29]. Для удаления кэпа трифосфатный мостик является основной мишенью фермента декэппинга мРНК в эукариотических клетках. Dcp1/2 и DcpS: Dcp1/2 расщепляет а- и в-фосфаты, а DcpS — в- и Y-фосфаты [30]. Поэтому многочисленные стратегии оптимизации структуры мРНК были применены для оптимизации m7G или трифосфатного мостика с целью получения аналогов кэпа с высоким сродством к eIF4E и низкой чувствительностью к ферментам расщепления [31]. Рудзик и коллеги повысили устойчивость кэпа к расщеплению, заменив атом кислорода трифосфатов на дигалогенметиленбисфосфонат [29]. Кроме того, модификация m7G является важным подходом для улучшения трансляции мРНК. Ранее сообщалось, что эффективность трансляции значительно повышается при замене 7-метилированного гуанозина (m7G) на 7-бензилированный гуанозин и еще в 2 раза при присоединении m7G к другому m7G через тетрафосфат (m7Gppppm7G), аналоги которого обладают более высоким сродством к eIF4E по сравнению с природными эукариотическими 5‘-кэпами [32]. Мостиковые атомы кислорода между а-в или в-Y фосфатами были, соответственно, заменены на метилен, чтобы получить m7GpCH2ppG или m7GppCH2pG для предотвращения деградации мРНК под действием Dcp1/2 или DcpS [33]. Дитиодифосфатная модификация также вводится в три- или тетрафосфатный мостик, что снижает чувствительность кэпа к Dcp1/2 и улучшает трансляцию мРНК. Кроме того, фосфоротиоатные аналоги кэпа повышают стабильность и трансляционную эффективность РНК-вакцин в незрелых дендритных клетках (ДК) [34]. Примечательно, что фосфоротиоатная замена чувствительна к положению, что, возможно, связано со стереохимией в катализе.
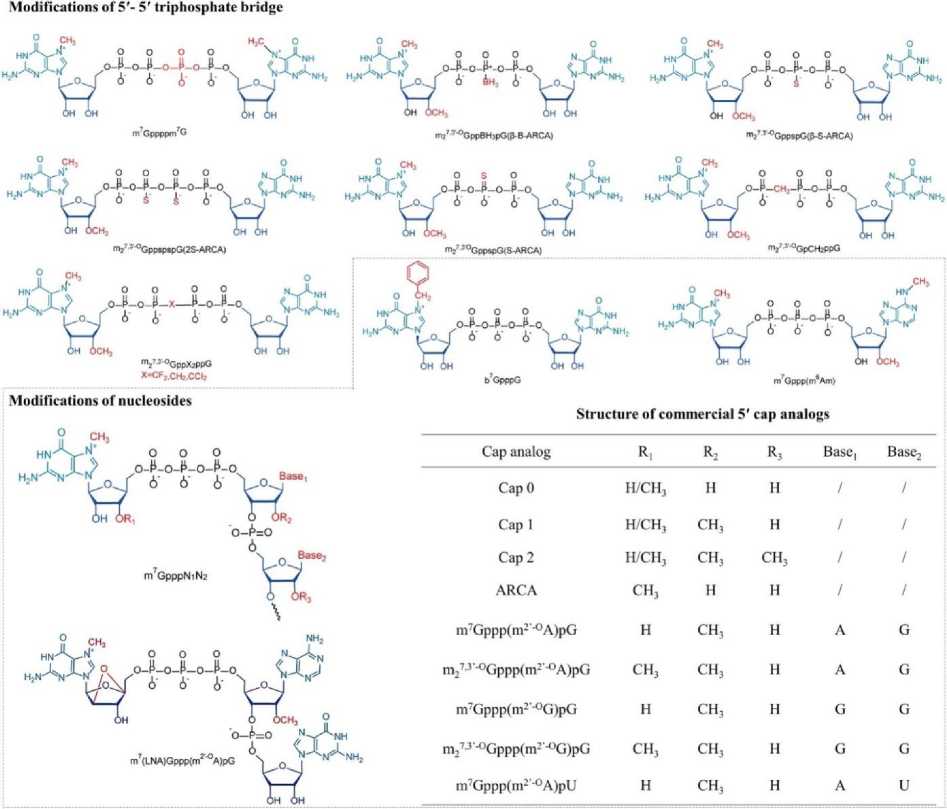
Рис. 4. Коммерческие и широко используемые кэпы [14].
Участие поли(А)-хвоста в трансляции и стабилизации молекулы мРНК
Поли(А)-хвосты обычно состоят из 10-250 аденинрибонуклеотидов. Хвосты поли(А) представляют собой динамические дополнения к мРНК, и их длина играет решающую роль в регуляции эффективности трансляции мРНК и экспрессии гена белка [35]. Механически 3'-концевой поли(А)-хвост соединяется с PABP и впоследствии взаимодействует с 5'-кэпом посредством факторов инициации трансляции eIF4G и eIF4E, что способствует созданию «замкнутой структуры» и регулирует эффективность трансляции мРНК [36]. Мокки и коллеги первыми наблюдали положительную корреляцию между длиной поли(А)-хвостов и эффективностью трансляции путем добавления поли(А)-хвоста из 100 аденозинов вместо 64, увеличивая уровень белка примерно в 35 раз [37]. Аналогичным образом, поли(А) длиной 120 единиц способствует образованию более стабильной мРНК и с более высокой эффективностью трансляции по сравнению с хвостами из 51 нуклеотидов и 42 нуклеотидов, а хвост поли(А) из 325 нуклеотидов демонстрирует более высокую эффективность, чем 172-нуклеотидный [38,39]. Интересно, что длина поли(А) не всегда положительно коррелирует с нестабильностью и аттенуацией мРНК. Традиционно считалось необходимым, чтобы поли(А)-хвосты содержали не менее 20 нуклеотидов для достижения достаточной трансляции мРНК, но поли(А)-хвосты стабильного транскрипта в-актина имеют длину менее 20 нуклеотидов, а поли(А)-хвосты 425 нт и 525 нт вносят больший вклад в эффективность трансфекции, чем 120 нт поли(А)-хвостов в первичных Т-клетках человека.
Регуляция трансляции путем модификации 5'-UTR и 3'-UTR
UTR на 3'- и 5'-концах мРНК не кодируют белки напрямую, но играют важную роль в регуляции трансляции мРНК и экспрессии белков. UTR участвуют в субклеточной локализации мРНК, а также регулируют эффективность трансляции и стабильность мРНК [40]. Как 5‘-UTR, так и 3‘-UTR регулируют уровень экспрессии белка, причем 5'-UTR в основном участвует в инициации процесса трансляции, тогда как 3'-UTR главным образом влияет на стабильность и период полураспада мРНК [41]. 5'-кэп запускает связывание рибосомы и впоследствии распознает последовательность инициации синтеза белка во время трансляции. Более того, внутренний сайт входа рибосомы в 5'-UTR также может рекрутировать рибосомы и инициировать трансляцию кэп- и eIF4E-независимым способом. Самая сильная последовательность Козака широко используется для улучшения трансляции мРНК. Форофманд и коллеги продемонстрировали улучшение экспрессии белка за счет замены последовательности Козака 5'-UTR бета-глобина человека на самую сильную последовательность [42]. Для проверки влияния UTR на экспрессию терапевтических мРНК была создана библиотека из 10 вариантов UTR, и было обнаружено, что 5'UTR, содержащие фактор комплемента 3 (C3) и цитохром p4502E1, значительно повышают трансляцию белка независимо от модификаций 3'UTR [43]. Аналогичным образом оптимизация 3'-UTR может также повысить стабильность мРНК и длительность трансляции. Стабильность мРНК повышается благодаря прерывистой пиримидин-богатой последовательности в З’-UTR аглобина, а в-глобин в мРНК способствует увеличению продолжительности экспрессии белка [44]. Разработаны более эффективные стратегии увеличения продукции белка и стабильности мРНК путем добавления двух последовательных 3'-UTR в-глобина, расположенных по направлению к мРНК, по сравнению с одной 3'-UTR в-глобина. Примечательно, что улучшение зависит от типа клеток: экспрессия белка значительно увеличивается в зрелых дендритных клетках, но незначительно - в незрелых [39]. И наоборот, мРНК eGFP с двумя повторяющимися З'-UTR в-глобина производит меньше белка, чем мРНК с 5'-UTR в-глобина в плюрипотентных стволовых клетках человека (PSC) [45]. Однако два повторяющихся З'-UTR альфа-полипептида цитохрома b -245 (CYBA) имели более низкую продукцию белка в клетках A549 по сравнению с одной З’-UTR [46]. Более того, 5'-UTR и З'-UTR влияют друг на друга в экспрессии белков [43]. В целом, 5‘-UTR вносит свой вклад в регуляцию экспрессии белка в зависимости от систем и типов клеток.
Трепотек и коллеги сконструировали серию коротких 5‘-UTR путем вставки или изменения менее двух рибонуклеозидов на основе последовательности Козака. Две короткие 5'-UTR были либо лучше, либо одинаково эффективны, чем 5'-UTR альфа-глобина человека [47]. Киршина и коллеги оценили UTR из пяти природных долгоживущих мРНК и обнаружили, что UTR из человеческой CYBA имеют самую высокую и стабильную экспрессию белка в клетках NIH3T3 и клетках A549 [46]. Шром и коллеги сравнили эффективность минимальной 5'-UTR, 5'-UTR альфа-глобина человека и 5'-UTR CYBA, что привело к более высокой экспрессии белка за счет кодон-оптимизации [48]. Также существуют исследования, в которых попытались уменьшить иммунную стимуляцию мРНК, используя 5'-UTR вируса венесуэльского лошадиного энцефалита (VEE) [49]. Асрани и коллеги использовали плазмиды и IVT мРНК для скрининга эффективных UTR, при этом они обнаружили различную экспрессию белка под действием плазмид и IVT мРНК в клетках HepG2 [43]. Примечательно, что исследователи пытались разработать эффективные UTR с помощью биоинформатики и машинного обучения [50].
Влияние открытой рамки считывания (ОРС) на трансляцию мРНК
Дизайн ОРС в основном сосредоточен на оптимизации кодонов и введении функциональных пептидов, а также на процессах репликации. Оптимизация кодонов -широко используемый, но противоречивый подход к улучшению трансляции [51]. Эффективность трансляции мРНК была улучшена за счет замены редких кодонов на синонимичные кодоны, декодируемые тРНК с более высоким содержанием в ОРС, но это может изменить конформацию белка и привести к появлению новых пептидов с неизвестной биологической активностью in vivo [52]. Увеличение содержания GC путем замены редких кодонов в ОРС защищает мРНК от деградации эндорибонуклеазой и усиливает экспрессию белка мРНК in vivo [53]. Кроме того, функциональные пептиды имеют решающее значение для лекарств на основе мРНК, а сигнальные пептиды, кодируемые мРНК, необходимы для белков, выполняющих функции вне клеток [54]. Соответственно, необходима оптимизация мРНК для улучшения функции терапевтической мРНК путем введения сигнальных пептидов в области ОРС. Сигнальные пептиды и сегменты белков также широко применяются для улучшения презентации антигена в мРНК-вакцинах. Крейтер и коллеги улучшили свойство белковых антигенов к транспортировке, закодировав сигнал секреции и трансмембранный цитоплазматический домен молекулы MHC I в ОРС, что увеличило презентацию антигена в дендритных клетках в ~10 раз и повысило противоопухолевую эффективность мРНК-вакцин у мышей [55]. Для усиления цитоплазматической экспрессии используются и другие функциональные пептиды: в2-микроглобулин молекул MHC I и сигнальный пептид лизосомально-ассоциированного мембранного белка дендритных клеток [56]. В целом контроль качества мРНК на каждом этапе напрямую связан с ее эффективностью; следовательно, производство и подготовка мРНК является ключевым фактором в терапии на основе мРНК.
Производство мРНК
Синтез и оптимизация мРНК
IVT мРНК выполняется с линеаризованными плазмидными ДНК-шаблонами или ПЦР-шаблонами, требующими, по крайней мере, промотора и соответствующей последовательности конструкции мРНК. IVT мРНК выполняется путем добавления полимераз (T7, T3 или SP6), но требует дополнительного кэпирования [57]. Некэпированная мРНК быстро разрушается РНКазой и содержит группу 5‘-ppp, которая вызывает большую иммунную стимуляцию и может быть обработана фосфатазой для снижения нежелательной эффективности [58]. Для кэпирования IVT мРНК применяются два метода: котранскрипционное кэпирование и посттранскрипционное кэпирование [58]. Кэпированные динуклеотидные смеси, содержащие четыре других нуклеозидтрифосфата (NTP), включаются в 5‘-конец РНК с РНК-полимеразой во время котранскрипционного кэпирования [59]. Описан метод без использования метки для идентификации 5'-концевого кэпа и ориентации мРНК [60]. Котранскрипционный кэппинг-процессинг позволил координировать транскрипцию с кэпированием мРНК, но его недостатками являются конкурентное включение нуклеозидов ГТФ, что снижает эффективность кэпирования [61].
Интересно, что GTP сначала связывается с цепями РНК через 5'-5' трифосфатную связь, а затем 7-метилирование 5‘-концевого гуанозина при посттранскрипционном кэпировании [62]. Кэпирующие ферменты из вируса коровьей оспы широко используются для кэпирования мРНК, обладают высокой эффективностью кэпирования концов и способны полностью кэпировать мРНК с помощью кэп-0 [63]. Кроме того, необходимо учитывать иммуностимуляцию мРНК, а кэп-специфическая 2‘-0 метилтрансфераза используется для получения кэпа 1 или кэпа 2 на основе кэпа 0, что снижает иммуногенность мРНК [64]. Полимераза инициирует транскрипцию посредством нуклеофильной атаки 3'-ОН гуанозина в m 7 G в а-фосфате следующего нуклеозидтрифосфата, указанного шаблоном ДНК, когда 47
мРНК кэпирована, и генерирует m 7 GpppGpG. Примечательно, что m 7 GpppGpG образуется, когда эта атака происходит на 3′-ОН m 7 G, что приводит к обратной связи, в результате чего примерно 50 процентов мРНК кэпируются в обратном направлении и не могут быть распознаны рибосомой, а также затрудняют общую трансляционную активность мРНК [65]. Как правило, аналоги антиобратного кэпа синтезируются для модификации части m 7 G кэпа в положении 2′ или 3′ (2′-O-метил, 3′-O-метил, 3′-H), что инициирует исключительное включение кэпа в правильном направлении и повышает эффективность трансляции [66].
Поли(А)-хвосты мРНК IVT обычно кодируются в матрице ДНК или прикрепляются к мРНК IVT путем ферментативного полиаденилирования. Кодирование имеет более точный контроль длины поли(А)-хвостов. Примечательно, что рестриктазу типа II для линеаризации плазмидной матрицы использовали для внесения вклада в нависание на 3'-конце поли(А)-хвоста, когда участок поли(А)-хвоста был закодирован в векторе-матрице, что препятствовало трансляционной эффективности мРНК IVT. Этого необходимо избегать, заменяя рестриктазу типа II на рестриктазы типа IIS [39].
Очистка мРНК
IVT мРНК смешиваются с РНК-полимеразой и шаблонами ДНК после синтеза. Таким образом, необходимо очистить IVT мРНК от иммуностимулирующих примесей, свободных рибонуклеотидов, коротких мРНК и шаблонов ДНК [67]. Обычно ДНКаза используется для гидролиза избыточных шаблонов ДНК. В современных лабораториях для очистки синтезированной мРНК все чаще используются готовые коммерческие наборы. Разделение мРНК и примесей проводят осаждением с использованием этанола или изопропанола. Данный метод позволяет удалить большинство примесей и получить мРНК высокой частоты. Дальнейшее осаждение в присутствии LiCl, а также хроматографические методы очистки (молекулярно-эксклюзионная хроматография, ионообменная хроматография или аффинная хроматография с иммобилизованным олиго-dT) позволяют почти полностью удалить белки и свободные нуклеотиды, но не примеси дцРНК [68]. Для удаления примеси дцРНК, мешающей проведению транскрипции, Карико и коллеги использовали обращенно-фазовую ВЭЖХ для очистки мРНК. Этот способ позволил добиться увеличения экспрессии белка в 1000 раз и полностью устранил иммуногенность модифицированной мРНК. Однако данный метод очистки трудно реализуем в рамках промышленного производства мРНК [57].
Был предложен новый метод очистки РНКазой III для устранения загрязнений дцРНК. Было показано, что этот метод значительно снижает иммуногенность мРНК и увеличивает эффективность цитотоксического действия CAR T-клеток путем электропорации РНКазы III в CAR T-клетки. Потенциальным недостатком является то, что РНКаза III может расщеплять двухцепочечную вторичную структуру, образованную одноцепочечной РНК [69]. Недавно была предложена целлюлозная хроматография для очистки IVT мРНК и получения больших мРНК до 4 кб без какого-либо специального оборудования или токсичности. Важным аспектом предложенного метода является то, что все материалы являются одноразовыми. Это позволяет избежать перекрестной контаминации, что является серьезным преимуществом по сравнению с ВЭЖХ. Кроме того, целлюлозная хроматография показала более высокую эффективность в восстановлении и очистке IVT мРНК [57]. Подводя итог, можно сказать, что для очистки мРНК можно использовать различные методы в зависимости от критериев чистоты целевого продукта и возможности масштабирования. Очевидно, что независимо от метода очистки, строгие стандарты контроля качества мРНК являются основой для обеспечения максимальной эффективности и безопасности терапии с использованием мРНК.
Преодоление проблем в разработке РНК-терапии
Эффективность доставки РНК в цитоплазму за счет преодоления внеклеточных и внутриклеточных барьеров остается решающей для успешной реализации РНК-терапии. Во-первых, большие гидрофильные отрицательно заряженные свойства предотвращают пассивную диффузию РНК через липидные бислои. За пределами физического барьера РНК-препараты должны уклоняться от сывороточных нуклеаз и уничтожать макрофаги в ретикулоэндотелиальной системе. Во-вторых, РНК-препараты должны проходить через внеклеточный матрикс и через клеточную мембрану посредством рецептор-опосредованного эндоцитоза. Выход из эндосомы и высвобождение РНК в цитоплазму нетоксичным способом является критической технической проблемой. По этой причине различные химические модификации и разработка составов для доставки были изучены для решения проблем, связанных с фармакодинамикой и фармакокинетикой [13].
Химические модификации
Химические модификации мРНК, направляющих РНК CRISPR-Cas и аптамера мРНК IVT представляет собой оцРНК, содержащую 5'-кэп-структуру, ОРС, фланкирующие 5'- и 3'-UTR и 3'-поли(А)-хвост. Оптимизация мРНК-вакцин часто начинается с этих пяти структур посредством оптимизации последовательности, нуклеозидной модификации или замены последовательности UTR для усиления трансляционной способности РНК [70]. Различные химические модификации нуклеозидов, включая псевдоуридин (Т), Nl-метилпсевдуридин (т1Т), 5-метилцитидин (m5C), 5-гидроксиметилцитозин (5hmC), 5-метилуридин (m5U) и 2-тиоуридин (s2U), были введены в мРНК для минимизации врожденного иммунного ответа, запускаемого IVT мРНК [71].
Несмотря на свою надежность и простоту, терапевтическое использование систем CRISPR сталкивается со многими препятствиями, включая эффективность доставки, обнаруживаемые нецелевые эффекты, потенциальную иммуногенность и т. д. Паттерны химической модификации, используемые в АСО и миРНК, могут быть применены к гРНК и мРНК Cas9 [72]. Например, химические модификации, содержащие 2'-OM-3'PS (MS), 2'-OM или 2'-OM-3'thioPACE (MSP), могут быть интегрированы в одиночные гРНК (sgRNA) по трем концевым нуклеотидам на как 5'-, так и 3'-концы для повышения эффективности редактирования генома в первичных Т-клетках человека и CD34+ гемопоэтических стволовых и клетках-предшественниках [73]. Рибозо-фосфатный остов гРНК с модификацией 2'-OM-3'-фосфоноацетата (MP) может значительно минимизировать нецелевое расщепление, сохраняя при этом высокую эффективность воздействия на цель [74]. Модификация 5'-Н-группы sgRNAs может быть высокоактивной и препятствовать врожденным иммунным реакциям [75]. Включение мостиковых нуклеиновых кислот (2',4'-BNANC[N-Me]) и LNA в определенные сайты crRNA может значительно снизить нецелевое расщепление ДНК с помощью Cas9 [76]. Химическая модификация мРНК IVT может быть использована для мРНК Cas9.
Подобно АСО и миРНК, разнообразные химические модификации и конъюгации могут усиливать фармакокинетические характеристики РНК-аптамеров (рис. 5) [56]. Большинство аптамеров в клинических испытаниях химически модифицируются с использованием 5'-концевого ПЭГилирования (для сопротивления почечного клиренса), стратегии кэпирования З'-конца инвертированным тимидином и 2'-замен в сахарном кольце (для предотвращения деградации нуклеаз) [77]. Модификация связи PS также может оптимизировать свойства аптамеров за счет улучшения аффинности связывания с мишенью [78].
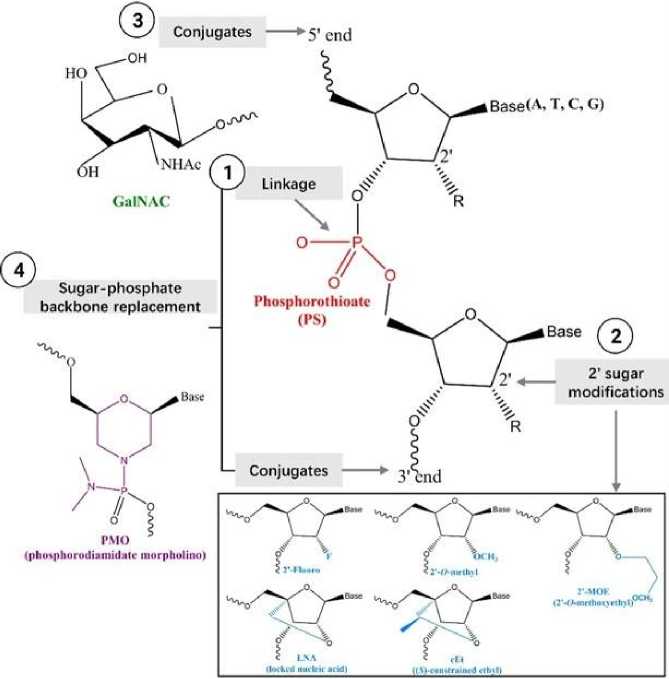
Рис. 5. Распространенные химические модификации [79].
Доставка с использованием наноносителей
Разработка эффективного носителя для защиты переносимой РНК от вредной физиологической среды необходима, поскольку РНК имеют значительные отрицательные заряды и химические модификации. Достижения в области нанотехнологий и материаловедения предлагают преимущества и потенциальные решения проблем доставки олигонуклеотидных лекарств, особенно для требований внутриклеточной доставки через биологические барьеры и мембраны. Ключевые преимущества систем доставки лекарств на основе наночастиц включают индивидуальную оптимизацию биофизики наночастиц (например, размера, формы и химического/материального состава) и биологических свойств (например, нацеливание на функционализацию лигандов), что обеспечивает высокую степень настройки платформы доставки.
В заключение следует отметить, что актуальность РНК-терапии обусловлена ее огромным потенциалом в лечении широкого спектра заболеваний, от генетических и онкологических до инфекционных и дегенеративных. РНК-терапия предлагает уникальные возможности для персонализированного лечения с высокой специфичностью и минимальными побочными эффектами. Успех мРНК-вакцин против COVID-19 значительно ускорил развитие этой области и привлек внимание как научного сообщества, так и широкой общественности к потенциалу РНК-терапии. Продолжающиеся исследования и разработки в этой области, вероятно, приведут к появлению новых эффективных методов лечения и профилактики заболеваний, которые ранее считались неизлечимыми или трудноизлечимыми, что делает РНК-терапию одним из наиболее перспективных направлений в современной медицине.
Вклад авторов. Аминулла К.Г.: формирование базы литературных источников, написание текста рукописи; Довгань Ф.Н.: подбор литературных источников, написание глав статьи; Гончарова О.И.: анализ и корректировка рукописи; Киселева Я.Ю.: корректировка рукописи, подготовка к публикации; Кулинич Т.М.: подборка и анализ базы литературных источников, корректировка рукописи; Боженко В.К.: разработка концепции статьи, анализ и интерпретация литературных данных, корректировка рукописи.
Финансирование. Исследования выполнены при поддержке Министерства здравоохранения Российской Федерации, тематика государственного задания № 1023021600033-1-3.2.21;3.4.3.
Соблюдение прав пациентов и правил биоэтики. Данное обзорное исследование было основано на опубликованных работах и поэтому не требовало одобрения этического комитета.


