Метаболические и нейрохимические изменения в головном мозге при хроническом стрессе и его коррекции ресвератролом и сертралином, при изначально тревожном поведении
Автор: Цейликман В.Э., Шатилов В.А., Жуков М.С., Щербаков И.В., Антонова А.С., Минеева А.А.
Рубрика: Медицина
Статья в выпуске: 3 (31), 2025 года.
Бесплатный доступ
При использовании модели предаторного хронического стресса на половозрелых самцах крыс линии Wistar с изначально тревожным поведением были выявлены особенности в метаболических и нейрохимических процессах в головном мозге. Основные признаки, определяющие изначально тревожное поведение и стресс-индуцированные изменения, были выявлены по результатам поведенческого теста «Приподнятый крестообразный лабиринт» (ПКЛ). При хроническом предаторном стрессе было установлено незначительное снижение индекса тревожности, снижение концентрации серотонина миндалевидном теле и гиппокампе, а также изменения в показателях перекисного окисления липидов в тканях мозга [1; 4] (рис. 1-6). Внутрибрюшинное введении ресвератрола в концентрации 50 мг/кг привело к значительному повышению индекса тревожности, имеющего беспокойный характер, и к возвращению ряда нейрохимических и метаболических показателей до контрольных значений [8; 21]. Совместное применение сертралина с ресвератролом (10 мг/кг, 50 мг/кг, соответственно) привело к аналогичному поведенческому эффекту, но снизив иммобилизацию, при этом не изменив нейрохимические и более слабо влияя на метаболические показатели. Полученные результаты исследования представляют собой практический и теоретический интерес в рамках коррекции стресс-индуцированных нарушений при изначально тревожном поведении и изучения сравнительных механизмов действия ресвератрола и сертралина [5; 6].
Приподнятый крестообразный лабиринт, индекс тревожности, хронический предаторный стресс, тревожное поведение, ресвератрол, сертралин, серотонин, перекисное окисление липидов, нейропротекция
Короткий адрес: https://sciup.org/170211529
IDR: 170211529 | УДК: 616-092.9
Текст научной статьи Метаболические и нейрохимические изменения в головном мозге при хроническом стрессе и его коррекции ресвератролом и сертралином, при изначально тревожном поведении
Введение. В настоящее время хронический стресс представляет собой одну из наиболее актуальных проблем современной нейробиологии и психофармакологии, оказывая глубокое воздействие на структуру и функции центральной нервной системы [7; 15]. В отличие от острого стресса, который может быть адаптивным, длительное воздействие стрессорных факторов приводит к де-задаптивным изменениям в работе гипоталамо-ги-пофизарно-надпочечниковой оси и формированию патологических состояний [20].
Особенно уязвимыми к воздействию хронического стресса являются ключевые структуры мозга, включая гиппокамп и префронтальную кору, которые играют критическую роль в процессах обучения, памяти и эмоциональной регуляции [15; 18]. Нейробиологические исследования последних лет выявили, что хронический стресс индуцирует каскад патологических изменений: от нарушений нейротрансмиттерных систем до структурных пе- рестроек дендритных сетей и снижения нейрогенеза [7; 17].
Хронический стресс оказывает многофакторное повреждающее воздействие на молекулярные механизмы нейропластичности. Гиперактивация гипоталамо-гипофизарно-надпочечниковой оси приводит к избыточной продукции глюкокортикоидов, которые через геномные и негеномные механизмы подавляют экспрессию BDNF, нарушают процессы синаптогенеза и индуцируют атрофические изменения дендритного дерева [20].
Префронтальная кора и гиппокамп характеризуются наибольшей уязвимостью к стрессорным воздействиям вследствие высокой плотности глюкокортикоидных рецепторов и интенсивной метаболической активности [15]. Морфометрические исследования демонстрируют выраженные атрофические изменения в этих структурах при хронических стрессорных состояниях: укорочение и упрощение дендритного дерева, снижение плот- ности дендритных шипиков, уменьшение объема нейропиля [18].
Миндалевидное тело, напротив, обнаруживает гипертрофические изменения при хроническом стрессе, что может лежать в основе гиперактивации эмоциональных реакций и формирования тревожно-фобических расстройств [17; 18]. Дисбаланс между атрофией префронтально-гиппокампальных структур и гипертрофией амигдалы рассматривается как ключевой патогенетический механизм стресс-ассоциированных психических расстройств [7].
Метаболические изменения в мозге при хроническом стрессе характеризуются повышением активности окислительных процессов и накоплением продуктов перекисного окисления липидов [1; 2]. Параллельно наблюдается активация воспалительных процессов с участием микроглии и выбросом провоспалительных цитокинов, что усугубляет нейродегенеративные процессы [10; 19].
Нейрохимические аспекты хронического стресса включают дисбаланс моноаминергических систем, прежде всего серотонинергической, дофаминергической и норадренергической. Снижение активности серотонинергической передачи рассматривается как ключевой механизм развития депрессивных состояний и тревожных расстройств [4; 23].
В поисках эффективных методов коррекции стресс-индуцированных нарушений особое внимание привлекают природные соединения с ней-ропротекторными свойствами [8; 21]. Ресвератрол, природный полифенол, содержащийся в кожуре винограда, демонстрирует многообещающие результаты в экспериментальных моделях стресса [13; 22]. Механизмы его действия включают антиоксидантную активность, противовоспалительное действие и модуляцию сигнальных путей SIRT1 и AMPK [8; 19].
Наряду с природными соединениями, важную роль в коррекции стресс-индуцированных нарушений играют селективные ингибиторы обратного захвата серотонина (СИОЗС), среди которых сертралин занимает особое место благодаря своему благоприятному профилю безопасности и эффективности [5; 6].
Цель исследования: изучить влияние хронического стресса на метаболические и нейрохимические изменения в головном мозге у животных с изначально тревожным поведением и оценить корректирующие эффекты ресвератрола и сертралина.
Материалы и методы исследования. Исследование проведено на 20 половозрелых самцах крыс линии Wistar массой 220–280 г в возрасте 8–10 недель, полученных из питомника лабораторных животных. Для нивелирования различных половых особенностей переноса стресса исследование проводилось исключительно на самцах в летний период [16; 23]. Животные содержались в одинаковых стандартных условиях вивария при температуре 22±2°C, относительной влажности 50–65% и естественном световом режиме 12:12 ч (свет/темнота) с началом светового периода в 07:00. Крысы размещались группами по 5 особей в поликарбонат-ных клетках размером 60×40×20 см с подстилкой из древесной стружки, которая менялась дважды в неделю. Кормление осуществлялось стандартным рационом, состоящим из злаковых культур. Доступ к воде был неограниченным через автоматические поилки. За 7 дней до начала экспериментов проводили акклиматизацию животных к условиям вивария с ежедневным контролем массы тела и общего состояния.
Все процедуры, выполняемые в ходе исследования, были выполнены в соответствии с регламентом декларации ЕС от 2010 г. об использовании лабораторных животных и этическими нормами по гуманизации работы с лабораторными животными.
Дизайн исследования и формирование групп. Исходя из целей эксперимента было сформировано 4 группы животных:
1-я группа — «Контроль» (n=5), которая не подвергалась никакому стрессированию;
2-я группа — «Тревожно-фобические расстройства (ТФР)» (n=5), которая подвергалась стресси-рованию методом предаторного стресса;
3-я группа — «ТФР+Сертралин» (n=5), получавшая сертралин и ресвератрол (дозировка 10 мг/кг и 50 мг/кг, соответственно) в виде внутрибрюшинных инъекций на фоне хронического стресса;
4-я группа — «ТФР+Ресвератрол» (n=5), получавшая ресвератрол (дозировка 50 мг/кг) в виде внутрибрюшинных инъекций на фоне хронического стресса.
Воспроизведение модели хронического стрес-сирования. Стрессорный стимул в виде пропитанного кошачьей мочой абсорбирующего материала (100 мл мочи на 50 г материала) помещали в перфорированные контейнеры и размещали в домашних клетках животных. Количество кошачьей мочи и количество опилок в емкости было стан- дартизировано для обеспечения воспроизводимости результатов.
Экспозиция проводилась ежедневно в течение 10 минут на протяжении 10 суток в период с 9:00 до 11:00. Контейнеры размещали в центральной части клетки на расстоянии 15 см от углов для обеспечения равномерного распределения одоранта. После каждой экспозиции контейнеры удаляли, а клетки проветривали в течение 30 минут.
Фармакологические вмешательства. Группы «ТФР+Ресвератрол» и «ТФР+Сертралин» получали соответствующие препараты в виде внутрибрюшинных инъекций, которые начинались после периода стрессирования и продолжались в течение последующих 7 дней.
Поведенческое тестирование. Оценка поведенческой активности проводилась на 24-й день эксперимента с использованием теста «Приподнятый крестообразный лабиринт» (ПКЛ).
Установка представляла собой крестообразную конструкцию, приподнятую на высоту 60 см над полом, состоящую из двух открытых рукавов (50×10 см) и двух закрытых рукавов (50×10×40 см), соединенных центральной платформой (10×10 см). Поверхность выполнена из серого пластика с нескользящим покрытием.
Видеофиксация поведенческой активности проводилась с помощью камеры в разрешении 1080p при 60 кадрах в секунду в течение 5 минут для каждого животного.
Каждое животное помещали в центр лабиринта головой к открытому рукаву и наблюдали в течение 5 минут. Регистрировали следующие параметры:
-
• Время пребывания в открытых и закрытых рукавах (сек)
-
• Количество заходов в открытые и закрытые рукава (критерий: все четыре лапы в рукаве) (шт)
-
• Количество свешиваний (шт)
-
• Количество актов грумминга (шт)
-
• Количество выглядываний из закрытых рукавов (шт)
-
• Количество актов замирания (фризинг) продолжительностью >2 сек (шт)
-
• Общую двигательную активность (пройденная дистанция)
Рассчитывали индекс тревожности как интегральный показатель оценки состояния экспериментальных животных. Расчёт проводили по формуле: ИТ = 1 — [(время в открытых рукавах/общее время) + (заходы в открытые рукава/общее количество заходов)]/2 [22].
Забор и подготовка биологического материала. Через 24 часа после завершения поведенческого тестирования животных подвергали эвтаназии диэтиловым эфиром с последующим забором крови. Головной мозг извлекали в течение 2 минут и подвергали экстренной заморозки при -80°C, предварительно отобрав следующие структуры:
-
• Гиппокамп (полные билатеральные образцы)
-
• Префронтальную кору (области Cg1, Cg3, IL, PrL)
-
• Миндалевидное тело (центральное и базолатеральное ядра)
Оценка концентрации серотонина. Содержание серотонина определяли флюориметрическим методом с помощью «ФЛЮОРАТ-02-АБЛФ-Т» (производства Люмекс, Россия), по реакции с о-ф-талевым диальдегидом. Для исследования головного мозга использовали 10% гомогенат объѐмом 1 мл. Флюоресценцию оценивали при длинах волн 360 и 480 нм [4].
Оценка активности моноаминооксидазы. Каталитическую активность МАО определяли в митохондриальных мембранах, выделенных из головного мозга лабораторных животных. Активность МАО-Б определяли фотометрическим методом. В качестве субстрата использовали бензиламина гидрохлорид, в ходе окислительного дезаминирования образуется одна молекула бензальдегида. Для остановки реакции использовали семикарбазид на хлорной кислоте, который одновременно останавливает ферментативную активность и образует, взаимодействуя с альдегидом, соответствующие семикарбазоны. Регистрацию образовавшихся продуктов осуществляли на спектрофотометре СФ-56 («ОКБ Спектр» Россия), по поглощению при длине волны 278 нм.
МАО-активность стандартизуют по количеству белка в пробе и выражают в наномолях продукта (бензальдегида) на 1 мг белка за 1 минуту. Для определения концентрации общего белка в митохондриальных суспензиях использовали микробиуретовый метод. Для определения концентрации общего белка измерения проводили при длине волны 330 нм.
Расчёт активности производили по формуле: Акт.МАО=(dА*Uраст)/(0,012*h*min*C)
dА — полученная оптическая плотность (опыт-контроль)
U раст — объем получившегося конечного раствора h — толщина кюветы min — время инкубации
C — концентрация общего белка
0,012 — коэффициент угла наклона калибровочного графика [4].
Оценка уровня перекисного окисления липидов. Для определения уровня перекисного окисления липидов (ПОЛ) использовался спектрофотометрический метод. Данный методический подход основан на феномене перегруппировки двойных связей в диеновые коньюгаты при переокисле-нии полиненасыщенных жирных кислот, сопровождающейся появлением максимума поглощения при 230–238 нм, что позволяет судить о содержании гидроперекисей в липидном экстракте по величине его оптической плотности при этих длинах волн. Окислительная деструкция липидных гидроперекисей сопровождается появлением ещё одного максимума в спектре поглощения при 260–290 нм. В качестве экстрагента использовалась смесь гептана и изопропилового спирта, что позволило разделять липидную вытяжку на фазы различной полярности путём добавления воды. При этом верхняя (гептановая) фаза сосредотачивает большую часть триацилглицеридов (резервных липидов), в то время как водноспиртовая фаза содержит основное количество мембранных фосфолипидов (структурных липидов).
Оценка производили с помощью спектрофотометра СФ-56 Спектр, Россия. Измерение проводилась на длинах волн 220, 232 и 278. По индексам 232/220 определялись первичные продукты, по 278/220 нм вторичные продукты ПОЛ соответственно [1].
Статистическая обработка данных. Статистическую обработку проводили с использованием программных пакетов Statistica 13.05.0.17. и Past 4.06b. Нормальность распределения проверяли тестом Шапиро-Уилка. Межгрупповые сравнения проводили однофакторным дисперсионным анализом (ANOVA) с последующим апостериорным тестом Тьюки для множественных сравнений. Для анализа корреляций использовали коэффициент корреляции Спирмена. Различия считали статистически значимыми при p<0.05, при p 0,1-0,05 различия считались на уровне тенденции.
Результаты исследования
Анализ поведенческих показателей в тесте ПКЛ. Комплексная оценка поведенческой активности животных в приподнятом крестообразном лабиринте выявила значительные изменения основных параметров тревожности под воздействи- ем хронического предаторного стресса и различную эффективность фармакологической коррекции [22; 23] Индекс тревожности (И.Т.), согласно литературным данным, соответствует умеренному уровню тревожности. В группе ТФР наблюдалось снижение И.Т., однако статистически значимых различий с группой контроль обнаружено не было (рис. 1). Применение комбинации сертралина и ресвератрола способствовало повышению И.Т, достоверно превышая значения группы ТФР (p<0,05). Группа ТФР+Ресв. демонстрировала И.Т. статистически достоверное повышение показателей по отношению к группе ТФР (p<0,01).
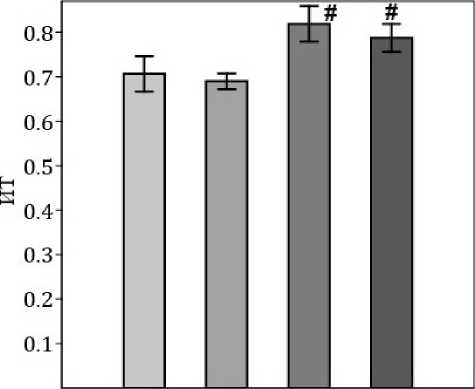
Контроль ТФР ТФР + С ТФР + Р
Рис. 1. Индекс тревожности по группам исследования. # — достоверные различия с группой ТФР
Fig. 1. Anxiety index by study group. # — significant differences with the TFR group
Наиболее выраженные изменения в количестве переходов в тёмные рукава наблюдались в группе ТФР+Ресв., что было статистически достоверно выше показателей всех остальных групп (p<0,001), свидетельствуя об активации общей двигательной активности (рис. 2).
Группа ТФР демонстрировала статистически достоверное снижение количества переходов в светлые рукава по сравнению с контрольной группой (p<0,001). Снижение данного показателя является классическим признаком повышенной тревожности. Ресвератрол частично восстановил уровень исследовательской активности, однако данная коррекция не достигла статистически значимого уровня (рис. 3).
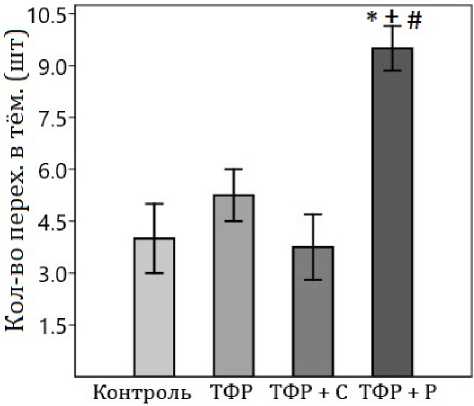
Рис. 2. Количество переходов в темные рукава по группам исследования. * — статистически достоверные различия с группой контроль; # — статистически достоверные различия с группой ТФР; + — статистически достоверные различия с группой ТФР + С
Fig. 2. Number of transitions to dark sleeves by study group. * — statistically significant differences with the control group; # — statistically significant differences with the TFR group; + — statistically significant differences with the TFR + C group
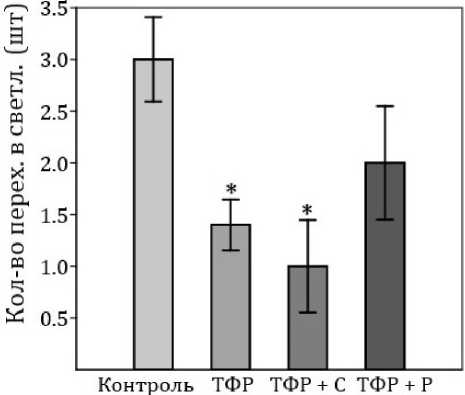
Рис. 3. Количество переходов в светлые рукава по группам исследования. * — статистически достоверные различия с группой контроль
Fig. 3. Number of transitions to light sleeves by study group. * — statistically significant differences with the control group
Нейрохимические изменения в структурах головного мозга. Анализ концентрации серотонина в различных структурах головного мозга выявил неоднородные изменения в зависимости от исследуемого региона и применяемого фармако- логического вмешательства. В префронтальной коре наблюдались наиболее выраженные изменения концентрации серотонина. В группе ТФР отмечено статистически достоверное снижение концентрации серотонина по сравнению с контрольной группой (p<0,001). Наиболее выраженный корректирующий эффект наблюдался в группе ТФР+Ресв., где концентрация серотонина составила. Сертралин в свою очередь не повлиял на данный показатель (p<0,01) (рис. 4).
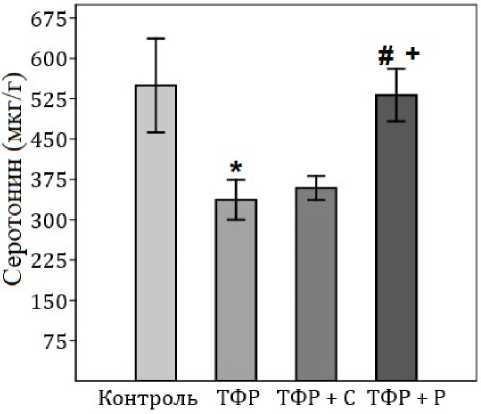
Рис. 4. Концентрация серотонина в префронтальной коре по группам исследования * — статистически достоверные различия с группой контроль;
# — статистически достоверные различия с группой ТФР; + — статистически достоверные различия с группой ТФР + С
Fig. 4. Serotonin concentration in the prefrontal cortex by study group * — statistically significant differences with the control group; # — statistically significant differences with the TFR group; + — statistically significant differences with the TFR + C group
В гиппокампе было обнаружено снижение концентрации серотонина в группах ТФР относительно контроля. Сертралин и ресвератрол, в свою очередь, не повлияли на данный показатель (рис. 5).
Моноаминооксидаза Б — это фермент, отвечающий за метаболизм моноаминов-нейротрансмиттеров, в частности серотонина, является одной из мешеней действия ресвератрола. Хронический предаторный стресс, сам по себе, не вызывал изменений в активности данного фермента. Однако терапия как сертралином, так и ресвератролом приводила к статистически достоверному повышению значений данного показателя (рис. 6.). Что согласуется с данными литературы.
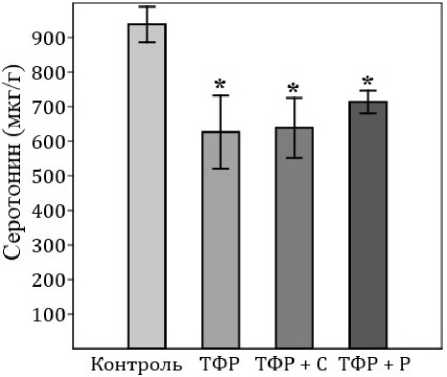
Рис. 5. Концентрация серотонина в гиппокампе по группам исследования. * — статистически достоверные различия с группой контроль
Fig. 5. Serotonin concentration in the hippocampus by study group. * — statistically significant differences with the control group
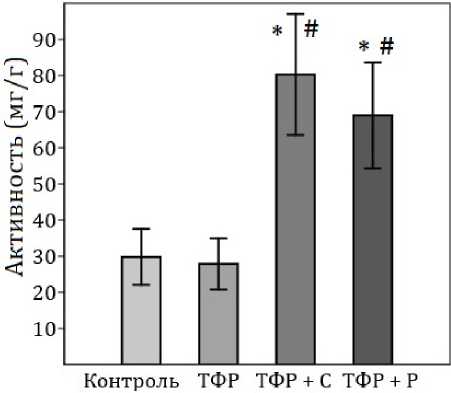
Рис. 6. Активность фермента МАО-Б в мозге мг/г* — статистически достоверные различия с группой контроль; # — статистически достоверные различия с группой ТФР
Fig. 6. MAO-B enzyme activity in the brain, mg/g* — statistically significant differences with the control group; # — statistically significant differences with the TFR group
Окислительные процессы в мозговой ткани. Исследование показателей перекисного окисления липидов в ткани головного мозга выявило значительные изменения в различных фракциях ПОЛ под воздействием хронического предаторного стресса и фармакологической коррекции.
Первичные продукты ПОЛ неструктурных компонентов (232/220 нм). Группа ТФР демонстриро- вала статистически достоверное снижение данного показателя, что может свидетельствовать об истощении липидных субстратов окисления. Сертралин, как и ресвератрол, восстанавливал данный показатель до значений группы контроля, что отражается статистически достоверным повышением по отношению к группе ТФР (рис. 7 А). Данное увеличение может быть сопряжено с усилением активности фермента МАО-Б.
В изопропиловой фазе наблюдались аналогичные тенденции: контроль (рис. 7 Б).
Вторичные продукты ПОЛ неструктурных компонентов (278/220 нм). Ресвератрол усиливал ПОЛ неструктурных компонентов в гептановой фазе (рис. 8 А).
ТФР, как и действие препаратов, не сказывались на уровне ПОЛ неструктурных компонентов в изопропиловой фазе (рис. 8 Б).
Полученные данные свидетельствуют о двухфазном характере окислительных процессов в мозговой ткани при хроническом стрессе. Снижение первичных продуктов ПОЛ в группе ТФР может отражать истощение легкоокисляемых липидных фракций на фоне длительного окислительного стресса, в то время как накопление вторичных продуктов указывает на хронический характер окислительного повреждения.
Обсуждение. Полученные результаты исследования выявили существенные метаболические и нейрохимические отклонения, связанные с поведенческой активностью, нарушениями серотонинергической передачи и окислительными процессами в головном мозге при моделировании хронического предаторного стресса у животных с изначально тревожным поведением [23; 24].
Региональная специфичность воздействия хронического предаторного стресса на серотонинергическую систему головного мозга подтверждается различной степенью выраженности изменений в префронтальной коре и амигдале [15; 18] (рис. 4, 5). Префронтальная кора демонстрировала наибольшую уязвимость к стрессорному воздействию, что согласуется с современными представлениями о роли данной структуры в регуляции эмоциональных состояний и стресс-реактивности [7; 15].
Парадоксальное снижение индекса тревожности в группе ТФР (рис. 1) может отражать развитие депрессивно-подобного поведения с элементами ан-гедонии, что часто наблюдается при длительном стрессорном воздействии [3; 6]. Это предположение подтверждается значительным снижением ис-
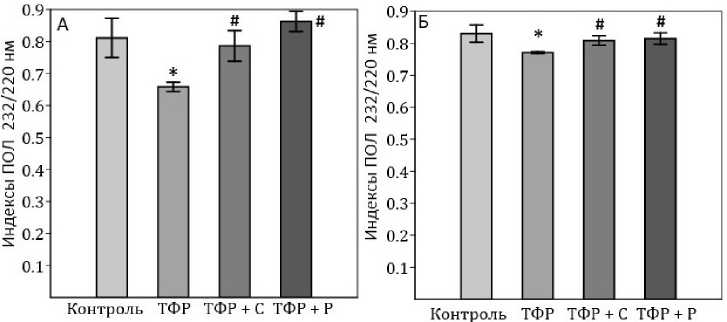
Рис. 7. Первичные продукты ПОЛ неструктурных компонентов (232/220 нм): А — гептановая фаза, Б — изопропиловая фаза. * — статистически достоверные различия с группой контроль; # — статистически достоверные различия с группой ТФР
Fig. 7. Primary products of POL of non-structural components (232/220 nm): A — heptane phase, B — isopropyl phase. * — statistically significant differences with the control group; # — statistically significant differences with the TFR group
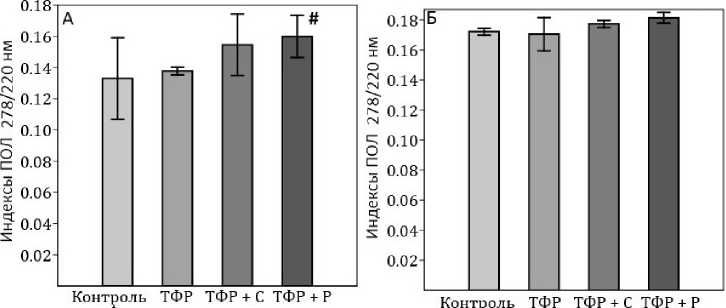
Рис. 8. Вторичные продукты ПОЛ неструктурных компонентов (278/220 нм): А — гептановая фаза, Б — изопропиловая фаза. # — статистически достоверные различия с группой ТФР
Fig. 8. Secondary products of POL of non-structural components (278/220 nm): A — heptane phase, B — isopropyl phase. # — statistically significant differences with the TFR group следовательской активности в открытых рукавах лабиринта (рис. 3) при сохранности общей локомоторной активности (рис. 2).
Двухфазный характер изменений показателей перекисного окисления липидов (рис. 6, 7) отражает сложность адаптивных процессов при хроническом стрессе [1; 2]. Снижение первичных продуктов ПОЛ может свидетельствовать об истощении липидных субстратов окисления или компенсаторной активации антиоксидантных систем, в то время как накопление вторичных продуктов указывает на хронический характер окислительного повреждения.
Сравнительный анализ эффективности фармакологической коррекции выявил преимущества ресвератрола перед сертралином в использованных дозах [8; 21]. Ресвератрол продемонстрировал комплексное нейропротекторное действие, включающее восстановление серотонинергической передачи в префронтальной коре (рис. 4), активацию общей двигательной активности (рис. 2) и частичное восстановление исследовательского поведения (рис. 3) [8; 13]. Механизмы действия ресвератрола могут включать прямое антиоксидантное действие, модуляцию сигнальных путей SIRT1 и AMPK, а также противовоспалительные эффекты [8; 19; 22].
Недостаточная эффективность сертралина в использованной дозе может быть связана с особенностями модели стресса, необходимостью более длительного курса терапии или индивидуальными особенностями серотонинергической системы у животных с изначально тревожным поведением [5; 6].
Ограничения исследования. Исследование имеет ряд ограничений, которые следует учиты- вать при интерпретации результатов. Во-первых, использование исключительно самцов не позволяет экстраполировать результаты на женскую популяцию, у которой механизмы стресс-реактивности и фармакологического ответа могут существенно различаться вследствие влияния половых гормонов [12; 16].
Во-вторых, временные рамки исследования ограничены периодом острых эффектов терапии. Долгосрочные эффекты комбинированной терапии, включая возможность предотвращения рецидивов и формирования устойчивых адаптивных изменений, требуют дополнительного изучения.
В-третьих, использованная модель хронического стресса, несмотря на высокую валидность, может не полностью отражать гетерогенность клинических проявлений тревожно-депрессивных расстройств у человека [3; 5]. Необходимы дополнительные исследования на других экспериментальных моделях для подтверждения универсальности выявленных закономерностей.
Заключение. Проведенное исследование продемонстрировало, что хронический предаторный стресс у животных с изначально тревожным поведением приводит к комплексным нарушениям нейрохимических процессов в головном мозге, характеризующимся региональной специфичностью изменений серотонинергической системы, двухфазными нарушениями процессов перекисного окисления липидов и развитием депрессивно-подобного поведения [23; 24].
Префронтальная кора является наиболее уязвимой структурой к воздействию хронического стресса, демонстрируя максимальное снижение концентрации серотонина, что коррелирует с выраженностью поведенческих нарушений [7; 15].
Ресвератрол в дозе 50 мг/кг продемонстрировал выраженные нейропротекторные эффекты, превосходящие по эффективности сертралин в аналогичной дозе [8; 21]. Механизмы действия ресвератрола включают восстановление серотонинергической передачи, нормализацию показателей перекисного окисления липидов и улучшение поведенческих параметров [8; 13; 22].
Полученные результаты открывают перспективы для разработки новых терапевтических подходов к коррекции стресс-индуцированных нарушений на основе природных соединений с нейропро-текторными свойствами и обосновывают целесообразность дальнейших исследований ресвератрола как потенциального антидепрессанта и анксиолитика [8; 21; 22].


