Метаболические изменения в щитовидной железе при коррекции ресвератролом тревожно-фобических расстройств
Автор: Цейликман В. Э., Шатилов В. А., Истомина Д. Н.
Рубрика: Медицина
Статья в выпуске: 2 (30), 2025 года.
Бесплатный доступ
При использовании модели предаторного хронического стресса на половозрелых самцов крыс линии Wistar были воспроизведены тревожно-фобические расстройства (ТФР). Основные признаки, определяющие ТФР, были выявлены по результатам поведенческого теста «Приподнятый крестообразный лабиринт» (ПКЛ). При ТФР было установлено повышение концентрации трийодтиронина в сыворотке, уровня перекисного окисления липидов и концентрации кетоновых продуктов окислительной модификации белков, а также тенденция к снижению концентрации альдегидных продуктов окислительной модификации белка в щитовидной железе. При внутрибрюшинном введении ресвератрола в концентрации 20 мг/кг было зафиксировано снижение индекса тревожности (И.Т.), однако наблюдался ряд побочных эффектов в виде повышения продуктов перекисного окисления липидов и окислительной модификации белка. Полученные результаты исследования представляют собой практический и теоретический интерес в рамках коррекции тревожно-фобических расстройств и изучения механизмов действия ресвератрола.
Приподнятый крестообразный лабиринт, индекс тревожности, щитовидная железа, тревожно-фобические расстройства, трийодтиронин, перекисное окисление липидов, окислительная модификация белка
Короткий адрес: https://sciup.org/170211016
IDR: 170211016 | УДК: 616-092.9 | DOI: 10.47475/2409-4102-2025-30-2-65-76
Текст научной статьи Метаболические изменения в щитовидной железе при коррекции ресвератролом тревожно-фобических расстройств
В настоящее время в связи с повышением плотности населения, происходящей с урбанизацией, и обострением социальных проблем повышается и частота встречаемости тревожно-фобических расстройств. По данным эпидемиологических исследований частота встречаемости ТФР составляет от 5 до 12 % среди амбулаторного контингента, а посещавшие муниципальный центр социальной помощи от 12,8 % до 29,3 % жаловались на тревожность [4; 5].
Из определения МКБ-10 следует, что ТФР — это группа психоэмоциональных расстройств ведущим признаком которых наблюдается боязнь определённых ситуаций/обстановок, в действительности не представляющих на данный момент опасности. Наиболее распространённой стратегией пациентов, страдающих данным расстройством, является избегание данных ситуации, вплоть до полного исключения действий, ведущих к возможности их появления, в случаях невозможности избегания переносятся со страхом [5; 6]. ТФР могут проявляться в виде отдельных симптомов, таких как дрожь, страх, обморочное состояние, тревога и т.д. Более того, данное расстройство может усугублять различные патологии, среди которых наиболее часто выделяют кардиомиопатии и инсульты [2; 5]. Работы, рассматривающие изучения формирования ТФР показывают его формирование в раннем возрасте, связывая с проявлениями эмоционального дизонтогенеза, а более тщательна идентификация особенностей проявления страхов представляет собой клинический интерес, позволяя своевременно диагностировать и скорректировать ТФР [27]. В более позднем возрасте пациенты менее эффективно поддаются психотерапии, однако данный метод лечения остаётся достаточно эффективным и часто дополняется психофармакотерапией [5].
Под психофармакотерапией наиболее часто при коррекции ТФР подразумевается использование антипсихотических и антидепрессантов, в более сложных клинических ситуациях транквилизаторов. Эффективность данных препаратов, как и лечение других психиатрических заболеваний, очень низка. Наиболее часто они вызывают негативные эффекты, ставя под вопрос их использование [11]. Таким образом, в настоящее время актуален поиск лекарственных средств, отличающихся свой эффективностью и меньшим спектром побочных эффектов, а также полифункциональностью. Ресвератрол, природный полифенол, обладает огромным спектром благоприятных свой ств, среди которых различные исследовательские группы выделяют антиоксидантную активность, кардиопротектор-ный, противовоспалительный и антипролифе-ративный эффект, а также свой ством регуляции активности генных сетей и способность профи-лактировать развитие опухолей [7]. Различные исследовательские группы, изучавшие воздействие ресвератрола на работу и функции щитовидной железы, отмечают его эффективность при коррекции окислительного стресса в териоцитах способствуя коррекции гипотериоза, через регуляцию экспрессии ТТГ [22; 28], снижению пролиферации клеток рака щитовидной железы [13], а также рядом других эффектов [18]. Таким образом, существуют данные о снижении окислительной нагрузки в щитовидной железе при введении ресвератрола, однако эти результаты были получены в ходе рассмотрения воздействия химического стресса, что не является сопоставимым с комплексным воздействием хронического психоэмоционального стресса, и рассматривают окислительный стресс в отдельных ультраструктурах тиреоцитах, но не в цельном органе. С другой стороны, имеются экспериментальные данные использования ресвератрола в качестве БАДа, корректирующего посттравматическое расстройство (ПТСР), но при этом отсутствуют данных о влиянии такого метода коррекции на метаболические изменения в щитовидной железе [26]. Направление данной работы способствует изучению влияние курсового применение низкой дозы ресвератрола на метаболические изменения и функциональность щитовидной железы, а также возможность ресвератрола корректировать ТФР, в крысиной модели у самцов крыс линии Вистар. Что даёт более комплексное понимание механизмов действия самого ресвератрола и перспектив его использования.
Материалы и методы исследования
В качестве модели по формированию ТФР, была выбрана модель предаторного стресса основанная на воздействии «присутствия» хищника [26]. Для нивелирования различных половых особенностей переноса стресса исследование проводилось на 30 половозрелых самцах крыс линии Вистар в летний период, возрастом 12 месяцев. Одним из ключевых антропометрических параметров, отображающих метаболические особенности жи -вотных и теоретически способных также повлиять на восприятие стресса, масса тела была ключевым параметром при подборе всей выборки, ис -ходная масса тела всех животных на начало экс -перимента составляла 225±25 г. Животные содер -жались в одинаковых условиях при естественном свете и получали стандартный рацион, состоящий из злаковых культур, ограничений по употребле нию воды не было. Все процедуры, выполняемые в ходе исследования, были выполнены в соответствии с регламентом декларации ЕС от 2010 г. об использовании лабораторных животных.
Исходя из целей эксперимента, были сформиро -ваны 3 группы животных: 1-я группа — это кры -сы, которые подвергались формированию ТФР, ме -тодом помещения запаха хищника в «домашнюю клетку» (берёзовые опилки, смоченные кошачьей мочой, модель предаторного стресса) с 1-го дня эксперимента по 10-й день (группа ТФР), ежеднев -но в течение 10 минут. В последующем этой группе животных внутрибрюшинно вводился растворить ресвератрола (10 % раствор ДМСО) с 11-го по 17-й день эксперимента, последующие 6 дней (18-й — 23- й день) содержались в стандартных условиях; 2 -я группа животных — это группа, которым во -дился ресвератрол в концентрации 20 мг на кг массы животного (группа ТФР+Ресв.), все производимые манипуляции были аналогичными с группой ТФР; 3-я группа — это группа контрольных животных, не подвергавшиеся воздействию запаха хищника, но ей также как и группе ТФР вводился растворитель. Дизайн эксперимента представлен на рисунке № 1 «Дизайн эксперимента».
В качестве теста для оценки поведенческих ре -акций с целью детекций различных поведенческих и психоэмоциональных проявления развития ТФР был выбран «Приподнятый крестообразный лабиринт», данный тест проводили на 24 - й день экспе -римента. Продолжительность теста ПКЛ, на одно животное, составляла 300 с, в течение которых производилась видеофиксация поведенческой активности. Основными оцениваемыми параметрами были: время нахождения в открытых и закры тых рукавах; количество переходов по рукавам (локомоторная активность) за отведённое время (300 с). Помимо основных параметров, были оценены дополнительные, к ним относятся: груминг, фризинг, выглядывание, свисание, стойки и акты дефекации. После расшифровки видеофиксции, по основным параметрам был рассчитан индекс тревожности (ИТ), разработанный В. Э. Цейлик-маном и соавторами [26] по формуле:
Тор + Nор Тобщ Nобщ где То — общее время, проведённое в открытых рукавах;
Тобщ— общее время тестирование животного; N o — общее количество заходов в открытые рукава; Кобщ — суммарное количество переходов в рукава.
|
Группа животных |
Выполняемые манипуляции |
||||
|
Группа ТФР |
Стрессирование |
Введение растворителя |
Обычные условия |
Тест ПКЛ |
Забой |
|
1-10 |
11-17 |
18-23 |
24 |
25 |
|
|
Греппа ТФР +Ресв. |
Стрессирование |
Введение ресвератрола |
Обычные условия |
Тест ПКЛ |
Забой |
|
1-10 |
11-17 |
18-23 |
24 |
25 |
|
|
Группа контроль |
Стрессирование |
Введение растворителя |
Обычные условия |
Тест ПКЛ |
Забой |
|
1-10 |
11-17 |
18-23 |
24 |
25 |
|
Рис. 1. Дизайн исследования
Fig. 1. Study design
На 25-й день производилась эвтаназия животного с помощью лёгкого диэтилового наркоза, затем отбирался биологический материл: сыворотка и щитовидная железа — который был немедленно заморожен методом экстренной заморозки. Полученная сыворотка использовалась для определе -ния уровня Т3, ИФА-методом на наборах «Хема» (Россия). Отобранная щитовидна железа использо -валась для биохимических исследований по опре -делению уровня окислительного стресса. Основ -ными методами для определения уровня окислительного стресса были исследования: перекисного окисления липидов (ПОЛ), суть данного мето -да заключается измерении оптической плотности липидных экстрактов, полученных в ходе гомоге низации в физиологическом растворе и последующем растворении в гептан-изопропиловом растворе, на определённых длинах волн в ультрафи -олетовой области спектра [1]; определения окис -лительной модификации белков (ОМБ), также фотометрическим методом на спектрофотометре СФ -56 (Россия) [3].
В качестве обработки результатов исследования был использован пакет программ Statistica 13.05.0.17. Основным методом для оценки в трёх независимых выборках использовался one-way ANOVA для выборки с ненормальным распределением. Критерий нормальности распределения рассчитывался по методу Колмогорова — Смирнова и Шапиро — Вилка. Для поиска корре -ляции использовался метод Спирмана. Различия и корреляции считались статистически достоверными и значимыми при p < 0,05, а при значениях p от 0,05 до 0,15 — имеющими тенденцию.
Результаты исследования
При тестировании в ПКЛ было выявлено, что крысы в группе ТФР характеризовались наибольшим И.Т. среди всех групп, что отображает релевантность используемой модели. Стоит от -метить, что при введении ресвератрола (груп па ТФР+Ресв.) показатель индекса тревожности уменьшался до уровня контрольной группы, рисунок № 2а «Влияние хронического стресса на рас -чётный показатель И.Т. по тесту ПКЛ и концентрацию Т3 в сыворотке». Согласно литературным данным, И.Т.< 0,8 соответствует фенотипу с низ -ким уровнем, а И.Т.> 0,8 ассоциируется с высоким уровнем тревожности. Таким образом, полу ченные данные рассчитанного И.Т. группы ТФР неполностью укладываются в параметры тревож ности, однако учитывая достоверное повышение по сравнению с контрольной группой (р = 0,0001), возможно утверждать, что полученные нами ре -зультаты имеют сопоставимое значение с литера турными данными. В группе ТФР+Ресв. наблюдается тенденция к снижению И.Т., по сравнению с группой ТФР (р = 0,0671), но не дотягивающей до контрольной группы (р = 0,08811), что свиде -тельствует о снижение тревожности.
Проведение ИФА по определению концентрации трийодтиронина (Т3) показало, что группа ТФР обладала повышенной концентрацией Т3 по сравнению с контрольной группой (р=0,000242) и группой ТФР+Ресв. (0,000459), при этом статистически достоверной разницы между контроль ной группой и ТФР+Ресв. нет, как и тенденции (р = 0,9438). Это подтверждает данные о влиянии стресса и ресвератрола на уровень Т3 в других ис -следованиях (рис. 2b) [17, 19].
Достаточно хорошо изучена связь хронического стресса, вызванного психоэмоциональными пере -живаниями, с окислительным стрессом. Также до -статочно известен эффект ресвератрола по сниже -нию уровня окислительного стресса, однако есть противоположные данные, говорящие о возможных побочных эффектах, связанных не с самим ресвератролом, а с его метаболитами [24]. Исходя из этого, было выбрано направление по изучению окислительного стресса.
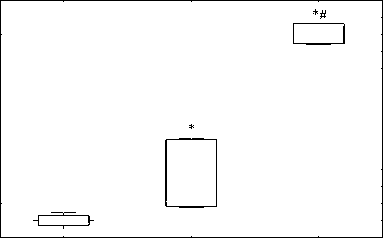
Согласно полученным данным, в группе ТФР наблюдалось статистически достоверное повыше -ние уровня окисления во всех 4 индексах ПОЛ от -носительно контроля (первичные продукты ПОЛ структурных и не структурных компонентов: р = 0,000195 и р = 0.002365; вторичные продукты ПОЛ структурных и неструктурных компонентов: р = 0,008656 и р = 0,005043), что отображает повышение окислительной нагрузки на щитовидную железу (рис. № 3 «Изменения, связанные с влия ние хронического стресса и ресвератрола на уро вень ПОЛ в щитовидной железе»). Эти результаты полностью соответствуют ожидаемым результатам и согласуются с рядом других исследований [7; 17]. Обратная картина наблюдается в группе ТФР+Ресв., там происходит статистически достоверное ещё большее повышение уровня ПОЛ сре -ди первичных и вторичных продуктов неструк турных компонентов (р = 0, 000144 и р = 0,000123), в сравнении не только с контрольной, но и группой ТРФ (р = 0,000144 и р = 0,000123) (рис. № 3a, b). Однако уровень первичных продуктов ПОЛ структурных компонентов, в группе ТРФ+Ресв., не отличается от группы ТРФ (рис. № 3c), а вто -ричные продукты ПОЛ структурных компонентов статистически достоверно ниже (р = 0,031841) (рис. № 3d).
Результаты, полученные в ходе изучения окис -лительной модификации белков (ОМБ), также яв -ляются неоднозначными. Так, в группе ТФР наблюдается повышение кетоновых продуктов ОМБ
2a
2b
Уровень концентрации Т3 в сыворотке (нМоль/л)
Расчетный показатель индекс тревожности (И.Т.) 1,1
0,9
0,6
0,5
0,4
0,8
S
0,7

Группы
Группы
Рис. 2а и 2b. Изменения, связанные с влиянием хронического стресса и ресвератрола на расчётный показатель индекса тревожности по тесту ПКЛ и концентрацию Т3 в сыворотке * достоверное различие с контрольной группой (p ≤ 0,05)
Fig. 2a and 2b. Changes related to the effect of chronic stress and resveratrol on the calculated index of anxiety according to the PCL test and the concentration of T3 in serum * significant difference with the control group (p < 0.05).
3a
0,56
0,54
0,52
0,50
0,48
0,46
0,44
0,42
0,40
0,38
0,36
0,34
0,32
0,30
0,28
Первичные продукты ПОЛ в щитовидной железе (гептановая фаза)
Контроль
ТФР ТФР + Ресв.
3b
0,24
0,22
оо
0,20
0,18
Я о к
0,16
0,14
0,12
Вторичные продукты ПОЛ в щитовидной железе (гептановая фаза)


Группы
Контроль ТФР ТФР + Ресв.
Группы
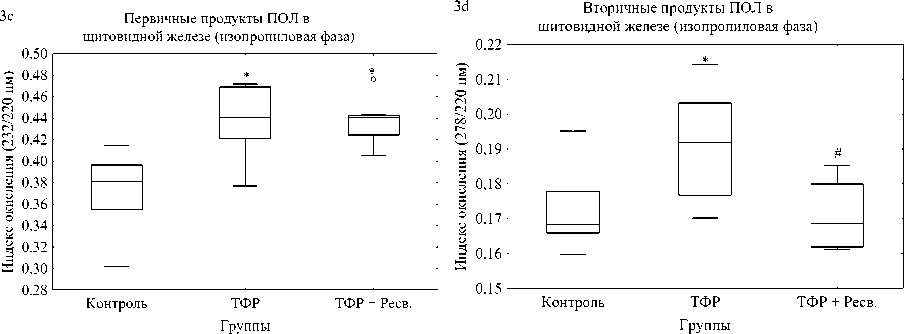
Рис. 3а, 3b, 3c и 3d. Влияние хронического стресса на продукты ПОЛ в щитовидной железе в ходе биохимических методов исследования
Fig. 3a, 3b, 3c, and 3d. The effect of chronic stress on LPO products in the thyroid gland during biochemical research methods
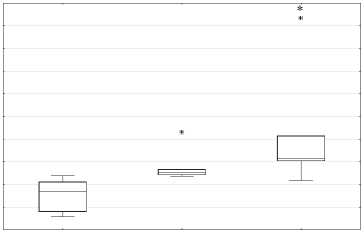
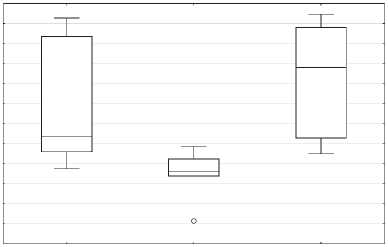
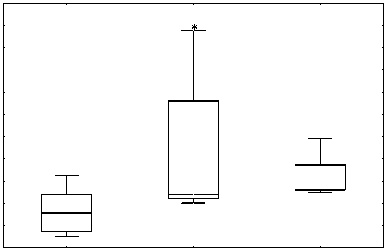
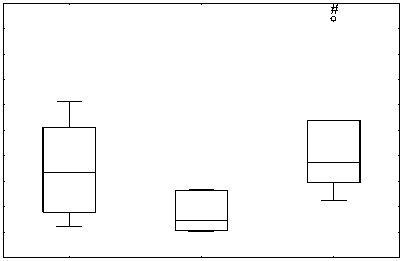
относительно контрольной группы (р = 0,011755) (рис. № 4а), а концентрация альдегидных продуктов на оборот ниже (р = 0,083480) (рис. № 4b). В группе ТФР+Ресв. не наблюдается статисти -чески достоверного повышения уровня кетоновых продуктов ОМБ, относительно контрольной группы, однако данные указывают на бли -зость к тенденции (р = 0,159626), а уровень аль -дегидных продуктов ОМБ находится на уровне контроля (рис. № 4a, b). Полученные результаты свидетельствуют о повышении окислительной нагрузки и косвенно подтверждают активацию антиоксидантной системы при хроническом стрессе. В свою очередь индуцибельное окисле -ние белка привело к тенденции и достоверному повышению кетоновых продуктов ОМБ в группе ТРФ и ТРФ+Ресв. соответственно (р = 0,5198 и р = 0,00173) (рис. № 4c). Концентрация альдегид -ных производных ОМБ относительно контроль -ной группы, при индукции окисления, в груп -пе ТРФ была снижена (р = 0,11041), в то время как у ТРФ+Ресв. не было различий с контролем
(рис. № 4d). Данные результаты напрямую подтверждают активацию антиоксидантной системы и при этом подтверждают гипотезу о двой -ственности ресвератрола в качестве антиокси данта.
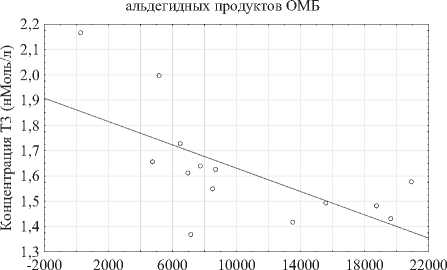
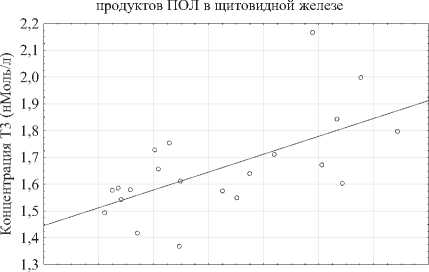
Более углублённое изучение полученных данных показало наличие корреляции ряда показате -лей. Так, были найдены корреляции между концентрацией Т3 и компонентами окислительного стресса в первичных неструктурных продуктах ПОЛ и альдегидными продуктами ОМБ (рис. 5b и 5a соответственно. Рисунок 5b говорит об уме -ренной прямой корреляции концентрации Т3 со вторичными структурными продуктами ПОЛ (р < 0,05; р = 0,6299), что согласуется с существующей концепцией влияния Т3 на окислительный стресс [14], однако наблюдаемая умеренная отри -цательна корреляция Т3 с альдегидными продуктами ОМБ свидетельствует о связи окислитель ного стресса с белковыми компонентами, вхо дящими в состав щитовидной железы (р < 0,05; р = -0,7010) (рис. 5a).
4a
4c
1E5
4b
О
2 ж
§
S
Индукция окислительной модификации белка в щитовидной железе
О
-о
к
3 т
Контроль
ТФР + Ресв.
ТФР
Группы
4d
#
Окислительная модификация белка в щитовидной железе
-2000
О
•В
S
Контроль
ТФР
ТФР + Ресв.
Группы
Рис. 4а, 4b, 4c и 4d. Влияние хронического стресса на показатели производных ОМБ в щитовидной железе в ходе биохимических методов исследования
Fig. 4a, 4b, 4c and 4d. The effect of chronic stress on the indicators of OMB derivatives in the thyroid gland during biochemical research methods
2000 0
1E5
Окислительная модификация белка в щитовидной железе
Контроль
ТФР + Ресв.
ТФР
Группы
Индукция окислительной модификации белка в щитовидной железе
Контроль
ТФР
ТФР + Ресв.
Группы
5a
Корреляция концентрации Т3 и
0 4000 8000 12000 16000 20000
Концентрация альдегидных продуктов ОМБ (нМоль/л)
5b Корреляция концентрации Т3 неcтруктурных, первичных
0,15 0,16 0,17 0,18 0,19 0,20 0,21 0,22
Индекс перекисного окисления
Рис. 5a, 5b. Корреляции концентрации Т3 в сыворотке с альдегидными продуктами ОМБ и неструктурными первичными продуктами ПОЛ
Fig. 5a, 5b. Correlations of serum T3 concentration with aldehyde products of OMB and non-structural primary POL products
Заключение
Полученные результаты исследования выявили существенные метаболические отклонения, связанные с поведенческой активностью, повышенной окислительной и косвенно антиоксидантной нагрузкой, а также гормональным статусом животных, при моделировании ТФР в контрасте с контрольной группой животных.
Известно, что ТФР формируется под воздействием хронического стресса, также одновременно с этим повышается окислительная нагрузка на различные отделы, системы и органы. Щитовидная железа хоть и не стоит на первой линии удара, всё же ряд авторов отмечают непосредственное участие в формировании адаптивного ответа посредством активации гипоталамо-гипо-физарно-тиреоидной оси [16]. Так в нашем исследовании при формации ТФР наблюдается значительный подъём И.Т., что говорит о повышенной тревожности и отображает эффективность выбранной модели стрессирования. Наиболее интересным показателем является концентрация Т3 в сыворотке, его повышение отображает активацию гипоталамо- гипофизарной-тиреоидной системы. Также обнаруженная связь Т3 и первичных продуктов ПОЛ подчёркивает классическое представление активации митохондриального дыхания посредством передачи сигнала, опосредованного UCP 1-го, 2-го, 3-го типов [10], что в совокупности с наблюдаемыми изменениями ПОЛ в группе ТФР отображает повышение АФК в результате размыкания цепи передачи электронов.
Метаболические изменения при применении ресвератрола, обнаруженные в результате исследования, являются отражением его возможных эффектов, связанных с различными видами метаболитов. Повышение нативных и индуцибельных альдегидных форм ОМБ и неструктурных компонентов ПОЛ возможно объяснить через воздействие o-хинона — токсичного метаболита ресвератрола. О-хинон в щитовидной железе может образовываться под воздействием изоформ цитохромов P450 — CYP3A4, CYP1A1 и в меньшей степени [15] путём гидроксилирования ресвератрола до 3,5,3,4-тетраоксистильбена и его последующего окисления [25]. О-хинон приводит к алкилированию основных регуляторов антиоксидантной системы Keap1 и Nrf2 [8; 20], что вызывает ингибирование синтеза и концентрации ферментов NQO1, GPX, TXNRD1, SRXN1 и TXN1, играющих основную роль в снижении активных форм кислорода и их продуктов в щитовидной железе [23]. Помимо снижения активности ферментов антиоксидантной системы, алкилирование Nrf2 приводит к повышению индукции Т3. Также под воздействием о-хинона происходит повышение Nf- Kb, через опосредованное снижение IkB, приводящее к усилению выработки АФК. Наиболее интересным с точки зрения метаболизма является снижение активности целого ряда цитохромов, в том числе CYP3A4 через ингибирование GST и ковалентную модификацию AhR под воздействием о-хинона [9].
С другой стороны, сохранение показателей ПОЛ и ОМБ в группе ТФР+Ресв. на уровне группы ТФР, а также их возвращение к значениям сопоставимых с контролем, свидетельствует о положительном эффекте, возможно связанном с 3,5,3,4-тетра-оксистильбеном и активацией антиоксидантной системы, что частично компенсирует негативное влияние метаболитов ресвератрола [23].
Все выше представленные данные свидетель - на допустимом уровне и положительном влиянии ствует о поддержании окислительного стресса ресвератрола при дозе 20 мг/кг.


