Мезенхимные стромальные клетки костного мозга и их роль в формировании опухолевой ниши при онкогематологических заболеваниях
Автор: Чубарь А. В., Семенова Н. Ю., Ругаль В. И., Бессмельцев С. С., Котова А. В., Масленникова И. И., Иволгин Д. А., Енукашвили Н. И.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Оригинальные статьи
Статья в выпуске: 1 т.15, 2019 года.
Бесплатный доступ
Мезенхимные стромальные клетки (МСК) являются одними из ключевых компонентов ниши гемопоэтической стволовой клетки. Несмотря на многочисленные исследования, посвящённые фенотипу и дифференцировке МСК в костном мозге (КМ), данные об их функционировании в организме ограничены. Функциональная пластичность этих клеток находит применение в терапии. Особый интерес МСК КМ представляют в связи с их ролью в развитии гематологических заболеваний. В обзоре рассматриваются фенотипические особенности МСК КМ, вопросы их гетерогенности и иерархии, а также их роль в формировании опухолевого микроокружения.
Мезенхимные стромальные клетки, костный мозг, микроокружение, ниша гемопоэтических стволовых клеток
Короткий адрес: https://sciup.org/170172531
IDR: 170172531
Текст обзорной статьи Мезенхимные стромальные клетки костного мозга и их роль в формировании опухолевой ниши при онкогематологических заболеваниях
колонии на культуральном пластике и обладали способностью к дифференцировке в хондрогенном и остеогенном направлениях. В 1991 году Каплан предложил термин «мезенхимные стволовые клетки» для МСК, дающих начало различным клеткам мезодермального происхождения и способных к самообновлению [2]. В 2005 году Междуна- родное общество клеточной терапии (МОКТ, ISCT — The International Society for Cellular Therapy) предложило называть такие клетки мультипотентными мезенхимными стромальными клетками (мМСК), так как лишь часть популяции соответствует критериям истинных стволовых клеток [3, 4]. Простота выделения и культивирования, способность к дифференцировке в различных направле-ниях,синтез различных биологически активных веществ открыли большие возможности к использованию МСК в регенеративной терапии. Однако на сегодняшний день большая часть информации об МСК была получена in vitro, а представление о функционировании и особенностях этих клеток in vivo весьма ограничено. Кроме того,сравнение результа-тов,полученных в разных экспериментах,ос-ложняется гетерогенностью популяции МСК костного мозга (МСК КМ), внутри которой можно выделить как клетки с характеристиками стволовых, так и клетки, вставшие на путь дифференцировки. В настоящем обзоре рассматриваются данные о происхождении, гетерогенности и фенотипе МСК КМ.
Распространение МСК
В 2006 году МОКТ представило критерии, определяющие МСК: 1) адгезия к культуральному пластику 2) определённый фенотип: CD105+, CD73+ и CD90+, CD45–, CD34–, CD14–, CD11b–, CD79–, CD19- и HLA-DR- 3) способность к дифференцировке in vitro в остеобласты, хондроциты и адипоциты [4]. Однако такое определение оказалось достаточно широким. Помимо КМ,МСК могут быть выделены из множества других органов и тканей, включая жировую ткань, пупочный канатик, периферическую кровь, сердце, лёгкие [5,6]. Все эти клетки соответствуют принятым критериям МСК. Для объяснения практически повсеместного нахождения МСК существует три предположения: 1) МСК развиваются в каждом органе или ткани независимо 2) МСК связаны с определёнными тканями,но способны циркулировать посредством кровеносного русла в другие органы и ткани 3) МСК — это циркулирующие клетки крови [7]. Стоит отметить, что несмотря на общую схожесть, МСК разных органов и тканей имеют различия,об-условленные влиянием локальной ниши [8]. Owen в работе 1988 года [9] предполагал, что
МСК КМ являются частью всех стромальных клеток организма, вписываясь в иерархическую модель, в основе которой находятся плюрипотентные стволовые клетки, дающие начало тканеспецифичным стволовым клеткам уже с ограниченными потенциями,в том числе МСК КМ,которые,в свою очередь,дают начало коммитированным предшественникам. Такие предшественники будут дифференцироваться в конкретные типы стромальных клеток в зависимости от действия ниши. Схема дифференцировки МСК КМ с тех пор изменилась благодаря новым данным, а повсеместное распространение МСК связывается с их периваскулярной локализацией [10–13].
Что касается циркуляции МСК, то хотя их можно выделить из периферической крови, вопросы вызывает характер этого явления — временный или постоянный [14]. Показано многократное увеличение числа МСК в крови крыс в условиях гипоксического стресса [15]. В условиях in vitro гипоксия индуцирует про-лиферацию,миграцию и проангиогенный эффект МСК КМ,что отражает возможную роль МСК в микроокружении опухоли, для которого характерна пониженная концентрация кислорода [16, 17].
Фенотип МСК
Одним из ключевых вопросов литературы о МСК является вопрос о том,как данные,по-лученные in vitro, соотносятся с условиями in vivo. Фенотип МСК КМ неоднороден и изменяется в культуре, что не позволяет с уверенностью утверждать, что в организме эти клетки экспрессируют те же маркеры и с той же интенсивностью [18,19]. Набор антигенов, предложенный МОКТ для определения МСК,не является специфическим только для именно стволовых клеток, в эту же популяцию попадают и стромальные клетки. В связи с этим ведётся активный поиск других маркеров МСК, среди которых CD271 [20], SCA-1 (МСК антиген-1), Stro-1, молекулы интегри-нов CD49a, CD51, CD146 [21–25]. Однако эти маркеры также могут присутствовать на поверхности других клеток (Stro-1, к примеру, экспрессируют эритробласты [26]), поэтому более надёжным представляется использование их в комбинации с другими положительными и отрицательными маркерами панели, предложенной МОКТ в 2006 г.
Основная часть МСК КМ не окрашивается маркерами плюрипотентных клеток. Однако с использованием маркеров плюрипотентных клеток, в том числе SSEA-4, Oct4 и Nanog, все же было выделено несколько популяций МСК, обладающих свойствами плюрипотентности (способность давать производные всех зародышевых листков, то есть эктодермы, мезодермы и энтодермы): APC, IA I, use [27–29] и другие.
IA I (от marrow-isolated adult multilineage inducible cells, индуцибельные взрослые клетки костного мозга с мульти-линейным потенциалом) были получены при культивировании на фибронектине и в условиях пониженной концентрации кислорода. Для этих клеток характерна дифференцировка в нервные клетки (производные эктодермы)и панкреатические клетки (производные энтодермы) в соответствующих условиях [27].
use (multilineage differentiating stress enduring, устойчивые к стрессу с мультили-нейным потенциалом дифференцировки) — субпопуляция клеток, среди особенностей которых можно выделить устойчивость к стрессовым воздействиям,низкую скорость пролиферации и образование М-кластеров, подобных кластерам эмбриональных стволовых клеток. use были выделены как из аспирата КМ, так и из культур фибробластов кожи человека [28].
Субпопуляция APC (multipotent adult progenitor cells, мультипотентные взрослые прогениторные клетки)— это очень небольшая популяция в составе пула МСК, состоящая из быстро делящихся клеток,способных давать начало клеткам трёх зародышевых листков, в том числе при инъекциях в раннюю бластоцисту [29].
В отличие от описанных субпопуляций, обладающих свойствами плюрипотентных клеток, PC (mesodermal progenitors cells, мезодермальные прогениторные клетки) дают начало только производным мезодермы (мезенхимным и эндотелиальным клеткам), то есть обладают свойством мультипотент-ности. Клетки этой субпопуляции по некоторым данным экспрессировали Oct-4, Nanog, SSEA-4, а также обладали альдегиддегидроге-назной активностью, характерной для гематопоэтических предшественников,но не зрелых МСК). PC способны к дифференцировке в МСК и эндотелий,причём полученные МСК не могут быть обратно дифференцированы в PC [30].
Таким образом, в популяции МСК КМ содержатся клетки с признаками плюрипотентности, однако их количество крайне малое, поэтому, в целом, МСК КМ являются мульти-потентными клетками, не способными давать производные энтодермы и эктодермы. Что касается вышеописанных субпопуляций МСК КМ с маркерами плюрипотентности, разобщённость полученных данных не даёт возможности соотнести эти субпопуляции друг с другом или чётко обозначить их взаимосвязь в линии развития МСК.
Показано существование стволовых клеток с мезенхимным фенотипом, но другого эмбрионального происхождения: например, стволовые клетки нервного гребня [31,32]. Для части клеток нервного гребня показана миогенная дифференцировка, индуцированная определёнными условиями культивирования [33]. В настоящий момент её возможность in vivo остаётся сомнительной, к тому же ей противоречит тот факт,что миогенное и остеогенное направление дифференцировки разделяются ещё в эмбриогенезе [34]. Однако показано,что гингивиальные фибробласты (одна из разновидностей МСК) способны к дифференцировке в миогенные фибриллы [35]. На сегодняшний день существуют протоколы дифференцировки МСК как КМ, так и других органов, в другие типы клеток, включая кардиомиоциты [36,37], нейроны [38], гепатоциты [39], клетки поджелудочной железы [40]. Таким образом, МСК являются очень пластичными клетками,а направление их дифференцировки определяется локальной концентрацией специфических факторов.
Гетерогенность МСК КМ в зависимости от условий культивирования
Гетерогенность МСК КМ была описана достаточно рано. В работе 1981 года авторы описывали морфологическое различие МСК в культуре и выявили два типа клеток: клетки 1 типа имели фибробластоподобную мор-фологию,активно делились и давали начало клеткам 2 типа. Клетки 2 типа были крупными, плоскими и имели эпителиоподобную форму. 1 тип обозначили как быстро обновляющиеся клетки, а 2 — как зрелые МСК [41]. Гетерогенность культивированных МСК КМ связывается с множеством факторов, среди которых техника получения, плотность высевания, время культивирования, состав сред и сывороток, а также различия между донорами [42–45]. Именно способ получения МСК КМ,а не пол или возраст считается определяющим различия культур, так как показана неоднородность материала из двух аспиратов одного донора,взятых в один момент времени [46,47]. В работе по изучению способности к остеогенной дифференцировкt МСК КМ здоровых доноров способность формировать кость in vivo терялась уже на 1–3 пассажах у разных доноров, при этом активность щелочной фосфатазы,как маркера остеогенной дифференцировки, не изменялась значительно, зато была отмечена разница в скорости пролиферации [48].
Различие по таким базовым характери-стикам,как размер,потенциал к остеогенной дифференцировке, форма клеток, способность к адгезии,наблюдается не только между клетками одной культуры МСК, но и внутри колонии, состоящей из потомков одной клетки, то есть КОЕф (или клон) [49]. Owen, описывая КОЕф,выделяет клетки с высоким потенциалом к самообновлению и мультипо-тентной дифференцировке и клетки с ограничением этих характеристик [9]. В качестве причин такой внутриклональной гетерогенности в настоящее время указываются спонтанная дифференцировка [47], высокая плотность клеток в колонии [51], длина теломер [50], возможное возникновение мутаций [52]. Для колоний МСК может быть характерна обратимая дифференцировка в центральной области колонии, где в сравнении с периферическими клетки слабее экспрессируют гены регуляции клеточного цикла и активнее — внеклеточного матрикса [53]. Если изменчивость внутри культуры МСК КМ можно объяснить наличием различных субпопуляций из более и менее коммитированных предшественников, то причины внутриклональной изменчивости требуют дальнейшего изучения, в том числе в целях практического применения МСК. Для обхода стадии культивирования МСК в некоторых исследованиях используется метод флуоресцентного сортинга, недостатком которого можно считать гораздо меньшее количество получаемого материала, достаточное только для небольших экспериментальных работ [54, 55].
Различие МСК по способности к дифференцировке
По отношению к дифференцировке клоны МСК КМ могут быть трипотентными, бипо-тентными и унипотентными. Ранее обсуждалась линейная модель дифференцировки МСК КМ, в которой трипотентные клетки постепенно теряли способность к адипоген-ной и хондрогенной дифференцировке, превращаясь в остеопрогениторные клетки [10]. В другой работе, исследовавшей дифференцировку клонов МСК КМ, выявлялись иные бипотентные предшественники, кроме остео-хондрогенных, а также унипотентные хондрогенные и адипогенные клоны. Интересно, что при этом наиболее часто встречающимися клонами были трипотентные, остео-хондрогенные и остеогенные. Фракция трипотентных МСК КМ состояла из быстро делящихся клеток, активно экспрессирующих CD146. Самым редким типом ожидаемо оказался адипогенно-хондрогенный предшественник, что позволяет сделать выводы о влиянии локальной ниши, факторы которой определяют направление дифференцировки мультипотентного предшественника [11]. Однако описаны случаи длительного (более полугода) непрерывного культивирования без утраты способности к дифференцировке в трёх направлениях [56].
Происхождение и периваскулярный характер расположения МСК
По локализации в КМ МСК можно разделить на периваскулярные (большинство) и находящиеся в районе эндоста. Такое расположение при этом соответствует распределению CD146: высокий уровень экспрессии наблюдается в МСК вблизи сосудов, а низкий уровень или отсутствие экспрессии во второй группе клеток. Обе группы при этом объединяла экспрессия CD271 и контакт с CD34+ГСК [57]. Периваскулярное расположение МСК позволяет объяснить повсеместное расположение МСК в организме. Так как помимо МСК в контакте с сосудами находятся перициты и адвентициальные клетки, исследователей заинтересовал вопрос о взаимосвязи всех трёх типов клеток. Исходя из данных литературы, всю совокупность взглядов можно свести к нескольким предположениям: 1)
МСК — это перициты [58] 2) Перициты — это предшественники МСК [59] 2) МСК — это адвентициальные клетки [60, 61] 3) Адвентициальные клетки — это предшественники перицитов, а перициты это предшественники МСК [62] 4) МСК — это не перициты и не адвентициальные клетки, а отдельный тип клеток [7]. Ввиду наличия фактов, подтверждающих каждую из приведённых гипотез, можно предположить, что внутри МСК можно выделить достаточно пластичные субпопуляции, иерархия и взаимоотношения которых требуют дальнейшего прояснения.
В пользу идентичности МСК и перицитов или адвентициальных клеток говорит наличие общих маркеров и способность дифференцироваться при индукции в трёх направлениях. Адвентициальные клетки также экспрессируют CD271, CD146, способны к мультипотентной дифференцировке [60]. При добавлении в культуральную среду ан-гиопоэтина-2 в адвентициальных клетках усиливается экспрессия генов маркеров перицитов, что позволило предположить их дифференцировку в перициты [63].
Перициты так же, как и МСК, способны к дифференцировке в трёх направлениях, имели сходный иммунофенотипический профиль CD146+/CD34-/CD-45–/CD56– [64]. Перициты и МСК демонстрируют сходный характер экспрессии генов, отличающий их от фибробластов [65]. Тем не менее, некоторые авторы, использующие мышиные модели, отвергают тождественность МСК и перицитов из-за недостаточной пластичности послед-них:перициты сохраняют свои свойства даже при индукции дифференцировки [66]. Как маркер, отличающий перициты и МСК, был предложен десмин,который в КМ синтезируют гладко-мышечные клетки, но не МСК [62]. Интересным представляется вопрос о взаимосвязи перицитов и группы МСК, расположенных в эндосте и отличающихся от периваскулярной фракции.
Другое направление исследований, касаю-щихсяМСК,связаноспоискомраннегообщего предшественника мезенхимных и эндотелиальных клеток. В качестве таковых описаны мезоангиобласт из эмбриональной аорты и мезенхимоангиобласт, полученный с помощью эмбриональных стволовых клеток. Мезоангиобласты — это стволовые клетки, ассоциированные с сосудами, участвующие в постнатальном формировании тканей мезодермы [67]. Мезенхимоангиобласт в культуре образует мезенхимные клетки с промежуточной эндотелиальной стадией, причём при определённых условиях можно получить три направления дифференцировки: МСК, перициты и гладко-мышечные клетки (Рисунок 1) [68].
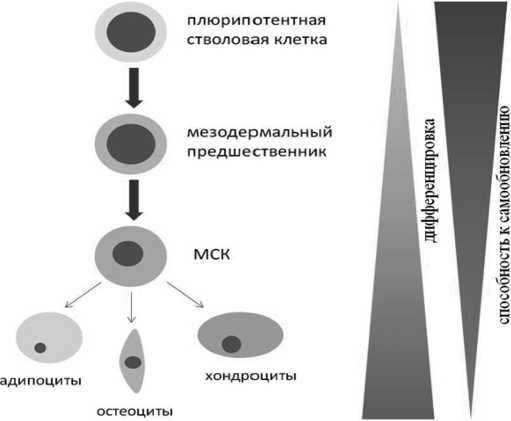
Рисунок 1. Схема дифференцировки МСК.
Исследования последних лет обращаются к идее ангиогенного происхождения МСК, что подтверждается удачными опытами дифференцировки МСК в эндотелиальные клетки и обнаружением маркеров эндотелия, таких как CD31, CD34, рецептор к фактору роста эндотелия сосудов (VEGF), фактор фон Виллебранда [7]. В то же время дифференцировка МСК в условиях культуры может не вызывать повышения экспрессии маркеров эндотелия, поэтому существование такого пути in vivo вызывает сомнения [56, 69].
В качестве источника части пула МСК рассматривается нейроэктодерма, так как МСК экспрессируют рецептор к фактору роста нейронов [70]. В настоящее время интенсивно изучаются стволовые клетки нервного гребня, приобретающие мезенхимный фенотип и участвующие в эмбриогенезе в формировании всех органов и тканей головы и шеи, а также участвующие в формировании миокарда [71].
Роль МСК в формировании опухолевого микроокружения
В настоящее время всё большее внимание уделяется вопросу о роли ниши костного мозга (КМ) в опухолеобразовании и развитии ранних рецидивов [72]. Если основной функцией МСК в здоровом КМ является поддержка гемопоэза,то при взаимодействии с раковыми клетками изменяется как фенотип,так и функции МСК — они начинают поддерживать рост опухоли и обеспечивают защиту от иммунной системы (Рисунок 2) [73–75].
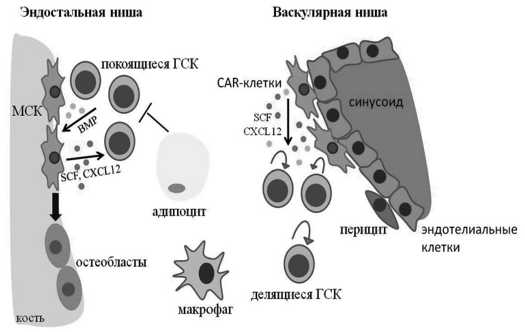
Рисунок 2. Схематическое строение гемопоэтической ниши костного мозга.
Например, при остром миелоидном лейкозе (ОМЛ) показано снижение экспрессии таких генов, как Cxcl12, Angptl1, необходимых в поддержке ГСК [76]. Сокультивирова-ние бластов от больных ОМЛ с МСК здоровых доноров повысило выживаемость бластных клеток в присутствии цитарабина, причём ключевуюроль вэтомигралипрямые контакты между клетками [77]. В культурах МСК КМ, полученных от больных множественной миеломой (ММ), наблюдался фенотип стареющих клеток, характеризующийся увеличением размера клеток,активным синтезом ассоциированной со старением β-галактозидазы, снижением способности к пролиферации и остеогенной дифференцировке [75, 78, 79]. Под действием опухолевых клеток МСК могут дифференцироваться в опухоль-ассоцииро-ванные фибробласты (ОАФ). МСК и ОАФ имеют сходный фенотип и набор синтезируемых цитокинов. Отличие ОАФ в резком повышении уровня синтеза таких молекул, как VEGF и интерлейкин-10, а также в экспрессии та- ких маркеров, как гладко-мышечный актин, десмин,рецептор к фактору роста тромбоцитов (PDGF) [80,81]. ОАФ также поддерживают рост опухоли,а их появление может быть признаком ухудшения прогноза лечения.
Взаимодействие МСК КМ с опухолью может осуществлятьсячерез прямые межклеточные контакты и посредством выделения цитокинов и экзосом,содержащих различные белки и РНК [82,83]. Считается, что, как и в случае нормального гемопоэза, при взаимодействии с раковыми клетками главной особенностью МСК КМ является синтез специфических цитокинов, преобразующих микроокружение и выделяемых под контролем раковых клеток [84,85]. Так, при ММ одним из ключевых факторов, индуцирующим рост опухоли, является интерлейкин-6 (ИЛ-6), который выделяется МСК КМ под действием фактора FGF-β, который в свою очередь синтезируют клетки ММ при контакте с ИЛ-6 [86].
Другими особенностями МСК КМ, благоприятными для развития опухоли, являются их проангиогенный эффект и иммуносупрессивные свойства, позволяющие раковым клеткам избегать реакций иммунной системы. МСК КМ оказывают влияние на пролиферацию Т и В-клеток, могут ингибировать активацию дендритных клеток [87]. Хотя для очага опухоли характерны условия гипоксии, в КМ при этом можно наблюдать повышенную васкуляризацию, кроме того, КМ считается привлекательным для заселения раковыми клетками в том числе в связи с большим количеством сосудов [88]. Для МСК КМ при этом характерно повышение уровня синтеза таких проангиогенных молекул, как VEGF, фактор роста фибробластов-β (FGF-β) и трансформирующий ростовой фактор-β (TGF-β). Плотность сосудов в очаге опухоли считается одним из прогностических факторов, определяющих исход лечения [89]. При ММ VEGF индуцирует повышение экспрессии в миеломных клетках нескольких протоонкогенов [90]. Поэтому существует необходимость в разработке препаратов, нацеленных на ограничение сосудообразования в опухоли. МСК КМ могут являться одной из мишеней подобного лечения [74].
МСК опухоли отличаются от здоровых доноров не только фенотипически, но и генетически. В работе по изучению генома МСК КМ больных ММ выявлялись участки с повышенной мутабельностью, где можно предпо- ложить наличие генов,важных в прогрессии заболевания. При этом мутации МСК необязательно идентичны таковым в опухолевых клетках [91]. Другой причиной гематологических заболеваний может быть экспрессия эндогенных ретровирусов, представляющих из себя не кодирующие последовательности генома и в норме молчащие [92,93]. Активация транскрипции таких областей показана при разных видах рака,в том числе лейкемии, где наблюдалось повышение экспрессии последовательности HERV-K [94].
МСК КМ могут играть роль на разных стадиях развития опухоли [95,96]. Концепция преметастатической ниши предполагает, что ниша специфически изменяется ещё до появления опухолевых клеток за счёт сигналов, попадающих в КМ [97,98]. На ранних стадиях возникновение и рост опухоли могут быть связаны с уже имеющимся нарушением гемопоэза или поддержкой мутантного клона,ко-торый может иметь некое конкурентное преимущество, причины которого пока неясны. Существует предположение,что в некоторых случаях возникновение опухоли может быть связано с дефектами в стромальных клетках, что показано в случае миелодиспластическо-го синдрома [99,96]. Так как популяцию МСК КМ можно считать относительно стабильной по локализации, в отличие от гемопоэтических предшественников, возможно формирование колоний МСК, несущих мутации, в определённом участке КМ, где они будут поддерживать рост мутантного гемопоэтического клона [100].
Исcледования взаимодействий опухолевых клеток и их стромального окружения в КМ необходимо для разработки новых методов лечения и преодоления резистентности, причины которой зачастую неясны. Име- ющиеся на данный момент формы терапии опухолей, локализованных в КМ, могут иметь эффект на раковые клетки, но не на клетки микроокружения, которое остаётся изменённым даже после проведённого лечения, что может приводить к ранним рецидивам [79]. В литературе рассматривается такой способ лечения заболеваний в КМ,при котором МСК используются как вектор для доставки растворимых факторов в микроокружение опухоли. Это связано с миграцией МСК в области воспаления согласно градиенту специфических хемокинов, например VEGF, интерлейкин-8, PDGF и других [101,82].
Заключение. Таким образом, МСК КМ представляют собой гетерогенную популяцию клеток, в составе которой есть как небольшое число плюрипотентных клеток,так и частично коммитированные предшественники. Основным направлением дифференцировки МСК КМ является остеогенное,однако при определённых культуральных условиях МСК демонстрируют высокий уровень пластичности, дифференцируясь в другие типы клеток,что является перспективным направлением регенеративной терапии. Гетерогенность МСК КМ при культивировании требует более детального изучения их фенотипа и происхождения, в том числе и для разработки новых методов регенеративной терапии. МСК КМ играют важную роль в патогенезе различных гемопоэтических заболеваний, являясь частью опухолевого микроокружения, черты которого могут сохраняться и после проведённой терапии. Дальнейшее изучение МСК КМ как части стромы,поддерживающей развитие опухоли,необходимо для разработки методов лечения и предотвращения развития ранних рецидивов и резистентности к лечению.
Список литературы Мезенхимные стромальные клетки костного мозга и их роль в формировании опухолевой ниши при онкогематологических заболеваниях
- Friedenstein A., Chailakhjan R., Lalykina K. The development of fibroblast colonies in monolayer cultures of guinea-pig bone marrow and spleen cells // Cell Tissue Kinet.— 1970.— Vol. 3, N4.— P. 393-403.
- Caplan A. Mesenchymal stem cells // J. Orthop. Res.— 1991.—Vol. 9, N5.— P. 641-650.
- Horwitz E. M., Le Blanc K., Dominici M. et al. Clarification of the nomenclature for MSC: The International Society for Cellular Therapy position statement // Cytotherapy.— 2005.— Vo.7, N5.— P. 393-395.
- Dominici M., Le Blanc K., Mueller I. et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement// Cytotherapy.— 2006.— Vol. 8, N4.—P. 315-317.
- Galderisi U., GiordanoA. The gap between the physiological and therapeutic roles of mesenchymal stem cells // Medicinal Research Reviews.— 2014.—Vol. 34, N5.—P. 1100-1126.
- da Silva Meirelles L., Chagastelles P. C., Nardi B. Mesenchymal stem cells reside in virtually all postnatal organs and tissues // J. Cell Sci.— 2006.— Vol. 119, N11.— P. 2204-2211
- Pacini S., Petrini I. Are MSCs angiogenic cells? New insights on human nestin-positive bone marrow-derived multipotent cells // Front. Cell Dev. Biol.— 2014.—Vol. 2.— 11 p.
- Al-Nbaheen M., Vishnubalaji R., Ali D. et al. Human stromal (mesenchymal) stem cells from bone marrow, adipose tissue and skin exhibit differences in molecular phenotype and differentiation potential // Stem Cell Rev.— 2013.— Vol. 9.— P. 32-43.
- Owen M. Marrow stromal stem cells // Journal of Cell Science — 1988.— Suppl. 10.— P. 63-76.
- MuragliaA., Cancedda R., Quarto R. Clonal mesenchymal progenitors from human bone marrow differentiate in vitro according to a hierarchical model // J. Cell Sci.— 2000.—Vol. 113 — P. 1161-1166.
- Russell K. C., PhinneyD. G., Barrilleaux B. L. et al. In Vitro High-Capacity Assay to Quantify the Clonal Heterogeneity in Trilineage Potential of Mesenchymal Stem Cells Reveals a Complex Hierarchy of Lineage Commitment // Stem Cells.— 2010.—Vol. 28.— P. 788-798.
- BakshD., SongL., Tuan R. S. Adult mesenchymal stem cells: characterization, differentiation, and application in cell and gene therapy // J. Cell. Mol. Med.— 2004.—Vol. 8, N3.— P. 301-316.
- Bianco P., Robey P. G., Saggio I., Riminucci M. "Mesenchymal" Stem Cells in Human Bone Marrow (Skeletal Stem Cells): A Critical Discussion of Their Nature, Identity, and Significance in Incurable Skeletal Disease // Hum. Gene Ther.— 2010.— Vol. 21, N9.— P. 1057-1066.
- Xe Q, Wan C, Li G. Concise review: Multipotent Mesenchymal Stromal Cells in Blood // Stem Cells.— 2007.— Vol. 25.— P. 69-77.
- Bonnet P., Delorme B., Lopez A. et al. Multipotential Mesenchymal Stem Cells Are Mobilized into Peripheral Blood by Hypoxia // Stem Cells.— 2006.—Vol. 24, N10.— P. 2202-2208.
- БуравковаЛ. Б., КапланскийА. С., Андреева Е. Р. и др. Особенности формирования костной мозоли у крыс после введения в область перелома мультипотентных мезенхимальных стромальных клеток, культивированных при различном содержании кислорода // Клеточная трансплантология и тканевая инженерия.— 2009.—Т. IV, № 3.— С. 52-56.
- Rankin E.B., NarlaA., Park J. K., Lin S. et al. Biology of the Bone Marrow Microenvironment and Myelodysplastic Syndromes // Mol. Genet. Metab.— 2015.—Vol. 116, N1-2.— P. 24-28.
- Pal B., Das B. In vitro Culture of Naive Human Bone Marrow Mesenchymal Stem Cells: A Stemness Based Approach // Front. Cell Dev.— 2017.—Vol. 5.— 19 p.
- Айзенштадт А. А., Енукашвили Н. И., ЗолинаТ. Л. и др. Сравнение пролиферативной активности и фенотипа МСК, полученных из костного мозга, жировой ткани и пупочного канатика // Вестник Северо-Западного государственного медицинского университета им. И.И. Мечникова.— 2015.— Т. 7, № 2.—С. 14-22.
- KufiS., KufiZ., KreyenbergH. et al. CD271 antigen defines a subset of multipotent stromal cells with immunosuppressive and lymphohematopoietic engraftment-promoting properties // Haematologica.— 2010.— Vol. 95, N4.— P. 651-659.
- Simmons P.J., Torokstorb B. Identification of stromal cell precursors in human bone-marrow by a novel monoclonal-antibody, Stro-1 // Blood.— 1991.—Vol.78, N1.—P. 55-62.
- Sobiesiak M., Sivasubramaniyan K., Hermann C. et al. The mesenchymal stem cell antigen MSCA-1 is identical to tissue non-specific alkaline phosphatase // Stem Cells Dev.— 2010.—Vol. 19, N5.— P. 669-677.
- Deschaseaux F., Gindraux F., Saadi R. et al. Direct selection of human bone marrow mesenchymal stem cells using an anti-CD49a antibody reveals their CD45med, low phenotype // Br. J. Haematol.— 2003.—Vol. 122, N3.—P. 506-517.
- Pinho S., LacombeJ., Hanoun M. et al. PDGFR alpha and CD51 mark human Nestin+ sphere-forming mesenchymal stem cells capable of hematopoietic progenitor cell expansion //J. Exp. Med.— 2013.— Vol. 210, N7.—P. 1351-1367.
- Tormin A., Li O., Brune J. C. et al. CD146 expression on primary nonhematopoietic bone marrow stem cells is correlated with in situ localization // Blood.— 2011.—Vol. 117, N19.— P. 5067-5077.
- Jones E., Schäfer R. Where is the common ground between bone marrow mesenchymal stem/stromal cells from different donors and species? // Stem Cell Res. Ther.— 2015.— Vol. 6, N1.— 143 p.
- D'Ippolito G., Diabira S., Howard G. A., Menei P., Roos B. A., Schiller P. C. Marrow-isolated adult multilineage inducible (MIAMI) cells, a unique population of postnatal young and old human cells with extensive expansion and differentiation potential // J. Cell Sci.— 2004.—Vol. 117, N14.— P. 2971-81.
- KurodaY., Kitada M., Wakao S. et al. Unique multipotent cells in adult human mesenchymal cell populations // Proc. Natl. Acad. Sci. USA.— 2010.—Vol. 107, N19.— P. 8639-8643.
- JiangY., Jahagirdar B. N., Reinhardt R. L., et al. Pluripotency of mesenchymal stem cells derived from adult marrow // Nature.— 2002.—Vol.418.—P. 41-49.
- Petrini M., Pacini S., Trombi L., et al. Identification and purification of mesodermal progenitor cells from human adult bone marrow // Stem Cells Develop.— 2009.—Vol. 18, N6.—P. 857-866.
- IsernJ., Garcia-Garcia A., MartinA. M. et al. The neural crest is a source of mesenchymal stem cells with specialized hematopoietic stem cell niche function // Elife. — 2014.—Vol.3.— e03696.
- Morikawa S., MabuchiY., Niibe K. et al. Development of mesenchymal stem cells partially originate from the neural crest // Biochem. Biophys. Res. Commun.— 2009.— Vol. 379, N4.— P. 1114-1119.
- Bani-Yaghoub M., KendallS. E., Moore D. P. et al. Insulin acts as a myogenic differentiation signal for neural stem cells with multilineage differentiation potential // Development.— 2004.—Vol. 131, N17.— P. 4287-4298.
- Bianco P., Robey P. G., Saggio I., Riminucci M. "Mesenchymal" Stem Cells in Human Bone Marrow (Skeletal Stem Cells): A Critical Discussion of Their Nature, Identity, and Significance in Incurable Skeletal Disease // Hum. Gene Ther.— 2010.—Vol. 21, N9.— P. 1057-1066.
- ZorinV. L., PulinA.A., Eremin 1.1. et al. Myogenic potential of human alveolar mucosa derived cells // Cell Cycle.— 2017.—Vol. 16, N6.—P. 545-555.
- Szaraz P., GratchY. S., Iqbal F., Librach C. L. In vitro differentiation of human mesenchymal stem cells into functional cardiomyocyte-like Cells // J. Visual Exp. JoVE.— 2017.—Vol. 126.— e55757.
- Qian Q, Qian H, ZhangX, et al. 5-azacytidine induces cardiac differentiation of human umbilical cord-derived mesenchymal stem cells by activating extracellular regulated kinase // Stem Cells Dev.— 2012.— Vol. 21, N1.—P. 67-75.
- Sanchez-Ramos J. R. Neural cells derived from adult bone marrow and umbilical cord blood // J. Neurosci. Res.— 2002.—Vol. 69, N6.— P. 880-893.
- Shu S. N., Wei L., WangJ. H. et al. Hepatic differentiation capability ofrat bone marrow-derived mesenchymal stem cells and hematopoietic stem cells // World J. Gastroenterol.— 2004.—Vol. 10, N19 — P. 2818-2822.
- Chen L. B., Jiang X. B., Yang L. Differentiation of rat marrow mesenchymal stem cells into pancreatic islet beta-cells // WorldJ. Gastroenterol.— 2004.—Vol. 10, N20.— P. 3016-3020.
- Mets T, VerdonkG.In vitro aging of human bone marrow derived stromal cells // Mech. Ageing Dev.— 1981.— Vol. 16, N1.— P. 81-89.
- Sivasubramaniyan K, Ilas DC, Harichandan A, et al. Bone marrow-harvesting technique influences functional heterogeneity of mesenchymal stem/stromal cells and cartilage regeneration // Am. J. Sports Med.— 2018.— Vol. 46, N14.— P. 3521-3531.
- Siegel G., Kluba T., Hermanutz-Klein U. et al. Phenotype, donor age and gender affect function of human bone marrow-derived mesenchymal stromal cells // BMC Med.— 2013.—Vol. 11.— 146 p.
- Siddappa R., Licht R., van Blitterswijk C. et al. Donor variation and loss of multipotency during in vitro expansion of human mesenchymal stem cells for bone tissue engineering // J. Orthop. Res.— 2007.— Vol. 25, N8.—P. 1029-1041.
- Bara J. J., Richards R. G., Alini M., Stoddart M. J. Concise review: Bone marrow-derived mesenchymal stem cells change phenotype following in vitro culture: Implications for basic research and the clinic // Stem cells.— 2014.— Vol. 32, N7.— P. 1713-1723.
- Sakaguchi Y., Sekiya I., Yagishita K. et al. Suspended cells from trabecular bone by collagenase digestion become virtually identical to mesenchymal stem cells obtained from marrow aspirates // Blood.— 2004.— Vol. 104, N9.— P. 2728-2735.
- DiGirolamo C.M., Stokes D., Colter D. et al. Propagation and senescence of human marrow stromal cells in culture: a simple colony-forming assay identifies samples with the greatest potential to propagate and differentiate // Br. J. Haematol.— 1999.—Vol. 107, N2.—P. 275-281.
- Agata H., Asahina I., Watanabe N. et al. Characteristic change and loss of in vivo osteogenic abilities of human bone marrow stromal cells during passage // Tissue Eng. PartA.— 2010.—Vol. 16, N2.— P. 663-673.
- Rennerfeldt D. A., Van Vliet K. J. Concise Review: When colonies are not clones: evidence and implications of intracolony heterogeneity in mesenchymal stem cells // Stem Cells.— 2016.—Vol. 34, N5.— P. 1135-1141.
- Baxter M.A., Wynn R. F., Jowitt Sn. et al. Study of telomere length reveals rapid aging of human marrow stromal cells following in vitro expansion // Stem Cells.— 2004.— Vol. 22, N5.— P. 675-682.
- Neuhuber B., Swanger S.A., Howard L. et al. Effects of plating density and culture time on bone marrow stromal cell characteristics // Exp. Hematol.— 2008.—Vol. 36, N9.— P. 1176-1185.
- Estrada J., Torres Y., Benguria A. et al. Human mesenchymal stem cell-replicative senescence and oxidative stress are closely linked to aneuploidy // Cell Death Dis.— 2013.—Vol. 4.— e691.
- YlostaloJ., BazhanovN., Prockop D. J. Reversible commitment to differentiation by human multipotent stromal cells in single cell-derived colonies // Exp. Hematol.— 2008.—Vol. 36, N10.— P. 1390-1402.
- Jones E. A., KinseyA. E., EngishA. et al. Isolation and characterization of bone marrow multipotential mesenchymal progenitor cells // Arthritis & Rheumatism.— 2002.—Vol. 46, N12.— P. 3349-3360.
- LiuL., CheungT.H., CharvilleG.W., RandoT. A.Isolation of skeletal muscle stem cells by Fluorescence-Activated Cell Sorting // Nat. Protoc.— 2015.—Vol. 10, N10.—P. 1612-1624.
- АйзенштадтА.А., СказинаМ.А., КотелевскаяЕ.А. и др. Характеристики мезенхимных стромаль-ных клеток пупочного канатика человека при длительном культивировании in vitro // // Вестник Северо-Западного государственного медицинского университета им. И.И. Мечникова.— 2015.— Т. 10, №1.—С. 11-19.
- Tormin A., Li O., Brune J. C. et al. CD146 expression on primary nonhematopoietic bone marrow stem cells is correlated with in situ localization // Blood.— 2011.—Vol. 117, N19.— P. 5067-5077.
- PéaultB.Are mural cells guardians of stemness? from pluri- to multipotency via vascular pericytes // Circulation.— 2012.—Vol. 125, N1.—P. 12-13.
- Caplan A. I. New MSC: MSCs as pericytes are sentinels and gatekeepers // J. Orthop. Res.— 2017.—Vol. 35, N6.—P. 1151-1159.
- Sacchetti B., FunariA., Michienzi S. et al. Self-renewing osteoprogenitors in bone marrow sinusoids can organize a hematopoietic microenvironment // Cell.— 2007.—Vol. 131, N2.— P. 324-336.
- Jones E., McGonagle D. Human bone marrow mesenchymal stem cells in vivo // Rheumatology.— 2008.— Vol. 47, N2.—P. 126-131.
- de Souza L. E., Malta T. M., Kashima Haddad S., Covas D. T. Mesenchymal stem cells and pericytes: to what extent are they related? // Stem cells Dev.— 2016.—Vol. 25, N24.— P. 1843-1852.
- Corselli M., Chen C. W., Sun B., Yap S. et al. The tunica adventitia of human arteries and veins as a source of mesenchymal stem cells // Stem Cells Dev.— 2012.—Vol. 21, N8.— P. 1299-1308.
- Crisan M., Yap S., Casteilla L. A perivascular origin for mesenchymal stem cells in multiple human organs // Cell Stem Cell.— 2008.—Vol. 3, N3.— 301 p.
- Covas D. T., Panepucci R.A., Aparecida M. Fontes AM, et al. Multipotent mesenchymal stromal cells obtained from diverse human tissues share functional properties and gene-expression profile with CD146+ perivascular cells and fibroblasts // Experimental Hematology.— 2008.— Vol. 36, N5.— P. 642-654.
- Guimaräes-Camboa N., Cattaneo P., Sun Y et al. Pericytes of multiple organs do not behave as mesenchymal stem cells in vivo // Cell Stem Cell.— 2017.— Vol. 20, N3.— P. 345-359.
- Minasi M. G., Riminucci M., De Angelis L. et al. The meso-angioblast: a multipotent, self-renewing cell that originates from the dorsal aorta and differentiates into most mesodermal tissues // Development.— 2002.— Vol. 129, N11.— P. 2773-2783.
- Slukvin 1.1., Kumar A. The mesenchymoangioblast, mesodermal precursor for mesenchymal and endothelial cells // Cell Mol. Life Sci.— 2018.
- Fan W., Crawford R., Xiao Y. The ratio of VEGF/PEDF expression in bone marrow mesenchymal stem cells regulates neovascularization // Differentiation.— 2011.—Vol. 81, N3.— P. 181-191.
- Quirici N., Soligo D., Bossolasco P. et al. Isolation of bone marrow mesenchymal stem cells by anti-nerve growth factor receptor antibodies // Exp. Hematol.— 2002.—Vol. 30, N7.— P. 783-791.
- TakashimaY., EraT., Nakao K. et al. Neuroepithelial cells supply an initial transient wave of MSC differentiation // Cell.— 2007.—Vol. 129, N7.— P. 1377-1388.
- Семенова Н. Ю., Бессмельцев С. С., Ругаль В. И. Биология ниши гемопоэтических стволовых клеток // Клиническая онкогематология. Фундаментальные исследования и клиническая практика.— 2014.— Т. 7, № 4.— С. 501-510.
- Kudo-Saito C. Cancer associated mesenchymal stem cells aggravate tumor progression // Front. Cell Dev. Biol.— 2015.—Vol. 3.— 23 p.
- Xu S., De Veirman K., De Becker A. et al. Mesenchymal stem cells in multiple myeloma: a therapeutical tool or target? // Leukemia.— 2018.—Vol. 32, N7.—P. 1500-1514.
- André T., Meuleman N., Stamatopoulos B. et al. (2013) Evidences of early senescence in multiple myeloma bone marrow mesenchymal stromal cells // PLoS ONE.— 2013.— Vol. 8, N3.— e59756.
- Xiao P., Heshmati Y., Bouderlique T. et al. Mesenchymal stromal cells, instigator or suppressor for the development of MLL-AF9 induced acute myeloid leukemia? // Blood.— 2016.—Vol. 2, N12.— P. 1488-1488.
- Ito S., BarrettA.J., DutraA. et al. Long term maintenance of myeloid leukemic stem cells cultured with unrelated human mesenchymal stromal cells // Stem Cell Res.— 2015.—Vol.14, N1.— P. 95-104.
- ЧубарьА. В., Семенова Н. Ю., Ругаль В. И. и др. Изменение морфо-функциональных характеристик мезенхимных стромальных клеток костного мозга у больных множественной миеломой // Сборик материалов всероссийской конференции «StemCellBio-2018: фундаментальная наука как основа клеточных технологий».— С. 113-114.— Тезисы устного доклада.
- Ругаль В. И., Бессмельцев С. С., Семенова Н. Ю. и др. Характеристика микроокружения костного мозга при множественной миеломе до и после терапии // Сибирский научный медицинский журнал.— 2019 —Т. 39, № 1.— С. 112-118.
- Paunescu V., Bojin F. M., Tatu C. A. et al. Tumour-associated fibroblasts and mesenchymal stem cells: more similarities than differences // J. Cell Mol. Med.— 2011.—Vol. 15, N3.—P. 635-646.
- Shiga K., Hara M., Nagasaki T. et al. Cancer-Associated Fibroblasts: Their Characteristics and Their Roles in Tumor Growth // Cancers.— 2015.—Vol. 7, N4.—P. 2443-2458.
- Khan M., Adil SER., Olson A. L. The role of mesenchymal stem cells in oncology and regenerative medicine // Future Oncol.— 2017.— Vol. 13, N9.— P. 821-831.
- Laurenzana I., LamorteD., TrinoS. et al. Extracellular Vesicles: A New Prospective in Crosstalk between Microenvironment and Stem Cells in Hematological Malignancies // Stem Cells Int.—2018.—Vol. 2018.— ID9863194.
- Sun Z., Wang S., Zhao R. C. The roles of mesenchymal stem cells in tumor inflammatory microenvironment // Journal of Hematology & Oncology.— 2014.— Vol. 7.— 14 p.
- Reagan M. R., Rosen C. J. Navigating the bone marrow niche: translational insights and cancer-driven dysfunction // Nat. Rev. Rheumatol.— 2016.—Vol. 12, N3.—P. 154-168.
- Bisping G., Leo R., Wenning D. et al. Paracrine interactions ofbasic fibroblast growth factor and interleukin-6 in multiple myeloma // Blood.— 2003.—Vol. 101, N7.— P. 2775-2783.
- Han Z., JingY., Zhang S. et al. The role of immunosuppression of mesenchymal stem cells in tissue repair and tumor growth // Cell Biosci.— 2012.— Vol.2.— 8 p.
- Dong X., Han Z. C., Yang R. Angiogenesis and antiangiogenic therapy in hematologic malignancies // Critical Reviews in Oncology/Hematology.— 2007.—Vol. 62.—P. 105-118.
- Pruneri G., Ponzoni M., Ferreri A. J.M. et al. Microvessel density, a surrogate marker of angiogenesis, is significantly related to survival in multiple myeloma patients // British Journal of Haematology.— 2002.— Vol. 118, N3.—P. 817-820.
- Palumbo A. P., Pileri A., Dianzani U. et al. Altered expression of growth-regulated protooncogenes in human malignant plasma cells // Cancer Res.— 1989.—Vol. 49, N17.—P. 4701-4704.
- Garayoa M., Garcia J. L., SantamariaC. et al. Mesenchymal stem cells from multiple myeloma patients display distinct genomic profile as compared with those from normal donors // Leukemia.— 2009.—Vol. 23, N8.—P. 1515-1527.
- IwabuchiH., KakiharaT., KobayashiT. et al. A Gene Homologous to human endogenous retrovirus overexpressed in childhood acute lymphoblastic leukemia // Leukemia & Lymphoma.— 2004.—Vol. 45, N11.—P. 2303-2306.
- Patzke S., Lindeskog M., Munthe E., Aasheim H. C. Characterization of a novel human endogenous retrovirus, HERV-H/F, Expressed in Human Leukemia Cell Lines // Virology.— 2002.— Vol. 303, N1.— P. 164-173.
- Depil S., Roche C., Dussart P., Prin L. Expression of a human endogenous retrovirus, HERV-K, in the blood cells of leukemia patients // Leukemia.— 2002.—Vol. 16, N2.— P. 254-259.
- Bergfeld S. A., DeClerck Y. A. Bone marrow-derived mesenchymal stem cells and the tumor microenvironment // Cancer Metastasis Rev.— 2010.— Vol. 29, N2.— P. 249-261.
- Aanei C. M., Catafal L. C. Evaluation of bone marrow microenvironment could change how myelodysplastic syndromes are diagnosed and treated // CytometryA.— 2018.—Vol. 93, N9.— P. 916-928.
- ManierS., SaccoA., LeleuX., GhobrialI.M. et al. Bone marrow microenvironment in multiple myeloma progression // J. Biomed. Biotechnol.— 2012.— 157496 p.
- SceneayJ., Mark J. Smyth M. J., MollerA. The pre-metastatic niche: finding common ground // Cancer Metastasis Rev.— 2013.—Vol. 32, N3-4.—P. 449-464.
- Raaijmakers M. H.G.P., Mukherjee S., Guo S. et al. Bone progenitor disfunction induces myelodysplasia and secondary leukaemia // Nature.— 2010.— Vol. 464.— P. 852-857.
- Hoggatt J., KfouryY., Scadden D. T. Hematopoietic stem cell niche in health and disease // Annu Rev. Pathol.— 2016.— Vol. 11.— P. 555-581.
- Tehrani R. M., Verdi J., Noureddini M. et al. Mesenchymal stem cells: A new platform for targeting suicide genes in cancer // J. Cell Physiol.— 2018.—Vol. 233.— P. 3831-3845.


