Миниинвазивные методы лечения дискогенной боли и фасеточного синдрома в поясничном отделе позвоночника: обзор литературы и собственный опыт
Автор: Яриков Антон Викторович, Денисов Антон Андреевич, Докиш Михаил Юрьевич, Перльмуттер Ольга Александровна, Бояршинов Алексей Андреевич, Павлинов Сергей Евгеньевич, Липатов Кирилл Сергеевич
Журнал: Клиническая практика @clinpractice
Рубрика: Обзоры
Статья в выпуске: 3 т.10, 2019 года.
Бесплатный доступ
В статье представлены современные методы лечения фасеточного синдрома - химическая денервация, радиочастотная абляция, интраартикулярное введение препаратов в межпозвонковые суставы. Анализируются современные методы устранения дискорадикулярного конфликта, такие как химическая денервация диска, хемонуклеолиз, механическая декомпрессия, интрадисковая электротермальная терапия, лазерная нуклеотомия, гидродискэктомия, нуклеопластика, лазерная реконструкция диска. Дано патогенетическое обоснование вышеперечисленных методик и описаны положительные и отрицательные стороны каждой из них. В работе представлены также собственные результаты клинических наблюдений.
Спондилоартроз, нуклеопластика, гидродискэктомия, радиочастотная нейротомия, хемонуклеолиз
Короткий адрес: https://sciup.org/143169547
IDR: 143169547 | DOI: 10.17816/clinpract10361-71
Текст научной статьи Миниинвазивные методы лечения дискогенной боли и фасеточного синдрома в поясничном отделе позвоночника: обзор литературы и собственный опыт
Хроническая боль в поясничном отделе позвоночника является одной из основных причин инвалидизации населения в развитых странах. Экономические потери при лечении лиц с болью в области поясничного отдела позвоночника в развитых государствах достигают колоссальных раз- меров и выходят на лидирующее место среди заболеваний населения трудоспособного возраста [1–3]. По некоторым оценкам, только один болевой синдром в зигапофизарном, или фасеточном, суставе, обусловленный проявлениями остеоартрита и патогенетически представленный ноцицептивной стимуляцией в синовиальной мембране или фиброзной капсуле дугоотросчатого сустава (ДОС), составляет до 30% случаев хронической боли в поясничном отделе позвоночника [2, 4]. В случае если болевой синдром, опосредованный ДОС, не отвечает на консервативное лечение пероральными нестероидными противовоспалительными препаратами, физиопроцедурами и постуральным переобучением, могут быть назначены миниинва-зивные методы лечения. В настоящее время доступны три нехирургических абляционных метода, которые потенциально могут обеспечить относительно длительное облегчение боли: это использование нейролитических агентов (спирт, фенол и др.) или повреждение нерва в зоне ДОС путем воздействия сверххолодной (криоанальгезия) или высокой температуры с целью достижения желаемого эффекта.
Другим источником болей являются симптоматически проявляемые грыжи межпозвонковых дисков (МПД). Согласно результатам ряда исследований, многие специалисты отмечают неудовлетворенность итогами консервативного лечения грыж МПД [2, 4]. Этим же интерпретируется расширение показаний к оперативному лечению и совершенствование его миниинвазивных методик [2, 3, 5, 6]. При небольшом размере грыж МПД или протрузиях, а также при их комбинации с признаками спондилоартроза поясничного отдела позвоночника продуктивность открытых оперативных вмешательств ниже, чем при секвестрах больших размеров [1, 5, 7].
До настоящего момента этиотропного лечения, способного приостановить дегенерацию структур позвоночника, не разработано, поэтому ведущая роль отводится методам патогенетической и симптоматической терапии [8]. Задачей хирургического лечения больных с патологией МПД является устранение механического фактора патологии, т.е. ликвидация дискорадикулярного конфликта [7, 9, 10]. Все открытые нейрохирургические вмешательства для лечения грыж МПД, в том числе с использованием эндоскопической и микрохирургической техники, имеет ряд недостатков: применение общей анестезии; формирование рубцово-спаечного процесса в зоне операционного вмешательства; объем кровопотери; риск повреждения твердой мозговой оболочки, невральных структур, артериальных и венозных сосудов; развитие инфекционных осложнений; риск развития постмикро-дискэктомического фасет-синдрома [9, 11–14]. Воздействие нейрохирурга при минимально инвазивном вмешательстве на позвоночнике может быть направлено на различные морфологические субстраты, в том числе собственно МПД, грыжевой дисковый секвестр, область позвоночного канала, включая дугоотросчатый сустав и связочный аппарат [7]. Новые методики отличаются минимальной травматизацией тканей и относительно коротким периодом выздоровления [11, 15, 16].
Таким образом, разнообразные комбинации клинических проявлений, патоморфологических изменений, а также возможных способов хирургического воздействия создают сложную тактическую задачу выбора адекватного хирургического вмешательства, которую постоянно приходится решать в клинической практике [17].
МИНИМАЛЬНО ИНВАЗИВНЫЕ
МЕТОДЫ ЛЕЧЕНИЯ АРТРОЗА ДУГООТРОСЧАТОГО СУСТАВА Химическая нейротомия (денервация)
Несмотря на то что в широких медицинских кругах химическая денервация не рекомендуется в качестве рутинного лечения хронической боли, нейрохирурги сталкиваются с дилеммой, когда речь заходит о повторных вмешательствах при рецидивирующем болевом синдроме в грудном и поясничном отделах после ранее успешной термической радиочастотной абляции (radio frequency ablation, RFA) медиальной ветви. Так, применение химической денервации раствором спирта при нейротомии медиальной ветви в ряде исследований обеспечило более длительный период обезболивания, а также более значимое улучшение качества жизни, чем повторная RFA, в грудном и поясничном отделах без существенных осложнений в течение 24-месячного периода наблюдения [5, 18]. Таким образом, вероятными показаниями на применение
сп и н ическая ■ 2019 п эакти keu Том 10 №3
химической денервации могут быть рецидивирующие боли, не купируемые методом RFA.
Техника выполнения . Нейротомию ДОС производят смесью спиртового раствора и местного анестетика только в случае удачного воспроизведения болей 4%-ным раствором бикарбоната натрия [19]. Манипуляцию выполняют под рентгеноконтролем [20]. Объем раствора, инъецируемого одномоментно в область заинтересованного ДОС, составляет 0,1–0,5 мл и подбирается в зависимости от анатомических особенностей, обнаруженных при помощи инструментальных методов обследования. Для стойкой нейротомии ДОС требуется не менее 3–4 введений препарата, до того пока окончательное введение не станет абсолютно безболезненным, что будет свидетельствовать о наступившем разрушении («химической перерезке») нерва в зоне ДОС [21–23].
RFA
RFA — техника, использующая тепловую энергию для прерывания болевых импульсов в спинномозговых нервах, — является наиболее предпочтительной процедурой в лечении хронической боли в различных отделах позвоночника [24]. Преимущества RFA заключаются в длительном облегчении боли, относительно более точной нейротомии нерва Люшка, а также способности произвести стимуляцию нервных окончаний перед нанесением ожога. RFA ДОС преследует задачу снизить локальную боль, уменьшить выраженность мышечно-тонического синдрома [25]. Нейротомия с использованием электромагнитного поля высокой частоты, в отличие от медикаментозных блокад области МПД, осуществляет более длительный и устойчивый эффект и в то же время обратимо денервирует капсулу ДОС [1, 26–28]. Так, согласно результатам ранее проведенных систематических анализов по определению эффективности данной методики при лечении болевого синдрома ДОС и крестцово-подвздошных сочленений, RFA значительно уменьшала степень проявления боли на ранних сроках наблюдения [8, 9, 29]. В настоящее время в научной литературе появляются доказательства пролонгированной эффективности данного метода при лечении артроза ДОС. Так, в исследовании Z. McCormick и соавт. у 62 пациентов были обнаружены значительные улучшения функций позвоночно-двигательного сегмента, уменьшение болевой чувствительности на сроке наблюдения от 12 до 24 мес после RFA [11, 30].
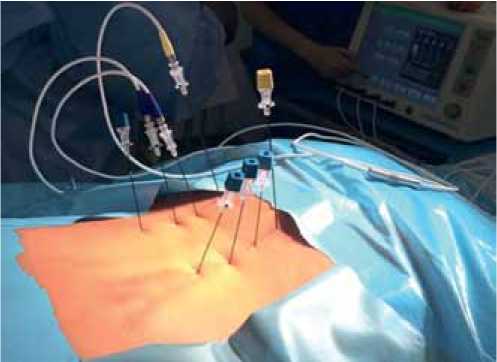
Рис. 1. Установка игл-направителей для RFA
Техника выполнения . RFA выполняют с помощью электрода с неизолированным концевым отделом, который устанавливают в ткань, подлежащую деструкции (рис. 1).
Высокочастотный ток, проходящий через неизолированную часть электрода, из-за сопротивления окружающих мягких тканей прогревает и повреждает их, производит коагуляцию втянутого в патологический процесс нерва Люшка и его окончаний [12, 13, 31, 32]. Электрод, располагающийся в игле, постоянно фиксирует температуру нагрева разрушаемой ткани и передает сведения на радиочастотный генератор [28, 33], который в свою очередь благодаря системе контроля не дает возможность температуре превысить заданную величину. Таким образом, нейрохирург осуществляет контроль за манипуляцией, гарантированной от неожиданных сбоев [24]. При этом практически на всех имеющихся устройствах есть возможность использования пульсовой генерации импульсов, что, по данным литературы, дает схожие результаты и отличается от техники с постоянной передачей импульса [7]. Метод высокопродуктивен, и у 60–80% пациентов позволяет добиться положительных результатов [14, 30, 31, 34].
Интраартикулярное введение препаратов в полость дугоотросчатого сустава
В последние годы одним из методов лечения спондилоартрозов является внутрисуставное введение препаратов гиалуроновой кислоты, глюкокортикостероидов, аутологической плазмы, обогащенной тромбоцитами (platelet rich plasma therapy) [35–37].
Отношение к внутрисуставному введению лекарственных препаратов в настоящее время неод-
кт ГА
нозначное, что может объясняться более сложной техникой манипуляции, а также более высоким риском развития осложнений. Жировая клетчатка верхнего заворота ДОС соединяется с жировой тканью, окружающей корешки. Собственный объем полости ДОС невелик и равен приблизительно 1,0–2,0 мл, поэтому при избыточном введении лекарственное вещество может проникнуть в эпидуральное пространство. В литературе описаны такие осложнения, как проникновение анестетика в субарахноидальное пространство, случаи менингита и разрыва капсулы ДОС [9]. Основное преимущество нейротомии перед вну-триартикулярными введениями заключается в том, что вокруг ДОС имеется большее количество ноцицептивных вегетативных образований (в том числе ветвей нерва Люшка), которые играют главную роль в организации рефлекторных синдромов ДОС [38, 39].
МИНИМАЛЬНО ИНВАЗИВНЫЕ МЕТОДЫ ЛЕЧЕНИЯ БОЛЕЙ ПРИ ПАТОЛОГИИ
МЕЖПОЗВОНКОВЫХ ДИСКОВ Химическая денервация
При проведении данной манипуляции предварительно, путем воспроизведения боли, следует установить клинически значимый МПД [16], для чего в заинтересованный МПД и смежные с ним диски вводят 4%-ный раствор бикарбоната натрия. В случае воспроизведения боли в области заинтересованного МПД его подвергают денервации [8, 16]. Единичные сообщения об инъекциях малых доз (до 0,4 мл) чистого этилового спирта в центр МПД поступают, в частности, из зарубежных источников [8, 15]. Связанная с этой манипуляцией высокая частота асептического дисцита и перидурита при- нуждает относиться к спиртовому хемонуклеолизу предусмотрительно [40].
Хемонуклеолиз
Первый из известных минимально инвазивных методов лечения грыжи МПД [10, 40]. В 1963 г. J. Smith применил инъекцию в МПД химопапаина при лечении 10 больных с ишиасом [16]. Химопапаин — это фермент, который лизирует элементы хрящевой ткани in vitro , а при внутривенной инъекции кроликам вызывает временное размягчение хрящевой трахеи и ушных раковин. Результат применения химопапаина — внутренняя декомпрессия МПД и его денервация, приводящая к фиброзу МПД и исчезновению дискогенной боли [9, 41].
Основные показания к хемонуклеолизу — клиническая значимая грыжа МПД с радикулярным болевым синдромом [24]. Немаловажную роль при этом играет подбор больных с превалированием болей в нижних конечностях над поясничным отделом позвоночника, положительными симптомами натяжения корешков. Эффективность методики связана с селективным лизисом хрящевой ткани пуль-позного ядра, при котором соединительнотканные волокна фиброзного кольца не растворяются, что может объяснять как успех, так и неудачу используемого метода. Длительно существующая грыжа МПД претерпевает фиброзную трансформацию и петрификацию из-за воспалительных и склеротических процессов, поэтому при «старой» грыже МПД перспективы благоприятного исхода при хемонуклеолизе значительно ниже, чем при новообразованной. Положительные результаты, по мнению различных нейрохирургов, варьируют от 20 до 85% в связи с ограничением четкого контроля дозировки фермента и глубины деструкции тканей [9].
Из осложнений хемонуклеолиза следует отметить аллергическую реакцию; кровотечение; изменения в свертывающей системе крови; развитие эпидурального фиброза, дисцита, спондилита, тромбофлебита и тромбоэмболии легочной артерии [9]. Наиболее тяжелым из вероятных осложнений является выход папаина в позвоночный канал с лизисом и грубым повреждением невральных структур. Несмотря на редкость перечисленных осложнений, данный препарат запрещен Управлением по контролю за качеством пищевых продуктов и лекарственных средств (Food and Drug Administration, FDA) к применению на территории США [34, 36].
В данный момент на рынке медицинских услуг широко представлено лечение с применением аналогов — карипазима и карипаима. Эти ферментные препараты рекомендуется использовать с применением электрофореза на область поясничного отдела позвоночника, что, со слов производителей, ведет к лизису и рассасыванию грыж МПД. Однако такие заявления не выдерживают никакой критики. Во-первых, глубина проникновения вещества в мягкие ткани при электрофорезе не превышает 1–1,5 см [11, 30, 32], при этом промежуток от кожи до МПД у взрослого человека составляет 8–12 см. Во-вторых, для достижения эффекта необходимо выполнить несколько десятков процедур, что значительно увеличивает риск развития аллергических осложнений и дерматитов и в конечном ито- сп и н ическая ■ 2019 п эакти keu Том 10 №3
ге не позволяет считать этот метод эффективным и безопасным [40].
В настоящий момент в качестве других химических препаратов для введения в МПД изучают хон-дроитиназы АВС (элиминативная деградация полисахаридов, содержащих 1,4-бета-D-hexosaminyl и 1,3-бета-D-glucuronosyl или 1,3-альфа-L-iduronosyl связи с дисахаридами, содержащими 4-дезокси-бе-та-D-Gluc-4- enuronosyl группы), озон [42].
Механическая декомпрессия
Метод фенестрации МПД впервые предложил L. Hunt в 1951 г. Ученый проводил переднелатеральную фенестрацию МПД через открытый ретроперитонеальный доступ и получил успешные результаты. По мнению некоторых авторов, переднелатеральный надрез МПД поможет перераспределить давление в МПД в переднелатеральном направлении и предотвратить возникновение задней грыжи [9]. В настоящее время этот метод имеет больше историческую ценность.
Интрадисковая электротермальная терапия
Интрадисковая электротермальная терапия (от англ. intradiscal electhrotermal therapy, IDET) производится через иглу с помощью гибкого нагревательного зонда, петля которого охватывает внутренние слои фиброзного кольца и нагревает их до 65°С в течение 16,5 мин. Это приводит к денатурации и сокращению коллагеновых волокон с одномоментным разрушением ноцицептивных рецепторов фиброзного кольца и коагуляции новообразованных сосудов МПД. Проспективное рандомизированное двойное слепое плацебоконтро-лируемое перекрестное исследование доказало отсутствие большой продуктивности IDET по сравнению с плацебо [2]. С учетом данных результатов государственная служба здравоохранения США (Medicare) с 2008 г. прекратила финансировать применение IDET.
Лазерная нуклеотомия
В начале 1990-х гг. для осуществления нуклео-томии начали применять лазерную вапоризацию. Так, появились сообщения о четырехлетнем исследовании чрескожной внутридисковой лазерной нуклеотомии при помощи ИАГ-неодимового лазера (лазер на иттрий-алюминиевом гранате, активированном неодимом) [43]. Как и механическая, лазерная нуклеотомия ориентирована на снижение давления в МПД путем неполного удаления пуль-позного ядра, что ведет к уменьшению воспаления и боли. При данном методе выпаривание хрящевой ткани рядом с корешком невозможно, так как рабочий конец лазерного проводника локализуется в центре ядра, т.е. вдалеке от грыжевого фрагмента [40]. По данным D. Choy и соавт. [37], успешным лечение было у 78,4% больных, которых наблюдали на протяжении 26 мес. Однако в обзоре литературы P. Goupille и соавт. [44], посвященном этой методике, с 1980 по 2006 г. не было показано весомых данных о продуктивности перкутанной лазерной нуклеотомии при лечении дискорадикулярного конфликта. Невзирая на долголетнюю историю, этот метод постепенно лишается своих позиций во всем мире в связи с низкой продуктивностью и разработкой более современных методов нуклетомии.
Гидродискэктомия
Суть метода заключается в расслоении и вымывании кусочков дегенерированного МПД через специальный введенный в МПД микрорезектор [31]. Зонд толщиной 3,8 мм (гидрорезектор) содержит два канала — узкий, через который в пульсирующем режиме поступает поток физиологического раствора, разделяющий ткань МПД на фрагменты, и более широкий аспирационный канал, через который производится забор резецированного материала [40]. Перед данной процедурой осуществляют дискографию, которая дает возможность контрастировать трещины в МПД и грыжевое выпячивание и упрощает ориентирование в момент манипуляции. Рабочую канюлю и зонд вводят через заднебоковой пункционный доступ с обязательным интраоперационным контролем (флюороскопия).
Техника выполнения . Техника гидродискэктомии заключается в хронологическом установлении в МПД из заднебокового доступа иглы, проволочного направителя, тупого расширителя и рабочей канюли. Далее внедряют одноразовый рабочий зонд, соединенный с консолью. Поступательные, вращательные и веерообразные движения кончика рабочего зонда дают возможность продуктивно и быстро резецировать ткань МПД как из центра пульпозного ядра, так и из области собственного грыжевого выпячивания. Управляя зондом, в течение 2–3 мин резецируется часть МПД. В момент работы применяют физиологический раствор в сочетании с антибиотиком. В сравнении с другими ми-ниинвазивными методами (в частности с лазерной вапоризацией) гидродискэктомия дает возмож-
кт ГА
ность оказывать влияние прямо на зону генератора боли. Отсутствие разогрева ткани в области действия зонда дает возможность удалять ткань даже из зоны задней трети фиброзного кольца, трещин фиброзного кольца и близлежащего эпидурального пространства без опасности травматиза-ции невральных структур. Выпадение тканей МПД приводит к обострению радикулярного болевого синдрома, а гидродискэктомия дает возможность резецировать часть МПД без дополнительного повреждения волокон фиброзного кольца [10, 40]. Эффективность пункционной гидродискэктомии в приведенных исследованиях составляет 88%. Возможность амбулаторного выполнения делает гидродискэктомию важной опцией лечения дискорадикулярного конфликта [10].
Нуклеопластика
Для воздействия на пульпозное ядро МПД с целью уменьшения его протрузии и снижения компрессии корешков с 1995 г. используется холодная плазма [8, 41, 42]. Метод, запатентованный компанией ArthroCare (США), называется нуклеопластикой и заключается в образовании каналов в пульпоз-ном ядре МПД посредством внедрения электрода, который выпускает высокочастотную энергию для образования высокозаряженных ионных частиц или плазменного поля и дальнейшего расщепления ткани МПД [2, 3, 5, 27, 39]. Это особенный тип электронейрохирургии, значительно отличающийся от коагуляционных методик [43, 44]. На конце специального электрода формируется дозированный слой плазмы, в котором осуществляется разделение молекулярных связей биообъекта (пульпозного ядра МПД). Возникает эффект «исчезновения» части МПД, при этом температура вокруг электрода не превышает 40–70°С. В ходе данной манипуляции ткань разрушается до молекулярных составляющих в радиусе около 1 мм от зонда, а объем удаленной ткани доходит до 1 см3 [40]. Экспери- ментальные результаты показывают, что кроме декомпрессионного эффекта нуклеопластика активизирует регенеративные процессы в МПД [44].
Показаниями к проведению нуклеопластики являются боли в нижних конечностях или иррадиирующие боли в комбинации с локальной болезненностью в поясничной области; наличие протрузии, грыжи МПД размером до 8–9 мм по данным МРТ; неэффективность консервативного лечения на протяжении 4–6 нед; невозможность проведения отрытого хирургического вмешательства [1, 9, 40, 45].
Абсолютные противопоказания к нуклеопластике [1, 6, 9, 45–48]:
-
• признаки разрыва фиброзного кольца по данным МРТ, секвестрирование грыжи МПД;
-
• размер протрузии более 1/3 сагиттального размера позвоночного канала;
-
• снижение высоты МПД более 50%;
-
• признаки значимой травматизации корешков спинного мозга на протяжении 2 смежных МПД;
-
• повреждение спинного мозга;
-
• наличие онкологического процесса, переломов позвоночника, местной или генерализованной инфекции;
-
• стеноз позвоночного канала менее 12 мм;
-
• быстропрогрессирущая неврологическая симптоматика;
-
• спондилолистез, нестабильность в позвоночно-двигательном сегменте.
Относительными противопоказаниями к нуклеопластике считают общие соматические противопоказания; аллергические реакции на лекарственные средства; выраженные признаки спондилоартроза с деформацией фораминального отверстия; выраженный спондилез [1, 45–48].
Техника выполнения . Непосредственно перед манипуляцией больному выполняется очистительная клизма и внутримышечно вводится антибиотик широкого спектра действия. Нуклеопластика выполняется в положении пациента на животе под комбинированным обезболиванием (местная и внутривенная седация) [45].
Пункция МПД под КТ-контролем. Производятся предварительные срезы на уровне пораженного МПД с шагом 2 мм. В проекции заинтересованного МПД на кожные покровы пациента вертикально укладываются несколько металлических полосок длиной по 8–10 см с шагом 2 см на протяжении 6–12 см от средней линии в сторону доступа и фиксируются к кожным покровам. При повторном поперечном КТ-сканировании прицепленные марке- ры выявляются в виде рентгеноконтрастных точек. Плоскость сканирования должна соответствовать плоскости МПД. На срезе, прошедшем через центр МПД, подбирается вектор, по которому должна пройти игла, перекрест этого вектора с поверхностью кожи маркируется раствором бриллиантовой зелени с применением в качестве поперечного ориентира светового курсора томографа, в качестве продольного — металлической полоски, фиксированной к коже. На пути игла не должна встречать костных структур (поперечные или суставные
сп и н ическая ■ 2019 п эакти keu Том 10 №3
отростки), и скан не обязан соответствовать уровню замыкательных пластин. Совокупив на КТ-скане место проникновения иглы через кожу с фиброзным кольцом МПД, определяется протяжение погружаемой части иглы. После введения иглы производится КТ-контроль. Для достижения высокого эффекта нужно манипулировать электродом от края пульпозного ядра до его центра, для чего кончик иглы не должен дотягиваться до центра МПД на 1,5–2 см. После введения иглы в необходимое положение через нее устанавливают электрод, и заново производится КТ-контроль. После определения максимальной глубины установления электрода выполняется маркировка специальным пружинным ограничителем, входящим в набор для нуклеопластики [45].
При выполнении нуклеопластики под контролем рентгеннавигации рекомендуются все известные способы пункции МПД, кроме трансдурального. Для пункции МПД L2–L3, L3–L4, L4–L5 рекомендуется способ DeSeze, для пункции МПД L5–S1 — способ Erlacher. При первом методе точка ввода иглы локализуется латеральнее остистого отростка на 10–12 см, угол внедрения иглы — 45°; при втором — точка ввода находится латераль-нее остистого отростка на 1,5–2 см, угол внедрения иглы — 5–10° [8, 45]. Пункцию МПД выполняют в зоне треугольника «безопасности», вне проекции корешка, что дает возможность миновать его повреждение [9]. При рентгеннавигации обязательно применение прямой и боковой проекций. При выполнении нуклеопластики сохраняется постоянный вербальный контакт с больным. При появлении болей с иррадиацией со стороны пациента нужно изменить положение иглы во избежание повреждения корешка.
Лазерная реконструкция диска
В 1993 г. И. Марков после лазерного выпаривания МПД выявил на границе некроза зоны регенерации хрящевой ткани. Этот феномен был досконально исследован, и в 1998 г. группа исследователей (Э. Соболь, А. Басков, А. Шехтер) представила новоявленный подход к лечению дегенеративных процессов хрящевой ткани, базированный на управлении полем механических напряжений в ткани под воздействием краткосрочного неразрушающего лазерного излучения. Импульсное лазерное излучение меняет механические свойства хрящевой ткани, что создает регенераторную реакцию. Эксперименты на животных и клинические исследования доказали вероятность образования новой хрящевой ткани фиброзно-гиалинового и гиалинового типа в МПД в ответ на влияние неаблаци-онного (не приводящего к удалению и разрушению ткани) излучения волоконного лазера на эрбиевом стекле. Совершенной новый метод лечения дискорадикулярного конфликта с помощью термомеханического лазера получил название лазерной реконструкции МПД. Клинический эффект пункционной лазерной реконструкции МПД при хронической дискогенной боли набирает 80%. Фактором, обеспечивающим лечебный эффект, является в первую очередь термомеханическое напряжение, формируемое в ткани МПД в момент облучения (механическое влияние на клетки может запустить регенераторные процессы — пролиферацию, синтез протеогликанов). Помимо того, формирование и движение в поле напряжения микропузырьков диаметром до нескольких долей микрометра активирует механическое напряжение и стимуляцию хрящевых клеток, формирование субмикронных пор в ткани замыкательных пластинок и фиброзного кольца. Эти субмикронные поры обеспечивают улучшение метаболизма ткани, усиление периодических движений в МПД жидких сред и содержащихся в них ионов. Предположительно, при этом также происходит активация стволовых и коммитированных клеток, которые являются источником регенерации хрящевой ткани [40].
Реконструктивная хирургия МПД.Тканевая инженерия МПД
Ожидания на успехи лечения хронического дискорадикулярного конфликта связывают с тканевой инженерией. Было выявлено, что мезенхимальные стволовые клетки приспособлены дифференцироваться в клетки, подобные пульпозному ядру, с функцией синтеза протеогликанового матрикса ядра МПД. Вопреки экспериментальным успехам, клиническое использование данного метода до настоящего времени не дало эффекта. Так, в результате пилотной пересадки в МПД мезенхимальных стволовых клеток 10 пациентам с дегенеративным процессами в МПД и верифицированным дискографией дискорадикулярным конфликтом не отмечено снижения интенсивности боли ни у одного из них через 12 мес после манипуляции [42].
Производство подходящей матрицы и условий для выживания и функционирования трансплантированных клеток, восстановление функции замыкательных гиалиновых пластин и реставрация
кт ГА
фиброзного кольца представляются основными целями тканевой инженерии МПД.
СОБСТВЕННЫЕ КЛИНИЧЕСКИЕНАБЛЮДЕНИЯ
В клинический работе нейрохирургических отделений Приволжского окружного медицинского центра, Городской клинической больницы № 39 (Нижний Новгород), отделений хирургии позвоночника РНИИТО им. Р.Р. Вредена (Санкт-Петербург) и МЦ «Мирт» (Кострома) широко применяются малоинвазивные пункционные методы лечения поясничного отдела позвоночника. По результатам собственных наблюдений, эффективность используемых процедур (RFA ДОС, химическая нейротомия ДОС, интраартикулярное введение химических агентов в полость ДОС, химическая дерецепция МПД, нуклеопластика и гидродискэктомия), которые проводятся только после полного комплексного обследования пациента и под контролем рент-геннавигации, составляет 70–80% в ближайшем периоде наблюдения. Серьезных осложнений, влияющих на исход операции, нами не зафиксировано.
ЗАКЛЮЧЕНИЕ
В настоящее время наблюдается активное внедрение в клиническую практику миниинвазивных методов лечения дегенеративных процессов позвоночника. Комплексное лечение не снижает возможностей неинвазивных подходов, однако при безуспешности консервативной терапии необходимо шире использовать достижения нуклеотомии, химической и радиочастотной дерецепции.
ИСТОЧНИК ФИНАНСИРОВАНИЯ
Исследование проведено без спонсорской поддержки.
Список литературы Миниинвазивные методы лечения дискогенной боли и фасеточного синдрома в поясничном отделе позвоночника: обзор литературы и собственный опыт
- Назаренко Г.И., Черкашов А.М., Кузьмин В.И., и др. Эффективность радиочастотной денервации позвоночных сегментов // Вестник травматологии и ортопедии им. Н.Н. Приорова. - 2013. - №2. - С. 26-31.
- Тюликов К.В., Мануковский В.А., Бадалов В.И., Коростелёв К.Е. Нуклеопластика как эффективный минимально инвазивный метод лечения протрузий межпозвонковых дисков поясничного отдела // Здоровье. Медицинская экология. Наука. - 2012. - №1-2. - С. 121-122.
- Асатурян Г.А., Туниманов П.Г. Ближайшие результаты холодноплазменной нуклеопластики у больных с поясничными межпозвонковыми грыжами // Креативная хирургия и онкология. - 2011. - №4. - С. 28-31.
- Луцик А.А., Колотов Е.Б. Диагностика и лечение спондилоартроза // Хирургия позвоночника. - 2004. - №1. - С. 113-120.
- Назаренко А.Г., Коновалов Н.А., Молодченков А.И., и др. Вертебрология 2.0: автоматическая виртуальная консультация // Вопросы нейрохирургии им. Н.Н. Бурденко. - 2015. - Т.79. - №5. - С. 43-51.
- Кубанов З.А. Внутрисуставная пульсовая радиочастотная денервация при лечении боли в фасеточных суставах // Российский журнал боли. - 2018. - №2. - С. 229-231.
- Назаренко Г.И., Черкашов А.М., Шевелев И.Н., и др. Эффективность одномоментного выполнения микродискэктомии и радиочастотной денервации межпозвонковых суставов в сравнении с микродискэктомией у пациентов с грыжами межпозвонковых дисков пояснично-крестцового отдела позвоночника // Вопросы нейрохирургии им. Н.Н. Бурденко. - 2014. - Т.78. - №6. - С. 4-8.
- DOI: 10.17116/neiro20147864-8
- Борщенко И.А., Мигачев С.Л., Басков А.В. Пункционная поясничная гидродискэктомия: первый опыт использования // Нейрохирургия. - 2010. - №3. - С. 45-51.
- Борщенко И.А., Басков А.В. Минимально инвазивная хирургия дегенеративного поражения поясничных межпозвонковых дисков // Нейрохирургия. - 2010. - №1. - С. 65-71.
- Закиров А.А., Древаль О.Н., Чагава Д.А., и др. Лечение спондилоартроза и дискоза поясничного отдела позвоночника комбинированными малоинвазивными методами // Вопросы нейрохирургии им. Н.Н. Бурденко. - 2012. - Т.76. - №2. - С. 17-22.
- McCormick ZL, Marshall B, Walker J, McCarthy R, Walega DR. Long-Term Function, Pain and Medication Use Outcomes of Radiofrequency Ablation for Lumbar Facet Syndrome // Int J Anesth Anesth. 2015;2(2). pii: 028.
- Тюликов К.В., Мануковский В.А., Литвиненко И.В., и др. Минимально инвазивные методы лечения болевого и корешкового синдромов, вызванных дегенеративно-дистрофическими заболеваниями поясничного отдела позвоночника // Вестник Российской военно-медицинской академии. - 2013. - №1. - С. 69-75.
- José-Antonio SS, Baabor-Aqueveque M, Silva-Morales F. Philosophy and concepts of modern spine surgery. Acta Neurochir Suppl. 2011;108:23-31.
- DOI: 10.1007/978-3-211-99370-5_5
- Колесов С.В., Курпяков А.П. Использование холодноплазменной нуклеопластики в лечении грыж межпозвонковых дисков // Хирургия позвоночника. - 2007. - №3. - С. 53-58.
- Никитин А.С., Асратян С.А., Смирнов Д.С., Шалумов А.З. Эффективность блокад фасеточных суставов у больных с поясничным остеохондрозом // Нейрохирургия. - 2017. - №3. - С. 57-62.
- Чертков А.К., Бердюгин К.А., Штадлер Д.И., Крысов А.В. Современная малоинвазивная хирургия грыж поясничных дисков // Вестник травматологии и ортопедии им. В.Д. Чаклина. - 2010. - Т.3. - №3. - С. 108-112.
- Кузнецов А.В., Древаль О.Н., Рынков И.П., и др. Лечение болевого фасет-синдрома у пациентов, перенесших микродискэктомию // Вопросы нейрохирургии им. Н.Н. Бурденко. - 2011. - Т.75. - №2. - С. 56-61.
- Joo YC, Park JY, Kim KH. Comparison of alcohol ablation with repeated thermal radiofrequency ablation in medial branch neurotomy for the treatment of recurrent thoracolumbar facet joint pain. J Anesth. 2013;27(3):390-395.
- DOI: 10.1007/s00540-012-1525-0
- Волков И.В., Карабаев И.Ш., Пташников Д.А., и др. Возможности ультразвуковой навигации для радиочастотной денервации межпозвонковых суставов поясничного отдела позвоночника // Травматология и ортопедия России. - 2017. - Т.23. - №4. - С. 29-38.
- DOI: 10.21823/2311-2905-2017-23-4-29-38
- Никитин А.С., Асратян С.А., Камчатнов П.Р. Стеноз поясничного отдела позвоночного канала // Журнал неврологии и психиатрии им. C.C. Корсакова. - 2015. - Т.115. - №7. - С. 130-140.
- DOI: 10.17116/jnevro201511571130-140
- Крутько А.В., Евсюков А.В. Пункционное хирургическое лечение болевых синдромов, обусловленных дегенеративно-дистрофическими заболеваниями позвоночника. - Новосибирск, 2011. - С. 11.
- Волков И.В., Карабаев И.Ш., Пташников Д.А., и др. Сравнительный анализ эффективности холодноплазменной нуклеопластики и радиочастотной аннулопластики при лечении дискогенных болевых синдромов // Травматология и ортопедия России. - 2018. - Т.24. - №2. - С. 49-58.
- Певзнер К.Б., Егоров О.Е., Евзиков Г.Ю., Розен А.И. Чрескожная высокочастотная деструкция дугоотростчатых суставов в лечении постдискэктомического синдрома на поясничном уровне // Хирургия позвоночника. - 2007. - №3. - С. 45-48.
- Бывальцев В.А., Калинин А.А., Оконешникова А.К., Иринцеев А.А. Дифференцированная хирургическая тактика при дегенеративных заболеваниях поясничного отдела позвоночника с использованием пункционных методик // Сибирское медицинское обозрение. - 2018. - №5. - С. 54-65.
- DOI: 10.20333/2500136-2018-5-54-65
- Гончаров М.Ю. Сравнительные результаты хирургической денервации фасеточных суставов // Российский журнал боли. - 2018. - №2. - С. 241.
- Бывальцев В.А., Калинин А.А., Оконешникова А.К. Анализ клинической эффективности применения фасетопластики при лечении фасет-синдрома в поясничном отделе позвоночника у пациента пожилого и старческого возраста // Успехи геронтологии. - 2017. - Т.30. - №1. - С. 84-91.
- Борщенко И.А., Борщенко Я.А., Басков А.В. Алгоритм выбора метода минимально инвазивного хирургического лечения дегенеративных заболеваний поясничного отдела позвоночника на основе современных методов математического интеллектуального анализа данных // Нейрохирургия. - 2013. - №2. - С. 49-58.
- Щедренок В.В., Себелев К.И., Иваненко А.В., Могучая О.В. Результаты пункционных методов лечения остеохондроза позвоночника // Хирургия позвоночника. - 2010. - №1. - С. 46-48.
- Евзиков Г.Ю., Егоров О.Е., Розен А.И. Радиочастотная денервация в лечении болевого синдрома при патологии крестцово-подвздошного сочленения // Нейрохирургия. - 2015. - №2. - С. 80-85.
- Борщенко И.А., Лялина В.В. Практика спинальной хирургии в условиях частной клиники. - Москва: Практика, 2014. - 172 с.
- Холодов С.А. Транскутанное протезирование синовиальной жидкости в суставе при спондилоартрозе поясничного отдела позвоночника // Нейрохирургия. - 2014. - №3. - С. 50-54.
- Перфильев С.В. Современные тенденции в лечении дегенеративных заболеваний позвоночника (обзор литературы) // Журнал теоретической и клинической медицины. - 2014. - №4. - С. 72-76.
- Щедренок В.В., Иваненко А.В., Себелев К.И., Могучая О.В. Малоинвазивная хирургия дегенеративных заболеваний позвоночника // Вестник хирургии им. И.И. Грекова. - 2010. - Т.169. - №2. - С. 102-104.
- Древаль О.Н. Нейрохирургия. Т. 2. - Москва: Литтера, 2013 - 864 с.
- Колотов Е.Б., Луцик А.А., Миронов А.В. Предоперационная диагностика и лечение рефлекторно-болевых синдромов у больных с грыжами межпозвонковых дисков на шейном и поясничном уровнях // Бюллетень сибирской медицины. - 2009. - Т.8. - №1-2. - С. 111-115.
- Мануковский В.А., Бадалов В.И., Тюликов К.В., Коростелёв К.Е. Метод холодноплазменной коагуляции пульпозного ядра в лечении протрузий межпозвонковых дисков поясничного отдела у военнослужащих // Военно-медицинский журнал. - 2012. - Т.333. - №6. - С. 28-33.
- Choy DS, Ascher PW, Ranu HS, et al. Percutaneous laser disc decompression. A new therapeutic modality. Spine (Phila Pa 1976). 1992;17(8):949-956.
- DOI: 10.1097/00007632-199208000-00014
- Крутько А.В., Кудратов А.Н., Евсюков А.В. Дископункционное лечение рефлекторно-болевых синдромов поясничного остеохондроза // Хирургия позвоночника. - 2010. - №3. - С. 52-59.
- Луцик А.А., Шмидт И.Р., Колотов Е.Б. Спондилоартроз. - Новосибирск: Издатель, 2003. - 290 с.
- Каракулова Ю.В., Пронин А.Ю. Применение метода малоинвазивной терапии радиочастотной денервации у пациентов с хронической болью в спине // Российский журнал боли. - 2018. - №2. - С. 228-229.
- Никитин А.С., Асратян С.А., Смирнов Д.С. Блокады в лечении фасеточного синдрома. В сб.: Новые технологии в скорой и неотложной медицинской помощи: материалы научно-практической конференции, 21-22 апреля 2016. - М., 2016. - С. 108.
- Щедренок В.В., Иваненко А.В., Себелев К.И., и др. Ближайшие и отдаленные результаты лечения компрессионных и рефлекторных синдромов при дегенеративно-дистрофических заболеваниях позвоночника // Гений ортопедии. - 2010. - №4. - С. 63-67.
- Кравец Л.Я., Боков А.Е. Минимально инвазивные технологии в лечении хронического дискогенного болевого синдрома // Нейрохирургия. - 2007. - №4. - С. 51-55.
- Goupille P, Mulleman D, Mammou S, et al. Percutaneous laser disc decompression for the treatment of lumbar disc herniation: a review. Semin Arthritis Rheum. 2007;37(1):20-30.
- DOI: 10.1016/j.semarthrit.2007.01.006
- Назаренко Г.И., Черкашов А.М., Назаренко А.Г. Новая методика оценки степени достижения цели лечения в практике ведения пациентов с поясничной болью // Вестник травматологии и ортопедии им. Н.Н. Приорова. - 2009. - №1. - С. 76-81.
- Журавлев Ю.И., Назаренко Г.И., Черкашов А.М., и др. Прогнозирование исходов хирургического лечения дегенеративной болезни межпозвонковых дисков пояснично-крестцового отдела позвоночника // Вопросы нейрохирургии им. Н.Н. Бурденко. - 2009. - №1. - С. 42-47.
- Гуща А.О., Герасимова Е.В., Полторако Е.Н. Болевой синдром при дегенеративно-дистрофических изменениях позвоночника // Анналы клинической и экспериментальной неврологии. - 2018. - Т.12. - №4. - С. 67-75.
- Коновалов Н.А., Прошутинский С.Д., Назаренко А.Г., Королишин В.А. Радиочастотная денервация межпозвонковых суставов при лечении болевого фасеточного синдрома // Вопросы нейрохирургии им. Н.Н. Бурденко. - 2011. - Т.75. - №2. - С. 51-55.


