Мишени CAR-T терапии рака яичников
Автор: Ранджит Р., Гончарова О.И., Кулинич Т.М., Боженко В.К.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Обзор
Статья в выпуске: 4 т.25, 2025 года.
Бесплатный доступ
Рак яичников (РЯ) является одним из ведущих злокачественных заболеваний женской репродуктивной системы. Отсутствие ранних симптомов и эффективных методов скрининга приводит к тому, что примерно в 70% случаев диагноз ставится на поздних стадиях (III или IV); для РЯ характерны высокая частота рецидивов и низкие показатели выживаемости. Несмотря на ряд успехов при лечении данной нозологии, общий уровень выживаемости остается неудовлетворительным, что диктует необходимость дальнейших исследований и инновационных стратегий. На сегодняшний день иммунотерапия стала революционным подходом в лечении ряда онкологических заболеваний, для РЯ иммунотерапия обладает значительным потенциалом, ведется большое количество исследований по поиску адекватных методов, включая ингибиторы иммунных контрольных точек (например, антитела против PD-1/PD-L1, CTLA-4), терапия Т-клетками с химерными антигенными рецепторами (CAR), противораковые вакцины. Многочисленные клинические испытания на ранних стадиях изучают CAR-T-клетки, нацеленные на специфические антигены, экспрессируемые опухолевыми клетками. В данном обзоре рассматриваются потенциальные мишени для CAR-T-клеточной терапии рака яичников, включая клаудин 6 (CLDN6), протеинтирозинкиназу 7 (PTK7), MUC16 (CA125), мезотелин и альфа-рецептор фолиевой кислоты. Обсуждаются проблемы, связанные с иммуносупрессивным микроокружением опухоли и антигенной гетерогенностью, а также стратегии их преодоления для повышения эффективности CAR-T-терапии солидных опухолей.
CAR-T, рак яичников, рецептор, CAR-T терапия солидных опухолей, противоопухолевая иммунотерапия
Короткий адрес: https://sciup.org/149150004
IDR: 149150004 | DOI: 10.24412/1999-7264-2025-4-154-171
Текст научной статьи Мишени CAR-T терапии рака яичников
Рак яичников представляет собой гетерогенное онкологическое заболевание, характеризующееся неконтролируемой пролиферацией опухолевых клеток. Это 8-й по частоте рак у женщин, на его долю приходится 3,7% всех злокачественных новообразований [1]. Основным препятствием в лечении рака яичников является его частое бессимптомное течение или проявление неспецифических симптомов на ранних стадиях, таких как боль в животе, вздутие и проблемы с мочеиспусканием. Это часто приводит к постановке диагноза на поздних стадиях, что значительно снижает эффективность лечения и выживаемость пациентов [2]. Стандартные методы лечения, как правило, включают хирургическое вмешательство и химиотерапию с использованием платины. Однако они имеют ограничения, поскольку со временем развивается устойчивость к химиотерапии, и высока вероятность рецидива. Недавние достижения в области иммунотерапии и таргетной терапии предлагают новую альтернативу стандартным методам лечения. Показательными являются клинические испытания ингибиторов контрольных точек, противораковых вакцин и адоптивной клеточной терапии с использованием лимфоцитов, инфильтрирующих опухоль [3,4].
В этом контексте Т-клеточная терапия химерными антигенными рецепторами (CAR) стала революционным иммунотерапевтическим подходом. CAR-T терапия включает генетическую модификацию Т-клеток пациента для экспрессии синтетических рецепторов (CARs), которые позволяют им распознавать и уничтожать опухолевые клетки, несущие специфические поверхностные антигены. Этот метод лечения позволил добиться значительных успехов в лечении гематологических злокачественных новообразований, и в настоящее время доступно несколько одобренных FDA методов лечения [5]. Однако перенести этот успех на солидные опухоли, в частности на рак яичников, оказалось сложнее. Уникальная биология солидных опухолей, иммуносупрессивное опухолевое микроокружение (TME) и антигенная гетерогенность представляют собой значительные препятствия для успешной терапии рака яичников [6,7]. Наиболее эффективна CAR-T терапия в случае, когда целевой антиген гомогенно экспрессируется в опухоли, а в нормальных тканях уровень его экспрессии минимален [8]. Поиск соответствующих мишеней является важнейшей задачей в разработке CAR-T терапии солидных опухолей. В этой статье мы рассмотрим ключевые молекулярные мишени для CAR-T-терапии рака яичников.
Сложный ландшафт CAR-T-терапии при раке яичников
Иммуносупрессивное микроокружение опухоли (TME) при раке яичников характеризуется плотной стромой, аномальной сосудистой сетью и обилием ингибирующих иммунных клеток (например, регуляторных Т-клеток, клеток-супрессоров миелоидного происхождения) и растворимых факторов (например, TGF-β, IL-10, хемокинов и др.). Эти элементы создают физические и химические барьеры, которые препятствуют проникновению CAR-T-клеток в опухоль, ограничивают их персистенцию и ослабляют их цитотоксические функции [3].
Еще одним существенным препятствием является гетерогенность антигенов. Опухоли яичников часто состоят из клеточных популяций, экспрессирующих различные уровни потенциальных антигенов-мишеней. Эта гетерогенность означает, что CAR-T-клетки, нацеленные на один антиген, могут не уничтожить все раковые клетки, что потенциально может привести к рецидиву опухоли из-за роста антиген-негативных или низко экспрессирующих вариантов. Идеальная антиген-мишень должна, по возможности, иметь однородный уровень экспрессии на опухолевых клетках и, при этом, иметь минимальную экспрессию в нормальных тканях, чтобы избежать токсического воздействия вне опухоли (так называемый off target эффект) [7].
Клаудин 6 (CLDN6)
Клаудин 6 (CLDN6) является членом семейства мембранных белков клаудинов, обеспечивающих плотные соединения, которые имеют решающее значение для поддержания полярности клеток и регулирования парацеллюлярной проницаемости в эпителиальных и эндотелиальных клеточных слоях [9]. CLDN6 демонстрирует особый паттерн экспрессии: он высоко экспрессируется в различных тканях во время эмбрионального и внутриутробного развития, играя решающую роль в органогенезе и создании тканевых барьеров. Однако в большинстве нормальных тканей взрослого человека его экспрессия минимальна или полностью отсутствует [10,11]. CLDN6 экспрессируется на высоком уровне при нескольких типах рака, включая эпителиальный рак яичников и карциному эндометрия [12]. Этот опухолеспецифичный профиль делает CLDN6 важной мишенью таргетной терапии.
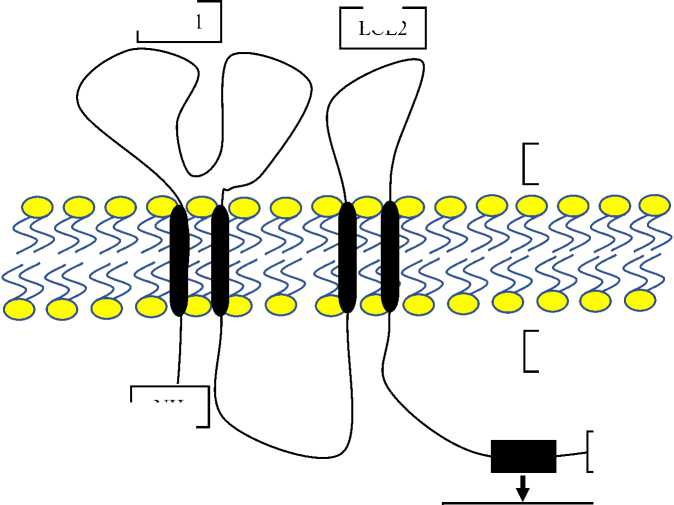
Структурно CLDN6 состоит из четырех трансмембранных доменов, двух внеклеточных петель (ECL1 и ECL2), короткой внутриклеточной петли и цитоплазматических N- и C-концов (Рис. 1). Внеклеточные петли особенно важны для взаимодействия клаудина и определения парацеллюлярной проницаемости [13].
ECL1
Extracellular
ECL2
Intracellular
-NH 2
-COOH
PDZ- binding motif
Рис. 1. Молекулярная структура клаудина 6 (CLDN6).
Помимо своей классической барьерной функции, CLDN6 участвует во внутриклеточных процессах передачи сигналов. Взаимодействуя с цитоплазматическими каркасами и регуляторными белками через свои внутриклеточные домены, CLDN6 участвует в модуляции ключевых клеточных процессов, таких как пролиферация, дифференцировка, миграция и апоптоз [11]. В опухолевых клетках аберрантная экспрессия CLDN6 может нарушить нормальную архитектуру и функцию плотных контактов. Это может привести к потере полярности эпителиальных клеток и ослаблению межклеточной адгезии, способствуя отслоению и миграции опухолевых клеток, тем самым усиливая инвазию и метастазирование. Измененная динамика плотного соединения также влияет на микроокружение, потенциально способствуя дальнейшей злокачественной трансформации. Ослабляя плотные контакты и изменяя полярность клеток, CLDN6 обеспечивает возможность метастазирования для опухолевых клеток [13].
Протеинтирозинкиназа 7 (PTK7)
Протеинтирозинкиназа 7 (PTK7) — эволюционно консервативный трансмембранный рецептор, который принадлежит к семье белков тирозинкиназ. Его альтернативное название — киназа 4 карциномы толстой кишки [14]. Несмотря на свое название и структурное сходство с другими PRTK, PTK7 классифицируется как псевдокиназа, потому что, в отличие от других киназ, ее каталитическая активность снижена. Таким образом, она не может фосфорилировать субстраты подобно обычной киназе, она осуществляет свою сигнальную функцию влияя на межбелковые взаимодействия [15,16].
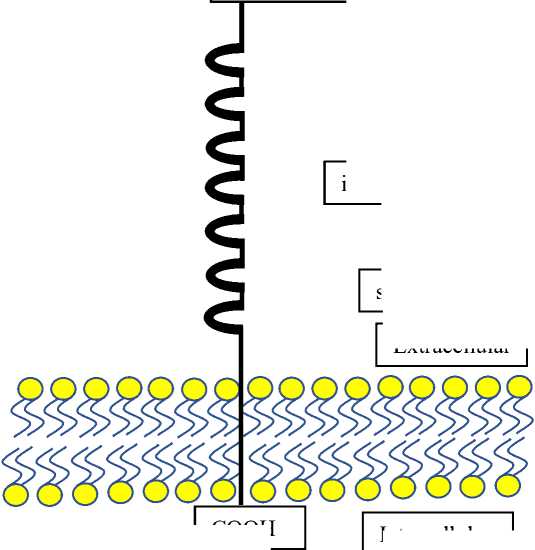
Структурно рецепторы PTK7 состоят из трех доменов — внеклеточного домена, трансмембранного домена и внутриклеточной области (Рис. 2). Внеклеточный домен начинается с N-концевой части и состоит из 7 иммуноглобин-подобных доменов. Эти 157
иммуноглобиноподобные домены участвуют в адгезии клеток [17]. Трансмембранный домен соединяет внеклеточный и внутриклеточный-псевдокиназный домен [18].
NH 2
immunoglobulin like single-pass transmembrane
Extracellular
COOH
Intracellular
Рис. 2. Структура протеинтирозинкиназы 7.
PTK7 играет многогранную роль в нормальной физиологии, особенно во время эмбрионального развития, например, в формировании полярности клеток плоского эпителия, закрытии нервной трубки, а также в Wnt/планарной клеточной полярности, координируя ориентацию клеток в тканях [19]. PTK7 также экспрессируется в миелоидных предшественниках [20], и его сигнальные функции помогают регулировать поведение клеток и поддерживать нормальный гемопоэтический гомеостаз [21,22]. Другая его физиологическая роль заключается в участии во взаимодействиях между клетками адгезии через свои иммуноглобулиноподобные-внеклеточные домены [23].
При онкологической патологии PTK7 оказывает влияние на несколько ключевых механизмов онкогенеза. Было показано, что при раке PTK7 взаимодействует с β-катенином и активирует канонический сигнальный путь Wnt/β-катенин, который часто участвует в прогрессировании опухоли, ее пролиферации и жизнеспособности [24]. В свою очередь измененные в опухолевых клетках адгезивные свойства иммуноглобулин-подобных доменов приводят к потере целостности плотных соединений и ослаблению межклеточных контактов. [25]. Аналогичным образом, PTK7 влияет на организацию цитоскелета, который реализует морфологические изменения, необходимые клеткам для отделения, миграции и проникновения в окружающие ткани [26]. Более того, PTK7 может способствовать устойчивости к химиотерапии. В некоторых работах было показано, что PTK7 взаимодействует с ключевыми регуляторами клеточной гибели, которые ингибируют апоптоз, обычно индуцируемый химиотерапевтическими средствами [27].
CA125
Муцин 16 (MUC16) — гликопротеин, представляет собой трансмембранный белок, часть которого (при отщеплении) является циркулирующей в периферической крови молекулой, получившей наименование онкомаркера — CA125 [28]. MUC16 — это белок, 158
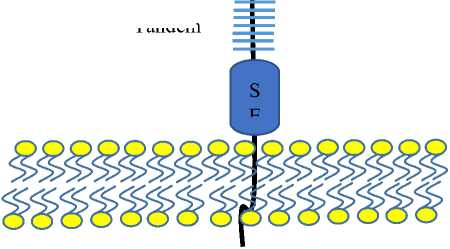
который занимает второе место по количеству аминокислот среди человеческих белков (22152 аминокислоты) после мышечного белка титина. Он относится к семейству муцинов. Его молекулярная масса составляет около 3–4 млн. Да [29]. MUC16 состоит из N-терминального домена, повторяющихся O-гликозилированных участков и C-терминального фрагмента, включающего SEA-модуль (sea urchin sperm protein, enterokinase, agrin) (Рис. 3).
MUC16 обнаружен на роговице, слизистой дыхательных и мочеполовых путей, в желудочно-кишечном тракте и слюнных железах. В нормальных тканях MUC16 выполняет защитную функцию, формируя гидрофильный барьер на поверхности эпителиальных клеток, предотвращая их повреждение механическими и химическими факторами [30]. Поскольку MUC16 содержит большое количество гликозилированных остатков, он помогает создавать гидрофильный барьер, защищающий эпителиальные клетки от патогенов. Аналогичным образом, он способствует процессам клеточной адгезии, взаимодействуя с Е-кадгерином и β-катенином, которые необходимы для поддержания целостности тканей [29,30].
NH 2
Tandem
COOH
Рис. 3. Структура муцина 16 (MUC16).
Как известно, при раке яичников формируется кислая микросреда вследствие метаболических особенностей опухолевых клеток и дисбаланса между продукцией и утилизацией молочной кислоты. Этому способствует анаэробный гликолиз опухолевых клеток (эффект Варбурга), активность транспортеров лактата, выводящих молочную кислоту во внеклеточное пространство, гипоксия и некроз тканей. Кислая среда подавляет активность Т-клеток и естественных киллеров (NK), способствуя росту опухоли. В свою очередь MUC16 повышает инвазивность опухоли за счет взаимодействия с такими сигнальными путями, как PI3K/AKT и JAK2/STAT3. Низкий pH активирует протеолитические ферменты (например, матриксные металлопротеиназы MMP2 и MMP9), которые разрушают внеклеточный матрикс и базальные мембраны, облегчая миграцию опухолевых клеток в соседние ткани [31]. Кроме того, протеолитические ферменты в кислой среде расщепляют эктодоменную область MUC16, высвобождая CA125, который исследуется в качестве онкомаркера [32].
Мезотелин
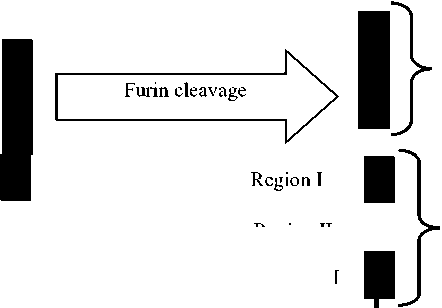
Мезотелин (MSLN) — гликозилфосфатидилинозитоловый (GPI) анкерный гликопротеин, состоящий из мегакариоцитстимулирующего фактора (MPF) (31 кДа) и 159
мезотелина (40 кДа). В процессе созревания происходит отщепление MPF фрагмента и образуется зрелый мезотелин (Рис. 4). Благодаря своей структуре, мезотелин участвует в клеточной адгезии и регуляции планарной полярности в процессе эмбрионального развития, так же как и протеинтирозинкиназа 7 [33,34].
MPF
Mebrane anchored MSLN
Region II
Region III

GPI
MSLN
Рис. 4. Структура мезотелина (MSLN).
Mature MSLN
Структурно MSLN состоит из трех ключевых областей: N-концевой области I, области II и C-концевой области III (Рис. 4). Область I, расположенная дальше всего от клеточной мембраны, взаимодействует с белком муцином MUC16, который часто экспрессируется в агрессивных опухолях.
Область III, расположенная ближе к трансмембранному домену, проявляет способность активировать Т-клетки и индуцировать их цитотоксическую активность против опухолевых клеток, что делает ее перспективной мишенью для иммунотерапии. Кроме того, положение области III способствует соединению внеклеточных доменов с якорем GPI. Наконец, область II структурно соединяет регионы I и III [37].
MSLN гиперэкспрессируется в аденокарциномах яичников, плевры и брюшины, что может приводить к инвазии в окружающие ткани за счет активации путей NFκB, MAPK и PI3K, а также индукции матриксных металлопротеиназ MMP7 и MMP9 [38], которые способствуют клеточной пролиферации, миграции и метастазированию [39]. MSLN может служить в качестве маркера для мезотелиомы, аденокарциномы легких, поджелудочной железы [39,40] и рака яичников [33]. Точные биологические функции белков MSLN и MPF, кодируемых геном MSLN , до сих настоящего времени не до конца изучены. Согласно клиническим наблюдениям, повышенный уровень мезотелина, как правило, связан с увеличением опухолевой нагрузки и более низкой выживаемостью.
Альфа-рецептор фолиевой кислоты
Витамин В9 (фолат или фолиевая кислота) необходим для синтеза, репарации и метилирования ДНК в быстро пролиферирующих клетках [41]. Фолат может проникать в клетки в основном тремя способами: через восстановленный переносчик фолата, протонный переносчик фолата и рецепторы фолата, которые делятся на четыре типа: FRa, FRβ, FRy и FRδ [42]. Альфа-изоформа (FRa) кодируется геном FOLR1 и называется фолатсвязывающим белком. Он обладает высоким сродством к связыванию и транспортировке 5-метилтетрагидрофолата (активная форма фолата) [43]. FRa, как правило, экспрессируется в нормальных клетках на низком уровне. Однако в некоторых случаях рака, таких как карциномы яичников, легких и молочной железы, его уровень значительно повышается [44].
FRa имеет сферическую форму, стабилизированную восемью дисульфидными связями. Эти связи обеспечивают структурную целостность и поддерживают конформацию рецептора. Он содержит глубокий фолатсвязывающий карман, который образован консервативными аминокислотными остатками, необходимыми для взаимодействия с фолиевой кислотой (Рисунок 5) [45].
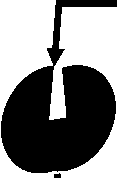
folate-binding pocket\
FRα
ч
GPI
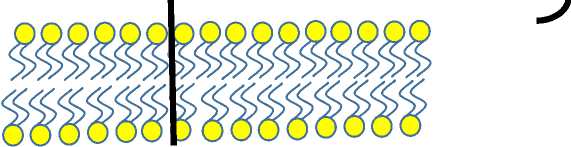
Рис. 5. Структура альфа-рецептора фолиевой кислоты.
Как и другие ранее обсуждавшиеся рецепторы, FRa прикрепляется к клеточной мембране через GPI [42]. Этот якорь обеспечивает локализацию рецептора на поверхности клетки. Рецептор претерпевает структурные изменения в зависимости от рН, что важно для его транспортировки в эндоциты. При кислом рН в эндосомах рецептор высвобождает связанный фолат [46].
Основной функцией FRa является транспорт фолата в клетки посредством рецептор-опосредованного эндоцитоза. Фолиевая кислота является предшественником для синтеза пуринов и пиримидинов, которые необходимы для производства ДНК и РНК. Способствуя усвоению фолиевой кислоты, FRa поддерживает синтез генетического материала, особенно в быстро делящихся клетках, таких как эпителиальные и ткани плода [47]. Более того, FRa также участвует в процессах метилирования, которые впоследствии регулируют экспрессию генов, эпигенетические модификации и синтез нейромедиаторов. В раковых клетках альфа-рецептор способствует лучшему усвоению фолиевой кислоты, что необходимо для производства нуклеотидов и быстрого деления клеток [48]. Более того, некоторые раковые клетки могут использовать FRa для уклонения от апоптоза и развития устойчивости к химиотерапии [49]. При эпителиальном раке яичников (который составляет около 90% всех случаев рака яичников) наблюдается значительная сверхэкспрессия FRα на 161
поверхности опухолевых клеток, что делает его значимым маркером определения рака яичников.
Молекула адгезии эпителиальных клеток (EpCAM)
Молекула адгезии эпителиальных клеток (EpCAM), также известная как CD326, является трансмембранным гликопротеином. У здоровых взрослых EpCAM экспрессируется в простом и переходном эпителии толстого кишечника, однако отсутствует в плоском многослойном эпителии [50]. При развитии злокачественных новообразований EpCAM экспрессируется в высокой степени на обширном спектре карцином, происходящих из эпителиальных клеток человека, включая рак яичников. Часто его уровни значительно превышают показатели в нормальном эпителии. Также встречается высокая экспрессия EpCAM в большинстве опухолей желудочно-кишечного тракта и мочеполовой системы [51].
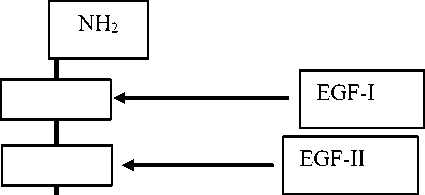
EpCAM состоит из большого внеклеточного домена, трансмембранного домена и короткого внутриклеточного домена. Внеклеточный домен начинается с N-конца, за которым следуют два домена, подобных эпидермальному фактору роста (EGF). Внутриклеточный домен принимает участие в передаче сигнала [52].
Extracellular
Plasma membrane
COOH
Intracellular
Рис. 6. Структура молекулы EpCAM.
Одной из фундаментальных функций EpCAM в здоровых клетках является контроль клеточной адгезии и последующей клеточной миграции путем регуляции сигнальных путей FAK/ERK [53]. Это было продемонстрировано в исследовании, где было обнаружено, что скорость миграции клеток снижается при нокауте EpCAM. Аналогичным образом, было показано, что EpCAM участвует в пролиферации, дифференцировке и морфогенезе [53,54]. У больных злокачественными опухолями, избыточная экспрессия EpCAM способствует метастазированию и невосприимчивости к химиотерапии [55]. Парадоксально, при некоторых видах рака, таких как почечно-клеточный рак и анапластический рак щитовидной железы [56], увеличение EpCAM ассоциировалось с улучшением выживаемости пациентов.
Аннексин A2 (ANXA2)
В отличие от рецепторов, описанных выше, ANXA2 не является трансмембранным рецептором. ANXА2 имеет два различных домена — высоковариантный N-концевой участок и С-концевой консервативный карбоксильный конец. N-конец имеет участки связывания тканевого активатора плазминогена и p11. C-концевой имеет участки связывания F-актина, гепарина и плазминогена и состоит из четырех повторов аннексина с пятью α-спиралями в каждом сегменте повтора [58]. N-концевой участок отвечает за межбелковые взаимодействия, а C-концевой — имеет решающее значение для связывания кальция и регулирования взаимодействий с фосфолипидами (Рис. 7) [59].
NH 2
COOH
Extracellular

Plasma membrane
Intracellular
Рис. 7. Структура Аннексина 2.
Аннексин A2 (ANXA2) является многофункциональным белком, играющим важную роль в поддержании нормальной клеточной физиологии. Его разнообразные функции обусловлены способностью взаимодействовать с клеточными мембранами, элементами цитоскелета и сигнальными молекулами.
Во-первых, ANXA2 способен связываться с отрицательно заряженными фосфолипидами, такими как фосфатидилинозитол, и регулировать динамику мембран, влияя на распределение липидов и белков в их пределах. Кроме того, он может опосредовать связь мембран с актиновым цитоскелетом, участвуя как в процессах эндоцитоза, так и экзоцитоза [60].
Во-вторых, ANXA2 активно вовлечен в систему фибринолиза. Он способен образовывать гетеротетрамер с белком P11, который функционирует как корецептор для плазминогена и тканевого активатора плазминогена. За счет ускорения конверсии плазминогена в плазмин, ANXA2 способствует эффективному расщеплению фибриновых сгустков. Таким образом, он поддерживает проходимость сосудов и играет роль не только в заживлении ран, но также способствует ангиогенезу, обеспечивающему кровоснабжение растущих опухолей [61].
В-третьих, ANXA2 взаимодействует с F-актином, оказывая влияние на стабильность цитоскелета. Это взаимодействие способствует динамическим изменениям формы клеток, что критически важно для направленного движения клеток. Данный механизм имеет существенное значение в таких физиологических процессах, как восстановление тканей и миграция клеток. Однако такая клеточная миграция также может способствовать отрыву опухолевых клеток от первичной опухоли и их инвазии в окружающие ткани [62].
Рецептор антимюллерова гормона 2-го типа (AMHR2)
Рецептор антимюллерова гормона 2-го типа (AMHR2), также известный как (MISR2), является серин/треонинкиназным рецептором, принадлежащим к семейству рецепторов трансформирующего фактора роста-бета (TGF-β). У мужчин AMHR2 наиболее выраженно экспрессируется в клетках Сертоли и клетках Лейдига яичек, а также в простате и мюллеровых протоках [63]. У женщин AMHR2 экспрессируется в гранулезных клетках яичников, плаценте, молочных железах и матке. Помимо репродуктивных органов, AMHR2 также обнаруживается в других тканях, включая нервную ткань, гипофиз, надпочечники и поджелудочную железу [63]. AMHR2 представляет собой трансмембранный рецептор, состоящий из трех основных доменов: внеклеточного домена, трансмембранного домена и внутриклеточного киназного домена (Рис. 8). Внеклеточный N-концевой домен специфически распознает и связывается с антимюллеровым гормоном (АМГ). Трансмембранный домен заякоривает рецептор в клеточной мембране, обеспечивая его правильную пространственную ориентацию. Внутриклеточный С-концевой домен содержит серин/треонинкиназную активность, которая критически важна для передачи сигнала путем фосфорилирования нижестоящих рецепторов I типа после связывания лиганда АМГ [64].
NH 2
Extracellular
Plasma membrane
Intracellular
COOH
Рис. 8 . Рецептор антимюллерова гормона 2-го типа (AMHR2).
AMHR2 демонстрирует сверхэкспрессию при различных видах рака, таких как рак эндометрия, молочной железы, яичников, предстательной железы и яичек [65,66].
Примечательно, что AMHR2 также сверхэкспрессируется при раке толстой кишки, немелкоклеточном раке легких, меланоме глаза и раке головы/шеи [67,68].
При злокачественной трансформации сигнальный путь TGF-β/SMAD4 индуцируется АМГ-AMHR2 и способен регулировать время клеточного цикла и индуцировать апоптоз, особенно на ранних стадиях [68,69]. Однако на более поздних стадиях тот же путь, как было обнаружено, способствует росту опухоли. Более того, истощение АМГ-AMHR2 может привести к химиорезистентности [70].
Ассоциированный с опухолью гликопротеин 72 (TAG72)
Ассоциированный с опухолью гликопротеин 72 (TAG72 или CA 72-4) представляет собой высокомолекулярный муциноподобный гликопротеиновый комплекс клеточной поверхности [71]. Он обладает обширным О-связанным гликозилированием, которое служит сайтом связывания для моноклональных антител. Было обнаружено, что TAG-72 слабо экспрессируется в нормальных тканях эндометрия во время секреторной фазы и в тканях плода [72].
Структурно и функционально TAG72 подобен муцинам, таким как MUC-1, но отличается по характеру гликозилирования и экспрессии эпитопов. TAG72 обычно прикрепляется к мембране. Внемембранный домен рецептора в высокой степени характеризуется О-связанным гликозилированием. Паттерны гликозилирования включают ассоциированные с опухолью углеводные антигены, такие как GalNAc-O-Ser/Thr и STn; Neu5Ac-GalNAc-O-Ser/Thr [73].
Заключение
Эффективность CAR-T терапии лимитирована рядом фундаментальных ограничений: иммуносупрессивным микроокружением опухоли, гетерогенностью антигенной экспрессии и сложностью проникновения Т-клеток в солидную опухоль. Для преодоления гетерогенности экспрессии мишеней на поверхности опухолевых клеток и возможной их потери в процессе клеточной трансформации разработаны подходы, основанные на последовательном использовании CAR-T, направленных на разные мишени, стратегии двойных CAR-T клеток и других мультитаргетных конструкций. Новизна подхода заключается в комплексном анализе молекулярных мишеней с позиции их функциональной роли в онкогенезе, что позволило сформулировать критерии оптимального антигенного таргета: высокоспецифичная экспрессия в опухолевых клетках, минимальная представленность в здоровых тканях, функциональная значимость в канцерогенезе и потенциал модуляции клеточных сигнальных путей.
Молекулярный ландшафт потенциальных мишеней CAR-T терапии при раке яичников характеризуется высокой гетерогенностью и сложной биологической архитектурой. Ключевые молекулы — CLDN6, PTK7, MUC16, мезотелин, FRα, EpCAM, ANXA2, AMHR2 и TAG72 — представляют собой не просто маркеры, а интегральные компоненты канцерогенеза, участвующие в процессах клеточной адгезии, миграции, пролиферации и метастазирования. Рациональный подход к планированию индивидуального лечения включает анализ профиля экспрессии потенциальных таргетов в опухолевой ткани и выбор терапии на основе анализа клональности опухоли с возможной элиминацией максимального количества клонов.
Вклад авторов. Ранджит Р.: формирование базы литературных источников, написание текста рукописи; Гончарова О.И.: анализ базы литературных данных, написание глав статьи, корректировка рукописи; Кулинич Т.М.: подборка и анализ базы литературных источников, корректировка рукописи; Боженко В.К.: разработка концепции статьи, анализ и интерпретация литературных данных, корректировка рукописи.
Финансирование. Исследования выполнены при поддержке Министерства здравоохранения Российской Федерации, тематика государственного задания № 1022040800109-5-3.2.21;3.4.2.
Соблюдение прав пациентов и правил биоэтики. Данное обзорное исследование было основано на опубликованных работах и поэтому не требовало одобрения этического комитета.


