Мутации NRAS, KRAS, BRAF при раке желудка: комплексный анализ российских и международных данных
Автор: Джикия Е.Л., Райлян А.А., Довгань Ф.Н., Боженко В.К.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Обзор
Статья в выпуске: 4 т.25, 2025 года.
Бесплатный доступ
Мутации генов семейства RAS/RAF, включая KRAS, NRAS и BRAF, играют важную роль в развитии злокачественных новообразований различной этиологии. При раке желудка эти мутации встречаются гораздо реже, но все же имеют важное клиническое значение. Мутации KRAS приводят к ухудшению прогноза, сниженной эффективности анти-EGFR терапии и требуют использования иммунотерапии в MSI-положительных (MSI+) случаях. Мутации BRAF характеризуются агрессивным течением заболевания, однако обладают уязвимостью к таргетной терапии. Анализ российских исследований показал, что частота мутаций KRAS среди граждан Российской Федерации существенно не отличается от международного уровня, достигая 7,5–9%. При этом мутации NRAS и BRAF встречаются крайне редко. Особое внимание уделяется подтипу MSI+. Среди российских пациентов только у 19% выявляются мутации KRAS, что существенно меньше по сравнению с мировой статистикой. На сегодняшний день наблюдается серьезная нехватка статистических данных об особенностях мутационного профиля рака желудка среди жителей Российской Федерации. Масштабное и углубленное изучение данной темы позволит существенно увеличить эффективность терапии и привнести большой вклад в развитие клинической онкологии. Стандартизация методов молекулярной диагностики и внедрение комплексного молекулярного тестирования необходимы для повышения эффективности персонализированной терапии и улучшения исходов заболевания.
Рак желудка, молекулярная генетика, онкогенетика, мутации, NRAS, KRAS, BRAF
Короткий адрес: https://sciup.org/149150001
IDR: 149150001 | DOI: 10.24412/1999-7264-2025-4-117-129
Текст научной статьи Мутации NRAS, KRAS, BRAF при раке желудка: комплексный анализ российских и международных данных
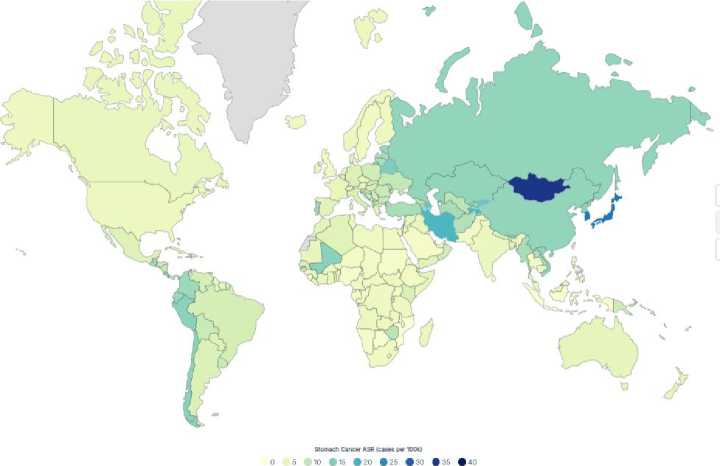
Stomach Cancer Rates by Country 2025
Снижение (Некардиальный)
Причины: Снижение Н. pylori, Лучшее хранение пищи
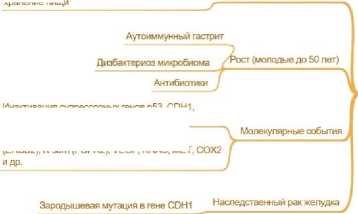
Динамика Заболеваемости
Инактивация супрессорных генов р53, CDH1 hMLHI, RAR-ЬеГаидр,___________________
Активация онкогенов EGFR (HER1), HER2 (ERBB2), K-sam (FGFR2), VEGF, KRAS, MET,
Н. pylori: Связь слабая Риски ,
\ Связь: Ожирение, ГОРБ, АС пищевода
Анатомия / Этиология
Главный
Доп, Риски (диета/образ жизни)
Распространённость: 50% населения
Риски: < 5% у инфицированных
Алкоголь / Курение
'Мясо, Соления, Гриль, Мало фруктов
Локализация: Пищеводножелудочный переход (кардия)
Гистологический тип: Кишечный
Молекулярные маркеры: Анеуплоидия, амплификация генов тирозинкиназ, мутации ТР53
Хромосомнонестабильный РЖ (49,8%)
Клинические маркеры: (нет данных) у

РЖ, ассоциированный с вирусом Эпштейна-Барр (8,8%)
Гистопогический тип: Лкбой
L Молекулярные маркеры
Гилерметилирование
CDKN2A/p16INK4A, гипфэкспрессия
PD-L1 и PD-L2, мугацииР1КЗСА
; (80%), AR ID1A (55%), редкие ТР53
Клинические маркеры: ’-аще у мужчин (81%)
Клинические маркеры: Ранний аозраст манифестации (59 лет)
Локализация: Любая
Гистологический тип: Диффузный
Молекулярные маркеры: Частые мутации в CDH1, RHOA, химерные гены CLDN18/ARHGAP, гиперэкспрессия генов клеточной адгезии и подвижности
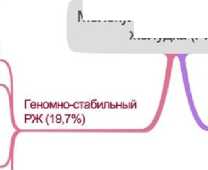
РЖ, ассоциированный с микросателлитной нестабильностью (21,7%)
Локализация: Любая
[ Гистопогический тип: Килечный
Молекулярные маркеры:
Микросателлигная нестабильность, мутации ТР53, KRAS, FIK3A, ARID1A, . гиперметилирование М Н1
Клинические маркеры: Поздний возраст (72 пода), чаще у женщин ущ ____
В 2015 году Азиатская группа по исследованию рака (ACRG) предложила альтернативную классификацию, опирающуюся на полногеномное секвенирование, профилирование экспрессии генов, анализ числа копий и таргетное секвенирование [12]. Эта модель выделяет четыре молекулярных подтипа: MSI, подтип с эпителиальномезенхимальным переходом (MSS/EMT), MSS с мутацией TP53 (MSS/ TP53 +) и MSS с диким типом TP53 (MSS/ TP53 ) (Рис. 4).
Локализация: Любая
Гистологический тип: Любой
Молекулярные маркеры: Стабильные микросателлитные повторы, Нет экспрессии ТР53, частью мутации в ТР53
Клинические маркеры:
Промежуточный прогноз
РЖ с микросателлитной нестабильностью (MSI)
РЖс MSS и инактивированным ТР53

Локализация: Любая
I Гистологический тип: Кишечный
Молекулярные маркеры:
i Микросателлигная нестабильность. Гипермутированный фенотип. Частые мутации в ТР53, KRAS, PIK3A и ARID 1А
Клинические маркеры: Благоприятный прогноз Низкая частота развития рецидивов Лучшие показатели общей , выживаемости
Гистопогический тип: Любой
Молекулярные маркеры: Стабильные микросателлитные повторы. Активная экспрессия ТР53. Высокий процент опухолей с положительным ВЭБ-статусом

РЖ с MSS и фенотипом эпителиально-мезенхимального перехода (15%)
Клинические маркеры:
Промежуточный прогноз
Локализация; Любая
Гистопогический тип: Диффузн ый
I Молекулярные маркеры: Стабильные
I микросателлитные повторы.
I Гипомутированный фенотип.
. Гиперэкслрессия генов эпителиальномезенхимального перехода
Клинические маркеры: Плохой прогноз. Ранний возраст манифестации. Высокая частота развития рецидивов
Частоты, паттерны ко-мутаций, прогностические эффекты и возможности таргетной терапии различаются в зависимости от типа опухоли и этнической принадлежности пациентов [14,15,18].
Частоты мутаций в российской популяции
Анализ российских исследований выявил, что мутации KRAS встречаются с частотой 7,5-9% [7,8]. Мутации NRAS крайне редки (<1%), а мутации BRAF встречаются с еще более низкой частотой (~0,8%), при этом мутация BRAF V600E отсутствует, что согласуется с международными данными [25,28-33] (Табл. 2).
Табл. 2. Спектр мутаций в генах KRAS, NRAS и BRAF по данным российских и международных исследований
|
Россия (Данишевич, 2023) |
Россия (Спирина, 2024) |
Великобритания (van Grieken, 2013) |
Япония (van Grieken, 2013) |
Сингапур (van Grieken, 2013) |
|||||||
|
Всего пациентов |
159 |
21 |
278 |
230 |
204 |
||||||
|
Найдено мутаций |
10 |
15 |
10 |
3 |
|||||||
|
p.G12D |
3 |
30% |
5 |
33% |
6 |
60% |
1 |
33% |
|||
|
KRAS 12 |
p.G12V |
2 |
20% |
9% |
4 |
27% |
0 |
0% |
0 |
0% |
|
|
05 |
p.G12C |
0 |
0% |
1 |
7% |
0 |
0% |
1 |
33% |
||
|
p.G12A |
1 |
10% |
2 |
13% |
0 |
0% |
0 |
0% |
|||
|
KRAS 13 |
p.G13C |
0 |
0% |
1 |
7% |
0 |
0% |
0 |
0% |
||
|
p.G13D |
3 |
30% |
1 |
7% |
4 |
40% |
1 |
33% |
|||
|
KRAS 61 |
Q61H |
1 |
10% |
1 |
7% |
0 |
0% |
0 |
0% |
||
|
aq <4 ^ к V600E |
0 |
0% |
0 |
0% |
1 |
10% |
0 |
0% |
|||
|
Самая распространенная |
p.G12D |
p.G12D |
p |
.G12D |
- |
||||||
|
мутация |
|||||||||||
существенно возрастает при рассмотрении в сочетании с другими генетическими изменениями [8]. Важно оценивать не только наличие мутаций KRAS , но и их корреляцию с такими мутациями, как TP53, PIK3CA, PTEN и HER2 , а также с уровнем экспрессии таких иммунных маркеров, как PD-L1. Корреляция мутаций KRAS с мутациями TP53 , выявленная в исследовании, связана с изменением микросреды опухоли и влиянием на иммунный ответ. Мутации в этих генах способствуют формированию агрессивного фенотипа опухоли с повышенной экспрессией PD-L1, что способствует уклонению от действия иммунной системы. Такой иммунный профиль указывает на потенциал использования иммунных ингибиторов PD-1/PD-L1 в терапии, особенно у пациентов с мутациями KRAS .
Кроме того, мутации KRAS в сочетании с изменениями в PIK3CA и PTEN влияют на активацию сигнальных путей PI3K/AKT/mTOR, что также отражается на ответе опухоли на таргетную терапию. В совокупности с экспрессией PD-L1 эти мутации образуют комплексный молекулярный фон, который определяет чувствительность к различным видам лечения, включая стандартную химиотерапию FLOT и новые иммунотерапевтические подходы.
Заключение
Для определения точной частоты и клинической значимости данных мутаций требуется проведение дополнительных исследований с применением секвенирования нового поколения (NGS) на обширных когортных выборках российских пациентов.
В перспективе необходимо внедрение стандартизированных методов выявления мутаций, расширение проспективных клинических исследований и разработка персонализированных лечебных подходов с использованием новых таргетных препаратов.
Вклад авторов. Джикия Е.Л.: формирование базы литературных источников, написание текста рукописи; Райлян А.А.: подбор литературных источников, написание разделов статьи; Довгань Ф.Н.: анализ и корректировка рукописи; Боженко В.К.: разработка концепции статьи, анализ и интерпретация литературных данных, корректировка рукописи.
Финансирование. Исследования выполнены при поддержке Министерства здравоохранения Российской Федерации, тематика государственного задания № 1023021500033-4-3.2.21;3.1.5 «Проведение II фазы клинических исследований лекарственного средства на основе ингибитора Ras-ГТФазы (К26К) для лечения пациентов с перитонеальным канцероматозом при опухолях желудочно-кишечного тракта».
Соблюдение прав пациентов и правил биоэтики. Данное обзорное исследование было основано на опубликованных работах и поэтому не требовало одобрения этического комитета.


