Обоснование критериев селекционного отбора форм сои с повышенной заморозкоустойчивостью на основе явления криогенной седиментации цитоколлоидов (обзор)
Автор: Зеленцов С.В., Мошненко Е.В., Бубнова Л.А.
Рубрика: Обзорные статьи
Статья в выпуске: 2 (178), 2019 года.
Бесплатный доступ
Серия экспериментов с промораживанием клеточного сока сои, люпина узколистного и льна обыкновенного при температурах от -3 до -20 °С и определением остаточных концентраций цитозолей позволила сформулировать основные положения коллоидной гипотезы заморозкоустойчивости сои на основе явления криогенной седиментации цитоколлоидов. Согласно этой гипотезе цитоплазма сои представляет собой водно-коллоидный раствор (цитозоль). Коллоидные мицеллы цитозоля за счёт поверхностного заряда частично связывают молекулы воды, препятствуя её кристаллизации при докритических отрицательных температурах. Длительное воздействие отрицательных температур на переохлаждённый цитозоль ведёт к непрерывному уменьшению поверхностных зарядов коллоидных мицелл, их критическому взаимному сближению и объединению в крупные агрегаты (коагуляты) и гравитационной седиментации. Раствор цитозоля после выпадения коллоидов в нерастворимый осадок, приобретает свойства истинных растворов с близкой к 0 °С точкой кристаллизации и стремительно кристаллизуется...
Соя, холодоустойчивость, заморозкоустойчивость, клеточный сок, цитозоль, цитоколлоиды, криогенная коагуляция, криогенная седиментация
Короткий адрес: https://sciup.org/142220373
IDR: 142220373 | УДК: 633.853.52:631.52 | DOI: 10.25230/2412-608X-2019-2-178-128-143
Текст обзорной статьи Обоснование критериев селекционного отбора форм сои с повышенной заморозкоустойчивостью на основе явления криогенной седиментации цитоколлоидов (обзор)
Введение . Вследствие непрерывно усиливающейся аридизации целого ряда южных регионов России сельхозтоваропроизводители всё чаще отдают предпочтение выбору очень ранних сортов сои, успевающих созреть до наступления позднелетних пиков засух. Однако такие сорта, как правило, формируют пониженный урожай, по сравнению с более поздними сортами [7].
Одним из альтернативных путей решения проблемы повышения рентабельности полевого растениеводства в засушливых климатических зонах является сдвиг сроков посева яровых культур на более ранние и сверхранние сроки (конец зимы – начало весны), а в некоторых случаях (в климатических подзонах с мягкой зимой) даже их перевод на подзимние посевы [11]. Для этого необходимы холодоустойчивые сорта, обеспечивающие быстрые и дружные всходы, а также активное развитие растений в ранневесенний период на фоне пониженных положительных температур. Кроме этого, холодоустойчивые сорта должны отличаться повышенной заморозкоустойчиво-стью и выживать в случае наступления ранневесенних заморозков.
Мировой опыт изучения экологических требований растений к температуре окружающей среды показывает, что ранние яровые культуры, способные прорастать при пониженных положительных температурах, также способны выдерживать довольно глубокие заморозки – до минус 8–12 °С [1]. Поэтому признаки холодоустойчивости и заморозкоустойчиво-сти вполне успешно сочетаются в одном генотипе и, вероятнее всего, являются следствием действия одних и тех же физиологических и биохимических реакций.
В имеющемся мировом генофонде культурной сои практически нет сортов, способных прорастать в условиях пониженных (ниже 6–8 °С) положительных температур. А ранневесенние заморозки ниже минус 2,5–4,0 °С являются причиной необратимого нарушения проницаемости мембран, замерзания клеточного сока в тканях и гибели растений подавляющего большинства образцов сои [5; 8; 10; 15].
До 2019 г. в Государственный реестр селекционных достижений РФ был включён только один холодоустойчивый сорт сои Славия селекции ФБНУ ФНЦ ВНИИМК, способный выдерживать неоднократные ранневесенние заморозки до минус 5 °С [4]. В то же время сорта сои с повышенной заморозкоустойчивостью имеют широкий потенциальный ареал распространения. Однако эффективность селекционных программ в этом направлении существенно ограничивается недостаточным пониманием внутренних механизмов заморозкоустойчивости сои, препятствующим разработке наиболее результативных методов выделения источников повышенной заморозкоустойчи-вости. Только изучение внутренних механизмов сои, обеспечивающих устойчивость к отрицательным температурам, позволит усовершенствовать существующие или разработать новые методы отбора на этот признак и повысить эффективность дальнейшей селекции на заморозкоустойчивость [3; 7].
Для объяснения особенностей отклика тканей сои на отрицательные температуры нами была сформулирована гипотеза криогенной седиментации коллоидов клеточного сока (коллоидная модель), в основе которой лежат физико-химические процессы, происходящие в переохлаждённой цитоплазме [5; 7]. Эта модель ос- нована на том, что жидкая фаза цитоплазмы с физико-химических позиций представляет собой цитозоль, состоящий из сложного комплекса не только водорастворимых низкомолекулярных неорганических и органических веществ, образующих истинные растворы, но и высокомолекулярных белковых и углеводных соединений, образующих коллоидные растворы [14; 21; 22].
При этом точка замерзания истинного раствора описывается вторым законом Рауля [16]. Согласно этому закону, понижение температуры кристаллизации разбавленных растворов не зависит от природы растворённого вещества и прямо пропорционально молярной концентрации раствора. Эта закономерность описывается следующим уравнением (1):
T ° fr – T fr = Δ T fr = Km , (1)
где T ° fr – температура кристаллизации растворителя;
T fr – температура начала кристаллизации раствора;
К – криоскопическая постоянная растворителя, имеющая физический смысл температуры кристаллизации раствора с молярной концентрацией 1 моль/кг;
m – молярность вещества в растворе.
Точки начала замерзания высокомолекулярных коллоидных растворов намного ниже, чем у истинных растворов, поскольку часть молекул воды в коллоидных мицеллах находится в связанном состоянии [14; 18]. Поэтому коллоидная модель вполне может объяснить тот факт, что при температуре тканей растений сои до минус 1 °С клеточный сок может оставаться в жидкой фазе неограниченно долгое время.
Термодинамическая устойчивость коллоидных систем во многом зависит от температуры среды, размеров коллоидных мицелл и их поверхностных зарядов. За счёт взаимного отталкивания частиц с одноимёнными зарядами и диффузионного 130
эффекта броуновского движения, мицеллы равномерно распределяются в объёме растворителя [2; 18]. На основании обнаруженного Р. Броуном явления броуновского движения, развитого А. Эйнштейном до теории, кинетическая устойчивость золя (жидкой фазы коллоидного раствора), прямо пропорциональна размеру коллоидных частиц [9; 12; 19]. При этом уравнение броуновского движения (2) Эйнштейна выглядит следующим образом:
X 2 = 2 Dt , (2)
где Х – расстояние между взвешенными частицами раствора;
D – коэффициент диффузии частиц, зависящий от концентрации и плотности растворённого вещества; t – время перемещения частиц в растворе на расстояние Х .
Роберт Броун, в 1827 г. впервые наблюдавший в капле воды хаотическое движение пыльцевых зёрен кларкии хорошенькой ( Clarcia pulchella Pursh.) из рода Кипрей, определил их размеры в 1/4000–1/5000 дюйма [20], что в метрической системе составляет около 5000–6000 нм. В 1908–1909 гг. Ж. Перрен, изучив размеры взвешенных в водном растворе сахарозы микрочастиц, фактически подтвердил визуальные измерения Р. Броуна и показал, что уравнение Эйнштейна описывает равновесно-диффузионные возможности броуновского движения размерами частиц 0,212–5,15 мкм (212–5150 нм) [12]. Таким образом, можно считать, что размеры коллоидных мицелл в равновесных цитозолях растений сои также не должны превышать 5000–6000 нм, или 5–6 мкм.
Материалы и методы. Исследования проводили в 2010–2017 гг. на центральной экспериментальной базе ФГБНУ ФНЦ ВНИИМК, г. Краснодар. В качестве совокупного критерия холодо- и замороз-коустойчивости сортообразцов оценивали их заморозкоустойчивость. Слабозаморозкоустойчивыми стандартами в экспериментах служили сорта сои Лира и Чара.
В качестве сортообразцов с повышенной заморозкоустойчивостью использовали сорта сои Славия и Парма. В качестве высокозаморозкоустойчивых растительных модельных объектов использовали люпин узколистный (сорт Смена) и лён обыкновенный (зимостойкая линия ФХЛ-М), с устойчивостью к отрицательным температурам до минус 12 и минус 20 °С соответственно.
Концентрацию цитозолей ω (%) определяли на рефрактометре PR-101а с погрешностью ± 0,1 абс. % по методике Г.М. Саенко и С.В. Зеленцова [13]. Расчёт температур замерзания водных растворов на основе второго закона Рауля [16] выполняли с использованием on-line калькулятора [17].
В рамках эксперимента по изучению динамики концентрации цитозоля при промораживании у сортов сои Чара и Парма, в рулонах фильтровальной бумаги в термостате проращивали семена обоих сортов в течение 3-х суток при температуре 25 °С. Затем извлекали из термостата проростки сои, среди них отбирали типичные, нормально развитые растения без признаков угнетения и болезней, опять закладывали в рулоны фильтровальной бумаги и помещали их в термостат, где выращивали в течение 5 суток при температуре 10 °С в условиях естественного освещения для имитации ранневесенних полевых условий с низкими температурами воздуха и почвы. После 5-суточной экспозиции растения измельчали и прессованием получали из них клеточный сок. Остальные рулоны с растениями помещали в криокамеру для промораживания при температуре минус 3 °С. После включения таймера из криокамеры с интервалом 0,5 ч извлекали по три рулона каждого сорта, из них также получали образцы клеточного сока, у которых на рефрактометре определяли концентрацию. Затем все образцы клеточного сока извлекали из криокамеры, закупоривали и выдерживали при комнатной температуре в течение 15 ч для размораживания и завершения процесса седиментации всего криоколло-идного комплекса. После этого ёмкости с клеточным соком откупоривали и повторно помещали в криокамеру. Вторичное промораживание образцов осуществляли при температуре минус 4 С. Измерения концентрации клеточного сока проводили в течение 4 ч с интервалом 0,5 ч. Все полученные результаты усредняли по трём повторениям в пределах каждого варианта.
Для оценки применимости выявленных у сои коллоидных факторов повышенной заморозкоустойчивости к другим растительным организмам дополнительно изучали динамику изменения концентрации клеточного сока при отрицательных температурах у люпина узколистного, сорта Смена и масличного льна ФХМ-Л. Для этого ранее описанным способом у этих сортообразцов получали проростки растений и отжимали клеточный сок.
Пробирки с растворами клеточного сока в трёх повторениях по каждому варианту помещали в криокамеру, отдельно при минус 5, при минус 15 и при минус 20 °С. После 24-часовой экспозиции при заданных температурных режимах пробирки извлекали из криокамеры, выдерживали при комнатной температуре в течение 24 ч для размораживания и завершения всех процессов коагуляции и седиментации. После этого у всех образцов определяли концентрацию жидкой фазы цитозолей.
Результаты исследований. Исходя из анализа литературы по физической, коллоидной химии и криохимии [2; 9; 14; 18; 21; 22], в случае реакции цитозоля сои на переохлаждение как коллоидной системы, его концентрация в период начального охлаждения может немного снизиться вследствие понижения электрического заряда на поверхности коллоидных мицелл, сопровождающегося высвобождением из них связанной воды и образования слабоконцентрированных областей цитоплазмы со свойствами истинных растворов. Затем в условиях продолжающейся низкотемпературной потери заряда коллоидных частиц и сокращения расстояний между ними концентрация цитозоля должна увеличиваться из-за образования ячеистой гелеподобной пространственной структуры коллоидной фракции с вторичным связыванием свободных молекул воды на основе явления термообратимого гелеобразования. Дальнейшее снижение поверхностных зарядов и взаимное сближение коллоидных частиц приведут к начальной стадии их агрегации (коагуляции). Если масса коллоидных коагулятов превышает диффузионные возможности броуновского движения частиц по обеспечению равномерного распределения коллоидных мицелл в объёме растворителя (то есть размер частиц превысил установленные Р. Броуном размеры 6000 нм или 6 мкм), то в цитозоле развиваются процессы их гравитационного оседания (рис. 1).
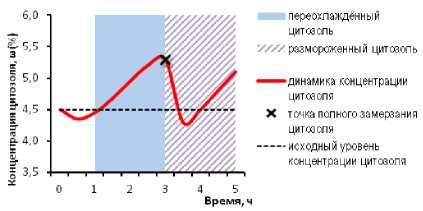
Рисунок 1 – Коллоидная модель динамики концентрации ω (%) цитозоля сои при промораживании
В результате седиментации микрокоагулятов в цитозоле возникает расслоение на верхнюю дисперсионную (водорастворимую) и нижнюю дисперсную (коллоидную) фазы. При дальнейшем нарастании массы коагулирующих коллоидных частиц их седиментация приобретёт более массовый характер. Общая концентрация цитозоля при этом должна резко снизиться до уровня ниже исходного, со сдвигом дисперсионно-коллоидной структуры исходного раствора цитозоля в сторону менее концентрированного истинного 132
раствора. При остаточных концентрациях 2–3 % точка замерзания такого цитозоля, в рамках второго закона Рауля, будет приближаться к нулю, и такой раствор быстро замёрзнет.
Длительное сохранение такого цитозоля в замороженном состоянии может приводить к дополнительному повышению его концентрации за счёт сублимационной возгонки молекул воды в соответствии с кристаллизационной моделью.
Для экспериментальной проверки коллоидной модели заморозкоустойчивости было проведено исследование откликов цитоплазмы сои на температуры минус 3 и 4 °С у сортов Чара и Парма, отличающихся по заморозкоустойчивости на начальных этапах онтогенеза. Дополнительно, с целью оценки возможного модифицирующего влияния на замороз-коустойчивость запасных веществ, поступающих в ткани растений из семядолей, у половины проростков каждого сорта заранее удаляли семядольные листья.
Если заморозкоустойчивость сои действительно определяется комплексом цитоколлоидов, то после промораживания цитозоля этот комплекс должен коагулировать и выпасть в осадок, а концентрация оттаявшего клеточного сока станет меньше. При повторном помещении в среду с отрицательными температурами, при частичном или полном отсутствии в растворе цитоколлоидов, такой клеточный сок должен вести себя как истинный раствор. Для усиления процессов коагуляции и седиментации повторное промораживание осуществляли при более низкой (минус 4 °С) температуре.
Оценка концентрации клеточного сока в динамике показала, что в течение первых 7 ч замораживания этот параметр возрастал у обоих сортов на вариантах с семядолями и с их удалением. При этом образцы клеточного сока, полученные из растений без семядолей, отличались пониженной концентрацией. И только на конечном этапе промораживания (последние 0,5 ч – для сорта Чара, и 2,5 ч для сорта Парма) разница в концентрациях цитозоля растений с семядолями и с их удалением практически нивелировалась (рис. 2).
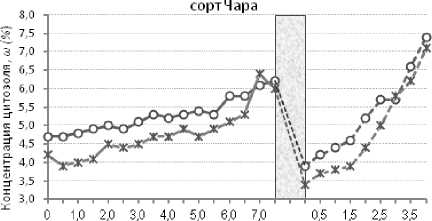
1=1послеморозный периодседиментации КОК Время экспозиции, ч ^<^—цитозоль расте ний с семядолями до замораживания
— О— цитозольрастений ссемядолями после размораживания
-Ж-цитозольрастений без семядолей до замораживания - X™ цитозольрастений без семядолей после размораживания
Рисунок 2 – Динамика концентрации ω (%) клеточного сока сортов Чара и Парма при последовательной экспозиции при минус 3 и минус 4 °С
После размораживания клеточного сока его концентрация оказалась ниже по сравнению с исходным уровнем в начале эксперимента. Затем при вторичном промораживании на фоне температуры минус 4 °С концентрация цитозоля, в соответствии с коллоидной моделью, начала возрастать. И через 4 ч экспозиции возросла у сорта Чара до 7,1–7,4 %, у сорта Парма – до 7,8–7,9 %.
Как и при первичном промораживании при минус 3 °С, в начале экспозиции при температуре минус 4 °С на вариантах с удалением семядолей у обоих сортов была выявлена пониженная концентрация клеточного сока. Следует отметить, что этот факт указывает на значимый вклад семядолей в формирование цитозоля у сои. Только через 3 ч у сорта Чара и через 4 ч у сорта Парма концентрация клеточного сока на этих вариантах сравнялась с концентрацией образцов без удаления семядолей.
У более заморозкоустойчивого сорта Парма после 7-часового воздействия от- рицательных температур седиментационное снижение концентрации клеточного сока ωcr. (%) оказалось больше по сравнению с показателями цитозоля сорта Чара, как в варианте с удалением семядолей, так и без их удаления, что указывает на выпадение из цитозоля в осадок большего количества коллоидов (табл. 1).
Таблица 1
Сортовые различия по седиментационному снижению концентрации цитозоля после 7-часовой экспозиции при минус 3 °С
|
Сорт |
Исходная концентрация цитозоля в растениях, ω in. (%) |
Концентрация цитозоля после седиментации коллоидов, ω cr. (%) |
Разница концентраций между исходным и седиментированным цитозолем, Δ ω (%) |
|||
|
с семядолями |
без семядолей |
с семядолями |
без семядолей |
с семядолями |
без семядолей |
|
|
Чара |
4,7 |
4,2 |
3,9 |
3,4 |
0,8 |
0,8 |
|
Парма |
5,6 |
4,6 |
4,5 |
3,6 |
1,1 |
1,0 |
Таким образом, можно утверждать, что повышенная устойчивость сорта Парма к отрицательным температурам, определяется как повышенной концентрацией раствора цитозоля в целом, так и повышенной массовой долей криопротекторных коллоидов в цитозоле.
В целом, анализ результатов проведённого эксперимента показал, что в условиях отрицательных температур динамика концентрации клеточного сока у сои вполне адекватно описывается коллоидной моделью. В рамках этой модели в цитоплазме растений сои можно предположить наличие определённого комплекса обладающих криопротекторными свойствами коллоидов. Выявленные между сортами сои с различной устойчивостью к отрицательным температурам различия в динамике остаточных после седиментации концентраций цитозоля позволяют их использовать в качестве нового критерия при лабораторной оценке сорто-образцов сои на заморозкоустойчивость.
Согласно нашим экспериментальным наблюдениям, при понижении температуры цитозолей сои до минус 1,0—1,5 ° С они 133
остаются в жидкой фазе, с полным сохранением жизнеспособности органелл клеток. Однако дальнейшее понижение температур ниже критического уровня заморозко-устойчивости сои (до минус 4-5 °С и ниже) приводит к их постепенной кристаллизации. При этом, согласно литературным данным [9; 14; 18], у коллоидных мицелл последовательно снижается величина поверхностного заряда, вплоть до нулевых значений. В результате потери заряда коллоидные частицы сближаются между собой, коагулируют в укрупнённые агрегаты и выпадают в осадок. Модельный эксперимент с промораживанием клеточного сока сои в течение 5 ч до минус 5 и 15 °С подтверждает эти заключения (рис. 3).

а б
в
Рисунок 3 - Развитие седиментационного процесса при промораживании профильтрованного клеточного сока сои, сорт Лира:
а - исходное состояние цитозоля, концентрация раствора - 4,7 %;
б - после промораживания при минус 5 °С, концентрация раствора над осадком - 3,6 %; в - после промораживания при минус 15 °С, концентрация раствора над осадком - 3,4 %
Прозрачность клеточного сока в пробирке на рис. 3 а определяется тем, что коллоидные мицеллы равномерно распределены в растворе, а их линейные размеры меньше длин волн видимого спектра света, то есть менее 380–780 нм. Вследствие чего световые волны свобод-134
но огибают цитоколлоидные частицы, а не отражаются от них. Исходная концентрация цитозоля у сорта Лира в этом эксперименте составила 4,7 %.
На рис. 3 б помутнение клеточного сока в верхней части пробирки вызвано коагуляционным укрупнением коллоидных частиц, размеры которых уже превышают длины волн видимого света (> 380780 нм), Но поскольку эти видимые частицы ещё поддерживаются броуновским движением во взвешенном состоянии, их размеры не должны превышать 5000– 6000 нм.
В таком цитозоле уже на начальных стадиях коагуляции часть ранее связанных на поверхности мицелл молекул воды высвобождается. В результате между укрупнёнными коллоидными агрегатами образуются менее концентрированные области со свойствами, приближающимися к истинным растворам, снижающие общую концентрацию цитозоля, в данном случае до 3,6 %. Светлая взвесь в нижней половине пробирки на рис. 3 б - более крупные (> 6000 нм) седиментировавшие коллоидные коагуляты, опускающиеся ко дну пробирки под действием гравитации.
На рис. 3 в процессы коагуляции и седиментации, в основном, уже завершены и на дне пробирки сформировался непрозрачный осадок. Объём цитозоля над осадком практически прозрачен, в нижней части с небольшими областями помутнения. Большинство ранее связанных коллоидами молекул воды высвобождены, что привело к дальнейшему снижению концентрации жидкой фазы цитозоля. Его компонентный состав в этой фазе, преимущественно, должен состоять из продуктов фотосинтеза и гидролиза крахмала в семядолях - моно- и дисахаридов, а также, возможно, небольшой части более криостабильных коллоидов. В нашем эксперименте остаточная концентрация цитозоля составила 3,4 %. При расчёте точки замерзания по молярной массе глюкозы (180,16 г/моль), этот параметр составляет всего минус
0,36 °С; по молярной массе сахарозы (342,2965 г/моль) ещё выше – минус 0,19 °С [17].
Можно сделать предположение, что термодинамическая стабильность переохлаждённого цитозоля сои должна определяться как массовой долей коллоидных фракций в исходном растворе, так и устойчивостью электрических зарядов их мицелл, определяющих скорость коагуляции и седиментации при воздействии отрицательных температур.
Тогда сортообразцы сои с повышенной заморозкоустойчивостью в условиях око-локритических отрицательных температур, например, при минус 2,5–5,0 °С, должны отличаться пониженной коагуляцией и седиментацией цитоколлоидов. При этом в их клеточном соке массовая доля коллоидной фракции теоретически должна быть выше, чем у обычных образцов. Поэтому в случае длительного охлаждения высокозаморозкоустойчивых образцов до сверхкритических для сои (ниже минус 5 °С) температур, вследствие массовой коагуляции потерявших заряды коллоидных частиц, общий объём выпавших в осадок коагулятов должен быть больше по сравнению со слабозаморозкоустойчивыми образцами сои.
Для проверки этого предположения перед промораживанием образцов клеточного сока слабозаморозкоустойчивого сорта Лира и высокозаморозкоустойчивого сорта Славия, с целью визуализации дисперсной и дисперсионной фаз, в пробирки с клеточным соком добавляли 1%-ный раствор бисдиметиламинофенотиоцианит хлорида C 16 H 18 ClN 3 S (метиленовый синий) в пропорции 1 : 10. Использование метиленового синего было обусловлено тем, что ранее нами было экспериментально установлено, что этот краситель длительное время сохраняет свою окраску в истинных растворах, но вступает в реакции с коллоидными мицеллами с образованием неокрашенных соединений.
Визуальный анализ изначально равномерно окрашенных образцов цитозоля, после их 24-часовой экспозиции при минус 5 °С и завершения всех процессов коагуляции и седиментации, показал заметные различия между сортами (рис. 4).
Как следует из рисунка 4, в исходном состоянии цитозоли обоих сортообразцов сои были непрозрачными и имели равномерно голубую окраску. После 24-часового промораживания цитозоль слабоустойчивого к отрицательным температурам сорта Лира разделился на три фазы (рис. 4 б ).

а б в
Рисунок 4 – Криоседиментационное фракционирование цитозоля двух сорто-образцов сои с различной заморозко-устойчивостью после 24-часовой экспозиции при температуре минус 5 °С: а – исходное состояние цитозоля обоих образцов сои;
б – цитозоль слабозаморозкоустойчивого сорта Лира после промораживания;
в – цитозоль высокозаморозкоустойчивого сорта Славия после промораживания
В нижней части сформировался коричневатый осадок из седиментировавших коагулятов. Среднюю часть занимает полупрозрачный раствор с очень мелкими светлыми частицами микроагрегатов коллоидов. В самом верхнем слое цитозоля расположен непрозрачный голубой слой, предположительно представляющий собой близкий к истинному раствор из водорастворимых соединений.
Цитозоль высокозаморозкоустойчивого сорта Славия расслоился на четыре фазы (рис. 4 в ). В придонной части также образовался коричневатый осадок коагулятов. Однако его объём несколько меньше аналогичной фракции у цитозоля сорта Лира. Средняя часть столба цитозоля оказалась разделена на две фазы. В нижней половине этой части цитозоль полупрозрачен, с видимыми мелкими частицами микрокоагулятов. Верхняя половина средней части столба цитозоля стала практически прозрачной и не имела видимых включений. Однако на просвет в ней заметны признаки опалесценции (слабого рассеяния света), свойственные коллоидным растворам. Самый верхний, окрашенный метиленовым синим, слой оказался в два раза меньше по сравнению с цитозолем сорта Лира.
В целом этот эксперимент показал, что у более заморозкоустойчивого образца сои при суточном промораживании при минус 5 °С в осадок выпало меньше коагулятов. При этом часть цитоколлоидов при таком режиме промораживания оказалась термодинамически устойчивой без видимых признаков коагуляции.
Для изучения связи степени заморозко-устойчивости с общим количеством коллоидов в цитозоле оценили объёмы выпавших в осадок коллоидных коагулятов при длительной экспозиции клеточного сока при сверхкритических для сои отрицательных температурах в криокамере. В эксперименте использовали полученный ранее описанным способом клеточный сок тех же сортов сои Лира и Славия с различной степенью заморозко-устойчивости.
После 24-часовой экспозиции при минус 15 °С пробирки с клеточным соком извлекали из криокамеры, выдерживали при комнатной температуре в течение 8 ч для размораживания и завершения всех процессов коагуляции и седиментации. После этого пробирки с седиментировав- шими цитозолями визуально анализировали (рис. 5).

а б
Рисунок 5 – Объёмы криоседиментацион-ных осадков в цитозоле сортообразцов сои с различной заморозкоустойчивостью после 24-часовой экспозиции при температуре минус 15 °С:
а – цитозоль слабозаморозкоустойчивого сорта Лира после промораживания;
б – цитозоль высокозаморозкоустойчивого сорта Славия после промораживания
Как следует из рисунка 5а, объём выпавших в осадок коагулятов в цитозоле сорта Лира оказался даже несколько меньше по сравнению с его объёмом при седиментации на фоне минус 5 °С. По всей вероятности, в предыдущем эксперименте на момент фотофиксации гравитационное осаждение коагулятов ещё не полностью завершилось. В целом можно предположить, что для термодинамической стабильности цитоколлоидов слабо-замороз-коустойчивого сорта Лира отрицательные температуры на уровне минус 5 °С уже оказались закритически-ми, и большинство коллоидных мицелл, потеряв поверхностный заряд, коагулировали и выпали в осадок. Более низкие температуры практически не оказали зна- чительного влияния на изменение объёма коагулятов.
Объём седиментировавших коагулятов цитоколлоидов у более заморозкоустойчивого сорта Славия после 24-часового промораживания при минус 15 °С визуально оказался заметно больше (см. рис. 5 б ). Следовательно, общий объём цитоколлоидов в цитозоле более устойчивого к заморозкам сорта Славия превышал этот показатель у слабозаморозкоустойчивого сорта Лира. При промораживании этого же сорта при минус 5 °С количество коагулятов в его цитозоле было меньше, чем у сорта Лира, что указывает на повышенную термодинамическую стабильность поверхностных зарядов коллоидной фракции при минус 5 °С цитозоля сорта Славия.
В целом проведённые эксперименты показали, что повышенная заморозко-устойчивость сои в рамках гипотезы отсроченной криогенной седиментации коллоидов может определяться как их массовой долей в цитозоле, так и повышенной стабильностью поверхностных зарядов мицелл при отрицательных температурах, удерживающих их от взаимного сближения, коагуляции и седиментации.
Исходя из результатов предыдущих экспериментов с образцами сои, более высокая заморозкоустойчивость люпина узколистного и льна обыкновенного гипотетически также может определяться как более высокой, по сравнению с соей, массовой долей коллоидов в цитоплазме, так и повышенной стабильностью заряда поверхности коллоидных мицелл при отрицательных температурах. Если одно из этих предположений подтвердится, то можно будет говорить об определённой универсальности цитоколлоидного механизма заморозкоустойчивости, а возможно, и морозоустойчивости у цветковых растений.
Для проверки этого предположения образцы клеточного сока двух сортов сои Лира и Славия с различной заморозко- устойчивостью, а также образцы клеточного сока люпина и льна одновременно при одних и тех же условиях в течение 24 ч промораживали в криокамере отдельно при температурах минус 5, при минус 15 и при минус 20 °С.
Анализ концентрации седиментировавших цитозолей изучаемых образцов показал, что при суточной экспозиции в криокамере при температуре минус 5 °С образец цитозоля сорта сои Лира с низкой заморозкоустойчивостью уже отличался значительным (на 1,2 абс. %, или на 28 относит. %) снижением концентрации цитоплазмы за счёт интенсивной седиментации коагулятов. Концентрация цитозоля более заморозкоустойчивого сорта сои Славия при этих условиях снизилась всего на 0,5 абс. %, или на 12 относит. %. Цитозоли люпина узколистного и масличного льна после 24-часового промораживания при минус 5 °С остались в жидкой фазе без видимых признаков коагуляции и седиментации коллоидов. Их концентрация также оставалась на уровне исходных значений (рис. 6).
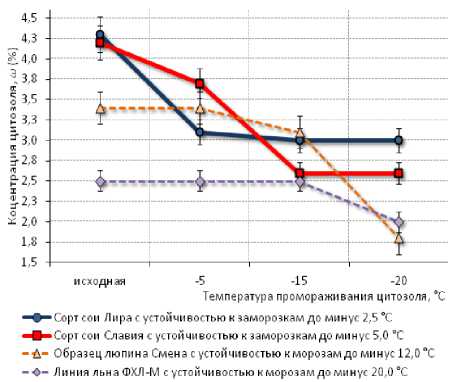
Рисунок 6 - Концентрации го (%) цитозолей образцов сои, люпина узколистного и масличного льна после суточного промораживания при температурах минус 5, минус 15 и минус 20 ° С
При промораживании при минус 15 °С седиментационное снижение концентра-137
ции цитозоля слабозаморозкоустойчивого сорта сои Лира уменьшилось всего на 2 относит. % относительно режима промораживания при минус 5 °С – до 3,0 абс. %, и составило 70 относит. % от исходного состояния. В то же время у высокоустойчивого к заморозкам сорта сои Славия снижение концентрации цитозоля от исходного уровня составило 1,6 абс. %, или 38 относит. %. При этом же режиме промораживания отмечена частичная кристаллизация клеточного сока и незначительное (на 0,3 абс. %, или 9 относит. %) уменьшение концентрации цитозоля у люпина. Цитозоль линии льна ФХЛ-М оставался в жидкой фазе и сохранил исходный уровень концентрации.
Экспозиция цитозолей обоих образцов сои при минус 20 °С практически не повлияла на изменение их остаточной концентрации по сравнению с их экспозицией при минус 15 °С. При этом концентрация цитозоля люпина снизилась почти в два раза (на 47 относит. %) по сравнению с исходным уровнем. Концентрация цитозоля самого устойчивого к отрицательным температурам в опыте образца льна ФХЛ-М только при снижении температуры до минус 20 °С начала снижаться, составив 2,0 абс. %, или 80 относит. %, от исходного уровня.
В целом, полученные экспериментальные результаты показывают, что наиболее заморозко- и морозоустойчивые в опыте образцы люпина и льна отличаются самой высокой стабильностью концентрации цитозоля при 24-часовой экспозиции на фоне отрицательных температур минус 15 и минус 20 °С. При этом самый морозоустойчивый образец – линия масличного льна ФХЛ-М, характеризовался минимальной в опыте исходной концентрацией цитозоля – 2,5 абс. %. Второй по криоустойчивости образец – цитозоль люпина узколистного с полевой устойчивостью к морозам до минус 12 °С, имел исходную концентрацию клеточно-138
го сока 3,4 абс. %, что было на 0,9– 0,8 абс. % ниже, чем у сортов сои Лира и Славия.
При анализе динамики концентраций у образцов сои у высокозаморозкоустойчивого сорта Славия при критической для сои температуре минус 5 °С выявлено меньшее, в сравнении сортом Лира, снижение концентрации цитозоля. Это также может свидетельствовать о повышенной устойчивости цитоколлоидов сорта Славия к криокоагуляции. В то же время у этого сорта подтверждено наличие увеличенного количества седиментировавших коллоидов в условиях сверхкритических отрицательных температур (минус 15 °С).
Таким образом, можно считать подтверждённым на образцах цитозолей трёх видов растений (соя культурная, люпин узколистный и лён обыкновенный) двух семейств (сем. Бобовые и Льновые), что признак повышенной заморозкоустойчи-вости преимущественно определяется криостабильностью поверхностных зарядов коллоидных мицелл при критических отрицательных температурах, сдерживающих их сближение и коагуляцию. Для сои дополнительным фактором уровня заморозкоустойчивости также может быть увеличенная доля коллоидной фракции цитозоля.
Серия проведённых экспериментов и всесторонний анализ полученных результатов позволили нам сформулировать основные положения коллоидной гипотезы заморозкоустойчивости сои на основе явления криоседиментации цитоколлоидов:
-
1. Цитоплазма сои представляет собой водно-коллоидный раствор (цитозоль), включающий, помимо истинных растворов низкомолекулярных неорганических и органических водорастворимых соединений, гидратированные коллоидные фракции с различной молекулярной массой и физико-химическими свойствами.
-
2. Присутствующие в цитозоле коллоидные мицеллы за счёт поверхностного заряда частично связывают молекулы воды, препятствуя её кристаллизации при докритических (для сои - до минус 1,01,5 °С) отрицательных температурах. Поэтому связанная вода имеет пониженную точку кристаллизации в отличие от несвязанной воды, точка кристаллизации которой определяется только концентрацией водного раствора.
-
3. На первых этапах понижения температуры цитозоля до отрицательных значений цитоколлоиды некоторое время сохраняют поверхностный заряд мицелл, препятствующий их сближению и коагуляции, обеспечивая сохранение цитозоля в состоянии переохлаждённого коллоидного раствора, также позволяющего сохранять полную жизнеспособность органоидов и мембран клеток сои.
-
4. Дальнейшая экспозиция цитозоля при отрицательных температурах, за счёт формирования из коллоидных мицелл рыхлых пространственных структур, приводит к его постепенному застудневанию с сохранением части молекул воды в связанном состоянии. Это временное (в зависимости от значений отрицательных температур - от 1 до 5-6 ч) агрегатное состояние цитозоля позволяет сохранять жизнеспособность всех органоидов и мембран клеток сои.
-
5. Длительное воздействие отрицательных температур на переохлаждённый цитозоль ведёт к непрерывному уменьшению поверхностных зарядов коллоидных мицелл, их критическому взаимному сближению и объединению в крупные агрегаты (коагуляты) и гравитационной седиментации. Раствор цитозоля после выпадения коллоидов в нерастворимый осадок приобретает свойства истинных растворов с близкой к 0 °С точкой кристаллизации и стремительно кристаллизуется.
-
6. Увеличение массовой доли цитоколлоидов в цитозоле приводит к увеличению доли связанной воды с пониженной точкой кристаллизации и более интенсивному застудневанию переохлаждённо-
- го цитозоля с более длительной отсрочкой его кристаллизации.
-
7. Скорость коагуляции и скорость седиментации цитоколлоидов соевого цитозоля определяется их структурной устойчивостью к криогенной потере поверхностных зарядов мицелл. Чем стабильнее поверхностный заряд в низкотемпературных условиях, тем более устойчив коллоид к криокоагуляции и седиментации.
Положения коллоидной гипотезы позволяют сформулировать основные элементы и этапы криоседиментационного метода селекционного отбора сои на повышенную заморозкоустойчивость. Эти критерии включают в себя следующие шаги:
-
1. Определение исходной концентрации клеточного сока (цитозоля) в фазе растений с максимальной вероятностью попадания под заморозки. При очень раннем посеве сои под ранневесенние заморозки вероятнее всего попадут растения в фазе семядольных и примордиальных листьев.
-
2. Определение концентрации цитозоля в образцах после 5–7 ч (вероятный период воздействия заморозка) промораживания при заданных околокритических отрицательных температурах (например, при минус 5 °С).
-
3. Определение концентрации цитозоля в образцах после 5–7 ч промораживания при сверхкритических отрицательных температурах (например, при минус 15 °С), при которых в осадок выпадает основная часть коллоидной фракции цитозоля.
-
4. Все три значения концентрации цитозоля, включая исходную, после промораживания при минус 5 °С и после промораживания при минус 15 °С используются для определения степени холодоустойчивости с применением разработанного нами уравнения термодинамической устойчивости цитозоля к отрицательным температурам (3).
-
— ( toin. - toCr. ) _ A to 1
-
( tocr. - to scr. ) A to 2
где Cr – индекс термодинамической устойчивости цитозоля к отрицательным температурам;
ω in. – начальная концентрация цитозоля;
ω cr. – концентрация цитозоля, седиментировавшего при околокри-тических отрицательных температурах, приводящих к развитию криоповреждений растений;
ω scr. – концентрация цитозоля, седиментировавшего при сверхкритических отрицательных температурах, приводящих к необратимой криогибели растений;
Δ ω 1 – разница между начальной и околокритической концентрациями цитозоля;
Δ ω 2 – разница между околокритиче-ской и сверхкритической концентрациями цитозоля.
Согласно уравнению (3) термодинамическая холодоустойчивость цитозоля будет тем выше, чем меньше разница между начальной и седиментировавшей при около-критических отрицательных температурах концентрациями и чем выше разница между околокритической и сверхкритической концентрациями цитозоля.
Практическую применимость криоседи-ментационного метода оценки заморозко-устойчивости оценивали при изучении клеточного сока серии линий сои, выделившихся в 2013 г. при очень ранних посевах (26 марта) по признаку повышенной холодоустойчивости (табл. 2).
Как следует из таблицы 2, слабозаморозкоустойчивые сортообразцы при промораживании в условиях околокритиче-ских (минус 5 °С) температур отличались повышенным седиментационным снижением концентрации цитозоля (на 25 относ. %). Снижение концентрации цитозоля при минус 15 °С оказалось незначительно выше – относительно исходного уровня на 27– 29 относ. %. Индекс холодоустойчивости Cr у этих образцов составил Cr = 0,08–0,15.
Среднезаморозкоустойчивые линии № 2816 и 2823 отличались несколько меньшим снижением концентрации цитозоля при минус 5 °С – на 20–22 относ. %. Но при минус 15 °С концентрация их цитозолей понизилась относительно исходного уровня уже на 29–33 относ. %. Индекс холодоустойчивости у этих линий составил Cr = 0,40–0,55.
Криоседиментационное уменьшение концентрации цитозоля при минус 5 °С практически у всех сортообразцов с повышенной заморозкоустойчивостью было в 2,0–2,5 раза меньше по сравнению со слабозаморозкоустойчивой группой образцов и составляло всего 10–13 относ. %. При минус 15 °С концентрация их цитозолей уменьшилась значительнее – на 37– 43 относит. %. Индексы холодоустойчивости в пределах этой группы варьировали в пределах Cr = 2,00–2,80.
Один из самых холодоустойчивых образцов – линия № 2859 (Л-2577 × Aldana) с индексом холодоустойчивости Cr = 2,80 под коммерческим названием «Ирбис» в 2016 г. был передан на Государственное сортоиспытание [6]. С 2019 г. холодоустойчивый сорт сои Ирбис включён в Государственный реестр селекционных достижений РФ и допущен к использованию в Северо-Кавказском и ЦентральноЧернозёмном регионах РФ.
Ещё одна холодоустойчивая линия № 2842 (и.о. Парма) с индексом холодоустойчивости Cr = 2,67 под коммерческим названием «Барс» проходит Государственное сортоиспытание в СевероКавказском, Центрально-Чернозёмном и Дальневосточном регионах РФ с 2018 г. В 2018 г. на Государственное сортоиспытание под коммерческим названием «Иней» была передана третья холодоустойчивая ( Cr = 2,67) линия № 2845 (Белогорская × Фора).
Табл. 2
Выводы. Таким образом, проведённые исследования позволили сформулировать основные положения коллоидной гипотезы заморозкоустойчивости сои на основе явления криоседиментации цитоколлоидов.
Предложенная гипотеза убедительно описывает такое явление, как длительная устойчивость к кристаллизации цитозоля сои при температурах до минус 1,0–1,5 °С. В рамках этой гипотезы показано, что сохранение переохлаждённого цитозоля сои в жидкой фазе определяется массовой долей цитоколлоидов и термодинамической стабильностью их поверхностных зарядов при отрицательных температурах.
Сформулированы основные элементы криоседиментационного метода селекционного отбора сои на повышенную замо-розкоустойчивость и уравнение расчёта термодинамической устойчивости цитозоля к отрицательным температурам.
Показано, что термодинамическая холодоустойчивость цитозоля сои будет тем выше, чем меньше разница между начальной и седиментировавшей при околокри-тических отрицательных температурах концентрациями и чем выше разница между околокритической и сверхкритической концентрациями цитозоля.
С использованием ранневесенних полевых посевов и лабораторного криоседи-ментационного метода выделена и передана на государственное сортоиспытание серия холодоустойчивых сортов сои с полевой заморозкоустойчивостью в фазе примордиальных листьев до минус 5,0 °С.
Список литературы Обоснование критериев селекционного отбора форм сои с повышенной заморозкоустойчивостью на основе явления криогенной седиментации цитоколлоидов (обзор)
- Березина Н.А., Афанасьева Н.Б. Экология растений. -М.: Изд. центр «Академия», 2009. -С. 181-187.
- Биохимическая термодинамика/Под ред. М. Джоунса, пер. М.Г. Гольфельда -М.: Мир, 1982. -С. 204-205.
- Бубнова Л.А., Зеленцов С.В. Отбор заморозкоустойчивых генотипов сои на ранних этапах онтогенеза -Современные тенденции в сельском хозяйстве//Сб. тр. I Междунар. интернет-конф. -Казань: ФГАОУ ВПО Казанский (Приволжский) Федеральный университет, 15-17 октября 2012 г. -С. 39-43.
- Зеленцов С.В., Мошненко Е.В. Перспективы использования сверхранних посевов сои в условиях Краснодарского края//Масличные культуры. Науч.-тех. бюл. ВНИИМК. -2010. -Вып. 1 (142-143). -С. 87-94.
- Зеленцов С.В., Мошненко Е.В., Рябенко Л.Г., Зеленцов В.С., Будников Е.Н., Бубнова Л.А., Вайлова А.В. Роль цитоколлоидов в формировании морозо-и заморозкоустойчивости яровых культур на примере сои и льна//Проблемы современной науки и образования. -2015. -№ 12 (42). -С. 102-107.
- Зеленцов С.В., Мошненко Е.В., Ткачёва А.А, Рамазанова С.А., Трунова М.В., Будников Е.Н., Бубнова Л.А., Олейник В.И. Высокобелковый холодоустойчивый сорт сои Ирбис//Масличные культуры. Науч.-тех. бюл. ВНИИМК. -2017. -Вып. 3 (171). -С. 115-119.
- Зеленцов С.В., Мошненко Е.В., Бубнова Л.А., Зеленцов В.С. Некоторые аспекты устойчивости растений к отрицательным температурам на примере сои и масличного льна.//Масличные культуры. Науч.-тех. бюл. ВНИИМК. -2018. -Вып. 2 (174). -С. 55-70.
- Кошкин Е.И. Физиология устойчивости сельскохозяйственных культур. -М.: Дрофа, 2010. -С. 80-121; 123-148.
- Левченков С.И. Физическая и коллоидная химия. Ч. 4. Коллоидная химия. -Ростов-на-Дону, РГУ, 2004. -С. 26-27.
- Лукомец В.М., Бочкарёв Н.И., Зеленцов С.В., Мошненко Е.В. Создание сортов сои с расширенной адаптацией к изменяющемуся климату Западного Предкавказья//Труды Кубанского государственного аграрного университета. -2012. -Т. 1. -№ 35. -С. 248-254.
- Оценочный доклад об изменениях климата и их последствиях на территории Российской Федерации. Т. I. Изменения климата/Под общ. ред. А.И. Бедрицкого, В.Г. Блинова, Д.А. Гершинковой . -М.: Росгидромет, 2008. -227 с.
- Перрен Ж. Атомы//Современные проблемы естествознания. Книга 20/Под ред. А.Д. Архангельского и др. -М.: Госиздат, 1921. -С. 123-124, 134-138.
- Саенко Г.М., Зеленцов С.В. Отбор толерантных к пепельной гнили генотипов сои на основе онтогенетической динамики осмотического давления клеточного сока//Масличные культуры. Науч.-тех. бюл. ВНИИМК. -2011. -Вып. 2 (148-149). -С. 74-81.
- Сергеев Г.Б., Батюк Б.А. Криохимия. -М.: Химия, 1978. -296 с.
- Степанова В.М. Климат и сорт. Соя. -Л.: Гидрометиздат, 1985. -С. 97-142.
- Стромберг А.Г., Семченко Д.П. Физическая химия. -М.: Высшая школа, 2001. -С. 192-199.
- Температура начала кипения и кристаллизации (замерзания) растворов неэлектролитов . -URL: http://planet-calc.ru/352/(дата обращения: 21.03.2019).
- Хмельницкий Р.А. Физическая и коллоидная химия. -М.: Высшая школа, 1988. -С. 174-177.
- Эйнштейн А. К теории броуновского движения//В сб.: А. Эйнштейн. Собр. соч. -М.: Наука, 1966. -Т. 3. -С. 118-127.
- Brown R. A brief account of microscopical observations made on the particles made in the months of June, July, and August, 1827, on the particles contained in the pollen of plants; and on the general existence of active molecules in organic and inorganic bodies // In: The miscellaneous botanical works of Robert Brown / Ed. by J.J. Bennett, 1866. - Vol. 1. - P. 466-483 [Репринтное издание] [Электронный ресурс]. - URL: https://en.wikisource.org/wiki/ The_miscellaneous_botanical_works_of_Robert_Brown/Volume_1/A_brief_account_of_microscopical_observations_made_on_the_particles_contained_in_the_pollen_of_plants (дата обращения: 20.03.2019).
- Clegg J.S. Properties and Metabolism of the Aqueous Cytoplasm and its Boundaries//The American Journal of Physiology. -1984. -Vol. 246. -No. 2 (Pt. 2). -P. 133-151.
- Luby-Phelps K. Cytoarchitecture and physical properties of cytoplasm: volume, viscosity, diffusion, intracellular surface area//International review of Cytology. -2000. -Vol. 192. -P. 189-221.


