Оценка антипролиферативной активности пептидного ингибитора E2F в условиях in vitro
Автор: Кулинич Т.М., Иванов А.В., Захаренко М.В., Горбаренко А.В., Боженко В.К.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Молекулярная медицина
Статья в выпуске: 4 т.22, 2022 года.
Бесплатный доступ
Соединение возможности целевой доставки пептидов в клетку и обнаружение коротких функциональных доменов в белках регуляторах различных клеточных функций создали предпосылки для конструирования молекул, имеющих патогенетическую направленность. Относительная простота синтеза таких молекул позволяет говорить о принципиальной возможности создания на их основе индивидуальных химиопрепаратов, т.е. соединений, влияющих на патологические изменения свойственных данной конкретной опухоли. Белки семейства E2F - перспективные мишени для создания новых противоопухолевых препаратов. Они являются ключевыми эффекторами сигнального пути Cdk-Rb-E2F, и возможность воздействия на их активность открывает большие возможности в регулировании пролиферативной активности опухолевых клеток. В статье приведены результаты исследования антипролиферативных свойств последовательности пептидного ингибитора E2F1 на клеточных линиях рака легкого и колоректального рака.
Онкология, e2f, иммунотерапия, пептидная последовательность
Короткий адрес: https://sciup.org/149142262
IDR: 149142262
Текст научной статьи Оценка антипролиферативной активности пептидного ингибитора E2F в условиях in vitro
Финансирование: Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта №20-015-00068/22.
Evaluation of the antiproliferative activity of the peptide inhibitor E2F in vitro
Kulinich T. M., Ivanov A.V., Zarharenko M.V., Gorbarenko A.V., V. K. Bozhenko
Federal State Budgetary Institution "Russian Scientific Center of Roentgenoradiology" of the Ministry of Healthcare of the Russian Federation (RSCRR), Moscow 117997, Profsoyuznaya, 86 Authors
Введение
Семейство факторов транскрипции E2F (E2Fs) состоит у млекопитающих из восьми генов. Эти гены кодируют десять белков, которые обычно классифицируются как транскрипционные активаторы или транскрипционные репрессоры. Сигнальный путь передачи митотического сигнала циклин-зависимые киназы – Rb-E2F является важнейшим транскрипционным механизмом, направленным на стимуляцию пролиферации, контролирующим сроки и точность репликации генома, обеспечивающим сохранность генетического материала [9]. При нахождении клетки в фазе покоя (G0) белок Rb образует комплекс с E2F и DP (Rb-E2F-DP), при получении миитотического сигнала следует каскад реакций, в результате которых происходит фосфорилирование Rb и выход E2F из комплекса. Передача сигнала обеспечивается путем последовательного образования комплексов циклин/циклин-зависимая киназа, а регулирование происходит за счет изменения уровня циклинов и фосфорилирования Rb в зависимости от фазы клеточного цикла. Конечными эффекторами сигнального пути Rb-E2F являются восемь генов семейства E2F 1-8, кодирующие активаторы транскрипции (E2F1, E2F2, E2F3a) и ингибиторы транскрипции (E2F3b, E2F4, E2F5, E2F6, E2F7, E2F8); а также ген белка ретинобластомы (Rb), один из основных супрессоров опухолевого роста.
Белки семейства E2F участвуют во многих клеточных процессах, их важнейшая роль заключается в регуляции процессов клеточного деления, но также показано их участие в ангиогенезе, репарации ДНК, апоптозе и ряде других не менее важных, внутриклеточных процессах [12]. Транскрипционная активность генов E2Fs строго регулируется на протяжении всего клеточного цикла посредством транскрипционной и трансляционной регуляции, посттрансляционных модификаций, фосфорилированием белков, связывания с ко-факторами и изменением внутриклеточной локализации. Нарушения, мутации одного или нескольких компонентов сигнального пути циклин-зависимые киназы – Rb-E2F (CDK, циклины, ингибиторы CDK или белков E2F, или Rb) обнаруживаются при большинстве онкологических заболеваний [9]. Показана связь активности белков E2Fs не только с процессами пролиферации в опухолевых клетках, но и с возможностью к метастазированию, развитием лекарственной резистентности, возникновением рецидивов, в связи с чем E2Fs рассматриваются как перспективные биомаркеры и терапевтические таргетные мишени [6]. Внедрение в клиническую практику таргетных препаратов значительно улучшило результаты лечения больных со злокачественными опухолями, многие из которых считались резистентными к существующей химиотерапии и характеризовались крайне неблагоприятным прогнозом. В настоящее время в Российской Федерации зарегистрировано и применяются для лечения солидных опухолей около 40 препаратов, большая часть которых направлена на лечение больных раком легкого, молочной железы, меланомы, колоректальным раком, раком почки. Активно ведется поиск потенциальных мишеней и разработка новых препаратов направленного действия; на конгрессе ASCO в 2022 году большое внимание было уделено испытаниям препаратов, направленно воздействующих на разнообразные новые молекулярные мишени, в том числе препаратов, направленных на мишени, не специфичные для отдельных локализаций опухолей, и потенциально способных приобрести так называемые «tumor-agnostic» показания [8]. E2Fs и Rb, для которых характерны нарушения при опухолях различных локализаций, представляют собой оптимальные мишени для создания «агностических» противоопухолевых препаратов.
Не менее важной проблемой, чем поиск мишеней, является эффективная доставка лекарственных препаратов, особенно необходимая при воздействии на внутриклеточные мишени. Активные вещества большинства таргетных препаратов нестабильны, могут подвергаться биодеградации в организме и удаляться из него, не достигая клеточных мишеней [1]. В настоящее время предложено несколько вариантов решения проблемы эффективной внутриклеточной доставки, в частности использование наночастиц [5,10], экзо-или липосом [3], рецепторно опосредованный транспорт [4]. Один из вариантов решения проблемы адресной доставки – это использование технологии интернализуемых пептидов (ИнП, CPP – cellpenetrating peptide). ИнП представляют собой короткие последовательности аминокислот (n=15-30), способные выполнять векторные функции в отношении пептидных последовательностей и соединений другой химической природы (РНК, ДНК) [7,11].
Начиная с 2003 г., на базе ФГБУ «РНЦРР» активно ведется поиск возможности создания таргетных противоопухолевых препаратов, воздействующих на ключевые молекулы пролиферации и апоптоза с использованием технологии ИнП. В данной статье изложены результаты исследования антипролиферативных свойств пептидной последовательности, включающей ингибитор E2F-1 и ИнП (Tat) [13].
Целью данного исследования являлось определение цитостатических свойств пептидной последовательности, ингибитора E2F-1, полученной с помощью методов математического моделирования, в отношении опухолевых линий рака легкого и колоректального рака.
Материалы и методы
Объектом исследования являлась пептидная последовательность (E2F-1), потенциальный ингибитор соответствующего белка. Для обеспечения внутриклеточного транспорта исследуемая последовательность включала ИнП - Tat (фактор транскипционной активности ВИЧ).
Исследование проведено in vitro на культивируемых клетках линий опухолей человека: А549 и Н1299 (рак легкого), НТ29 и НСТ116 (аденокарцинома толстой кишки). Клетки культивировали в стандартных условиях: 37 ºС, 5% СО2, среда DMEM (ПанЭко), содержащая 10% эмбриональной телячьей сыворотки (ЭТС) (ПанЭко), 50 мкг/мл гентамицина и 2 мМ L-глутамина. Пересев клеток осуществлялся таким образом, чтобы на момент добавления к среде исследуемых пептидных последовательностей конфлюэнтность составляла 40-50%.
Динамика пролиферации клеточных популяций была оценена с помощью биосенсорной технологии RTCA iCELLIgence (ACEA Biosciences) по изменению показателя «клеточный индекс». Принцип метода основан на измерении клеточного сопротивления электродами, располагающимися на дне лунки планшета. В присутствии клеток, они присоединяются к сенсорной поверхности электрода и действуют как изолятор, что приводит к изменению локального ионного окружения на границе раствора/электрода, и увеличению сопротивления. Таким образом, чем больше клеток располагается на электроде, тем сильнее меняется сопротивление этого электрода. Основным показателем, который оценивали методом RTCA iCELLIgence является «клеточный индекс» (КИ), рассчитываемый по формуле:
КИ = (импеданс в определенный момент времени П) - (импеданс в отсутствие клеток) (номинальное значение импеданса)
Значения импеданса зависят от количества адгезированных клеток, их размера и формы, а также от силы адгезии к субстрату.
Результаты и обсуждение
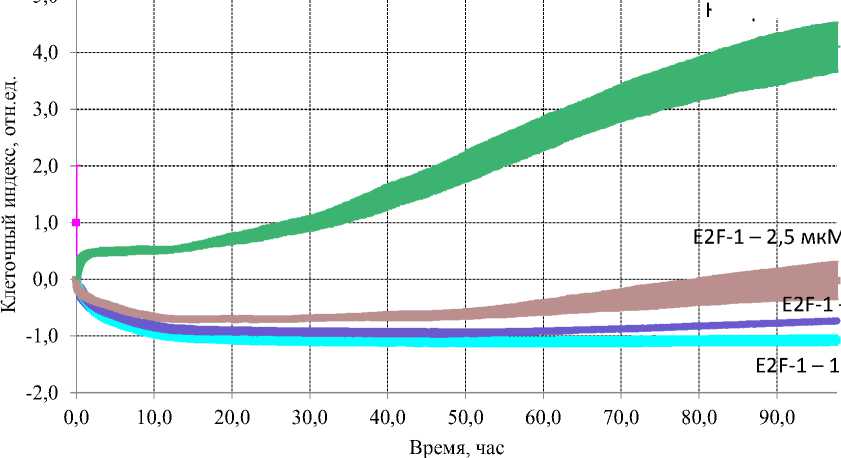
Было исследовано влияние на скорость пролиферации клеточных линий внесением в культуральную среду последовательности E2F-1 в концентрациях 2,5 мкМ; 5 мкМ и 10 мкМ. Сравнение проводилось с контрольными клетками, которые не подвергались воздействию исследуемой пептидной последовательности. Было показано, что на все исследованные клеточные линии пептид E2F-1 оказывает цитостатический эффект, замедляет процессы роста клеточной популяции. При сравнении воздействия E2F-1 на культуры клеток рака легкого (Рис. 1) было установлено, что цитостатический эффект более выражен для линии
А549 (Рис. 1А), внесение последовательности в исследуемых концентрациях приводило к снижению клеточного индекса меньше «0», что указывает на клеточную гибель, последующее воздействие пептида E2F-1 в концентрациях 5 мкМ и 10 мкМ вызывало стойкую задержку роста клеток. После 40 часов инкубации воздействие E2F-1 в концентрации 2,5 мкМ снижалось и наблюдалось возобновление клеточного роста.
Контрольный образец
– 5 мкМоль
Моль мк
А
Время, час
Б
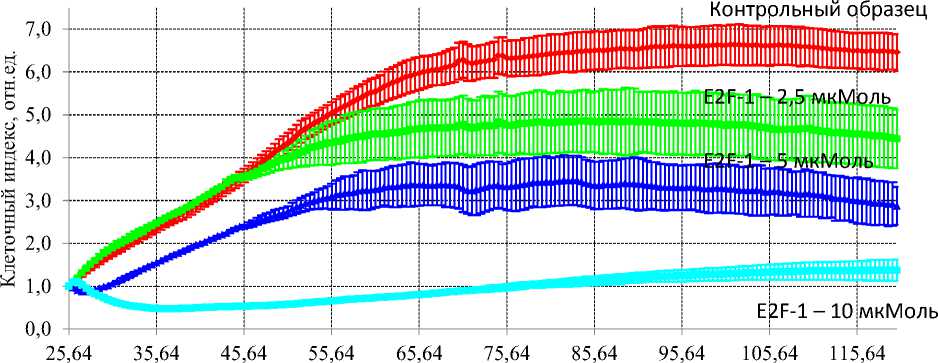
Рис. 1. Влияние пептидной последовательности, ингибитора E2F-1, в концентрациях 2,5 мкМ, 5 мкМ и 10 мкМ на рост и пролиферацию культур клеток рака легкого человека. (А) Воздействие E2F-1 на культуру А549. (Б) Воздействие E2F-1 на культуру Н1299.
При исследовании воздействия пептидной последовательности E2F-1 на рост культуры Н1299 было показано, что при концентрации E2F-1 10 мкМ наблюдался выраженный эффект задержки пролиферации, снижение количества клеток. При концентрациях 2,5 и 5 мкМ оказываемый цитостатический эффект был значительно слабее, снижение клеточного индекса по сравнению с контрольными образцами, наблюдалось в 1,3 и 1,97 раза, соответственно. Оценка воздействия пептидной последовательности E2F-1 в отношении культур клеток колоректального рака человека, также показала наличие цитостатического эффекта в отношении клеток обеих исследуемых культур (НТ29 и НСТ116) (Рис. 2). Однако в отношении клеток культуры НТ29 данный эффект был более выражен, наблюдалась остановка пролиферации при внесении E2F-1 во всех исследуемых концентрациях (Рис. 2А). При воздействии исследуемой пептидной последовательности на культуре НСТ116, эффект был менее выражен, достоверные отличия в снижении клеточного индекса получены только при концентрациях E2F-1 5 и 10 мкМ (Рис. 2Б).
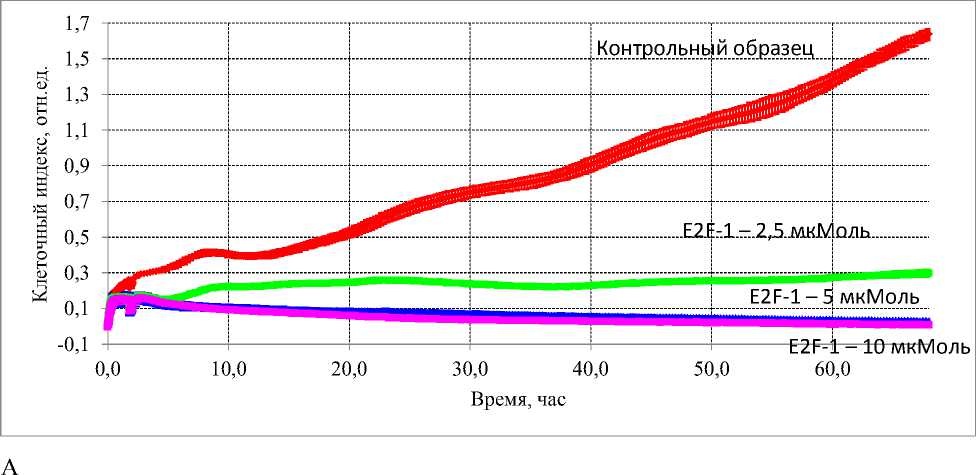
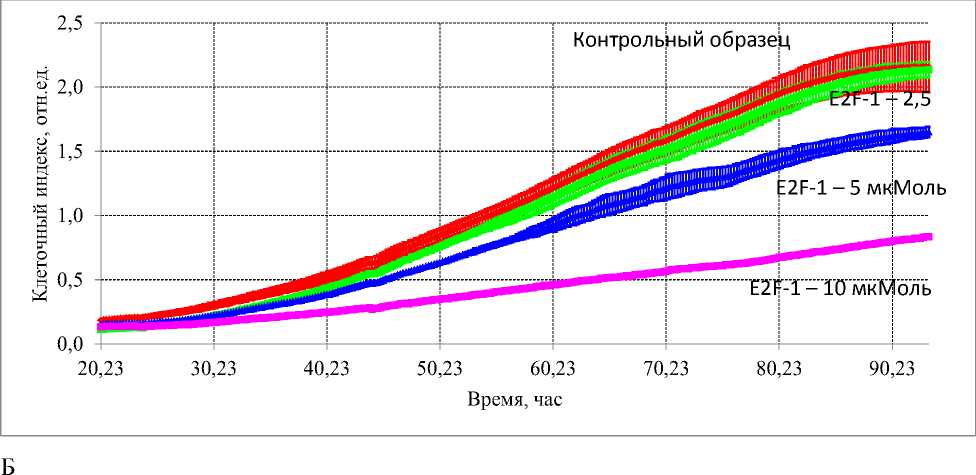
Рис. 2. Влияние пептидной последовательности, ингибитора E2F-1, в концентрациях 2,5 мкМ, 5 мкМ и 10 мкМ на рост и пролиферацию культур клеток колоректального рака человека. (А) Воздействие E2F-1 на культуру НТ29. (Б) Воздействие E2F-1 на культуру НСТ116.
Таким образом, проведенные исследования позволили установить, что разработанная последовательность проявляет свойства потенциального цитостатического препарата, являясь ингибитором транскрипционного фактора E2F-1, проявляет специфические свойства, характерные для данной последовательности. Эффект, оказываемый данной пептидной последовательностью, имеет концентрационную зависимость и различается в зависимости от типа клеток. На основании литературных данных был проведен анализ мутационного статуса исследуемых клеточных линий [2]. Все используемые в работе клеточные культуры имеют мутации в генах белков, ответственных за процессы пролиферации. Линия А549 имеет мутации в генах RAS и CDKN2A , линия Н1299 в гене RAS , НТ29 в генах BRAF и PIK3CA , НСТ116 – RAS , PIK3CA , CDKN2A , CCND1 , т. о. во всех исследуемых линиях клеток присутствуют мутации сигнального пути циклин-зависимые киназы – Rb-E2F, однако, данных по наличию мутаций в генах семейства E2F или в генах белка ретинобластомы (RB) или взаимосвязь локализации мутации и ответа на воздействие исследуемой пептидной последовательности, выявить не удалось.
Полученные результаты позволяют рассматривать разработанный пептидный ингибитор E2F-1 в качестве потенциального цитостатического препарата, оказывающего таргетное воздействие на внутриклеточные молекулярные мишени. Для понимания и доказательства специфичности механизмов взаимодействия пептидной последовательности с ее целевой молекулой необходимо продолжение исследований, расширение спектра методов оценки эффектов пептидного ингибитора E2F-1на клетки.
Список литературы Оценка антипролиферативной активности пептидного ингибитора E2F в условиях in vitro
- Мирошина Ю.Д., Киселева Е.В. Применение таргетной терапии для медикаментозного лечения онкологических заболеваний. Молодой ученый. 2021. № 36. С. 30-32. URL: https://moluch.ru/archive/378/83894.
- ATCC® Cell lines by gene mutation. American Type Culture Collection. 2014.
- Barile L., Vassalli G. Exosomes: Therapy delivery tools and biomarkers of diseases. Pharmacol Ther. 2017. V. 174. P. 63-78. DOI: 10.1016/j.pharmthera.2017.02.020.
- Candelaria P.V., Leoh L.S., Penichet M.L., Daniels-Wells T.R. Antibodies Targeting the Transferrin Receptor 1 (TfR1) as Direct Anti-cancer Agents. Front Immunol. 2021. V. 12. Article ID 607692. DOI: 10.3389/fimmu.2021.607692.
- Craciun B.F., Clima L., Bostiog D.I., et al. Multilayer gold nanoparticles as non-viral vectors for targeting MCF-7 cancer cells. Biomater Adv. 2022. V. 144. Article ID 213201. DOI: 10.1016/j.bioadv.2022.213201.
- Engeland K. Cell cycle regulation: p53-p21-RB signaling. Cell Death Differ. 2022. V. 29. No. 5. P. 946-960. DOI: 10.1038/s41418-022-00988-z.
- Habault J., Poyet J.L. Recent Advances in Cell Penetrating Peptide-Based Anticancer Therapies. Molecules. 2019. V. 24. No. 5. Article ID 927. DOI: 10.3390/molecules24050927.
- Ferrario C., Zoe A. ASCO 2022 – Anti-EGFR or anti-VEGF? The question in RAS wild-type colorectal cancer. 2022. Available online: https://www.univadis.com/viewarticle/asco-2022-anti-egfr-or-anti-vegf-the-question-in-ras-wild-type-colorectal-cancer-d776a376-1178-3bb4-a30f-8594cdca8df4 (accessed on December 02, 2022).
- Kent L.N., Leone G. The broken cycle: E2F dysfunction in cancer. Nat Rev Cancer. 2019. V. 19. No. 6. P. 326-338. DOI: 10.1038/s41568-019-0143-7.
- Pérez-Herrero E., Fernández-Medarde A. Advanced targeted therapies in cancer: Drug nanocarriers, the future of chemotherapy. Eur J Pharm Biopharm. 2015. V. 93. P. 52-79. DOI: 10.1016/j.ejpb.2015.03.018.
- Xiao Q., Dong X., Yang F., et al. Engineered Cell-Penetrating Peptides for Mitochondrion-Targeted Drug Delivery in Cancer Therapy. Chemistry. 2021. V. 27. No. 59. P. 14721-14729. DOI: 10.1002/chem.202102523.
- Xie D., Pei Q., Li J., et al. Emerging Role of E2F Family in Cancer Stem Cells. Front Oncol. 2021. V. 11. Article ID 723137. DOI: 10.3389/fonc.2021.723137.
- Zhao H., Wu M., Zhu L., et al. Cell-penetrating Peptide-modified Targeted Drug-loaded Phase-transformation Lipid Nanoparticles Combined with Low-intensity Focused Ultrasound for Precision Theranostics against Hepatocellular Carcinoma. Theranostics. 2018. V. 8. No. 7. 1892-1910. DOI: 10.7150/thno.22386.


