Определение последовательности аминокислот в высвобождаемых фрагментах гидролизата молочного белка
Автор: Остроумов Л.А., Линник А.И., Кригер О.В., Асякина Л.К.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Технология переработки
Статья в выпуске: 7, 2012 года.
Бесплатный доступ
Проведен детальный анализ пептидных профилей гидролизата молочных белков, полученных с использованием различных протеолитических ферментов, и определена аминокислотная последовательность полученных фрагментов, выявлены в составе казеиновых гидролизатов пептиды, обладающие биологической активностью.
Гидролизат казеина, биологическая активность, ангиотензин-конвертирующий фермент, последовательность, термолизин, гидролиз, фермент, биологически активный пептид, функциональный продукт питания
Короткий адрес: https://sciup.org/14082523
IDR: 14082523 | УДК: 637.12.04
Текст научной статьи Определение последовательности аминокислот в высвобождаемых фрагментах гидролизата молочного белка
Одним из перспективных направлений в области биотехнологии является использование белковых гидролизатов в качестве основного компонента продуктов специального назначения. Это продукты, предназначенные для систематического употребления в составе пищевых рационов, сохраняющие и укрепляющие здоровье за счет наличия в их составе веществ, обладающих способностью оказывать благоприятный эффект на физиологические функции и процессы обмена веществ в организме [1, 2].
Гидролиз пищевых белков и включение полученных гидролизатов в состав продуктов питания улучшают пищевую ценность последних, задерживают их порчу, придают им желательные функциональные характеристики (содержание аллергенов, токсинов и ингибиторов) [3, 4]. Особым при создании продуктов специализированного назначения является вопрос определения последовательности аминокислот в высвобождаемых фрагментах гидролизата молочного белка, который определяет особые свойства полученного продукта.
Целью данной работы является определение последовательности аминокислот в высвобождаемых фрагментах гидролизата молочного белка при оптимальных параметрах биотехнологической обработки.
Для достижения поставленной цели проведен детальный анализ пептидных профилей гидролизата молочных белков, полученных с использованием различных протеолитических ферментов, определена аминокислотная последовательность полученных фрагментов методом MALDI-TOF с помощью хромато-масс-спектрометра REFLEX IV. Анализ спектров молекулярных весов изученных образцов свидетельствует об очень многокомпонентном составе. Подавляющее большинство пептидов имеет молекулярную массу менее 1000 Да. Результаты полученных исследований представлены на рисунках 1–3 и в таблицах 1–3.
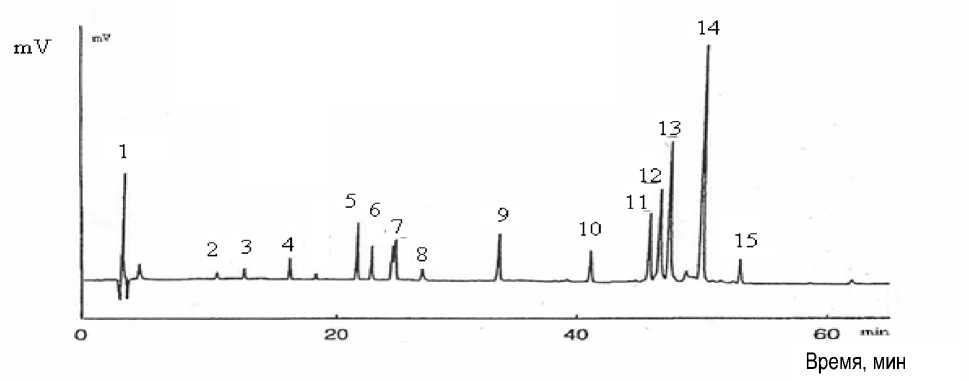
Рис. 1. Масс-спектры продуктов гидролиза молочного белка трипсином
Таблица 1
Характеристика пептидов, образовавшихся в результате гидролиза молочного белка трипсином
|
Номер |
Молекулярная масса, Да |
Порядок расположения в полипептидной цепи |
Аминокислотная последовательность |
|
1 |
3803 |
1–25 |
RELEELNVPGEIVESLSSSEESITR |
|
2 |
615 |
26–28 |
INK |
|
3 |
98 |
29 |
К |
|
4 |
390 |
30–32 |
IEK |
|
5 |
1463 |
33–48 |
FQSEEQQTEDELQDK |
|
6 |
4451 |
49–97 |
IHPFAQTQSLVYPFPG-PIHNSLPQNIPPLT-PVVVPPFLQPEVMGVSK |
|
7 |
180 |
98–99 |
VK |
|
8 |
664 |
100–105 |
EAMAPK |
|
9 |
233 |
106–107 |
HK |
|
10 |
690 |
108–113 |
EMPFPK |
|
11 |
2107 |
184–202 |
DMPILYQEPVLGPVR |
|
12 |
589 |
170–176 |
VLPVPQK |
|
13 |
687 |
177–183 |
AVPYPQR |
|
14 |
5172 |
114–169 |
YPVEPFTESQSLTLTDVENLHLP LPLLQSWMHQPHQPLPPWVMFP PQSVLSLSQSK |
|
15 |
585 |
203–209 |
GPFPIIV |
Примечание. А – аланин; N – аспарагин; D – аспарагиновая кислота; Q – глутамин; Е – глутаминовая кислота; G – глицин; Н – гистидин; I – изолейцин; L – лейцин; K – лизин; P – пролин; S – серин; T – треонин; W – трипотофан; Y – тирозин; V – валин.
На рисунке 2 представлена хроматограмма химотрипсинового гидролизата казеина с расшифровкой пептидных фракций и пиков.
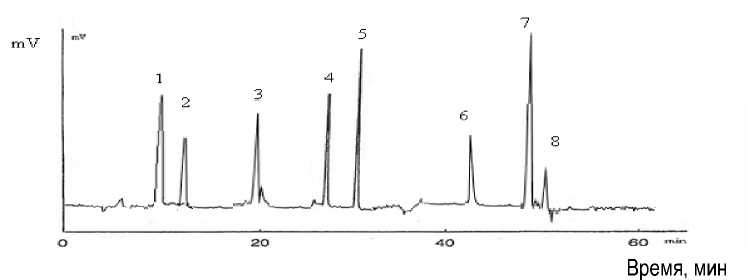
Рис. 2. Масс-спектры продуктов гидролиза молочного белка химотрипсином
Характеристика пептидов, образовавшихся в результате гидролиза молочного белка химотрипсином, представлена в таблице 2.
Таблица 2
Характеристика пептидов, образовавшихся в результате гидролиза молочного белка химотрипсином
|
Номер |
Молекулярная масса, Да |
Порядок расположения в полипептидной цепи |
Аминокислотная последовательность |
|
1 |
3803 |
1–25 |
RELEELNVPGEIVESLSSSE ESITR |
|
2 |
1802 |
26–32 |
INKKIEKF |
|
3 |
2329 |
33–51 |
QSEEQQQTEDELQDKIHPF |
|
4 |
3754 |
52–86 |
AQTQSLVYPFPGPIPNSLPQ NIPPLTQTPVVVPPF |
|
5 |
3668 |
87–118 |
LQPEVMGVSKVKEAMAPKHK EMPFPKYPVEPF |
|
6 |
2734 |
119–142 |
TESQSLTLTDVENLHLPLPL LQSW |
|
7 |
5286 |
143–189 |
MHQPHQPLPPTVMFPPQSVL SLSQSKVLPVPQKAVPYPQR DMPIQAF |
|
8 |
1717 |
190–209 |
QEPVLGPVRGPFPIIV |
Примечание см. табл. 1.
На рисунке 3 представлена хроматограмма термолизинового гидролизата казеина с расшифровкой пептидных фракций и пиков.
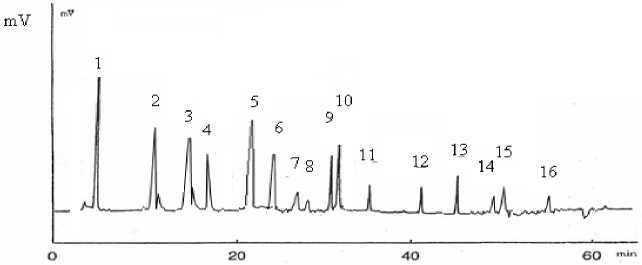
Время, мин
Рис. 3. Масс-спектры продуктов гидролиза молочного белка термолизином
Характеристика пептидов, образовавшихся в результате гидролиза молочного белка термолизина, представлена в таблице 3.
Анализ данных, представленных на рисунках 1–3 и в таблицах 1–3, свидетельствует о том, что все исследованные фракции гидролизата содержат в своем составе какие-либо пептиды разной молекулярной массы.
Характеристика пептидов, образовавшихся в результате гидролиза молочного белка термолизином
Таблица 3
|
Номер |
Молекулярная масса, Да |
Порядок расположения в полипептидной цепи |
Аминокислотная последовательность |
|
1 |
1197 |
55–64 |
LSKDIGSEST |
|
2 |
763 |
100–104 |
KEDVPS |
|
3 |
915 |
205–210 |
ENSEKTT |
|
4 |
972 |
81–88 |
SSSEEIVP |
|
5 |
914 |
22–28 |
KHQGLPQ |
|
6 |
773 |
185–190 |
GTQYTD |
|
7 |
705 |
118–122 |
KYKVP |
|
8 |
683 |
177–183 |
AVPYPQR |
|
9 |
616 |
195–199 |
SDIPN |
|
10 |
642 |
125–129 |
EIVPN |
|
11 |
385 |
173–176 |
AYP |
|
12 |
585 |
145–148 |
QQKE |
|
13 |
443 |
161–163 |
YPE |
|
14 |
439 |
92–94 |
EQK |
|
15 |
416 |
17–19 |
PKH |
|
16 |
368 |
48–50 |
GKE |
Примечание см. табл. 1.
Идентификацию полученных последовательностей пептидов проводили посредством поиска в базах данных NCBI ( и SwissProt (. Результаты сравнительных исследований представлены в таблице 4.
В результате идентифицирования в исследуемых гидролизатах пептидов было выявлено, что в каждом из исследуемых образцов при ферментации трипсином или химотрипсином, или термолизином образуется хотя бы один пептид, обладающий биологической активностью.
Исследования показали, что в казеиновых гидролизатах присутствуют более 10 олигопептидов.
Основным результатом данной части исследования явилось нахождение в составе казеиновых гидролизатах пептидов, обладающих биологической активностью.
Пептиды, идентифицированные в исследуемых гидролизатах
Таблица 4
|
Фрагмент |
Используемый фермент |
Последовательность аминокислот в пептидах |
Название |
Функция |
|
1–25 |
Трипсин, химотрипсин |
Arg-Glu-Leu-Glu-Glu-Leu-Asn-Val-Pro-Gly-Glu-Ile-Val-Glu-Ser(P)-Leu-Ser(P)Ser(P)-Ser(P)-Glu-Glu-Ser-Ile-Thr-Arg |
Фосфопептид |
Стимулирование усвоения минеральных веществ |
|
177–183 |
Термолизин |
Ala-Val-Pro-Tyr-Pro-Gln-Arg |
β-Казоки-нин |
Ингибитор ангио-тензинконвертиру-ющего фермента |
В трипсиновом и химотрипсиновом гидролизате казеина идентифицирован фосфопептид с последовательностью аминокислот Arg-Glu-Leu-Glu-Glu-Leu-Asn-Val-Pro-Gly-Glu-Ile-Val-Glu-Ser(P)-Leu-Ser(P)Ser(P)-
Ser(P)-Glu-Glu-Ser-Ile-Thr-Arg, который обладает функцией усвоения и стимулирования минеральных веществ в организме человека [5]. К основной функции фосфопептидов относят связывание минеральных элементов и поддержание их в растворенном состоянии для облегчения всасывания кальция и фосфора в кишечнике человека.
Из термолизинового гидролизата казеина выделен пептид β-казокинин (аминокислотная последовательность Ala-Val-Pro-Tyr-Pro-Gln-Arg), который является ингибитором ангиотензин-конвертирующего фермента. Механизм действия основан на ингибировании ангиотензин-конвертирующего фермента (АКФ) – неспецифической дипептидилкарбоксипептидазы, играющей ключевую роль в регуляции давления в системе кровообращения путем модуляции ренин-ангиотензиновой системы (РАС). Поэтому подавление активности АКФ имеет антигипертензивный эффект, что в дальнейшем важно учитывать при разработке технологии функциональных продуктов питания.
Полученные исследования могут быть использованы при разработке технологии получения функциональных продуктов питания на основе биологически активных ферментативных гидролизатов.


