Оптимизация условий инкапсуляции рутина в клетки дрожжей Saccharomyces cerevisiae
Автор: Калинина Ирина Валерьевна, Фаткуллин Ринат Ильгидарович, Науменко Екатерина Евгеньевна
Рубрика: Биохимический и пищевой инжиниринг
Статья в выпуске: 4 т.10, 2022 года.
Бесплатный доступ
Целью настоящего исследования стал поиск рациональных режимов инкапсуляции биологически активного вещества рутина в живые клетки дрожжей Saccharomyces cerevisiae. Рутин является одним из наиболее хорошо изученных флавоноидов. Более известный как витамин Р в экспериментальных исследованиях рутин демонстрирует антиоксидантные, противомикробные, противовоспалительные, антидиабетические, антиадипогенные, нейропротекторные и другие свойства. Вместе с тем рутин, как и многие другие флавоноиды, является веществом нестабильным, склонным к окислительной деградации и активно вступающим в химические реакции со снижением или потерей биоактивных свойств. Для минимизации указанных проблем предложено использование технологии инкапсуляции рутина в клетки дрожжей Saccharomyces cerevisiae. В данном исследовании процесс инкапсуляции вели с применением методов простой диффузии в живые клетки Saccharomyces cerevisiae. Для этого использовали режимы инкапсуляции в условиях термостатируемого встряхивателя, продолжительность процесса достигала 24 часов. В задачи исследования входила оценка влияния температурного и временного факторов на эффективность инкапсуляции рутина в клетки дрожжей. Использовались температурные режимы 28; 32 и 37 °С. Эффективность инкапсуляции определяли через 8, 16 и 24 часа после начала эксперимента. Проведенные исследования показали, что оба варьируемых фактора оказывают существенное влияние на эффективность загрузки биологически активного вещества в клетки дрожжей. Установлена прямая зависимость показателя эффективность инкапсуляции как от температуры, так и от продолжительности процесса. Вместе с тем, было отмечено, что использование температуры инкапсуляции 37 °С приводит к тому, что во второй временной отрезок 16-24 ч эффективность инкапсуляции снижается в сравнении с аналогичным периодом времени при температуре 32 °С. С использованием двухфакторного регрессионного анализа при проведении процедур оптимизации был установлен наиболее рациональный режим инкапсуляции рутина в клетки дрожжей, который составил 22 ч при температуре 33,8 °С.
Рутин, инкапсуляция, дрожжи saccharomyces cerevisiae, температура, продолжительность инкапсуляции
Короткий адрес: https://sciup.org/147239406
IDR: 147239406 | УДК: 664.8.038+663 | DOI: 10.14529/food220408
Текст научной статьи Оптимизация условий инкапсуляции рутина в клетки дрожжей Saccharomyces cerevisiae
Развитие новых научных знаний в области биохимии, биотехнологии, пищевой технологии и в смежных областях подтверждает гипотезу о том, что питание, помимо своей основной функции, играет важную роль в поддержании здоровья человека и минимизации рисков возникновения неинфекционных заболеваний. На этом принципе основана концепция функционального питания. Компоненты, которые обеспечивают функциональное питание, чаще всего представляют собой витамины, минеральные вещества, ненасыщенные жирные кислоты, про-, пре- и синбиотики, а также минорные биологически активные соединения [1–5].
Минорные биологически активные вещества, среди которых растительные полифенолы, в последнее время привлекают большое внимание как потенциальные пищевые ингредиенты функциональной направленности [1, 5, 7, 15–18]. Класс флавоноидов наиболее богат такими веществами, которые в том числе достаточно хорошо изучены. Среди представителей биологически активных веществ (БАВ) – флавоноидов: рутин, куркумин, кверцетин, дигидрокверцетин и другие.
Клинические исследования, проведенные в отношении флавоноидов показывают, что многие из указанных соединений обладают способностью снижать риск развития рака, диабета, сердечно-сосудистых и других дегенеративных заболеваний. Тем не менее, исследования многих флавоноидов по химиопрофилактике рака in vivo не оправдали ожиданий. Основной причиной является их плохая растворимость во многих растворителях и в воде, биодоступность при пероральном приеме и неспособность пройти барьер в виде жестких воздействий процесса желудочнокишечного переваривания [6, 8–10, 19, 20].
Для обеспечения стабильности биологически активных соединений или улучшения их технологической пригодности для пищевых производств, а также увеличения биодоступности для организма человека требуется разработка новых решений. В качестве такого решения может выступать инкапсуляция – процесс, при котором БАВ защищаются материалом носителя при образовании капсул в микрометровом или нанометровом масштабе [3, 5, 8, 11, 17, 19].
Одним из экономически доступных видов инкапсуляции БАВ можно рассматривать использование в качестве защитной капсулы дрожжевой клетки, в частности Saccharomyces cerevisiae .
Клеточная стенка дрожжей состоит из внутреннего слоя несущих полисахаридов, выступающих в качестве каркаса и защитного наружного слоя маннопротеинов. Основным полисахаридом, несущим нагрузку, является разветвленный 1,3-β-глюкан. Благодаря наличию боковых цепей молекулы 1,3-β-глюкана и гибкой спиралевидной форме, отдельные молекулы β-глюкана могут связываться только локально через водородные связи, что приводит к образованию трехмерной сети, очень эластичной и способной пропускать молекулы разного размерного ряда. Полисахариды клеточной стенки дрожжей функционируют как каркас для внешнего слоя гликопротеинов. В совокупности эти гликопротеины ограничивают проницаемость клеточной стенки для макромолекул, и наоборот, они способны пропускать малые молекулы. Плазматическая же мембрана клеточной стенки дрожжей состоит в основном из липидов и белков примерно в равных пропорциях. Мембранные белки отвечают за регуляцию транспорта растворенных веществ в клетку и из нее, а также препятствуют свободной диффузии растворенных веществ из клетки. Некоторые авторы утверждают, что свойства мембраны клеточной стенки схожи липосомами, что дает осно- вание предполагать возможность инкапсуляции в клетки дрожжей гидрофобных веществ, в том числе флавоноидов [12].
Целью настоящего исследования была оценка влияния температуры и продолжительности процесса инкапсуляции на динамику эффективности загрузки гидрофобного антиоксиданта рутина в живые клетки дрожжей Saccharomyces cerevisiae.
Материалы и методы
Объекты исследования
В качестве биологически активного соединения был выбран флавоноид рутин (3', 4', 5,7-тетрагидрокси-флавон-3β-D-рутинозид), который представляет собой полифенол, обычно встречающийся в различных растениях, включая цитрусовые плоды, яблоки, помидоры и абрикосы [13].
Рутин, также известный как витамин Р, состоит из агликона кверцетина и дисахарида рутинозы, связанного с кверцетином в положении 3 С-кольца (рис. 1).
Рис. 1. Пространственная структура молекулы рутина [1 313]
На сегодняшний день известно более 130 фармацевтических препаратов, содержащих в своем составе рутин. Среди установленных фармакобиологических свойств рутина можно выделить антиоксидантные, противомикроб-ные, противовоспалительные, антидиабетические, антиадипогенные, нейропротекторные и другие [14, 19, 20].
Условия инкапсуляции
Инкапсуляцию рутина в дрожжевые клетки проводили в водной среде при соотношении компонентов дрожжи:рутин, равной 5:1 по массе. Использовался гидромодуль 1:100.
Инкапсуляцию проводили в термостатируемом встряхивателе при 200 об/мин, в двух температурных режимах 28; 32 и 37 °С в течение 24 часов.
Контроль эффективности инкапсуляции проводили в 3 временных точках, через каждые 8 часов.
Номенклатура показателей и методы анализа
Морфологическая структура образцов рутина была получена с применением просвечивающей электронной микроскопии высокого разрешения (Jeol JEM-2100), увеличение ×5000 .
Количественное содержание рутина определяли при взаимодействии с хлоридом алюминия спектрофотометрически по методике государственной фармакопеи XIV.
Эффективность инкапсуляции (ЭИ) определяли, как отношение БАВ, инкапсулированных, к количеству БАВ, оставшемуся на поверхности клеток дрожжей.
Эффективность инкапсуляции в % рассчитывали по формуле:
Xl-XO
ЭИ (%) = ×100, (1)
где X 1 – общее содержание БАВ (после процедуры разрушения капсул), мг; X 0 – содержание неинкапсулированного БАВ, мг; X 2 – количество БАВ, добавленное при инкапсуляции, мг.
Поиск оптимальных режимов инкапсуляции вели при использовании двухфакторного регрессионного анализа с использованием программного продукта MatCad.
Результаты исследования и их обсуждение
Результаты микроскопии рутина (рис. 2) показывают, что БАВ представляет собой скопление частиц в разном размерном диапазоне, в том числе достаточно крупных кристаллических частиц, склонных к агломерации.
В таблице представлены данные о физико-химических свойствах БАВ, имеющих решающее значение для оценки фармакологического потенциала вещества.
В литературе встречаются противоречивые данные о способности клеток дрожжей сорбировать частицы разного размера. Эластичность β-глюкановой сетки дает возможность предположить способность рутина проникать через нее. Вместе с тем, следующий барьер на пути БАВ – фосфолипидная мембрана – может быть менее проницаема для частиц крупного размера [12, 15].

Рис. 2. Морфология частиц рутина ( ×5000 )
Физико-химические свойства рутина [13]
|
Свойство |
Значение |
|
Растворимость в воде |
12,8 г/л |
|
log P |
–0,54 |
|
Количество акцепторов водорода |
21 |
|
Количество доноров водорода |
13 |
|
Количество бензойных колец |
6 |
Многие исследования показывают, что эффективность инкапсуляции биологически активных веществ в клетки дрожжей во многом определяется диффузионными процессами, эффективность которых, в том числе, зависит от растворимости инкапсулируемого вещества [11, 12, 15].
С учетом низкой растворимости рутина, около 1 %, принципиальное влияние может оказать повышение температуры инкапсуляции и увеличение продолжительности самого процесса.
Исследованиями, проведенными ранее, было установлено, что растворимость рутина в воде значительно увеличивается при повышении температуры более 70 °С. И уже через 30– 35 мин значение растворимости рутина превышает указанное в таблице более чем на 40 %.
Вместе с тем, такой температурный диапазон неприемлем для роста и развития дрожжевых клеток. По этой причине в данном исследовании мы осуществляли поиск оптимальных условий инкапсуляции рутина в клетки дрожжей Saccharomyces cerevisiae, используя двухфакторный регрессионный анализ.
Оценка динамики процесса инкапсуляции рутина в дрожжи Saccharomyces cerevisiae представлена на рис. 3. Полученные данные свидетельствуют о значительной вариабельности процесса инкапсуляции рутина в клетки дрожжей Saccharomyces cerevisiae. Установлено, что на эффективность инкапсуляции оказывают влияние оба оцениваемых фактора: температура и продолжительность процесса инкапсуляции.
Весомый вклад в повышение эффективности инкапсуляции внес временной фактор. Наблюдается четкая положительная зависимость роста эффективности инкапсуляции от продолжительности ведения процесса.
Так, через 24 часа значения эффективности инкапсуляции увеличивается по отношению к значениям в 8 часовой отметке, не зависимо от температуры. Положительное влияние продолжительности процесса инкапсуляции на его эффективность являлось ожидаемым и согласуется с данными, представленными в литературе. Определяется это, вероятно, вкладом двух факторов: постепенным увеличением доли растворенного рутина и ростом биомассы дрожжей, способных инкапсулировать биологически активные вещества.
Вместе с тем, было установлено, что в промежуток 8–16 ч процесс инкапсуляции протекал с более высокой эффективностью, чем во второй период (16–24 ч). (удалила)
Биосорбция органических веществ клетками дрожжей может быть представлена следующими стадиями: миграция органических соединений из жидкого раствора в пограничный слой частиц дрожжей; поверхностная диффузия внутрь клеток дрожжей; диффузии в поры биомассы; биосорбция активных центров внутри клеток [11]. Вероятно, каждый из этих этапов характеризуется собственными значениями удельной скорости и эффективности инкапсуляции, что требует дальнейшего изучения.
Положительное влияние повышения температуры на процесс инкапсуляции было отмечено в период 8–16 ч. Однако во второй временной отрезок эффективность инкапсуляции рутина при температуре 37 °С снижается в сравнении с температурным режимом 32 °С. Объяснением данному факту может быть то, что оптимальным температурным режимом для роста дрожжей Saccharomyces cerevisiae является диапазон 30–32 °С. Согласно литературным данным кратковременное увеличение температуры до сверхоптимальных значений (37–40 °С) может стимулировать рост дрожжевой массы, при этом длительное воздействие таких температур угнетает жизнедеятельность дрожжей.
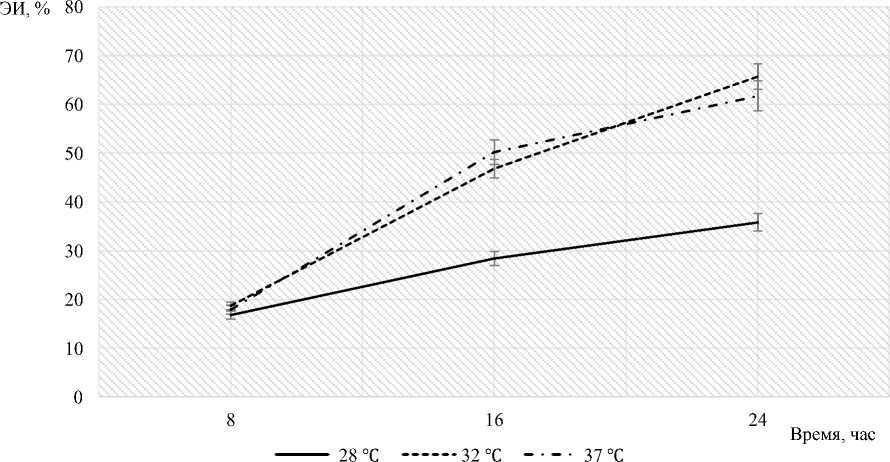
Рис. 3. Динамика процесса инкапсуляции образцов рутина в клетки дрожжей
Проведение процедуры оптимизации позволило установить оптимальное сочетание двух факторов: температуры и продолжительности процесса инкапсуляции. Установлено, что наиболее высокие значения эффективности инкапсуляции рутина в клетки дрожжей Saccharomyces cerevisiae достигаются при 23,7 часа и 33,8 °С (рис. 4).
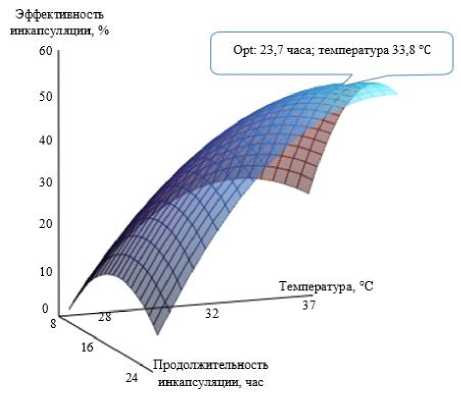
Рис. 4. Зависимость эффективности инкапсуляции рутина от температуры и продолжительности процесса
С учетом физического смысла величин в качестве рационального режима был принят режим инкапсуляции: температура 33 °С и длительность процесса 24 часа. Установлен- ный режим инкапсуляции был отработан, фактическая эффективность инкапсуляции составила 64,8 %.
Заключение
Таким образом, проведенные исследования подтвердили возможность инкапсуляции рутина в живые клетки дрожжей Saccharo-myces cerevisiae методом простой диффузии. Вместе с тем, эффективность инкапсуляции рутина, даже при значительных временных затратах, не достигала 65 %. Такие результаты могут объясняться низкой растворимостью флавоноида в воде, его склонностью к полимеризации и агломерации частиц.
Вместе с тем, для увеличения загрузки БАВ в клетки дрожжей целесообразно варьировать и временной режим процесса.
В качестве перспективного подхода для повышения эффективности инкапсуляции рутина в клетки дрожжей может также рассматриваться предварительное микроструктурирование БАВ.
Кроме того, следует оценить влияние соотношения БАВ:дрожжи на эффективность процесса инкапсуляции, а также более глубоко оценить термодинамические закономерности процесса инкапсуляции минорных биологически активных веществ полифенольной природы в клетки дрожжей Saccharomyces cerevisiae . Все это составляет основу будущих исследований.
Список литературы Оптимизация условий инкапсуляции рутина в клетки дрожжей Saccharomyces cerevisiae
- Бурлакова Е.Б. Антиоксиданты. Термины и определения / В.М. Мисин, Н.Г. Храпова, А Ю. Завьялов. М.: Изд-во РУДН, 2010. 63 с.
- Глобальный план действий по профилактике неинфекционных заболеваний и борьбе с ними на 2013-2020 гг. [Электронный ресурс]. URL: https://www.who.int/nmh/publications/ncd-action-plan/ru.
- Калинина И.В. Повышение биоактивности дигидрокверцетина на основе ультразвуковой микронизации / И.В. Калинина, И.Ю. Потороко, Р.И. Фаткуллин и др. // Технология и товароведение инновационных пищевых продуктов. 2019. № 1(54). С. 27-33.
- Нилова Л.П. Оптимизация ассортимента хлебобулочных изделий на основе анализа структуры потребительского рынка в г. Санкт-Петербурге и Челябинске / Л.П. Нилова, Н.В. Науменко, И.В. Калинина, К.Ю. Маркова // Вестник ЮУрГУ. Сер.: Экономика и менеджмент. 2011. Вып. 17, № 8(225). С. 183-189.
- Потороко И.Ю. Антиоксидантные свойства функциональных пищевых ингредиентов, используемых при производстве хлебобулочных и молочных продуктов, их влияние на качество и сохраняемость продукции / И.Ю. Потороко, А.В. Паймулина, Д.Г. Ускова и др. // Вестник ВГУИТ. 2017. Т. 79, № 4. С. 143-151. DOI: 10.20914/2310-1202-2017-4-143-151.
- Фаткуллин Р.И. и др. Влияние ультразвукового микроструктурирования биологически активных веществ на эффективность процесса их инкапсуляции / Р.И. Фаткуллин, И.В. Калинина, А.К. Васильев и др. // Вестник ЮУрГУ. Серия «Пищевые и биотехнологии». 2021. Т. 9, № 4. С. 100-107. DOI: 10.14529/food210411
- Шатнюк Л.Н. Инновационные ингредиенты для обогащения хлебобулочных изделий // Кондитерское и хлебопекарное производство. 2016. № 7-8(166). С. 41-45.
- Agati G., Azzarello E., Pollastri S., Tattini M. Flavonoids as antioxidants in plants: location and functional significance // Plant Sci., 2012, vol. 196 (3), pp. 67-76. DOI: 10.1016/ j.plantsci.2012.07.014
- Chen G.-L. Total phenolic, flavonoid and antioxidant activity of 23 edible flowers subjected to in vitro digestion / G.-L. Chen, S.-G. Chen, Y.-Q. Xie, F. Chen, Y.-Y. Zhao et al. // Journal of Functional Foods. 2015. Vol. 17. Р. 243-259. DOI: 10.1016/j.jff.2015.05.028
- Chua L.S. A review on plant-based rutin extraction methods and its pharmacological activities // J. Ethnopharmacol. 2013. V. 150. DOI: 10.1016/j.jep.2013.10.036
- Dardelle G. et al. Flavor encapsulation and flavor release performances of a commercial yeast-based delivery system // Food Hydrocolloids. 2007. V. 21. P. 953-960. DOI: 10.1016/ j.foodhyd.2006.12.013
- De Nobel, J.; Klis, F.; Priem, J.; Munnik, T.; Van den Ende, H. The glucanase-soluble mannoproteins limit cell wall porosity in Saccharomyces cerevisiae // Yeast 6. 1990. P. 491-499. DOI: 10.1002/yea.320060606
- FooDB [Electronic resource]. URL: http://foodb.ca.
- Fang Z.; Bhandari B. Encapsulation of polyphenols - A review // Trends Food Sci. Tech. 2010. V. 21. P. 510-523. DOI: 10.1016/j.tifs.2010.08.003
- Guorong S., Liqun R., Huazhong Y., Hua X., Hua Y., Runa Ji. Stabilization and encapsulation of photosensitive resveratrol within yeast cell // International Journal of Pharmaceutics. 2008. V. 349, Iss. 1-2. P. 83-93. DOI: 10.1016/j.ijpharm.2007.07.044
- González-Centeno R. et al. Effect of power ultrasound application on aqueous extraction of phenolic compounds and antioxidant capacity from grape pomace (Vitis vinifera L.): Experimental kinetics and modeling // Ultrasonics Sonochemistry. 2015. V. 22. P. 506-514. DOI: 10.1016/j.ultsonch.2014.05.027
- Potoroko I.Yu. et al. Sonochemical Micronization of Taxifolin Aimed at Improving Its Bioavailability in Drinks for Athletes // Человек. Спорт. Медицина. 2018. Т. 18, № 3. Р. 90-100. DOI: 10.14529/hsm180309
- Potoroko I.U. et al. Possibilities of Regulating Antioxidant Activity of Medicinal Plant Extracts // Человек. Спорт. Медицина. 2017. Т. 17, № 4. Р. 77-90. DOI: 10.14529/hsm170409
- Walle T. Methoxylated flavones, a superior cancer chemopreventive flavonoid subclass? // Semin. Cancer Biol. 2007. V. 17 (5). P. 354-362. DOI: 10.1016/j.semcancer.2007.05.002
- Yang J., Guo, J., Yuan, J. In vitro antioxidant properties of rutin // LWT Food Sci. Technol. 2008. V. 41. DOI: 10.1016/j.lwt.2007.06.010


