Осложнения при проведении позитронно-эмиссионной томографии, совмещенной с рентгеновской компьютерной томографией у пациентов со злокачественными новообразованиями
Автор: Аладин А.С., Абутина Н.А., Нуднов Н.В., Насырова И.И.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Оригинальная статья. Лучевая диагностика
Статья в выпуске: 3 т.23, 2023 года.
Бесплатный доступ
Большинство научных исследований и публикаций по позитронно-эмиссионной томографии в сочетании с рентгеновской компьютерной томографией (ПЭТ/КТ) у пациентов со злокачественными новообразованиями (ЗНО) связано с ролью ПЭТ/КТ в уточнении распространенности опухолевого процесса, влиянию исследования на выбор терапевтической тактики и в оценке контроля лечения. Осложнения при проведении ПЭТ/КТ существуют, но они не часто становятся объектом научного анализа и публикаций. В то же время осложнения ПЭТ/КТ могут привести к неточной оценке опухолевого процесса и выбору неадекватного лечения. Осложнения могут быть потенциально летальными. Целью нашей работы был обзор публикаций, посвященных осложнениям при ПЭТ/КТ, и проведение собственного проспективного обсервационного исследования для выявления характера осложнений и их частоты при ПЭТ/КТ у больных с ЗНО.
Позитронно-эмиссионная томография (пэт), позитронно-эмиссионная томография, совмещенная с рентгеновской компьютерной томографией (пэт/кт), компьютерная томография, 18f-фтордезоксиглюкоза, контрастный препарат, экстравазация контрастного препарата, анафилактическая реакция, анафилактический шок, контраст-индуцированная нефропатия, транзиторное нарушение сознания, вазовагальный обморок
Короткий адрес: https://sciup.org/149143503
IDR: 149143503
Текст научной статьи Осложнения при проведении позитронно-эмиссионной томографии, совмещенной с рентгеновской компьютерной томографией у пациентов со злокачественными новообразованиями
«Трудность заключается не в новых идеях, а в избавлении от старых.
Старая идея состоит в том, чтобы классифицировать болезнь в первую очередь на основе гистологии. Диагноз, основанный на регионарных биохимических нарушениях с гораздо большей вероятностью приведет к дизайну и разработке лекарств, а также к индивидуализации терапии пациента»1.
Эволюция ПЭТ/КТ, начавшись в 30-х годах прошлого столетия, состоит из переплетения научных исследований и теорий в квантовой механике, космическом излучении, атомном синтезе, физике, молекулярной биологии, биохимии, медицине [1-3]. В настоящее время ПЭТ/КТ это метод молекулярной визуализации, позволяющий обнаружить, локализовать и количественно определить радионуклиды, введенные в организм человека, метод, занимающий лидирующую роль в диагностике злокачественных опухолей (стадирование, оценка эффекта лечения, выявление рецидива) [4-6].
Как в отечественной, так и в зарубежной литературе подавляющая доля публикаций посвящается роли ПЭТ/КТ в диагностике и лечении злокачественных опухолей разных локализаций [7-9]. В то же время, как и любой метод диагностики, ПЭТ/КТ может сопровождаться осложнениями, которые могут негативно влиять на качество исследования, а порой являются опасными для жизни пациента.
Что бы получить качественную и точную визуализацию при ПЭТ/КТ необходимо внутривенно ввести радиофармпрепарат (РФП) и контрастный препарат (КП). Иногда инъекция лекарственного препарата может сопровождаться экстравазацией, которая описывается как непреднамеренное поступление лекарственного препарата из кровеносного сосуда в ткани, окружающие место внутривенного введения [10,11]. Экстравазация РФП 18F-фтордезоксиглюкозы (18F-ФДГ) имеет минимальные клинические проявления из-за малого объема вводимого лекарственного препарата, отсутствия раздражающего и токсического действия. Из-за перечисленных причин экстравазация 18F-ФДГ, особенно частичная, может оставаться незамеченной медицинским персоналом [12, 13]. Лекарственный препарат при экстравазации поступая в мягкие ткани, не может полноценно попасть в клетки-мишени из-за нарушенной фармакокинетики [14]. Это не случайно, так как при внутривенном введении рассчитанной дозы 18F-ФДГ весь он должен попасть в кровоток; в дальнейшем эта доза будет использована для расчета стандартного значения поглощения (англ.: standard uptake value, SUV). Поэтому, даже частичная экстравазация 18F-ФДГ создаст несоответствие между фактически расчетной введенной дозой и дозой, фактически введенной в кровоток. Часть 18F-ФДГ, оставаясь в зоне экстравазации, инфильтрирует ткани, а затем возвращается в системный кровоток за счет лимфатической резорбции, с непредсказуемой скоростью изменяя клиренс 18F-ФДГ в тканях, что снижает точность расчета SUV [15,16].
Частота экстравазации РФП при ПЭТ/КТ приводится с большим диапазоном, от 1,9% до 15,7%, что связано как с минимальными клиническими проявлениями, так и трудностями ее обнаружения при сканировании пациента [17].
Экстравазацию можно просто обнаружить при сканировании пациента и визуальном анализе полученных данных, но статическое изображение при ПЭТ/КТ получают в среднем через 60 мин после инъекции, а это не отражает реальной картины в зоне экстравазации в момент ее возникновения. Ведь в период сканирования в зоне экстравазации часть препарата распалась, часть резорбировалась в лимфатическую систему. В трети случаев место введения 18F-ФДГ находится за пределами сканирования из-за стандартной укладки пациента (руки подняты), поэтому около 23% случаев частичной экстравазации 18F-ФДГ остаются незамеченными при описании исследования [18]. Если проводить ПЭТ/КТ пациента в течение определенного времени, игнорируя факт экстравазации, то кумулятивная вероятность того, что экстравазация 18F-ФДГ повлияет на оценку исследования, увеличивается с ростом числа исследований [5].
Кроме экстравазации 18F-ФДГ при проведении ПЭТ/КТ у пациента может произойти экстравазация контрастного препарата (КП), что в ряде случаев негативно повлияет на качество исследования. Клиническими проявлениями экстравазация КП являются местные изменения в легкой форме: умеренная боль, отек, эритема кожи в зоне экстравазации. Значительно реже экстравазация КП протекает в тяжелой форме с развитием компартмент-синдрома, с изъязвлением и некрозом тканей [19].
Причин поступления КП в мягкие ткани при внутривенной инъекции много: непреднамеренные действия медицинского персонала, статус пациента (пол возраст, сопутствующая патология, проведенная ранее химиотерапия и др.). В клинической практике наблюдается сочетание разных факторов, приводящих к экстравазации.
В рандомизированных исследованиях частота экстравазации КП составляет не более 1%. Heshmatzadeh Behzadi с соавторами приводят следующие данные – из 1104872 пациентов после проведения компьютерной томографии (КТ) и магнитно-резонансной томографии (МРТ) экстравазация КП была у 2191 (0,2%). Частота экстравазации КП на основе гадолиния была в 0,045% случаях и почти в 6 раз выше после введения КП на основе йода – 0,26% случаев [20-24].
Лечение экстравазации КП простое. Охлаждение области экстравазации и наблюдение медицинского персонала. Редко может потребоваться хирургическое лечение из-за развития компартмент-синдрома [25]. Профилактика экстравазации заключается в обеспечении надежного внутривенного доступа и его контроль перед введением КП, снижение скорости КП у пациентов с высоким риском (если это позволяет протокол исследования), непосредственное наблюдение за местом введения КП в течение первых 15 секунд инъекции, общение с пациентом для выявления любых необычных ощущений в месте внутривенного введения КП и немедленное прекращение введения, если есть опасения по поводу экстравазации [26].
Кроме экстравазации, после введения КП могут развиваться и потенциально летальные осложнения, такие как анафилактические реакции (АР) и контраст индуцированная нефропатия (КИН). В настоящее время их частота в сравнении с 90 годами прошлого века снизилась. Это связано с тем, что раньше применяли высокоосмолярные КП, сегодня - низко- и изоосмолярные препараты [27]. Рабочая группа Американского колледжа аллергии, астмы и иммунологии (англ.: American College of Allergy, Asthma and Immunology, AСAAI) приводит частоту анафилаксии на йод содержащие КП от 30 до 950 случаев на 100000 населения в год, с частотой летальных случаев менее 1% [28,29].
Европейский комитет Академии аллергологии и клинической иммунологии (англ.: The European Academy of Allergology and Clinical Immunology, EAACI) определяет анафилаксию как острую, тяжелую, опасную для жизни, генерализованную реакцию гиперчувствительности, характеризующуюся быстро развивающимися опасными для жизни изменениями дыхательных путей и/или кровообращения, обычно ассоциированными с изменениями кожи и слизистых оболочек [30].
Тяжелым и жизнеугрожающим проявлением АР является анафилактический шок (АШ), связанный с острой недостаточностью кровообращения в результате генерализованной реакции гиперчувствительности. Критериями АШ являются снижение систолического артериального давления ниже 90 мм рт. ст. или ниже 30% от рабочего уровня, приводящего к нарушению гемодинамики и гипоксии жизненно важных органов [31-34].
Анафилаксия остается тяжелым и опасным осложнением при проведении ПЭТ/КТ с контрастным усилением, поэтому каждый медицинский работник должен быть готов справиться с АР и АШ. Внутримышечное введение эпинефрина (адреналина) эффективно купирует АР, предотвращает переход анафилаксии в АШ [35,36]. Несмотря на это, существует практика, когда адреналин заменяется антигистаминными препаратами или глюкокортикоидами [37,38]. Последние часто используются в качестве дополнительной терапии анафилаксии, но в настоящее время недостаточно доказательств, подтверждающих их клиническую эффективность [39,40].
Другим потенциально летальным осложнением, связанным с применением КП является контраст-индуцированная нефропатия (КИН) (синонимы: острое постконтрастное повреждение почек, контраст-индуцированное острое повреждение почек). Критерии, позволяющие диагностировать КИН, следующие: повышение сывороточного креатинина ≥ 25% по сравнению с исходным значением или увеличение сывороточного креатинина > 0,5 мг/дл (44 ммоль/л) в течение 48 - 72 часов после введения контрастного препарата [41,42]. Европейское общество урогенитальной патологии (англ.: European Society of Urogenital Radiology, ESUR) описывает КИН как повышение сывороточного креатинина > 0,3 мг/дл (> 26,5 мкмоль/л) или в > 1,5 - 1,9 раза выше исходного уровня в течение 48 - 72 часов после введения КП [43]. В большинстве случаев КИН - обратимое состояние, но иногда может приводить к стойкой почечной недостаточности, необходимости гемодиализа и смерти [44, 45]. Разными авторами частота КИН оценивается от 0% до 24% [46,47].
Исследования, выполненные в последние два десятилетия, показали отсутствие высокой корреляции между острым повреждением почек и введением изо- и низкоосмолярных йод содержащих контрастных препаратов и продемонстрировали многофакторный патогенез КИН [48,49]. Это привело к либерализации рекомендаций по внутривенному применению современных йод содержащих контрастных препаратов, а именно к отказу определения сывороточного креатинина у всех пациентов перед введением КП и использованию простых опросников, позволяющих выявить пациентов с высоким риском развития КИН [50].
Обморок пациента при проведении медицинских манипуляций – ситуация знакомая медицинскому персоналу. Делая венопункцию и катетеризацию периферической вены пациенту, перед введением лекарственного препарата, медицинские работники могут наблюдать потерю сознания у пациента. При проведении таких инвазивных манипуляций чаще всего встречается вазовагальный обморок (синонимы: вазовагальная синкопа, нейрокардиогенный обморок), относящийся к подгруппе рефлексогенных обмороков, группе нетравматической транзиторной потери сознания [51].
Вазовагальные обмороки характеризуются внезапным началом, пресинкопе, проявляющимся головокружением, тошнотой, потливостью, появлением черных точек перед глазами и чувством приближающейся потери сознания, кратковременностью обморока, спонтанным и полным восстановлением сознания, амнезией периода потери сознания. Лечебные мероприятия при возникновении вазовагального обморока простые; они представлены в клинических рекомендациях Европейского общества кардиологов (англ.: European Society of Cardiology, ESC) по диагностике и лечению синкопальных состояний [52]. В Российской Федерации нет утвержденных клинических рекомендаций по ведению пациентов с острым нарушением сознания [53].
ПЭТ/КТ, несомненно, является одним из лучших диагностических инструментов в онкологии, сочетающим анатомическую точность КТ с молекулярной и метаболической детализацией ПЭТ, что позволяет поставить исключительно точный диагноз и повлиять на выбор лечения пациента с ЗНО. В то же время важно понимать, что, восхищаясь диагнозом, мы часто забываем о возможных осложнениях, которые зачастую остаются в тени.
Поэтому целью нашего исследования стало изучение частоты осложнений у пациентов с ЗНО при проведении позитронно-эмиссионной томографии, совмещенной с рентгеновской компьютерной томографией с контрастным усилением.
Материалы и методы
Мы провели проспективное обсервационное исследование, включив в него 2492 пациента с ЗНО, которым выполняли ПЭТ/КТ с 18F-ФДГ. Подготовка к исследованию была стандартной. После венопункции периферической вены и установки венозного катетера, через него вводили раствор 18F-ФДГ (средняя введенная активность составила 4,5 МБк × 1 кг массы тела пациента). После инъекции 18F-ФДГ промывали катетер изотоническим раствором натрия хлорида объемом 10 мл. Время от внутривенной инъекции 18F-ФДГ до начала сканирования пациента составляло от 60 до 75 мин.
ПЭТ/КТ с контрастным усилением в венозную фазу выполнили 2359 (94,6%) пациентам2. Внутривенное введение КП, через ранее установленный катетер проводили с применением автоматического инжектора. Скорость введения КП была от 1 мл до 3 мл в минуту. Внутривенное контрастирование не проводили при отказе пациента от применения КП, аллергической реакции на йод содержащие КП и при СКФ ≤ 30 мл/мин/1,73м2.
Мы проспективно фиксировали возникающие осложнения до проведения ПЭТ/КТ, во время и после исследования. При венопункции и установке венозного катетера в периферическую вену, введении в катетер РФП и изотонического раствора натрия хлорида регистрировали жалобы пациента. Визуально и пальпаторно оценивали состояние мягких тканей в зоне расположения катетера во время и после введения лекарственного препарата для исключения экстравазации. При сканировании и внутривенном введении КП с применением автоинжектора оценивали жалобы пациента и изменение графика при премониторинге в момент введения КП в венозной фазе на мониторе рабочей станции. После проведения исследования наблюдали пациента в течение 30 минут для исключения анафилаксии.
Из группы пациентов, наблюдаемых проспективно случайным образом, были выбраны 235 протоколов исследований, при анализе и описании которых мы оценивали визуализацию места ведения и наличие или отсутствие экстравазации 18F-ФДГ.
Результаты
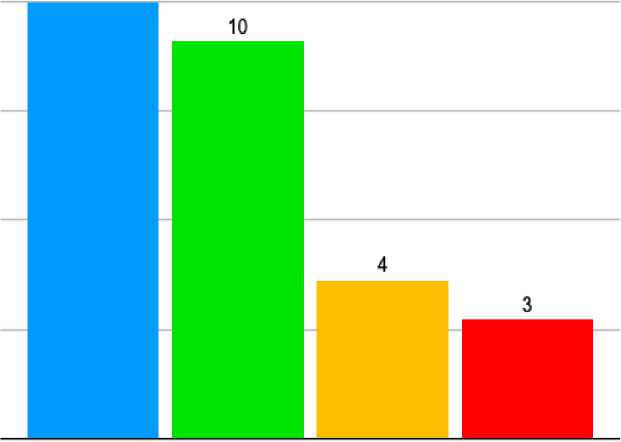
В нашем исследовании осложнения при проведении ПЭТ/КТ (до, во время и после исследования) наблюдали у 28 (1,12%) пациентов. Анафилаксия была у 11 (0,47%), экстравазация КП у 10 (0,42%), экстравазация 18F-ФДГ у 4 (0,16%), вазовагальный обморок у 3 (0,12%) больных (рис. 1).
-
■ Анафилаксия
-
■ Экстравазация контрастного препарата Экстравазация радиофармпрепарата 18Е-ФДГ
-
■ Вазовагальный обморок
Рис. 1 . Характер и частота осложнений при проведении ПЭТ/КТ.
Fig. 1 . Character and frequency of complications in PET/CT.
Частоту КИН мы не оценивали, так как не имели возможности наблюдать за пациентами в течение 48 – 72 часов после проведения ПЭТ/КТ.
У всех 11 пациентов с АР, ее дебют был в течение первых 30 минут после внутривенного введения КП. Никто из 11 пациентов ранее не отмечал АР на КП. Легкая реакция была у 3 пациентов в виде единичных уртикарных элементов на коже шеи, груди, живота и верхних конечностей с легким кожным зудом. Она не требовала медикаментозного лечения, регрессировала самостоятельно в течение двадцатиминутного наблюдения медицинским персоналом. У 8 пациентов АР была средней степени тяжести, что потребовало внутримышечного введения эпинефрина и дексаметазона (в верхнюю треть переднелатеральной поверхности правого бедра эпинефрин 1 мл (1мг/мл), затем дексаметазон 8 мг). Повторных инъекций эпинефрина не потребовалось, проявления анафилаксии были купированы в течение 30 минут после его инъекции. Мы не наблюдали АР тяжелой степени и АШ.
Из 2492 пациентов экстравазация КП была у 10. Экстравазация КП у 8 пациентов была в начале введения контрастного препарата, у 2 – в процессе введения. В 8 случаях экстравазация КП проявлялась жалобами на умеренную боль, чувство распирания, жжения, дискомфорта в месте инъекции препарата, в 2 случаях было только увеличение объема тканей в области внутривенного введения КП. Лечение заключалось в прекращении введения КП, удалении внутривенного катетера, наложении давящей повязки и локального холодного компресса на 20 – 30 минут.
Экстравазацию РФП мы наблюдали у 4 пациентов. У 2 – при введении 18F-ФДГ, и у 2 – ретроспективно при анализе и описании исследования. Непосредственно при внутривенном введении экстравазация 18F-ФДГ была нами замечена в 2 случаях. Единственным клиническим признаком экстравазации было незначительное увеличение объема мягких тканей в области введения препарата. Увеличение объема тканей заметили в момент введения изотонического раствора натрия хлорида, промывая катетер после инъекции 18F-ФДГ.
Из 2492 проведенных ПЭТ/КТ исследований мы случайным образом выбрали 235 протокола исследований с единственным критерием включения – стандартная укладка пациента (руки вверх). Область введения 18F-ФДГ была видна у 58 пациентов (24,68 %) из них частичная экстравазация 18F-ФДГ обнаружена у 2 (3,4 %) (рис. 2).
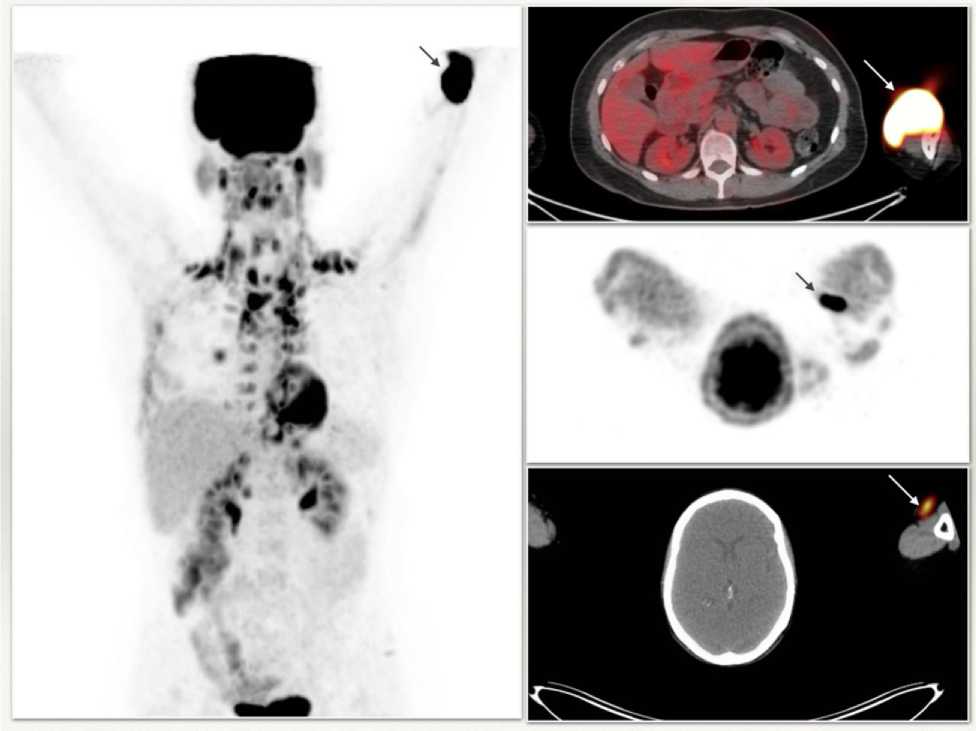
Рис. 2 . Изображения частичной экстравазации 18F-ФДГ при проведении ПЭТ/КТ (места экстравазации 18F-ФДГ маркированы стрелками).
Fig. 2. Images of partial extravasation of 18F-FDG on PET/CT (the area of extravasation of 18F-FDG is marked with arrows).
Вазовагальный обморок наблюдали у 3 (0,12%) пациентов при венопункции. Обморок характеризовался коротким продромальным периодом, бледностью и гипергидрозом кожных покровов, отсутствием сознания в течении нескольких секунд, а затем быстрым и полным восстановлением сознания. Лечения, или каких-либо действий, связанных с применением нашатырного спирта, «похлопывания» пациента, «обмахивания», мы не проводили. После восстановления сознания пациент сжимал кисти рук, напрягал мышцы предплечий на несколько секунд. Подготовку к проведению ПЭТ/КТ продолжали. Вазовагальный обморок не был поводом для отмены исследования.
Обсуждение и заключение
ПЭТ/КТ представляется безопасным и малоинвазивным методом диагностики пациентов с МНД, обладающим высокой точностью и специфичностью. В то же время ПЭТ/КТ, как и любой другой современный метод диагностики, сопряжен с риском осложнений. В своей работе мы представили актуальные литературные данные, показывающие характер и частоту осложнений при проведении ПЭТ/КТ, и провели собственное исследование. Частота осложнений при проведении ПЭТ/КТ составила 1,12%.
Самым частым осложнением была АР – 0,44%. Развивалась она в первые 30 минут после окончания введения КП, протекая в легкой и среднетяжелой формах. Анафилаксия полностью купировалась внутримышечным введением адреналина при среднетяжелом течении и не требовала медикаментозной терапии при легкой форме.
При развитии АР медицинские сотрудники, участвующие в проведении ПЭТ/КТ с применением КП должны помнить, что анафилаксия является потенциально летальным осложнением, всегда иметь доступ к адреналину для купирования анафилаксии.
Реже наблюдалась экстравазация КП - 0,40% и экстравазация 18F-ФДГ - 0,16%. Диагностика экстравазии КП не представляет сложности из-за большего объема вводимого раствора. Экстравазация 18F-ФДГ наблюдается редко из-за малого объема вводимого раствора, отсутствия раздражающего действия препарата на ткани и отсутствия визуализации зоны инъекции при сканировании. При анализе ПЭТ/КТ мы видели место введения РФП в 24,68% случаев. В данной работе мы не оценивали влияние экстравазации на качество рентгенологического исследования, но, учитывая данные литературы, экстравазация РФП может негативно влиять на результат исследования, особенно при проведении ПЭТ/КТ в динамике [3]. Для улучшения выявления экстравазации РФП целесообразно использовать специальные портативные устройства [14,15].
Вазовагальный обморок был редким осложнениям при проведении ПЭТ/КТ – 0,12%. Он не требовал проведения лечебных мероприятий, проходил быстро и самостоятельно, не приводил к отмене исследования.
Вклад авторов. А.С. Аладин: предложение идеи статьи, дизайн исследования, написание текста; Н.А. Абутина: выполнение исследования; Н.В. Нуднов: написание и редактирование текста; И.И. Насырова: выполнение исследования. Все авторы прочитали и согласились с версией рукописи, представленной для публикации.
Финансирование. Это исследование не получило внешнего финансирования.
Соблюдение прав пациентов и правил биоэтики. Разрешение этического комитета не требовалось.
Список литературы Осложнения при проведении позитронно-эмиссионной томографии, совмещенной с рентгеновской компьютерной томографией у пациентов со злокачественными новообразованиями
- Wagner HN Jr. A brief history of positron emission tomography (PET). Semin Nucl Med. 1998 Jul;28(3):213-220. doi: 10.1016/s0001-2998(98)80027-5.
- Jones T, Townsend D. History and future technical innovation in positron emission tomography. J Med Imaging (Bellingham). 2017 Jan;4(1):011013. doi: 10.1117/1.JMI.4.1.011013.
- Joliot F, Curie I. Artificial production of a new kind of radio-element. Nature. 1934;133(3354):201-202. doi: 10.1038/133201a0.
- Graham MM, Wahl RL, Hoffman JM, Yap JT, Sunderland JJ, Boellaard R, et al. Summary of the UPICT Protocol for 18F-FDG PET/CT Imaging in Oncology Clinical Trials. J Nucl Med. 2015 Jun;56(6):955-961. doi: 10.2967/jnumed.115.158402.
- Kiser JW, Crowley JR, Wyatt DA, Lattanze RK. Impact of an 18F-FDG PET/CT Radiotracer Injection Infiltration on Patient Management-A Case Report. Front Med (Lausanne). 2018 May 15;5:143. doi: 10.3389/fmed.2018.00143.
- Anderson H, Price P. What does positron emission tomography offer oncology? Eur J Cancer. 2000 Oct;36(16):2028-2035. doi: 10.1016/s0959-8049(00)00292-6.
- Сорокина М.В., Редькин А.Н., Устинова Е.Ю., Мануковская О.В. Роль и место ПЭТ/КТ в оценке распространенности меланомы кожи. Вестник рентгенологии и радиологии. 2022:103(1-3):77-82. doi: 10.20862/0042-4676-2022-103-1-3-77-82.
- Ларюков А.В., Хасанов Р.Ш., Афанасьева З.А., Ларюкова Е.К. Анализ информативности магнитно-резонансной томографии и позитронно-эмиссионной компьютерной томографии с 18F-ФДГ в диагностике метастатического поражения позвоночника и костей таза у больных немелкоклеточным раком легкогого. Сибирский онкологический журнал. 2021;20(5):100-107. doi: 10.21294/1814-4861-2021-20-5-100-107.
- Paydary K, Seraj SM, Zadeh MZ, Emamzadehfard S, Shamchi SP, Gholami S, et al. The Evolving Role of FDG-PET/CT in the Diagnosis, Staging, and Treatment of Breast Cancer. Mol Imaging Biol. 2019 Feb;21(1):1-10. doi: 10.1007/s11307-018-1181-3.
- Kim JT, Park JY, Lee HJ, Cheon YJ. Guidelines for the management of extravasation. J Educ Eval Health Prof. 2020;17:21. doi: 10.3352/jeehp.2020.17.21.
- Буйденок Ю.В. Рекомендации по лечению последствий экстравазации противоопухолевых препаратов. Злокачественные опухоли. 2021;10(3s2-2):141-147. doi: 10.18027/2224-5057-2020-10-3s2-48.
- Perrin S, Kiser JW, Knowland J, Bowen SL. Development of a classifier for [18F]fluorodeoxyglucose extravasation severity using semi-quantitative readings from topically applied detectors. EJNMMI Phys. 2022 Sep 14;9(1):61. doi: 10.1186/s40658-022-00488-6.
- Currie GM, Sanchez S. Topical sensor metrics for 18F-FDG positron emission tomography dose extravasation. Radiography (Lond). 2021 Feb;27(1):178-186. doi: 10.1016/j.radi.2020.07.013.
- Sanchez S, Currie GM. Detection of 18F-FDG Dose Leakage Using a Topical Device. J Nucl Med Technol. 2020 Sep;48(3):283-284. doi: 10.2967/jnmt.119.240283.
- Silva-Rodríguez J, Aguiar P, Sánchez M, Mosquera J, Luna-Vega V, Cortés J, et al. Correction for FDG PET dose extravasations: Monte Carlo validation and quantitative evaluation of patient studies. Med Phys. 2014 May;41(5):052502. doi: 10.1118/1.4870979.
- Sagara H, Inoue K, Yaku H, Ohsawa A, Someya T, Yanagisawa K, et al. Optimization of injection dose in 18F-FDG PET/CT based on the 2020 national diagnostic reference levels for nuclear medicine in Japan. Ann Nucl Med. 2021 Nov;35(11):1177-1186. doi: 10.1007/s12149-021-01656-x.
- Wong TZ, Benefield T, Masters S, Kiser JW, Crowley J, Osborne D, et al. Quality Improvement Initiatives to Assess and Improve PET/CT Injection Infiltration Rates at Multiple Centers. J Nucl Med Technol. 2019 Dec;47(4):326-331. doi: 10.2967/jnmt.119.228098.
- Osman MM, Muzaffar R, Altinyay ME, Teymouri C. FDG Dose Extravasations in PET/CT: Frequency and Impact on SUV Measurements. Front Oncol. 2011 Nov 16;1:41. doi: 10.3389/fonc.2011.00041.
- Wang CL, Cohan RH, Ellis JH, Adusumilli S, Dunnick NR. Frequency, management, and outcome of extravasation of nonionic iodinated contrast medium in 69,657 intravenous injections. Radiology. 2007 Apr;243(1):80-87. doi: 10.1148/radiol.2431060554. Erratum in: Radiology. 2015 Jan;274(1):307.
- Beckett KR, Moriarity AK, Langer JM. Safe Use of Contrast Media: What the Radiologist Needs to Know. Radiographics. 2015 Oct;35(6):1738-1750. doi: 10.1148/rg.2015150033.
- Pasternak JJ, Williamson EE. Clinical pharmacology, uses, and adverse reactions of iodinated contrast agents: a primer for the non-radiologist. Mayo Clin Proc. 2012 Apr;87(4):390-402. doi: 10.1016/j.mayocp.2012.01.012.
- Bellin MF, Jakobsen JA, Tomassin I, Thomsen HS, Morcos SK, Thomsen HS, et al.; Contrast Media Safety Committee Of The European Society Of Urogenital Radiology. Contrast medium extravasation injury: guidelines for prevention and management. Eur Radiol. 2002 Nov;12(11):2807-2812. doi: 10.1007/s00330-002-1630-9.
- Pacheco Compaña FJ, Gago Vidal B, Méndez Díaz C. Extravasación de medios de contraste intravenosos en el sitio de la punción: Protocolo de actuación [Extravasation of contrast media at the puncture site: Strategies for managment]. Radiologia. 2014 Jul-Aug;56(4):295-302. Spanish. doi: 10.1016/j.rx.2014.02.003.
- Heshmatzadeh Behzadi A, Farooq Z, Newhouse JH, Prince MR. MRI and CT contrast media extravasation: A systematic review. Medicine (Baltimore). 2018 Mar;97(9):e0055. doi: 10.1097/MD.0000000000010055.
- Currie GM. Pharmacology, Part 5: CT and MRI Contrast Media. J Nucl Med Technol. 2019 Sep;47(3):189-202. doi: 10.2967/jnmt.118.220012.
- Thomas R, Vermaak L, Price G. Iodinated Contrast Media Extravasation Injuries: Should Osmolality and the Pattern of Distribution Affect Management?: A Literature Review and Case Report Comparison. Eplasty. 2022 Jun 30;22:e23. PMID: 35903426; PMCID: PMC9280047.
- Krestan C. Kontrastmittel – Handlungsempfehlungen für die Praxis [Contrast media - Guidelines for practical use]. Radiologe. 2019 May;59(5):444-453. German. doi: 10.1007/s00117-019-0523-8.
- Johansson SG, Bieber T, Dahl R, Friedmann PS, Lanier BQ, Lockey RF, et al. Revised nomenclature for allergy for global use: Report of the Nomenclature Review Committee of the World Allergy Organization, October 2003. J Allergy Clin Immunol. 2004 May;113(5):832-836. doi: 10.1016/j.jaci.2003.12.591.
- Soar J, Pumphrey R, Cant A, Clarke S, Corbett A, Dawson P, et al.; Working Group of the Resuscitation Council (UK). Emergency treatment of anaphylactic reactions--guidelines for healthcare providers. Resuscitation. 2008 May;77(2):157-169. doi: 10.1016/j.resuscitation.2008.02.001.
- Cardona V, Ansotegui IJ, Ebisawa M, El-Gamal Y, Fernandez Rivas M, Fineman S, et al. World allergy organization anaphylaxis guidance 2020. World Allergy Organ J. 2020 Oct 30;13(10):100472. doi: 10.1016/j.waojou.2020.100472.
- Wood RA, Camargo CA Jr, Lieberman P, Sampson HA, Schwartz LB, Zitt M, et al. Anaphylaxis in America: the prevalence and characteristics of anaphylaxis in the United States. J Allergy Clin Immunol. 2014 Feb;133(2):461-467. doi: 10.1016/j.jaci.2013.08.016.
- Галимова Е.С., Нуртдинова Г.М., Кучер О.Н., Муслимова В.К. Лекарственно-индуцированный анафилактический шок. Врач скорой помощи. 2020;5:6-9.
- Матвеев А.В., Крашенинников А.Е., Белостоцкий А.В., Андреева Д.М., Марченко С.Д., Егорова Е.А. Лекарственный анафилактический шок. Общая реаниматология. 2020:16(3):76-84. doi: 10.15360/1813-9779-2020-3-76-84.
- Астафьева Н.Г., Баялиева А.Ж., Заболотских И.Б., Ильина Н.И., Куликов А.В., Латышева Т.В. и др. Анафилактический шок. Клинические рекомендации. Российский Аллергологический Журнал. 2021;18(1):56-72. doi: 10.36691/RJA1422.
- Ильина Н.И., Заболотских И.Б., Астафьева Н.Г., Баялиева А.Ж., Куликов А.В., Латышева Т.В. и др. Анафилактический шок. Клинические рекомендации Российской ассоциации аллергологов и клинических иммунологов и Общероссийской общественной организации «Федерация анестезиологов и реаниматологов». Вестник интенсивной терапии имени А.И. Салтанова. 2020;(3):15-26. doi: 10.21320/1818-474X-2020-3-15-26.
- Turner PJ, Gowland MH, Sharma V, Ierodiakonou D, Harper N, Garcez T, et al. Increase in anaphylaxis-related hospitalizations but no increase in fatalities: an analysis of United Kingdom national anaphylaxis data, 1992-2012. J Allergy Clin Immunol. 2015 Apr;135(4):956-963.e1. doi: 10.1016/j.jaci.2014.10.021.
- Pumphrey RS. Fatal anaphylaxis in the UK, 1992-2001. Novartis Found Symp. 2004;257:116-28; discussion 128-32, 157-60, 276-85. PMID: 15025395.
- Pumphrey RS, Gowland MH. Further fatal allergic reactions to food in the United Kingdom, 1999-2006. J Allergy Clin Immunol. 2007 Apr;119(4):1018-1019. doi: 10.1016/j.jaci.2007.01.021.
- Sampson HA, Muñoz-Furlong A, Campbell RL, Adkinson NF Jr, Bock SA, Branum A, et al. Second symposium on the definition and management of anaphylaxis: summary report--Second National Institute of Allergy and Infectious Disease/Food Allergy and Anaphylaxis Network symposium. J Allergy Clin Immunol. 2006 Feb;117(2):391-397. doi: 10.1016/j.jaci.2005.12.1303.
- Inagaki N, Miura T, Nagai H, Koda A. Antiallergic mechanisms of beta-adrenergic stimulants in rats. Life Sci. 1992;51(21):PL201-205. doi: 10.1016/0024-3205(92)90316-h.
- de Laforcade L, Bobot M, Bellin MF, Clément O, Grangé S, Grenier N, et al. Kidney and contrast media: Common viewpoint of the French Nephrology societies (SFNDT, FIRN, CJN) and the French Radiological Society (SFR) following ESUR guidelines. Diagn Interv Imaging. 2021 Mar;102(3):131-139. doi: 10.1016/j.diii.2021.01.007.
- Shams E, Mayrovitz HN. Contrast-Induced Nephropathy: A Review of Mechanisms and Risks. Cureus. 2021 May 4;13(5):e14842. doi: 10.7759/cureus.14842.
- Khwaja A. KDIGO clinical practice guidelines for acute kidney injury. Nephron Clin Pract. 2012;120(4):c179-184. doi: 10.1159/000339789.
- Mamoulakis C, Tsarouhas K, Fragkiadoulaki I, Heretis I, Wilks MF, Spandidos DA, et al. Contrast-induced nephropathy: Basic concepts, pathophysiological implications and prevention strategies. Pharmacol Ther. 2017 Dec;180:99-112. doi: 10.1016/j.pharmthera.2017.06.009.
- Hossain MA, Costanzo E, Cosentino J, Patel C, Qaisar H, Singh V, et al. Contrast-induced nephropathy: Pathophysiology, risk factors, and prevention. Saudi J Kidney Dis Transpl. 2018 Jan-Feb;29(1):1-9. doi: 10.4103/1319-2442.225199.
- Yang SY, Chiou TT, Shiao CC, Lin HY, Chan MJ, Wu Ch, et al. Nomenclature and diagnostic criteria for acute kidney injury - 2020 consensus of the Taiwan AKI-task force. J Formos Med Assoc. 2022 Apr;121(4):749-765. doi: 10.1016/j.jfma.2021.08.005.
- Stacul F, van der Molen AJ, Reimer P, Webb JA, Thomsen HS, Morcos SK, et al.; Contrast Media Safety Committee of European Society of Urogenital Radiology (ESUR). Contrast induced nephropathy: updated ESUR Contrast Media Safety Committee guidelines. Eur Radiol. 2011 Dec;21(12):2527-2541. doi: 10.1007/s00330-011-2225-0.
- Bruce RJ, Djamali A, Shinki K, Michel SJ, Fine JP, Pozniak MA. Background fluctuation of kidney function versus contrast-induced nephrotoxicity. AJR Am J Roentgenol. 2009 Mar;192(3):711-718. doi: 10.2214/AJR.08.1413.
- Lima FO, Lev MH, Levy RA, Silva GS, Ebril M, de Camargo EC, et al. Functional contrast-enhanced CT for evaluation of acute ischemic stroke does not increase the risk of contrast-induced nephropathy. AJNR Am J Neuroradiol. 2010 May;31(5):817-821. doi: 10.3174/ajnr.A1927.
- Hinson JS, Ehmann MR, Fine DM, Fishman EK, Toerper MF, Rothman RE, Klein EY. Risk of Acute Kidney Injury After Intravenous Contrast Media Administration. Ann Emerg Med. 2017 May;69(5):577-586.e4. doi: 10.1016/j.annemergmed.2016.11.021.
- Goldberger ZD, Petek BJ, Brignole M, Shen WK, Sheldon RS, Solbiati M, et al. ACC/AHA/HRS Versus ESC Guidelines for the Diagnosis and Management of Syncope: JACC Guideline Comparison. J Am Coll Cardiol. 2019 Nov 12;74(19):2410-2423. doi: 10.1016/j.jacc.2019.09.012.
- Brignole M, Moya A, de Lange FJ, Deharo JC, Elliott PM, Fanciulli A, et al. 2018 ESC Guidelines for the diagnosis and management of syncope [2018 ESC Guidelines for the diagnosis and management of syncope]. Kardiol Pol. 2018;76(8):1119-1198. Polish. doi: 10.5603/KP.2018.0161.
- Джиоева О.Н., Резник Е.В., Никитин И.Г. Дифференциальная диагностика синкопальных состояний. Кардиоваскулярная терапия и профилактика. 2019;18(2):76-83. doi: 10.15829/1728-8800-2019-2-76-83.


