Особенности диагностики и лечения ВИЧ-ассоциированных неходжкинских лимфом
Автор: Хайретдинов Раис Кэтдусович, Давыдкин Игорь Леонидович, Спирин Алексей Васильевич, Агафонова Ольга Вячеславовна, Данилова Олеся Евгеньевна, Вехова Екатерина Васильевна, Кривова Светлана Петровна, Анисимова Елена Владимировна, Царева Екатерина Владимировна, Куртов Игорь Валентинович, Кузьмин Владимир Петрович
Рубрика: Клиническая медицина
Статья в выпуске: 5-4 т.16, 2014 года.
Бесплатный доступ
Представлены особенности патогенеза, клинической картины, диагностики и лечения ВИЧ-ассоциированных неходжкинских лимфом, для которых характерна быстрая опухолевая прогрессия, требующая быстрого начала химиотерапии. Химиотерапия должна проводиться на фоне высокоактивной антиретровирусной терапии, которая восстанавливает иммунную систему, снижает развитие инфекционных осложнений, вследствие чего химиотерапия проводится в обычных, полноценных дозах.
Вич-ассоцированные лимфомы, высокоактивной антиретровирусной терапии
Короткий адрес: https://sciup.org/148101942
IDR: 148101942 | УДК: 616.006.441
Текст научной статьи Особенности диагностики и лечения ВИЧ-ассоциированных неходжкинских лимфом
Агафонова Ольга Вячеславовна, заместитель главного врача по медицинской части
Данилова Олеся Евгеньевна, кандидат медицинских наук, заведующая вторым гематологическим отделением клиники госпитальной терапии. E-mail:
Вехова Екатерина Васильевна, кандидат медицинских наук, врач-инфекционист
заболевания, ассоциированные с иммунодефицитом» [1, 24]. Вирус иммунодефицита человека (ВИЧ) значительно повышает риск развития хронических лимфопролиферативных заболеваний как неходжкинских лимфом (НХЛ), так и лимфомы Ходжкина (ЛХ). Эпидемиологические исследования показали, что для ВИЧ-инфицированных пациентов характерно 60-200-кратное повышение заболеваемости НХЛ.
Таблица 1. Относительный риск различных лимфом у ВИЧ-инфицированных больных по сравнению с неинфицированными ВИЧ (Goedert, 2000; с изменениями)
|
Вид лимфом |
Риск |
|
неходжкинские лимфомы, все |
165 |
|
неходжкинские лимфомы высокой степени злокачественности |
348 |
|
иммуноблоастная НХЛ |
652 |
|
лимфома Беркина |
261 |
|
неклассифицированные |
580 |
|
первичная лимфома ЦНС |
> 10000 |
|
неходжкинские лимфомы низкой степени злокачественности |
14 |
|
плазмоцитома |
5 |
|
лимфогранулематоз (болезнь Ходжкина) |
8 |
Увеличение числа больных НХЛ среди ВИЧ-инфицированных составляет 5,6% в год по сравнению с 0,015% в общей популяции [6]. Риск НХЛ или первичной лимфомы центральной нервной системы (ЦНС) у ВИЧ-инфицированных лиц тесно связан с уровнем CD4. В одном из исследований [7] установлено, что частота НХЛ повысилась с 15,6 до 253,8 на 10 тыс. человеко-лет, а первичная лимфома ЦНС от 2 до 93,9 на 10 тыс. человеко-лет у пациентов с числом лимфоцитов CD4 >350 клеток/мкл по сравнению с пациентами с <50 клеток/мкл CD4 соответственно [1, 3, 10]. При ВИЧ-инфекции чаще всего встречаются диффузная B-крупноклеточ-ная лимфома (40-60%), лимфома Беркитта (30-40%), MALT- лимфомы (1-4%) [1, 3].
Диагностика лимфом у ВИЧ-инфицированных в России вызывает большие трудности, которые связаны как с поздним обращением пациента, так и с длительным периодом до проведении биопсии. По данным Ермак Т.Н., прижизненная диагностика лимфом в структуре вторичных заболеваний составила всего 0,5% (ФНЦМБСПИД, Суздаль, 19-22 апреля 2010 г).
Патогенез ВИЧ-ассоциированных лимфом. Возникновению ВИЧ-ассоциированной лимфомы могут способствовать сложное взаимодействие ряда факторов, таких как хроническая стимуляция антигеном, ко-инфекция онкогенных вирусов, генетические аномалии и нарушения регуляции цитокинов [22]. Хроническая антигенная стимуляция, которая связана с ВИЧ-инфекцией, может привести к увеличению количества поликлональных В-клеток и, вероятно, в дальнейшем способствовать появлению моноклональных [18, 25]. В 40% случаев ВИЧ-ассоциированных лимфом выявляют онкогенный вирус Эпштейна-Барр (ВЭБ) [1, 3]. Почти у всех больных первичной лимфомой ЦНС и ЛХ определяют ВЭБ. В большинстве случаев ВИЧ-ассоциированной первичной лимфомы экссудатов (ПЛЭ) отмечают ассоциацию 2 онкогенных вирусов: ВЭБ и вируса герпеса 8-го типа (human herpesvirus – HHV-8), который присутствует практически у всех пациентов [8]. ВЭБ определяется у 30–50% при ВИЧ-ассоциированной лимфоме Беркитта и в 50% случаев плазмобластной лимфомы [1, 3, 5].
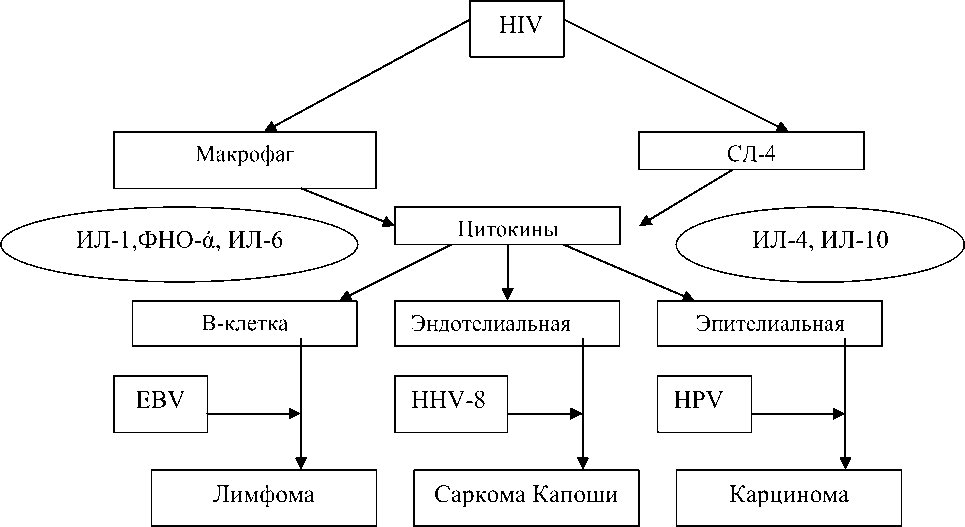
Рис. 1. Схема патогенеза возникновения ВИЧ-ассоцированных опухолей (Robert J. Biggar, Elaine S, 2006)
ВЭБ-положительные ВИЧ-ассоциирован-ные лимфомы часто экспрессируют латентный мембранный белок 1, который активирует пролиферацию клеток путем активации NF-kB пути и индуцирует гиперэкспрессию BCL2, тем самым блокирует апоптоз опухолевых B-клеток, способствуя их выживанию [11, 14, 21]. Повышение концентрации цитокинов (IL-6, IL-10, фактора некроза опухоли-β) свидетельствуют о роли иммунной стимуляции в лимфоонкогенезе у ВИЧ-инфицированных пациентов [1]. Полиморфизм хемокиновых путей также влияет на риск развития ВИЧ-ассоциированных лимфом. Например, при ВИЧ-инфекции 3՛A-вариант фактора 1 стромальных производных клеток увеличивается вдвое, что в 4 раза повышает риск НХЛ у гетерозиготах и гомозиготах соответственно [19, 25].
Клиническая картина. Клинические проявления лимфом у ВИЧ-инфицированных разнообразны. Опухолевые клетки НХЛ могут определяться в организме повсеместно, чаще всего в лимфатических узлах, а также в других органах, включая печень, селезенку, легкие, сердце, головной мозг, ЖКТ и реже кости. Но основным симптом является увеличение лимфатических узлов. Лимфатические узлы при лимфомах представляют собой плотные безболезненные образования, неподвижные или малоподвижные. Главным диагностическим методом исследованием является биопсия лимфатических узлов, с последующей гистологической и иммуногистохимической оценкой.
Одним из признаков ВИЧ-инфекции яв-ляяется персистирующая лимфаденопатия. Пациента с персистирующей лимфаденопатией необходимо направить на биопсию лимфатических узлов основываясь на использовании клинического протокола для Европейского региона ВОЗ 2006 г. «Тактика ведения пациентов с оппортунистическими инфекциями и общими симптомами ВИЧ/СПИДа» если у него:
-
- обнаруживается несимметричное увеличение лимфоузлов;
-
- выраженное увеличение лимфоузлов (по крайней мере, один лимфоузел более 3 см в диаметре);
-
- лимфоузлы остаются увеличенными в течение всего периода наблюдения;
-
- увеличение прикорневых лимфоузлов при рентгенологическом исследовании;
-
- потеря веса, лихорадка и ночная потливость в течение более 1 недели.
Следовательно, при любых изменениях в состоянии пациента, длительной лихорадке или других подозрительных симптомах необходимо провести биопсию лимфатических узлов лучше из двух разных анатомических областей. Пункционная биопсия узлов для диагностики лимфом у ВИЧ-инфицированных и неинфицированных пациентов мало информативна [1, 3, 4].
К моменту постановки диагноза у многих больных имеется поздняя стадия лимфомы (IIIIV стадия по Анн-Арборской классификации). В большинстве случаев (60-80%) обнаруживаются B-симптомы – лихорадка, ночные поты и потеря веса. Нередко имеются астенический синдром, выраженное недомогание и быстрое ухудшение физического состояния. Диагностируются экст-ранодальные очаги, нередко очень большие. По данным Hoffmann (2003 г) из наблюдаемых им 203 больных хотя бы один экстранодальный очаг был обнаружен у 81% пациентов. Очаги возможны в любых органах – сердце, яичках, молочных железах, мочевом пузыре, глазнице, мышцах, костях. Однако чаще всего они обнаруживаются в ЖКТ, печени и костном мозге. Возможно также вторичное поражение ЦНС. При наличии экстранодальных очагов симптоматика зависит от их локализации. Возможны боль в животе при гепатоспленомегалии, кровотечения или симптомы кишечной непроходимости при поражении кишечника, боль в костях при опухолевой инфильтрации скелета и головная боль при поражении головного мозга (Hoffmann, 2011 г).
Для определения стадии заболевания и тактики дальнейшего лечения необходимо проведение базовых диагностических исследований:
-
- КТ головного мозга, КТ шеи и грудной полости, КТ, УЗИ брюшной полости;
-
- биопсия ЛУ с гистологическим и иммуногистохимическим исследованием;
-
- костномозговая пункция, трепанобиопсия;
-
- общий анализ крови с подсчетом лейкофор-мулы, тромбоцитов, ретикулоцитов, ЛДГ, креатинин, АЛТ, АСТ, ГГТ, билирубин;
-
- иммунофенотипирование клеток периферической крови;
-
- ЭКГ, ЭХО (необходимость применения в лечении антрациклинов!);
-
- функция легких (применение блеомицина);
-
- ß 2 -микроглобулин;
-
- антитела к: Toxo-, Lues-, CMV, гепатиты В и C, ТБ;
-
- вирусная нагрузка;
-
- иммунный статус.
При НХЛ III-IV стадии по Анн-Арборской классификации, когда затронуты ЛОР-органы, перед началом химиотерапии следует провести люмбальную пункцию, МРТ головного мозга для исключения поражения ЦНС [1, 3, 4, 24].
Прогноз при ВИЧ-ассоциированных лимфомах. Применяемый в обычной практике гематологами и онкологами международный прогностический индекс (МПИ) является стандартным прогностическим критерием у ВИЧ-отрицательных пациентов с лимфомами. Однако в ряде исследований было показано, что прогнозировать с его помощью выживаемость общую и без прогрессирования у больных с ВИЧ-ассоци-ированными лимфомами не представляется возможным [15, 20]. Прогностическое значение у ВИЧ-инфицированных пациентов имеет количество CD4-положительных лимфоцитов. Доказано, что пациенты с уровнем CD4 <100 кле-ток/мкл подвержены повышенному риску развития серьезных оппортунистических инфекций и летальному исходу. У больных с тяжелым иммунодефицитом чаще диагностируют лим-фомы ЦНС и диффузную B-крупноклеточную лимфому ДВККЛ. При несвоевременной терапии они имеют неблагоприятный прогноз [1, 8, 13, 22].
Лечение при ВИЧ-ассоциированных НХЛ. В связи с очень быстрой генерализацией лимфом даже при «ранней» диагностике опухоль редко бывает ограниченной одной анатомической областью. Реальная стадия часто недооценивается, поэтому при каждой ВИЧ-обусловленной лимфоме желательно по возможности быстрее начать полихимиотерапию, так как опухоль быстро прогрессирует. В связи с
тем, что в большинстве случаев диагноз лимфомы у ВИЧ-инфицированных пациентов ставится уже когда затронуты больше 2 анатомических
областей, изолированное хирургическое лечение и лучевая терапия недостаточны.
Таблица 2. Результаты терапии ВИЧ-ассоциированных лимфом по данным клинических исследований
|
Вид исследования (количество пациентов, n) |
Вариант лимфомы |
Схема терапии |
Количество CD4 кле-ток/мм 3 |
Результаты терапии |
||||
|
полная ремиссия, % |
выживаемость без прогрессирования |
общая выживаемость |
||||||
|
Kaplan L.D., 1997 [29] |
Многоцентровое рандомизированное, фаза ІІІ (n=192) |
Агрессивная НХЛ |
m-BACOD + GM-CSF |
107 |
52 |
38 нед |
31 нед |
|
|
m-BACOD low + GM-CSF |
100 |
41 |
56 нед |
35 нед |
||||
|
Ratner l., 2001 [44] |
фаза ІІ (n=65) |
ДВККЛ, иммуноб-ластная НХЛ |
m-CHOP |
138 |
30 |
медиана ответа на терапию – 65 нед |
||
|
CHOP |
122 |
48 |
медиана ответа на терапию не достигнута |
|||||
|
Sparano J. A., 2004 [48] |
фаза ІІ (n=98) |
ДВККЛ, ЛБ |
didanosine |
90 |
47 |
1-годичная – 42%, 2-летняя - 35% |
6,8 мес |
|
|
CDE |
227 |
44 |
1-годичная – 40%, 2-летняя - 38% |
13,7 мес |
||||
|
Mounier N., 2006 [37] |
фаза ІІІ (n=485) |
ДВККЛ |
HIV (score 0) |
AC VBP |
239 |
61 |
5-летняя -35,54% |
5-летняя -41,61% |
|
CH OP |
239 |
51 |
5-летняя -30,49% |
5-летняя -38,57% |
||||
|
HIV (score 1) |
CH OP |
72 |
49 |
5-летняя -16,35% |
5-летняя -18,37% |
|||
|
CH OP low |
72 |
32 |
5-летняя -10,29% |
5-летняя -15,34% |
||||
|
HIV (score 2– 3) |
CH OP low |
21 |
20 |
5-летняя -0,16% |
5-летняя -2,20% |
|||
|
VS |
21 |
5 |
5-летняя - 0% |
5-летняя -0,8% |
||||
|
Little R. F., 2003 [36]. |
фаза ІІ (n=39) |
ДВККЛ, ЛБ, ПЛЭ |
EPOCH |
198 |
74 |
4,4-летняя — 73% |
4,4-летняя — 60% |
|
|
Kaplan L.D., 2005 [28] |
фаза ІІІ (n=150) |
ДВККЛ, ЛБ |
R-CHOP |
130 |
49,5 |
45 нед |
139 нед |
|
|
CHOP |
147 |
41,2 |
38 нед |
110 нед |
||||
|
Boue F., 2006 [7] |
фаза ІІ(n=61) |
ДВККЛ, ЛБ, имму-нобластная, плазмобластная |
R-CHOP |
172 |
35 |
2-летняя -69% |
2-летняя -75% |
|
|
Spina M., 2005 [49] |
фаза ІІ (n=74) |
ДВККЛ, ЛБ, анапластическая крупноклеточная лимфома, иммуноб-ластная |
CDE-R |
161 |
70 |
2-летняя — 59% |
2-летняя — 64% |
|
|
CDE |
227 |
45 |
2-летняя — 38% |
2-летняя — 45% |
||||
|
Sparano J.A., 2010 [51] |
фаза ІІ (n=101) |
ДВККЛ, ЛБ |
R-DAEPOC H |
181 |
73 |
1-годичная -78%; 2-летняя - 66% |
2-летняя -70% |
|
|
DAEPOC H→R |
194 |
55 |
1-годичная -66%; 2-летняя - 63% |
2-летняя -67% |
||||
|
Dunleavy K., 2010 [21] |
фаза ІІ (n=33) |
ДВККЛ |
SC-EPOCH-RR |
208 |
5-летняя -84% |
5-летняя -68% |
||
До появления ВААРТ терапия ВИЧ-ассоциированных лимфом была малоэффективная. Медиана выживаемости пациентов коррелировала с содержанием CD4 клеток и составляла в среднем в среднем 5-6 месяцев. Плохие результаты терапии были связаны с развитием как гематологических, так и негематологических осложнений на фоне химиотерапии. В этот период применялись более низкие дозы химиопрепаратов у больных с ВИЧ-ассоциированными лимфомами, которые не давали хороших результатов лечения [1, 3, 10]. Коренным образом ситуация изменилась при появление ВААРТ. Применение противовирусных препаратов позволило увеличить концентрацию CD4 клеток, снизить риск инфекционных осложнений и применять полихимиотерапию в стандартных дозах.
В начале 2000 г. были получены противоречивые результаты влияния ВААРТ на прогноз ВИЧ-обусловленной НХЛ. По крайней мере, четыре больших когортных исследования (Conti, 2000; Levine, 2000; Matthews, 2000; Chow, 2001) показали неутешительные результаты. Многие исследователи были обеспокоены тем, что неконтролируемая репликация ВИЧ во время химиотерапии приводит к ухудшению иммунной функции, а продолжение ВААРТ в процессе химиотерапии и восстановление имму-нитета могут предупредить развитие инфекционных осложнений, особенно у больных с малым количеством CD4. Возрастали число и тяжесть побочных действий, обусловленные взаимодействием химиотерапевтических и антиретровирусных первого поколения (зидовудин, ставудин, дида-нозин). Основываясь на этом, ряд авторов рекомендовали приостановить ВААРТ во время химиотерапии. W.H. Wilson и соавторы, B.N. Phenix в своих работах показали, например, что некоторые противовирусные препараты первого поколения (зидовудин и т.д.) тормозят апоптоз лимфоидных клеток и способствуют повышению риска развития новых мутаций ВИЧ [17, 18].
Антиретровирусные препараты нового поколения (тенофовир, эмтрицитабин, ралте-гравир и др.) хорошо переносятся, не кумулируют побочные эффекты цитостатиков и не влияют на апоптоз лимфоцитов. Кроме того, в условиях острых оппортунистических инфекций 4недельная задержка начала ВААРТ связана с существенным повышением риска развития СПИДа или смерти [24]. У пациентов с ВИЧ-ассоциированной лимфомой обычно отмечают сопутствующие оппортунистические инфекции, и средняя 7-недельная задержка ВААРТ во время химиотерапии может иметь негативные последствия в целом. Следует помнить, что пациентам с ВИЧ-ассоциированной лимфомой необходимо проведение 4-6 циклов химиотерапии, что может увеличить продолжительность перерыва ВААРТ и негативно отразиться на выживаемости пациентов в целом. M.H. Bateganya и W.O. Mwanda в результате своих исследований доказали явное преимущество выживаемости пациентов с ВИЧ-ассоциированной лимфомой при одновременном назначении ВААРТ и химиотерапии [6, 16].
Клиническиий случай.
Пациент Ч., 24 лет обратился 8.10.2012 г. с жалобами на головную боль, головокружение, тошноту, ухудшение зрения, повышение температуры до 38,50С, появление припухлости в области правой челюсти, увеличение лимфатических узлов, сильную общую слабость. Два раза были приступы потери сознания с судорогами. Ухудшение состояния отмечал с июля 2012 г. – прогрессировала общая слабость, беспокоила субфебрильная лихорадка, увеличились все группы лимфатических узлов. Госпитализирован в инфекционное отделение диагнозом «Лихорадка неясного генеза». При осмотре выявлено увеличенных шейных, подмышечных, паховых лимфатических узлов размерами до 2х3 см, подчелюстные справа до 5х6 см, подвижные, безболезненные. Пальпировались печень +5см из-под края реберной дуги, селезёнка +2см. Общий анализ крови: Нв – 116 г/л, эритроциты-3,7х1012/л, лейкоциты 3,0х109/л, э-1, п-2, с-83, л-11, м13, тромбоциты 178х109/л. СОЭ 65 мм/час. ЛДГ-1232 Е/л. Обнаружены антитела к ВИЧ методом ИФА, который был подтвержден иммунобло-том. В иммунограмме количество СД4-37 в клеток/мкл, вирусная нагрузка составила 225000 копий РНК ВИЧ/мл. Антител к токсоплазмозу, вирусу Эпштейна-Бара обнаружены не были. УЗИ органов брюшной полости: печень выступает из под края реберной дуги на 3 см, площадь селезёнки 61,4 см2 в брюшной полости и забрюшином пространстве лоцируются лимфатические узлы размерами от 2 до 4 см. КТ грудной клетки: увеличение лимфатических узлов в корневых зонах обеих легких до 3 см. Осмотрен окулистом: поставлен диагноз: нейроретиноваскулит. Для исключения лимфопролиферативного процесса гематологом были произведены стернальная пункция, трепанобиопсия, биопсия лимфоузла. Патология обнаружена по результатам гистологического исследования лимфатического узла диффузная инфильтрация мономорфными клетками с везикулярной структурой хроматина, округлой, овальной формы, с центрально расположенным ядром, со светлой цитоплазмой) – диффузная крупноклеточной В-клеточной неходжкинской лимфома, подвержденная иммуногистохимическим исследованием (Cytokeratinpan-cyt (-); HLA-DR (+); CD7 (+ по периферии); CD15 (+, как-во); CD20 (+, более 90%); CD23 (+как-во); CD30 (+); CD 79α (+). Проведена спинномозговая пункция: белок 98 мг/дл, глюкоза 68 мг/дл, лейкоциты 11 клеток/мм3 (лимфоциты). МРТ головного мозга: обнаружены опухолевые очаги поражения в срединных структурах (рис. 3 средневзвешенное изображение, горизонтальный срез через височные доли. Видны очаги пониженной интенсивности сигнала (маленькие стрелки), окруженные кольцом повышенной интенсивности сигнала (большие стрелки))
Поставлен диагноз ВИЧ-инфекция IVБ в фазе прогрессирования. Диффузная В-клеточная крупноклеточная лимфома IVст, с поражением ЦНС. С 17.10.2012 был назначена ВААРТ (калетра, видекс, никавир). Переведен для дальнейшего лечения в гематологическое отделение. Проведено 6 курсов ПХТ по схеме R-CHOP-21, с интратекальным ведением метотрексата 12,5мг/м2, в сочетании с цитарабином 30 мг/м2 и преднизолон мг/м2. После проведения второго курса отмечено повышение вирусной нагрузки до 1,5 раз от первоначального уровня, лейкопения IVст, агранулоцитоз. Применен неула-стим в дозе 0,6 п/к №1. Начало следующего курса было отложено на 10 дней.
Последующие курсы проводились под прикрытием гранулоцитарных колониестимулирующих факторов, вводился через 24 часа после каждого цикла. Состояние значительно улучшилось к 5 курсу: лимфатические узлы значительно уменьшились в размерах, нормализовались размеры печени и селезенки, санировалась спинномозговая жидкость, МРТ-признаков опухолевого поражения головного мозга не обнаружено).
Выводы: кличество ВИЧ-инфици рованных пациентов в нашей стране с каждым годом растёт. ВИЧ/СПИД перестала быть только инфекционной болезнью. С этой проблемой сталкиваются врачи различных специальностей, в том числе и онкогематологи. Плохие результаты лечения лимфом, у данной группы пациентов, связаны со спидофобией, поздней диагностикой, отказом от ВААРТ, несоблюдением протоколов ПХТ, наличием сопутствующих болезней. Нами показана возможность лечения лимфомы на фоне ВИЧ-инфекции, так как это возможна у неинфицированных пациентов. Соблюдение протоколов и быстрое назначение ВААРТ может продлить жизнь пациентам и улучшить качество их жизни.
Список литературы Особенности диагностики и лечения ВИЧ-ассоциированных неходжкинских лимфом
- Давыдкин, И.Л. Изменения костного мозга при ВИЧ-инфекции/И.Л. Давыдкин, Р.Л. Хайретдинов, Е.В. Вехова и др./Сб. материалов конференции посвященной 115-летию со дня рождения Е.М. Тарева. V национальный конгресс терапевтов. -М., 2010. С. 74-75.
- Давыдкин, И.Л. Особенности развития неходжкинских лимфом на фоне ВИЧ-инфекции/И.Л. Давыдкин, Р.К. Хайретдинов, Т.Ю. Степанова и др.//Вестник гематологии. 2012. Том VIII. № 1. С. 38-39.
- Хоффман, К. Лечение ВИЧ-инфекции/К. Хоффман, Ю.К. Рокштро. -М.: Р.Валент, 2012. С. 440-457.
- Пивник, В.Г. Дифференциальная диагностика лимфаденопатий при ВИЧ/СПИД/В.Г. Пивник, Ю.Г. Коровушкин и др.//Терапевтический архив. 2006. № 4. С. 28-32.
- Ambinder, R.F. (2001) Epstein-Barr virus associated lymphoproliferations in the AIDS setting//Eur. J. Cancer. 2001. 37(10). P.1209-1216.
- Bateganya, M.H. Predictors of Survival After a Diagnosis of Non-Hodgkin Lymphoma in a Resource-Limited Setting: A Retrospective Study on the Impact of HIV Infection and Its Treatment/M.H. Bateganya, J. Stanaway, P.E. Brentlinger et al.//J. of Acquired Immune Deficiency Syndromes. 2011. 56(4). P. 312-319.
- Boulanger, E. Prognostic factors and outcome of human herpesvirus 8-associated primary effusion lymphoma in patients with AIDS/E. Boulanger, L. Gerard, J. Gabarre et al.//J. Clin. Oncol. 2005. 23(19).P. 4372-4380.
- Chadburn, A. Immunophenotypic analysis of AIDS-related diffuse large B-cell lymphoma and clinical implications in patients from AIDS Malignancies Consortium clinical trials 010 and 034/A. Chadburn, A. Chiu, J.Y. Lee et al.//J. Clin. Oncol. 2009. 27(30). P. 5039-5048.
- Gopal, S. Association of early HIV viremia with mortality after HIV-associated lymphoma/S. Gopal, M.R. Patel, E.L. Yanik et.al.//AIDS. 2013. Sep 24; 27(15). P. 2365-2373.
- Davidkin, I. Highly action antretro viral therapy (HAART) improved efficiency of chemotherapy in patients with HIV-associated nonhodgkins lymphomas/I. Davidkin, R. Khairetdinov, O. Danilova et al.//18 Congress of the EHA. Stockholm. 2013. Abstract book. В 1626. 641p.
- Davis, R.E. Constitutive nuclear factor kappaB activity is required for survival of activated B cell-like diffuse large B cell lymphoma cells/R.E. Davis, K.D. Brown, U. Siebenlist et al.//J. Exp. Med. 2001. 194(12). P.1861-1874.
- Davis, R.E. Chronic active B-cell-receptor signalling in diffuse large B-cell lymphoma/R.E. Davis, V.N. Ngo, G. Lenz et al.//Nature. 2010. 463(7277). P. 88-92.
- Dunleavy, K. Role of molecular subtype in predicting outcome of AIDS-related diffuse large B-cell lymphoma/K. Dunleavy, W.H. Wilson//J. Clin. Oncol. 2010. 8(16). P. e260-e262.
- Gaidano, G. The molecular basis of acquired immunodeficiency syndrome-related lymphomagenesis/G. Gaidano, D. Capello, A. Carbone//Semin. Oncol. 2000. 27(4).P. 431-441.
- Kaplan, L.D. Rituximab does not improve clinical outcome in a randomized phase 3 trial of CHOP with or without rituximab in patients with HIV-associated non-Hodgkin lymphoma: AIDS-Malignancies Consortium Trial 010/L.D. Kaplan, J.Y. Lee, R.F. Ambinder et al.// Blood. 2005. 106(5). P. 1538-1543.
- Mwanda, W.O. Dose-Modified Oral Chemotherapy in the Treatment of AIDS-Related Non-Hodgkin’s Lymphoma in East Africa/W.O. Mwanda, J. Orem, P. Fu et al.//J. Clin. Oncol. 2009. 27 (21). P. 3480-3488.
- Phenix, B.N. Modulation of Apoptosis by HIV protease inhibitors/B.N. Phenix, C. Cooper, C. Owen et al.//Apoptosis. 2002. 7(4). P. 295-312.
- Phenix, B.N. Antiapoptotic mechanism of HIV protease inhibitors: preventing mitochondrial transmem-brane potential loss/B.N. Phenix, J.J. Lum, Z. Nie et al./Blood. 2001. 98(4). P. 1078-1085.
- Rabkin, C.S. Chemokine and chemokine receptor gene variants and risk of non-Hodgkin’s lymphoma in human immunodeficiency virus-1-infected individuals/C.S. Rabkin, Q. Yang, J.J. Goedert et al./Blood. 1999. 93. P. 1838.
- Ribera, J.M. Safety and efficacy of cyclophosphamide, adriamycin, vincristine, prednisone and rituximab in patients with human immunodeficiency virus-associated diffuse large B-cell lymphoma: results of a phase II trial/J.M. Ribera, A. Oriol, M. Morgades et al./Br. J. Haematol. 2008. 140(4). P. 411-419.
- Rothe, M. TRAF2-mediated activation of NF-kappa B by TNF receptor 2 and CD40/M. Rothe, V. Sarma, V.M. Dixit et al.//Science. 1995. 269(5229). P. 1424-1427.
- Sparano, J.A. Rituximab plus concurrent infusional EPOCH chemotherapy is highly effective in HIV-associated B-cell non-Hodgkin lymphoma/J.A. Sparano, J.Y. Lee, L.D. Kaplan et al./Blood. 2010. 115(15).P. 3008-3016.
- Swerdlow, S.H. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues/S.H. Swerdlow, E. Campo, N.L. Harris et al./Lyon, France: IARC. 2008. 324 p.
- Zolopa, A.R. Early Antiretroviral Therapy Reduces AIDS Progression/A.R. Zolopa, J. Andersen, L. Komarow et al.//Death in Individuals with Acute Opportunistic Infections: A Multicenter Randomized Strategy Trial. PLoS. One. 2009. 4(5). P. e5575.
- DeVita, V.T. Principles & Practice of Oncology/V.T. DeVita, T.S. Lawrence, S.A. Rosenberg//Cancer. 2012. 9. P. 1021-1027.