Особенности генетической идентификации генетически модифицированных источников пищи
Автор: Мухаммадиева Г.Ф., Каримов Д.О., Долгих О.В., Кривцов А.В., Мазунина А.А.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Практика оценки риска в гигиенических и эпидемиологических исследованиях
Статья в выпуске: 4 (24), 2018 года.
Бесплатный доступ
Целью исследования явился генетический анализ качества продуктов питания российского происхождения на присутствие генетически модифицированных компонентов, преимущественно сои, с установлением оптимального перечня генетических модификаторов колбасной продукции и соевых продуктов для задач мониторирования незаявленных генно-модифицированных организмов (ГМО) и обеспечения биологической безопасности пищи. Методом полимеразной цепной реакции в режиме реального времени выполнен анализ ряда пищевых продуктов (колбасы, соевые продукты) на содержание комплекса генетически модифицированных организмов. Проведена идентификация генов ГМО: промоторов (p35SCaMV, P-SSuAra, Ubi1, ract1, hsp70, промотора TA29 табака), терминаторов (nos3, T-E9, T-g7, T-OCS), репортерных генов (nptll, qHptFP308, bar, pat_10-P), биопестицидов Bacillus Thuringensis (Bt) или Cry-токсинов (Cry1Ab/Ac), репортерного гена β-глюкуронидазы (GUS-ген). Анализ ряда образцов колбас позволил идентифицировать гены ГМО - Cry1Ab/Ac, P-FMV, P-nos, bar, gus_9-P, Т-nos3, nptii, P-TA29, T-E9, T-g7, T-OCS...
Генетически модифицированные организмы, гены, промоторы, терминаторы, безопасность пищевых продуктов, полимеразная цепная реакция, днк
Короткий адрес: https://sciup.org/142215921
IDR: 142215921 | УДК: 338.45: | DOI: 10.21668/health.risk/2018.4.08
Текст научной статьи Особенности генетической идентификации генетически модифицированных источников пищи
технологий генной инженерии (гамбургеры, салаты, картофель-фри и др.) [1–3].
В России посевов трансгенных культур для коммерческого применения не существует. Имеют место лишь закрытые экспериментальные поля при различных исследовательских центрах. В Российской Федерации с целью испытаний на биобезопасность осуществляются посадки генетически модифицированных культур: картофеля (Москва и Московская область, Тамбов, Краснодар, Дальний Восток), сои (Краснодарский край), сахарной свеклы (Московская область, Тамбов, Краснодарский край, Дальний Восток), кукурузы (Московская область, Тамбов, Краснодарский край, Дальний Вос-
Мухаммадиева Гузель Фанисовна – кандидат биологических наук, заведующий лабораторией молекулярногенетических исследований отдела токсикологии и генетики (e-mail: ; тел.: 8 (347) 255-19-48; ORCID: .
Каримов Денис Олегович – кандидат медицинских наук, заведующий отделом токсикологии и генетики (e-mail: ; тел.: 8 (347) 255-19-48; ORCID: .
Долгих Олег Владимирович – доктор медицинских наук, профессор, заведующий отделом иммунобиологических методов диагностики (e-mail: ; тел.: 8 (342) 236-39-30; ORCID: .
Кривцов Александр Владимирович – кандидат медицинских наук, заведующий лабораторией иммуногенетики (e-mail: ; тел.: 8 (342) 236-39-30; ORCID: .
Мазунина Алена Александровна – младший научный сотрудник отдела иммунобиологических методов диагностики (e-mail: ; тел.: 8 (342) 236-39-30; ORCID: .
ток). С целью сортоиспытания выращивают трансгенный картофель (в 18 регионах), с целью переработки и употребления – сахарную свеклу и сою (Московская область и другие территории). В связи с отсутствием в России моратория на ввоз из-за рубежа трансгенной пищевой продукции и значительным увеличением ее производства в мире, она все в больших количествах поступает на российский продовольственный рынок [4, 5].
Система контроля за генетически модифицированными организмами (ГМО), применяемая в России, основана на выявлении регуляторных последовательностей (промотора 35S и терминатора NOS). Однако развитие генной инженерии привело к появлению ГМО второго поколения, которые не содержат данных регуляторных последовательностей. Подобные культуры потенциально могут присутствовать на российском продовольственном рынке и оставаться неидентифицированными [6, 7].
Актуальным для обеспечения биологической безопасности пищевых продуктов для населения является идентификация не заявленных генетически модифицированных источников пищи, а также комбинаций ГМО. Одной из важнейших задач в рамках решения проблемы обеспечения качества и безопасности продуктов питания является разработка оптимальной диагностической комбинации генетических маркеров (тест-систем) для каждого вида пищевой продукции. Эффективным методом анализа нуклеиновых кислот является полимеразная цепная реакция в реальном времени [8–12].
Цель работы – генетический анализ качества продуктов питания российского происхождения на присутствие генетически модифицированных компонентов (преимущественно сои) с установлением оптимального перечня генетических модификаторов колбасных изделий и соевых продуктов для задач мониторирования незаявленных ГМО и обеспечения биологической безопасности пищи.
Материалы и методы . Всего было исследовано 47 образцов пищевых продуктов, реализуемых на территории Республики Башкортостан и Пермского края, на присутствие генов как трансгенной, так и нетрансгенной сои. В структуре проанализированных проб преобладали колбасные изделия и мясные деликатесы (45 проб): колбасы (вареные, полукопченые, варено-копченые), копчености (ветчина, карбонат), сосиски, паштеты. Также исследованы соевые продукты (две пробы): тофу твердый, молоко соевое.
Количественное определение 35S промотора вируса мозаики цветной капусты в ДНК генетически модифицированной сои включало: отбор и предпод-готовку проб; экстракцию ДНК из образцов продуктов питания; амплификацию фрагментов ДНК и гибридизационно-флуоресцентную детекцию, которая производится непосредственно в ходе полимеразной цепной реакции (ПЦР) в реальном времени c использованием зондов TaqMan.
Помимо количественного определения маркера 35S промотора вируса мозаики цветной капусты проводилась качественная ПЦР-реалтайм для скрининга других маркеров генетической модификации [13–20], которая включала в себя1:
-
♦ выявление промоторов, используемых при трансфекции растений: p35SCaMV, Act1, Ubi1, hsp70, промотора TA29 табака – как правило, эти промоторы являются универсальными при использовании создателями ГМО;
-
♦ выявление терминаторов: nos3, T-E9, T-g7, T-OCS;
-
♦ выявление репортерных генов: nptll, hpt, bar, dhfr, epsps, cp4;
-
♦ выявление MARs.
Экстракцию ДНК из образцов осуществляли с использованием комплекта реагентов «ДНК-сорб-С» (ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора, г. Москва), предназначенного для выделения ДНК из клинического материала, продуктов питания и кормов для животных.
Амплификацию проводили, используя набор реагентов «АмплиКвант ГМ соя-FL», предназначенный для обнаружения следующих фрагментов ДНК: последовательность промотора 35S вируса мозаики цветной капусты (P-35S CamV ) и эндогенный контроль (ЭК) сои, то есть ген, специфичный как для трансгенной сои, так и для нетрансгенной. Такой подход позволил определять присутствие ДНК сои в исследуемом образце. Полимеразную цепную реакцию проводили на приборе Rotor-Gene Q (Qiagen, Германия) и на приборе CFX96 Real Time System с детекцией продуктов реакции в режиме реального времени. Для флуоресцентной детекции продуктов ПЦР были использованы каналы FAM/Green – рекомбинантная ДНК промотора 35S и JOE/Yellow – ген сои (эндогенного контроля).
Согласно методике определения ГМО параллельно осуществлялась постановка контролей: положительного (заведомо содержащая ГМ-сырье проба, линия сои MON89788) и отрицательного (заведомо не содержащая ГМ-сырье проба).
Осуществлялся пострегистрационный мониторинг на содержание ГМ-сырья, который включал в себя экспертизу документов на генетически модифицированные источники (ГМИ) и готовые продукты и контроль маркировки ГМИ-продукции.
Экспертиза документации основывалась на анализе перечня ГМИ, разрешенного к применению в РФ, и перечне ГМИ, выпускаемых в мире в промышленных объемах (этот перечень включает
81 ГМИ – соя, кукуруза, рапс, картофель, кабачки, папайя, томаты, рис, сахарная свекла, мускатная дыня, лен и др.). Контроль маркировки обеспечивался для всей пищевой продукции, полученной из ГМИ и содержащей в своем составе более 0,9 % компонентов из ГМИ.
Результаты и их обсуждение. Проведен лабораторный контроль пищевой продукции на качественное и количественное определение содержания ГМИ в соответствии с ГОСТ и МУК МУК2.
При исследовании продуктов питания на выявление генетически модифицированных источников наличие 35S промотора вируса мозаики цветной капусты во всех образцах обнаружено не было. Из 47 проанализированных проб продуктов в 38 установлено присутствие нетрансгенной сои. При этом в пяти образцах пищевой продукции в их составе наличие сои не было указано.
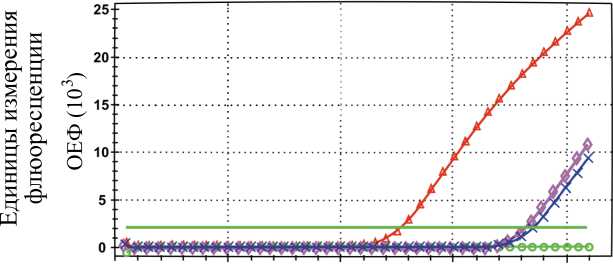
Скрининговые качественные исследования 16 образцов пищевой продукции (колбаса, салями, сырокопченая, сервелат) показали, что ряд образцов содержали генно-модифицированные ингредиенты (рисунок).
Проведенный нами анализ 16 образцов пищевой продукции, преимущественно колбасных изделий (таблица), по идентификации генов ГМО: промоторов (p35SCaMV, P-SSuAra, Ubi1, ract1, hsp70, TA29 табака), терминаторов (nos3, T-E9, T-g7,
T-OCS), репортерных генов (nptll, qHptFP308, bar, pat_10-P), генов биопестицидов Bacillus Thuringensis (Bt) или Cry-токсинов (Cry1Ab/Ac), репортерного гена β-глюкуронидазы (GUS-ген), выявил их отсутствие в семи анализируемых образцах пищевой продукции на фоне положительного и отрицательного контролей. Однако девять образцов колбас содержа-
Амплификация
О 10 20 30 40
Циклы
Считывание по каналу FAM
Крас А полож. контроль Син х образец 12
Зел о отрицал, контроль Роз О образец 16
Рис. Полимеразная цепная реакция на приборе CFX96 Real Time System с детекцией продуктов реакции в режиме реального времени. Кривые амплификации двух образцов пищевой продукции (колбасы сырокопченая «Банкетная», варено-копченая «Мускатная») с идентификацией гена P-FMV
Результаты исследования проб пищевой продукции на содержание ГМО
Выводы. Проведенные исследования не выявили наличие генетически модифицированной сои по маркеру 35S промотора вируса мозаики цветной капусты в пищевых продуктах. Одновременно в пяти образцах колбасных изделий выявлено нарушение заявленного состава продукта. Обнаруженный в пробах соевый белок дает основание говорить о факте фальсификации пищевой продукции.
Пострегистрационный мониторинг на содержание ГМ-сырья продуктов питания выявил наличие нерегламентированных нормативной документацией маркеров ГМО в 56 % анализируемых образцов колбасной продукции. Анализ образцов колбасной продукции позволил идентифицировать кандидатные гены генно-модифицированных организмов: промо- тора P-FMV, терминаторов (nos3, T-g7, T-OCS), эндотоксина Cry1Ab/Ac, репортера bar.
Генетический анализ качества продуктов питания российского происхождения на присутствие генетически модифицированных компонентов позволил рекомендовать к использованию службой в качестве маркерных генов контроля и обеспечения безопасности пищевых продуктов по критерию содержания ГМО следующие гены ГМ-сырья в пищевой продукции, свидетельствующие о произведенных генетических модификациях: Cry1Ab/Ac, P-FMV, P-nos, bar, gus_9-P, Т-nos3, nptii, P-TA29, T-E9, T-g7, T-OCS.
Финансирование. Исследование не имело спонсорской поддержки.
Список литературы Особенности генетической идентификации генетически модифицированных источников пищи
- Bawa A.S., Anilakumar K.R. Genetically modified foods: safety, risks and public concerns-a review//J. Food Sci. Technol. -2013. -Vol. 50, № 6. -P. 1035-1046 DOI: 10.1007/s13197-012-0899-1
- Development and application of a general Plasmid reference material for GMO screening/Y. Wu, J. Li, Y. Wang, X. Li, Y. Li, L. Zhu, J. Li, G. Wu//Plasmid. -2016. -Vol. 87-88. -P. 28-36 DOI: 10.1016/j.plasmid.2016.08.001
- James C. Global Status of Commercialized Biotech/GM Crops: 2014//ISAAA Brief. -ISAAA: Ithaca, NY, 2014. -№ 49. -P. 10-15.
- Донник И.М., Воронин Б.А. Правовое регулирование генно-инженерной деятельности в Российской Федерации//Аграрный вестник Урала. -2017. -Т. 156, № 2. -С. 4.
- Нормативно-правовые аспекты регулирования генетически модифицированных продуктов на территории Таможенного союза/А.А. Муратов, Н.В. Московенко, С.Л. Тихонов, Н.В. Тихонова, А.В. Курдюмов//Агропродовольственная политика России. -2017. -Т. 63, № 3. -С. 78-83.
- Тутельян В.А. Обеспечение безопасности генно-инженерно-модифицированных организмов для производства пищевых продуктов//Вестник Российской академии наук. -2017. -Т. 87, № 4. -С. 342-347 DOI: 10.7868/S0869587317040090
- Тышко Н.В. Контроль за генно-инженерно-модифицированными организмами растительного происхождения в пищевой продукции: научное обоснование и методическое обеспечение//Вопросы питания. -2017. -Т. 86, № 5. -С. 29-33.
- Чернышева О.Н., Сорокина Е.Ю. Методы аналитического контроля пищевой продукции, произведенной из генно-инженерно-модифицированных растений//Вопросы питания. -2013. -Т. 82, № 3. -С. 53-60.
- Diagnostics of Early Changes in the Immune System Due to Low Concentration of N-Nitrosamines in the Blood/N.V. Zaitseva, T.S. Ulanova, O.V. Dolgikh, T.V. Nurislamova, O.A. Mal’tseva//Bull. Exp. Biol. Med. -2018. -Vol. 164, № 3. -P. 334-338 DOI: 10.1007/s10517-018-3984-2
- Gerdes L., Busch U., Pecoraro S. GMOfinder -a GMO screening database//Food Analytical Methods. -2012. -Vol. 5, № 6. -P. 1368-1376 DOI: 10.1007/s12161-012-9378-6
- GMOseek: a user friendly tool for optimized GMO testing/D. Morisset, P.K. Novak, D. Zupanič, K. Gruden, N. Lavrač, J. Žel//BMC Bioinformatics. -2014. -Vol. 15, № 1. -P. 258 DOI: 10.1186/1471-2105-15-258
- JRC GMO-Matrix: a web application to support Genetically Modified Organismsdetection strategies/A. Angers-Loustau, M. Petrillo, L. Bonfini, F. Gatto, S. Rosa, A. Patak, J. Kreysa//BMC Bioinformatics. -2014. -Vol. 15, № 1. -P. 417 DOI: 10.1186/s12859-014-0417-8
- Alasaad N., Alzubi H., Kader A.A. Data in support of the detection of genetically modified organisms (GMOs) in food and feed samples//Data Brief. -2016. -Vol. 7. -P. 243-252 DOI: 10.1016/j.dib.2016.02.035
- Debode F., Janssen E., Berben G. Development of 10 new screening PCR assays for GMO detection targeting promoters (pFMV, pNOS, pSSuAra, pTA29, pUbi, pRice actin) and terminators (t35S, tE9, tOCS, tg7)//Eur. Food Res. Technol. -2013. -Vol. 236, № 4. -P. 659-669 DOI: 10.1007/s00217-013-1921-1
- Detection by real-time PCR and pyrosequencing of the cry1Ab and cry1Ac genes introduced in genetically modified (GM) constructs/F. Debode, E. Janssen, C. Bragard, G. Berben//Food Addit Contam Part A Chem Anal Control Expo Risk Assess. -2017. -Vol. 34, № 8. -P. 1398-1409 DOI: 10.1080/19440049.2017.1317925
- Development of a qualitative, multiplex real-time PCR kit for screening of genetically modified organisms (GMOs)/H.H. Dörries, I. Remus, A. Grönewald, C. Grönewald, K. Berghof-Jäger//Anal. Bioanal. Chem. -2010. -Vol. 396, № 6. -P. 2043-2054 DOI: 10.1007/s00216-009-3149-2
- Gu K., Mao H., Yin Z. Production of marker-free transgenic Jatropha curcas expressing hybrid Bacillus thuringiensis δ-endotoxin Cry1Ab/1Ac for resistance to larvae of tortrix moth (Archips micaceanus)//Biotechnol. Biofuels. -2014. -Vol. 7. -P. 68 DOI: 10.1186/1754-6834-7-68
- Randhawa G.J., Singh M. Multiplex, construct-specific, and real-time PCR-based analytical methods for Bt rice with cry1Ac gene//J. AOAC Int. -2012. -Vol. 95, № 1. -P. 186-194.
- Shared midgut binding sites for Cry1A.105, Cry1Aa, Cry1Ab, Cry1Ac and Cry1Fa proteins from Bacillus thuringiensis in two important corn pests, Ostrinia nubilalis and Spodoptera frugiperda/C.S. Hernandez-Rodriguez, P. Hernandez-Martinez, J. Van Rie, B. Escriche, J. Ferre//PLoS One. -2013. -Vol. 8, № 7. -Р. e68164 DOI: 10.1371/journal.pone.0068164
- Validation of a newly developed hexaplex real-time PCR assay for screening for presence of GMOs in food, feed and seed/C. Bahrdt, A.B. Krech, A. Wurz, D. Wulff//Anal. Bioanal. Chem. -2010. -Vol. 396, № 6. -P. 2103-2112 DOI: 10.1007/s00216-009-3380-x


