От алмазов и золота до экологической роли нанообъектов
Автор: Румянцев Владислав Александрович, Крюков Леонид Николаевич
Журнал: Общество. Среда. Развитие (Terra Humana) @terra-humana
Рубрика: Глобальный экологический кризис: мифы и реальность
Статья в выпуске: 3 (36), 2015 года.
Бесплатный доступ
За последние годы на смену давно существующим аналитическим методам пришла автоматизированная аппаратура высокого разрешения, с помощью которой были зафиксированы ранее неизвестные эффекты и явления окружающего мира. Оказалось, что при добыче алмазов достаточно часто на их поверхности наблюдается наличие нанопленок золота, нередко однослойных, вплоть до моноатомных. Показано, что микроорганизмы и водоросли служат биокаталитическими центрами аккумуляции и кристаллизации золота и сопутствующих металлов. В «цветущих» водоёмах при выпадении кислых атмосферных осадков на клеточных оболочках цианобактерий образуются нанопленки металлов, экранирующие функции цианобактерий, далее наноструктуры металлов превращаются в гель, агрегируют и выпадают в осадок. Характерной чертой наночастиц является их способность к ингаляционному, трансдермальному, транснейральному и энтеральному проникновению в любые органы и ткани человека, включая центральную нервную систему. В статье показано, что нанообъекты могут быть не только экологически опасными веществами, но и выполнять функции барьера для токсичных соединений.
Агрегат, алмаз, гель, золото, коллоид, металл, наночастица, токсичность
Короткий адрес: https://sciup.org/140225660
IDR: 140225660 | УДК: 551.513
Текст научной статьи От алмазов и золота до экологической роли нанообъектов
Румянцев В.А., Крюков Л.Н. От алмазов и золота до экологической роли нанообъектов // Общество. Среда. Развитие. – 2015, № 3. – С. 170–174.
Общество. Среда. Развитие ¹ 3’2015
За последние 10–20 лет в области наук о Земле произошли качественные изменения. На смену давно существующих аналитических методов пришла автоматизированная аппаратура высокого разрешения, с помощью которой были зафиксированы ранее не известные эффекты и явления окружающего мира. В частности, это касается геологических коллоидных систем, где в золях наночастицы металлов (размер 1–100 нм) ведут себя хаотично, а гидрогели обладают признаками твердого тела. Оказалось, что при добыче алмазов достаточно часто на их поверхности наблюдается наличие нанопленок золота, нередко однослойных, вплоть до моноатомных. Эти драгоценные находки, как правило, находят среди водных силикатов и окаменевших древних микроорганизмов и сине- зелёных водорослей, так называемых цианобактерий. Более того, в современных цианобактериальных матах содержание золота достигает 18 г/т [6, с. 11].
В лабораторных экспериментах с некоторыми видами цианобактерий и живой биомассой, полученной культивированием Penicillium luteum и Penicillium chrysoge-num, эффективное осаждение золота на клеточных оболочках было убедительно доказано (рис. 1) [2, с. 83]. По-видимому, микроорганизмы и водоросли служат био-каталитическими центрами аккумуляции и кристаллизации золота и сопутствующих металлов. При этом на долю Au и Ag приходится 54% общей емкости биосорбентов, 18% принадлежит Fe, доля Pb и Cu суммарно составляет 18%, сорбция Co, Zn, Mn и Ni достигает ~10%.
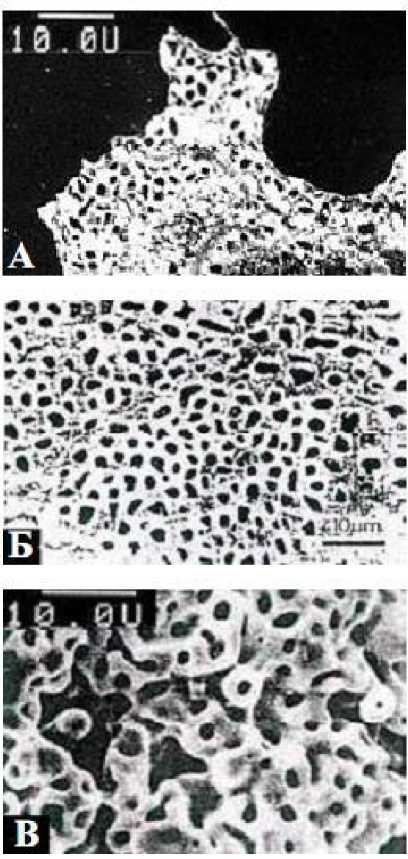
Рис. 1. Сетчатые наноструктуры золота;
А – полученные в эксперименте с микроми-цетами, Б – образованные фоссилизацией цианобактерий (месторождение Witwatersrand), В – коралловый агрегат (россыпи Ниманского района Хабаровского края)
Было констатировано, что процесс формирования сетчатых наноструктур металлов на клеточных оболочках перечисленных организмов завершается при температуре 15–20оС и водородном показателе (рН) ~5. Заметим, что в современных условиях при «цветении» водоемов и температуре 18–25оС цианобактерии концентрируются в слое воды не глубже 2–4 м и, вне сомнений, подвержены воздействию природных и техногенных кислот атмосферных осадков.
В дополнение к перечисленным обстоятельствам под влиянием климатических изменений в континентальных водоемах происходит увеличение концентрации естественных органических кислот. Среди последних превалируют продукты деструкции растительных остатков (гуминовые кислоты и фульвокислоты в концентрации 1–100 мг/л) и экзометаболиты водной биоты (полифенолы, полипептиды, аминокислоты и др.) [4, с. 574]. Когда органические кислоты вымываются с водосбора и попадают в водоем, нерастворимые высокомолекулярные соединения распадаются на более мелкие растворимые фрагменты (фульвокислоты), вода становится более прозрачной и подкисленной. При этом, к примеру, в организме рыб в низко минерализованных и подкисленных водах активируется аккумуляция большинства металлов [3, с. 222]. Связующим звеном в пищевой цепочке между рыбами (вторичные консументы) и водорослями (первичные потребители) являются планктонные беспозвоночные – рачки. Было показано, что наночастицы диоксида титана со средним размером частиц 5 нм и концентрацией в дисперсионной среде 1 мг/л быстро аккумулируются в культурах клеток водорослей Chlorella vulgaris и рачков Daphnia magna [5, с. 131]. Коэффициент накопления этих наночастиц клетками водорослей в два раза превышает коэффициент накопления наночастиц рачками, что соответствует первичному образованию наноструктур металлов на внешней оболочке клеток водорослей.
При интенсивном размножении водорослей происходит «цветение» водоемов. «Цветение» или изменение окраски воды обусловлено наличием в протоплазме клеток водорослей пигментов – зеленого хлорофилла, желто-оранжевых каротиноидов, синего фикоцианина и красного фикоэритрина. В зависимости от освещенности, температуры и содержания солей в воде меняются количественные соотношения красящих пигментов и, как следствие, природная вода становится либо сине-зеленой, либо желтоватой, либо буроватой и даже красной, фиолетовой и черной. Проблеме экологической опасности «цветения» сине-зелёных водорослей посвящено достаточно большое количество работ [8, с. 277]. Обратим внимание на тот факт, что на основе наночастиц железа был создан альгицид, избирательно воздействующий на цианобактерии Microcystis aeruginos, рис. 2 [14, с. 2316]. В этом варианте на клеточной оболочке цианобактерий образу-
Среда обитания
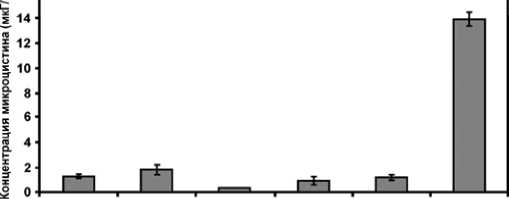
Контроль 500 мГ/л 100мГ/л 50 мГ/л 10 мГ/л Paraquat
50 мГ/л
Рис. 2. Сравнение действия на цианобактерии известного препарата Paraquat и средства с наночастицами nZVI (по выделению микроцистина в воду)
ется нанопленка железа, препятствующая их жизнедеятельности и выделению токсичных веществ. Закономерно, что сообщества биоплёнок цианобактерий Nostoc
Общество. Среда. Развитие ¹ 3’2015
commune различных экотопов играют роль биофильтров – поглотителей тяжелых металлов [1, с. 93].
Становится понятным, почему одни и те же виды токсиногенных цианобактерий выделяют в воду или вовсе не синтезирует токсичные вещества. Известно, что концентрация цианотоксинов в «цветущей» воде многократно возрастает на стадии отмирания цианобактерий и последующего лизиса их клеток (внутриклеточное содержание токсинов в молодых клетках составляет от 0,1 до 10 мкг/л). Тем временем в водохранилищах Верхней Волги концентрации микроцистина-LR варьируют в широком диапазоне доз от 0,1 мкг/л до >1000 мкг/л (при допустимой концентрации в воде не более 1 мкг/л) [10, с. 88]. По-видимому, в этих водоёмах при выпадении кислых атмосферных осадков на клеточных оболочках цианобактерий образуются нанопленки металлов, экранирующие функции цианобактерий, далее наноструктуры металлов превращаются в гель, агрегируют и выпадают в осадок. В этом случае концентрации цианотоксинов и наночастиц металлов в воде становятся существенно меньше и практически не контролируются. В других вариантах (18–25 0С, щелочная среда, высокое содержание в воде органических и неорганических соединений фосфора) опасность наличия цианотоксинов и наночастиц металлов в водоёмах сохраняется.
Относительно наночастиц металлов или других нанообъектов принято, что они имеют размеры 10-9–10-7м (1–100 нм) хотя бы в одном из измерений. Атомы, находящиеся на поверхности таких частиц, связаны с окружающими их атомами по-ино- му, нежели в объеме. В результате на поверхности нанообъекта может происходить атомная реконструкция, появляться новый порядок расположения атомов и могут находиться атомы и молекулы, адсорбированные из внешней среды.
Характерной чертой наночастиц является их способность к ингаляционному, трансдермальному, транснейральному и энтеральному проникновению в любые органы и ткани человека, включая центральную нервную систему (ЦНС). Известно, что частицы размером <5–10 нм удаляются из организма путем почечного клиренса, частицы >200 нм – депонируются в селезенке, частицы размером до 70 нм проникают через кровеносные капилляры, нанокомплексы размером в пределах 35–120 нм аккумулируются в лимфотических узлах, менее 40 нм способны проникать в ядро клетки [11, с. 20]. Иными словами, физические свойства наноразмерных частиц определяют их распространение в организме человека и влияют на их биологическое действие.
Наночастицы попадают в организм человека через легкие, обонятельный эпителий, кожу и желудочно-кишечный тракт. Уровень проникновения нанообъектов через клетки желудочно-кишечного тракта человека (эффективная площадь 200 м2) существенно выше и сложнее, чем через клетки легких (140 м2), обонятельный эпителий и поверхность кожи (1,5–2,0 м2). Результаты исследований биологической активности наночастиц, проведенные в условиях in vitro с использованием различных клеток перечисленных выше биосистем показали, что проникшие в клетку частицы приводят её к окислительному стрессу, увеличивая внутриклеточное содержание кальция и активируя отдельные гены. Как результат, воздействие на организм человека воды, содержащей наночастицы, потенциально может приводить к печальным последствиям.
Между тем воздушные пути легких человека хорошо защищены от проникновения частиц благодаря активному эпителию и вязкому слизистому слою на его поверхности. Однако в области альвеол барьер между альвеолярной стенкой и капиллярами очень тонок (~500 нм) и легко проницаем для наночастиц. Частицы размером 5 нм распределяются относительно равномерно по назофарингельному тракту,
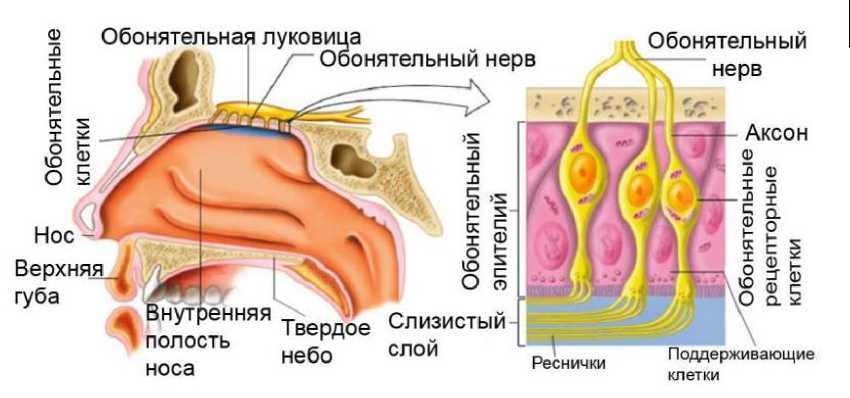
Рис. 3. Проникновение наночастиц в мозг через обонятельный эпителий носовых ходов
трахеобронхиальному тракту и альвеолам (~ по 30%). Частицы диаметром в 20 нм наиболее эффективно оседают в альвеолах (~50%). Одновременно в трахеобронхиальном и назофарингеальном регионах задерживается ~ по 15% от их общего количества. Такое дифференцированное распределение наночастиц разных размеров в различных разделах легких неизбежно сказывается на их экстрапульмонарном распределении [15, с. 823].
Проникновение наночастиц через кожу возможно тремя путями – между клеток, через клетки и через волосяные фолликулы. Верхний слой кожи (эпидермис) достаточно тонок. Лежащая под эпидермисом дерма богата макрофагами крови и тканей, лимфатическими узлами, дендритными клетками и окончаниями сенсорных нервов, которые способны поглощать и распространять нанообъекты за пределы их первоначальной аппликации.
Феноменальной особенностью наночастиц является их способность проникать в организм человека по нервным волокнам, идущим от обонятельного эпителия. Более 70 лет назад было установлено, что полиовирус (~ 30 нм), введенный экспериментальному животному интраназально, может через луковицу обонятельного нерва проникать непосредственно в ЦНС. В настоящее время сенсорное воздействие наночастиц на обонятельные нервы и ЦНС было достоверно зафиксировано для частиц органической и минеральной природы со средними диаметрами 3 нм, 10 нм и 30–60 нм, рис. 3 [15, с. 823]. Не удивительно, что фторопластовая нанопыль (26 нм)
на порядок токсичнее (60 мкг/м3), чем боевые отравляющие вещества нервнопаралитического действия [12, с. 98].
Вместе с тем, следует подчеркнуть, что нанообъекты могут быть не только экологически опасными веществами, но и выполнять функции барьера для токсичных соединений. Так, относительно недавно была установлена способность наноалмазов детонационного синтеза адсорбировать афлатоксин В1 из водных растворов при кислых, слабокислых и щелочных значениях водородного показателя. Причем, время адсорбции этого ядовитого соединения не превышает 2–3 минут [9, с. 117]. Было замечено, что в качестве адсорбентов для нейтрализации микотоксинов могут использоваться и другие наночастицы. Особенно это касается нанообъектов, полученных из гумусовых веществ, в которых существуют частицы фульво-кислот размером 2–4 нм и гуминовых кислот размером 8–12 нм. Гуминовые кислоты и фульвокислоты объединены в ассоциаты размером в десятки и сотни нанометров, которые, взаимодействуя между собой, образуют супраполимерную гумусовую матрицу [13, с. 846].
Наличие в молекулах гуминовых веществ различных активных функциональных групп и ароматических фрагментов предопределило способность их наночастиц вступать во взаимодействие с широким спектром экотоксикантов, тем самым снижая их токсическое воздействие на живые организмы и влиять на геохимические потоки в окружающей среде. Закономерно, что была зафиксирована способность гуминовых веществ детоксицировать действие
Среда обитания
полиароматических углеводородов, полихлорированных бифенилов, различных пестицидов и радионуклидов [7, с. 50]. В качестве механизма взаимодействия гуминовых веществ с этими соединениями рассматривают физическую сорбцию за счет Ван-дер-Ваальсовых и гидрофобных взаимодействий, хемосорбцию за счет ионного обмена, водородное связывание, лигандный обмен и донорно-акцепторное взаимодействие.
Таким образом, в настоящее время изучение биогеоэкологических функций нанообъектов в окружающей среде имеет актуальное фундаментально-прикладное значение. В этой связи в Институте озероведения РАН (ИНОЗ РАН, Санкт-Петербург) уделяется пристальное внимание соответствующим исследованиям в бассейне Ладожского озера [8, с. 266]. Так, было впервые зафиксировано, что при переходе от одного водного объекта к другому имеют место весьма значительные коле- бания количества наноразмерных частиц металлов. Существенные сезонные и гидродинамические изменения в количестве наночастиц свойственно водным средам истока р. Нева, откуда ниже по течению вода попадает на водозабор Санкт-Петербурга. Дифференциальное распределение по крупности наноразмерных частиц в воде притоков Ладоги с низкой и высокой концентрацией металлов существенно отличается. Анализ проведенных наномасш-табных измерений показывает, что спектр дисперсного состава воды является индивидуальным для каждого притока Ладоги и может служить идентификационным признаком. В целом, экосистема Ладожского озера обладает высокой специфичностью происходящей в ней золь-гель процессов, что с высокой долей вероятности может являться важной причиной роста заболеваемости населения в Санкт-Петербурге, Республике Карелия и Новгородской области.
Общество. Среда. Развитие ¹ 3’2015
Список литературы От алмазов и золота до экологической роли нанообъектов
- Горностаева Е.А., Фокина А.И., Кондакова Л.В., Огородникова С.Ю., Домрачева Л.И., Лаптев Д.С., Сластникова Е.М. Потенциал природных биопленок Nostoc commune как сорбентов тяжелых металлов в водной среде//Вода: химия и экология. -2013, № 1(55). -С. 93-101.
- Куимова Н.Г., Моисеенко В.Г. Биогенная минерализация золота в природе и эксперименте//Литосфера. -2006, № 3. -С. 83-95.
- Моисеенко Т.И. Влияние геохимических факторов водной среды на биоаккумуляцию металлов в организме рыб//Геохимия. -2015, № 3. -С. 222-233.
- Моисеенко Т.И., Дину М.И. Феномен нарастания органических кислот в природных водах и их влияние на закисление вод//Доклады академии наук. Т. 460. -2015, № 5. -С. 574-578.
- Моргалёв Ю.Н., Хоч Н.С., Моргалёва Т.Г., Гулик Е.С., Борило Г.А., Булатова У.А., Моргалёв С.Ю., Понявина Е.В. Биотестирование наноматериалов: о возможности транслокации наночастиц в пищевые сети//Российские нанотехнологии. Т. 5. -2010, № 11-12. -С. 131-135.
- Наноминералогия. Ультра-и микродисперсное состояние минерального вещества/Отв. ред. Н.П.Юшкин, А.М.Асхабов, В.И. Ракин -СПб.: Наука, 2005. -581 с.
- Перминова И.В. Гуминовые вещества -вызов химикам XXI века//Химия и жизнь. -2008, № 1. -С. 50-55.
- Перспективные направления развития науки в Петербурге/Отв. ред. Ж.И.Алферов, О.В.Белый, Г.В.Двас, Е.А.Иванова -СПб.: Изд-во ИП Перминов С.А., 2015. -543 с.
- Пузырь А.П., Пуртов К.В., Шендорова О.А. Адсорбция афлатоксина В1 наноалмазами детонационного синтеза//Доклады академии наук. Т. 417. -2007, № 1. -С. 117-120.
- Сиделев С.И., Зубишина А.А., Бабаназарова О.В., Кутузова В.Ю., Мартьянов О.В. Мониторинг содержания цианотоксинов микроцистинов в водоемах Верхней Волги: молекулярно-генетический и аналитический подходы//Вода: химия и экология. -2014, № 8(74). -С. 88-94.
- Супотницкий М.В. Нанообъекты как новая биологическая угроза//Новости медицины и фармации. -2014, № 6 (495). -С. 20-25.
- Третьяков Ю.Д. Эволюция наноматериалов, наночастиц, наноструктур и проблемы здоровья//Экология человека. -2011, № 1(8). -С. 98-107.
- Федотов Г.Н., Добровольский Г.В., Шоба С.А. Микрофазное расслоение супраполимерной гумусовой матрицы как процесс, формирующий наноструктурную организацию почвенных гелей//Доклады Академии наук. Т. 437. -2011, № 6. -С. 846-848.
- Marsalek B., Jancula D., Marsalkova E., Mashlan M., Safarova K., Tucek J., Zboril R. Multimodal action and selective toxicity of zerovalent iron nanoparticles against cyanobacteria//Environ. Sci. Technol. -2012, V. 46. -P. 2316-2323.
- Oberdorster G., Oberdorster E., Oberdorster J. Nanotechnology: an emerging discipline evolving from studies of ultrafine particles//Environmental Health Perspectives. V. 113. -2005, № 7. -P. 823-839.


