Папилломавирусная инфекция и возможности повышения эффективности терапии рецидивирующих аногенитальных бородавок
Автор: Чернова Н.И., Фриго Н.В., Атабиева А.Я., Майорова Е.М.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Инфекционно-воспалительные заболевания
Статья в выпуске: 2 т.16, 2023 года.
Бесплатный доступ
Введение. В последние годы отмечается увеличение количества случаев аногенитальных бородавок, с локализацией в области уретры, представляющих значительные трудности в тактике ведения в связи с высокой частотой рецидивов, прогрессированием клинических проявлений и поражением подлежащих тканей. По данным систематического обзора, включающего данные PubMed и EMBASE, тяжелое течение аногенитальных бородавок может быть сопряжено со снижением локального и системного иммунитета, снижением уровня витамина 25(OH)D и цинка в сыворотке крови. Поиск методов повышения эффективности терапии аногенитальных бородавок является весьма актуальной проблемой. Цель исследования разработка способа повышения эффективности комбинированной терапии рецидивирующих аногенитальных бородавок. Материалы и методы. Под нашим наблюдением находилось 25 мужчин в возрасте от 24 до 50 лет с рецидивирующими аногенитальными бородавками в области уретры и/или полового члена. Пациентам проводилось комплексное лабораторное обследование, включающее детекцию ДНК вируса папилломы человека (ВПЧ) в соскобах с зоны высыпаний с определением генотипа и количества вирусов; выявление инфекций, передаваемых половым путем (ИППП) в эякуляте молекулярно-генетическим методом при помощи полимеразной цепной реакции в реальном времени (Андрофлор); определение уровня 25(OH)D и цинка в сыворотке крови. Согласно актуальным клиническим рекомендациям Минздрава России по лечению аногенитальных (венерических) бородавок в комплексную терапию включили 0,004%раствор суммы полисахаридов побегов Solanum tuberosum (Панавир) для внутривенного введения и местно гель Панавир и спрей Панавир Интим. Высыпания на коже обрабатывались 5% кремом имихимод, новообразования на слизистых оболочках удалялись хирургически. Результаты. При наблюдении за пациентами в течение 6 месяцев отмечена ремиссия у 23 человек, рецидивы у 2 пациентов с бородавками в дистальном отделе уреты. Выводы. В результате проведенного исследования получены данные о высокой эффективности комплексной терапии с включением препаратов, содержащих суммы полисахаридов побегов растения Solanum tuberosum.
Панавир, аногенитальные бородавки, вирус папилломы человека, впч, папилломавирусная инфекция
Короткий адрес: https://sciup.org/142238994
IDR: 142238994 | DOI: 10.29188/2222-8543-2023-16-2-126-132
Текст научной статьи Папилломавирусная инфекция и возможности повышения эффективности терапии рецидивирующих аногенитальных бородавок
В последние годы отмечается увеличение количе ства случаев аногенитальных бородавок с локализа цией в области уретры, представляющих значительные трудности в тактике ведения в связи с высокой часто той рецидивов, прогрессированием клинических про явлений, выражающихся в увеличение количества высыпаний, площади и глубины поражения подлежа щих тканей [1–4]. Согласно МКБ-10, аногенитальные бородавки кодируются в группе инфекций, передавае мых преимущественно половым путем (ИППП) под кодом А63.0.
Клинические формы заболевания могут быть представлены доброкачественными новообразова ниями: остроконечными кондиломами, папулами, пят нами и формами с риском малигнизации: бовеноидным папулезом, гигантской кондиломой Бушке–Левенштайна локализующимися на коже и слизистых оболочках по ловых органов, уретры, перианальной области, аналь ного канала, ротоглотки (рис. 1).
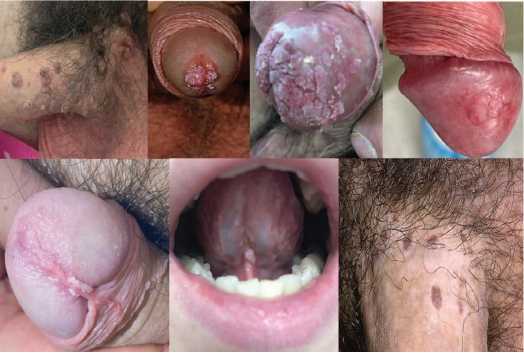
Рис.1. Клинические проявления папилломавирусной инфекции
Fig.1. Clinical manifestations of human papillomavirus (HPV)
Многочисленными исследованиями доказано, что аногенитальные бородавки ассоциируются с вирусами папилломы человека (ВПЧ) 6/11 генотипов, тогда как причиной интраэпителиальной неоплазии являются ВПЧ 16 и 18 типов, реже 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73, 82 типов [5]. Согласно данным отечественных и зарубежных исследователей, в последние годы отме чается высокая частота встречаемости ко-инфициро вания различными генотипами, в том числе ВПЧ 6, 11, 16, 18 типа. Присутствие нескольких генотипов высоко коррелирует с устойчивостью вируса к деструктивным методам лечения и склонностью рецидивам, а также су щественно увеличивает риск малигнизации [6–9].
Вирус папилломы человека, может передаваться при любой форме половых контактов: генитальный, орогенитальный, аногенитальный, через кожу при аутоинокуляции. В последние годы увеличилось количество случаев вертикальной передачи инфекции при прохождении через родовые пути. В связи с чем кондиломы в области крайней плоти, ануса не являются редкостью у детей в возрасте до трех лет [10]. Постоянное использование презервативов снижает риск инфицирования ВПЧ, но не гарантирует полной безопас-ности,так как инфекция может локализоваться вне зоны его действия, в частности на коже наружных половых органов, промежности.
Инкубационный период ВПЧ-инфекции окончательно не установлен. В большинстве (75-90%) случаев течение инфекции транзиторное,так как ВПЧ вызывает реакцию гуморального и клеточного типов иммунного ответа, вследствие чего при полноценной иммунной сопротивляемости в течение 8-12 месяцев происходит самопроизвольная элиминация возбудителя. При наличии провоцирующих экзогенных и эндогенных факторов, способствующих снижению локального или системного иммунитета, устанавливается персистенция или продуктивная инфекция (интраэпителиальная неоплазия, аногенитальные бородавки) [11]. К факторам, способствующим реактивации папилломавирусной инфекции, относят: иммунодефицитные состояния, в том числе ассоциированные с респираторными вирусными инфекциями; сопутствующие ИППП; анальные половые контакты; наличие заболеваний ассоциирующихся с атопией [12–15]. Результаты систематического обзора, включающего данные PubMed и EMBASE, свидетельствуют о том, что тяжелое течение аногенитальных бородавок может быть сопряжено с низким уровнем витамина 25(OH)D и цинка [16–19]. Известно так же, что ВИЧ-положительные пациенты наиболее подвержены ВПЧ-инфекции и составляют группу с высокой частотой рецидивов [20].
Наиболее частая локализация аногенитальных бородавок у мужчин – внутренний листок крайней плоти,

область венечной борозды полового члена, в последние годы – перианальная зона и анальный канал, несколько реже – головка и тело полового члена, уздечка, уретра. Диагноз устанавливается на основании осмотра, в сомнительных случаях используется тест с 3–5% уксусной кислотой. К дополнительным методам диагностики следует отнести дерматоскопию. В исследовании H. Dong и соавт. сообщается, что дерматоскопия обеспечивает более высокий процент положительных результатов в обнаружении крошечных бородавок, чем визуальное наблюдение ( p <0,01). Этот метод обладает высокой чувствительностью, быстрой и точной диагностикой и неинвазивностью [21]. Однако метод не может быть использован для осмотра уретры [22]. Биопсия аногенитальных бородавок показана в случае быстрого увеличения образований за счет периферического роста, инфильтрации подлежащих тканей, уплотнения, изменения цвета, появления кровоточивости, болезненности, неэффективности стандартной терапии [23].
Для установления субклинической формы папилломавирусной инфекции, необходимо применение цитологического метода (койлоцитарная атипия клеток, дискератоциты), при подозрении на малигнизацию процесса рекомендуется гистологическое исследование.
Для верификации диагноза следует выполнить исследование соскобов из зоны поражения молекулярнобиологическими методами с целью идентификации генотипа ВПЧ, определения степени вирусной нагрузки и прогнозирования течения заболевания.
Многочисленными исследованиями показана роль трансмиссивных инфекций и ИППП в прогрессировании аногенитальных бородавок, в связи с чем пациентам с наличием высыпаний рекомендуется обследование на вирусные гепатиты С и В, сифилис, вирус иммунодефицита человека и ИППП. Половой партнер больного также обследуется и при наличии клинических или субклинических проявлений заболевания направляется на лечение [23–24].
Дифференциальный диагноз остроконечных кондилом наиболее часто проводиться с папуллезным ожерельем полового члена, фолликулитами, гиперплазией сальных желез,гипертрофической формой красного плоского лишая, контагиозным моллюском, широкими кондиломами при вторичном сифилисе.
Методы лечения аногенитальных бородавок зависят от локализации процесса, его распространенности и формы элементов.Наиболее часто применяется деструкция (физическая или химическая), реже используются цитотоксические, иммунотропные способы терапии. Комбинированные методы рекомендуются в случае рецидивов заболевания. Препаратами выбора для воздействия на аногенитальные бородавки с локализацией на коже аногенитальной области являются подофиллотоксин или цинка 2-хлорпропионата раствор 1,5% в 2-хлорпропионовой кислоте, которые боль- ные могут применять в домашних условиях [25–26]. Иммуномодулятор имихимод (5% крем) так же относится к топическим средствам для самостоятельного применения. Механизм действия препарата заключается в модуляции иммунного ответа через активацию toll-like receptors (TLR) на поверхности дендритных клеток и усилении продукции интерферонов, в результате чего происходит резорбция бородавок и элиминация вирусов папилломы человека [27–28]. CO2 -лазер, радиоволновая эксцизия, электрокоагуляция и криодеструкция оптимальны для применения у пациентов с множественными аногенитальными бородавками. Однако исследованиями последних лет было показано, что при применении цитотоксических и деструктивных методов исчезают клинические проявления папилломавирусной инфекции (ПВИ), при этом санации ВПЧ инфицированного эпителия в зоне поражения не происходит, вследствие чего возникают рецидивы [29–30]. Более того, реакция на лечение у пациентов с иммунодефицитом может сопровождаются увеличением количества и площади высыпаний (рис. 2) [30]. Важно учитывать, что аногенитальные бородавки в сочетании с ВИЧ-инфекцией более склонны к злокачественному перерождению [31–33].
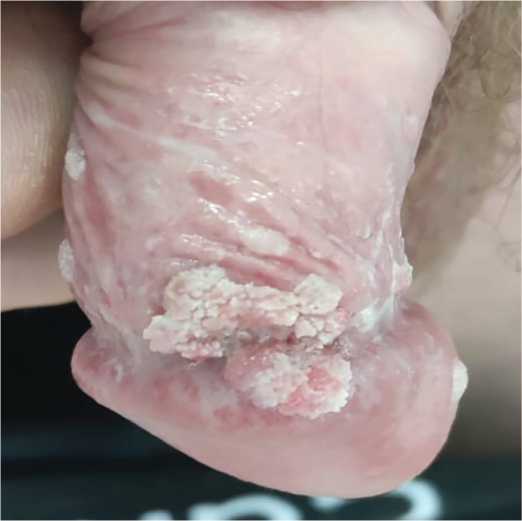
Рис.2. Аногенитальные бородавки в сочетании с ВИЧ-инфекцией
Fig.2. Anogenital warts with HIV-infection
Учитывая данные исследований последних лет, становится очевидна необходимость комплексной те рапии, включающей системные средства с иммуно-тропным и противовирусным действием. В случае рецидивов аногенитальных бородавок актуальными руководствами рекомендуется применение интерферо нов (ИФН) aльфа-2b, интерферонов гамма, инозина пранобекса, суммы полисахаридов побегов картофеля (Solanum tuberosum) в сочетании с деструктивными ме тодами [24]. Внутримышечное или внутриочаговое введение ИФН значительно повышает эффективность терапии рецидивирующих аногенитальных бородавок, но сопровождается такими реакциями, как повышение температуры тела, разбитость, головная боль, что снижает качество жизни пациентов в период ее проведения [34–36].
Доказана эффективность препарата на основе полисахаридов Solanum tuberosum в комплексной терапии рецидивирующих аногенитальных бородавок (Панавир). Препарат обладает широким спектром противовирусной активности, защитным, регенерирующим и заживляющим действием. По данным исследований, проведенных в НИИ вирусологии им. Д.И. Ивановского на моделях in vivo и in vitro , полисахариды побегов Solanum tuberosum показывают поливалентную противовирусную активность в отношении ДНК-содержащих вирусов: простого герпеса (ВПГ) I и II типов, папилломы человека, цитомегаловирусов. Доказана способность Панавира индуцировать синтез интерферонов. При однократном применении препарата увеличивался уровень лейкоцитарного ИНФ в 2,7–3 раза, что соответствовало терапевтическим дозам препаратов ИНФ [37, 38]. Противовирусное действие полисахаридов побегов Solanum tuberosum основано на препятствии адгезии и ингибировании пе-нетрации вирусов в клетку, блокировании раскрытия вирусного капсида, нарушении транскрипции и репликации вирусной ДНК, синтеза капсидных белков, приостанавливающих сборку вирусных частиц и выход их из клетки.В соответствии с клиническими рекоменда-циями,для ведения пациентов с аногенитальными бородавками Панавир назначается в форме раствора для внутривенных инъекций 0, 04 мг/мл 5 мл, ректальные и вагинальные суппозитории 200 мкг, гель для местного применения [24]. Для профилактики анального рака, ассоциированного с ВПЧ, и аногенитальных кондилом с убедительностью рекомендаций А и достоверностью доказательств 1, лицам мужского пола в возрасте от 9 до 26 лет рекомендуется вакцинация от ВПЧ [39–41].
МАТЕРИАЛЫ И МЕТОДЫ
Под нашим наблюдением по направлению урологов находилось 25 мужчин в возрасте от 24 до 50 лет, с диагнозом: рецидивирующие аногенитальные бородавки уретры и/или полового члена. У всех больных отмечалось от 4 до 6 рецидивов в течение года. Учитывая, что выявление факторов, способствующих прогрессированию ВПЧ инфекции, может иметь решающее значение для предотвращения рецидивов, всем пациентам проведено лабораторное обследование, включающее детекцию ВПЧ в соскобах с поверхности высыпаний и ИППП в эякуляте при помощи полиме- разной цепной реакции (ПЦР) в реальном времени, определение уровня 25(OH)D и цинка в сыворотке крови. В комплексной терапии использовали комплекс полисахаридов побегов Solanum tuberosum (Панавир) системно и местно. Раствор Панавира 0,04 мг/мл 5 мл вводили внутривенно, по схеме 3 инъекции через 48 ч в течение 1-й недели и 2 инъекции с интервалом в 72 ч в течение 2-й недели, всего – 5 инъекций на курс. На область высыпаний применялся Панавир-гель, ½ крае вой фаланги указательного пальца 3–4 раза в день в течение 10 дней. Спрей Панавир-Интим рекомендо вался до и после половых контактов по 2–3 дозы на по верхность интимных зон обоих партнеров. Новообразования на коже пациент обрабатывал самостоятельно имихимодом 3 раза в неделю на ночь в течение 12–16 недель. При локализации остроконечных кондилом в области ладьевидной ямки головки полового члена проводилась их деструкция урологом.
РЕЗУЛЬТАТЫ
У всех больных, включенных в исследование, на блюдались аногенитальные бородавки,слабый зуд и жжение в области высыпаний.
При анализе результатов исследования концент рации витамина Д в сыворотке крови у всех больных выявлен дефицит витамина различной степени (от уме ренного до значительного). Всем пациентам был реко мендован Колекальциферол (ФортеДетрим) по 10 000 МЕ утром во время еды в течение 2 месяцев. Результаты исследования концентрации цинка в сыворотке крови пациентов выявили снижение ниже референсных значений у 10 человек, у 6 больных показатели находи лись на нижней границы нормы. Данной группе паци ентов был рекомендован хелат цинка 25 мг 1 раз в день после еды в течение одного месяца.
При исследовании эякулята молекулярно-биоло гическим методом при помощи ПЦР в реальном вре мени обнаружена ДНК T. Vaginalis – у 2 мужчин, ДНК C. Trachomatis – в 1 случае, M. Genitalium – у 1 пациента. Повышенные концентрации G. Vаginаlis, Atopobium vaginae, Prevotella bivia, Streptococcus agalactiae, St. Аu-rеus, Ureaplasma spp. и/или M. Hominis, Candida spp. от мечено у 14 пациентов, в ко-инфекции с вирусом простого герпеса (HSV) I/ II и/или цитомегаловитусом (CMV), вирусом Эпштейн-Барр – у 9 человек. Следует отметить,что выявление ДНК герпесвирусов отмеча лось в отсутствии клинических проявлений и было об условлено реактивацией хронической инфекции. Таким образом, анализ результатов проведенного обследова ния свидетельствует о высокой частоте встречаемости нарушений микробиоценоза мочеполового тракта у па циентов с рецидивирующими аногенитальными боро давками. Больным проводилась терапия в соответствии с актуальными руководствами.
Анализ частоты выявления генотипов ВПЧ у па циентов, принявших участие в исследовании, показал, что наиболее часто определялись ДНК ВПЧ 6/11 гено типов, в 19 и 10 случаях соответственно. В 17 случаях отмечалось ко-инфицирование ВПЧ: у 5 больных соче тание ВПЧ 6 и 11 генотипов, у 9 пациентов ко-инфици рование ВПЧ 11 и 16 генотипов, у 3 – ко-инфицирование 6, 11 и 52 генотипов.
На основании полученных данных представляется обоснованной и универсальной комбинация консервативного и хирургического лечения. При наблюдении за пациентами в течение 6 месяцев отмечена ремиссия у 23 (92%) человек, рецидивы – у 2 (8%) пациентов с бородавками в терминальном отделе уретры (1 пациент относился группе мужчин, практикующих секс с мужчинами (МСМ), в 1 случае отмечена реинфекция M. Genitalium ).
В качестве примера успешного лечения больного с рецидивирующим течением ПВИ приводим клиниче ский случай.
Клинический случай
Пациент Д., 29 лет, городской житель, менеджер, не женат. Жалобы на высыпания в области уздечки по лового члена, ощущение зуда. Считает себя больным с января 2022 г., когда впервые отметил наличие мелких образований. Обратился на консультацию к урологу, где был установлен диагноз: остроконечные конди ломы. Дополнительные исследования не проводились. Проведена вапоризация элементов лазером. В течение 6 месяцев отмечено 2 рецидива, осуществлялась де струкция электрокоагулятором и жидким азотом. После очередного рецидива, направлен на консульта цию к дерматовенерологу с целью определения даль нейшей тактики ведения.
Локальный статус:процесс носит ограниченный характер, в области уздечки билатерально отмечаются множественные фиброэпителиальные узелки на широ ком основании, с хорошо васкуляризованными участ ками розового цвета (рис. 3).
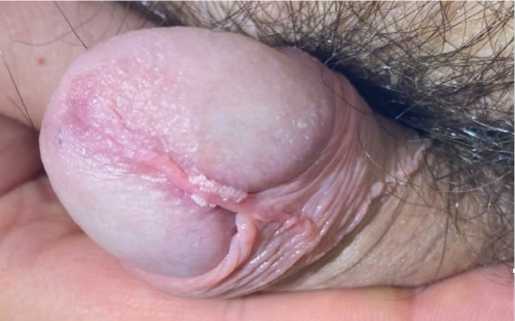
Рис.3. Фиброэпителиальные узелки в области уздечки полового члена у пациента Д. до лечения
Fig.3. Fibroepithelial nodules in the area of the frenulum of the penis in patient D. before treatment
При лабораторных исследованиях (комплекс серо логических реакций на сифилис; определение антител к ВИЧ, гепатиту В и С) получены отрицательные резуль таты. При сследовании эякулята с помощью ПЦР в ре альном времени ДНК N. gonorrhoeae, C. trachomatis M. genitalium, T. vaginalis, ВПГ I, ВПГ II не были обнару жены, ДНК ЦМВ обнаружено. Исследование соскоба с поверхности кондилом выявило ДНК 11 и 52 генотипов. Установлен дефицит витамина Д и цинка в сыворотке крови. Рекомендовано восполнение.
В соответствии с клиническими рекомендациями были назначены: имихимод 5% крем 3 раза в неделю на ночь – 12 недель; Панавир 0,04 мг/мл 5 мл внутривенно 3 инъекции через 48 ч в течение 1-й недели и 2 инъек ции с интервалом в 72 ч в течение 2-й недели – 5 инъ екций на курс. Гель Панавир на область высыпаний, ½ краевой фаланги указательного пальца 3 – 4 раза в день в течение 10 дней. После проведенного курса отмеча лось разрешение процесса (рис. 4).
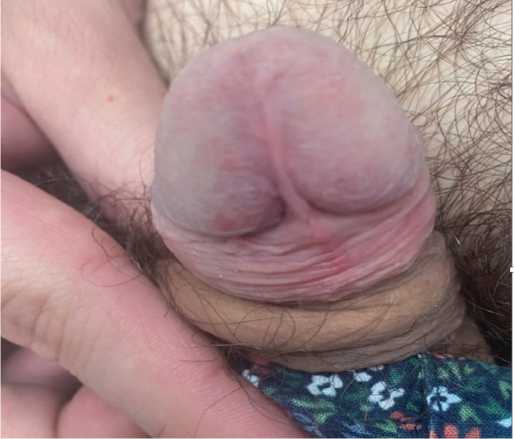
Рис.4. Внешний вод полового члена пациента Д. после лечения (Имиквимод + Панавир)
Fig.4. Appearance of the penis of patient D. after treatment (Imiquimod + Panavir)
Учитывая рецидивирующее течение ПВИ в период наблюдения, был рекомендован спрей Панавир Интим в профилактическом режиме длительное время. При наблюдении за пациентом в течение 6 месяцев рециди вов не отмечалось.
ОБСУЖДЕНИЕ
В результате проведенного исследования полу чены данные о высокой эффективности комплексной терапии с включением суммы полисахаридов побегов Solanum tuberosum. Высокая эффективность предло женного метода отмечена у 23 (92%) пациентов. Не за регистрировано ни одного случая отсутствия эффекта от лечения.При наблюдении за пациентами в течение 6 месяцев ремиссия отмечалась в 92% случаев. Перено симость раствора, геля, спрея комплекса полисахари дов побегов Solanum tuberosum была хорошей. Ослож нений и побочных действий на фоне используемой те рапии не наблюдалось.
ВЫВОДЫ
Таким образом, для предупреждения риска про грессирования ВПЧ-инфекции чрезвычайно важным является выявление и устранение провоцирующих факторов. Перспективным и патогенетически обосно ванным представляется применение в комплексной терапии отечественного противовирусного и иммуно модулирующего препарата Панавир в форме раствора для внутривенных инъекций 0,04 мг/мл 5 мл, геля для местного применения и спрея для интимной гигиены, показавших высокую эффективность и хорошую пе реносимость. Предложенный метод, учитывающий патогенез вирусного процесса, способствует сниже нию риска рецидивов аногенитальных бородавок и повышению качества жизни больных.
ЛИТЕ РАТУPA/REFEREN CE S
экспериментальная и клиническая урология № 2 2023
Список литературы Папилломавирусная инфекция и возможности повышения эффективности терапии рецидивирующих аногенитальных бородавок
- Kombe Kombe AJ, Li B, Zahid A, Mengist HM, Bounda GA, Zhou Y, Jin T. Epidemiology and burden of human papillomavirus and related diseases, molecular pathogenesis, and vaccine evaluation. Front Public Health 2021;(8):552028. https://doi.org/10.3389/fpubh.2020.552028.
- Pérez-González A, Cachay E, Ocampo A, Poveda E. Update on the epidemiological features and clinical implications of human papillomavirus infection (HPV) and human immunodeficiency virus (HIV) coinfection. Microorganisms 2022;10(5):1047. https://doi.org/10.3390/microorganisms10051047.
- Gross GE, Werner RN, Becker JC, Brockmeyer NH, Esser S, Hampl M et al. S2k guideline: HPV-associated lesions of the external genital region and the anus-anogenital warts and precancerous lesions of the vulva, the penis, and the peri-and intra-anal skin (short version). J Dtsch Dermatol Ges 2018;16(2):242-55. https://doi.org/10.1111/ddg.13441.
- Graham SV. The human papillomavirus replication cycle, and its links to cancer progression: a comprehensive review. Clin Sci (Lond) 2017;131(17):2201–21. https://doi.org/10.1042/CS20160786.
- Рахматулина М. Р., Большенко Н. В. Особенности клинического течения папилломавирусной инфекции в зависимости от генотипа и количественных показателей вирусов папилломы человека высокого онкогенного риска. Вестник дерматологии и венерологии 2014;(3):95–105. [Rakhmatulina M.R. Bolshenko N.V., Kuevda D.A., Trofimova O.B. Particular features of the clinical course of the papilloma viral infection depending on quantitative indices of human papilloma viruses of a high carcinogenic risk. Vestnik dermatologii i venerologii Vestnik dermatologii i venerologii=Vestnik dermatologii i venerologii 2014;(3):95–105. (In Russian)].
- Колбашова Ю.Н., Афанасьев Д.В., Философов С.Ю., Бурцев В.В. Гигантская кондилома Бушке–Левенштейна (клиническое наблюдение). Тазовая хирургия и онкология 2019;9(3):54–8. [Kolbashova YU. N., Aphanasyev D.V., Philosophov S. YU., Burtsev V.V. BuschkE-Lowenstein tumor: a case report. Tazovaya Khirurgiya i Onkologiya = Pelvic Surgery and Oncology 2019;9(3):54–8. (In Russian)].
- Fay N, Panté N. Nuclear entry of DNA viruses. Front Microbiol 2015;(6):467. https://doi.org/10.3389/fmicb.2015.00467/.
- Agrawal N, Mane M, Chiriva-Internati M. Temporal acceleration of the humanpapillomavirus life cycle by adeno-associated virus (AAV) type 2 superinfection in natural hosttissue. Virology 2002;297(2):203–10.
- Thappa DM, Chiramel MJ. Evolving role of immunotherapy in the treatment of refractory warts. Indian Dermatol. Online J 2016;7(5):364–3.
- Коколина В.Ф., Бычкова О.С., Кузетченко И.Н. Оценка результатов комбинированной терапии папилломавирусной инфекции аногенитальной области у детей и подростков. Российский вестник акушера-гинеколога 2014;14(4):44
- 8.[Kokolina V.F., Bychkova O.S., Kuzetchenko I.N. Assessment of the results of combined therapy for anogenital papillomavirus infection in children and adolescents. Rossiyskii Vestnik Akushera-Ginekologa = Russian Bulletin of Obstetrician-Gynecologist 2014;14(4):44–8.(In Russian)].
- O'Mahony C, Gomberg M, Skerlev M, A Alraddadi , M E de Las Heras-Alonso , S Majewski, et al. Position statement for the diagnosis and management of anogenital warts. J Eur Acad Dermatol Venereol 2019;33(6):1006-19. https://doi.org/10.1111/jdv.15570.
- Ducatman BS. The impact and burden of human papillomavirus – associated disease. Arch Pathol Lab Med 2018;142(6):686-7. https://doi.org/10.5858/arpa.2018-0084-ED
- Colpani V, Soares Falcetta F, Bacelo Bidinotto A, Kops NL, Falavigna M, Serpa Hammes L, et al. Prevalence of human papillomavirus (HPV) in Brazil: A systematic review and meta-analysis. PLoS One 2020;15(2):e0229154. https://doi.org/10.1371/journal.pone.0229154.
- Koster S, Gurumurthy RK, Berger H, Drabkina M, Mollenkopf H-J Y, Goosmann C, et al. Chlamydia coinfection inhibits HPV-induced safeguards of the cellular and genomic integrity in patient-derived ectocervical organoids. BioRxiv 2021.04.15.439996. https://doi.org/https://doi.org/10.1101/2021.04.15.439996.
- Alonio LV, Dalbert D, Mural J, et al. Early Herpes Simplex Virus proteins as risk markers progression of papillomavirus cervical lesions: aretrospective study. Cervix Lower Female Genital Tract 1993;11(4):161–4.
- Mohta A, Kushwaha RK, Gautam U, Sharma P, Nyati A, Jain SK. A comparative study of the efficacy and safety of intralesional measles, mumps, and rubella vaccine versus intralesional vitamin D3 for the treatment of warts in children. Pediatr Dermatol 2020;37(5):853-9. https://doi.org/10.1111/pde.14280.
- Rech MA, Fleming JN, Moore CL. 25-hydroxyvitamin D deficiency and opportunistic viral infections after kidney transplant. Exp Clin Transplant 2014;12(2):95–100.
- Özgu E, Yilmaz N, Baser E. et al. Could 25-OH vitamin D deficiency be a reason for HPV infection persistence in cervical premalignant lesions? J Exp Ther Oncol 2016;11(3):177–80.
- Luong TND, Nguyen CTH, Firas AN, Van TT. Serum Zinc Level in Patients with Severe Genital Warts: A Case-Control Study in a Dermatology Hospital. Infect Dis Obstet Gynecol 2022; 2022:7616453. https://doi.org/10.1155/2022/7616453.
- Werner RN, Westfechtel L, Dressler C, Nast A. Anogenital warts and other HPVassociated anogenital lesions in the HIV-positive patient: a systematic review and meta-analysis of the efficacy and safety of interventions assessed in controlled clinical trials. Sex Transm Infect 2017;93(8):543–50.
- Dong H, Shu D, Campbell TM, Frühauf J, Soyer HP, Hofmann-Wellenhof R. Dermatoscopy of genital warts. J Am Acad Dermatol 2011;64(5):859–64. https://doi.org/10.1016/j.jaad.2010.03.028..
- Zhang Y, Jiang S, Lin H, Guo X, Zou X. Application of dermoscopy image analysis technique in diagnosing urethral condylomata acuminata. An Bras Dermatol 2018;93(1):67–71. https://doi.org/10.1590/abd1806-4841.20186527.
- Gilson R, Nugent D, Werner RN, Ballesteros J, Ross J. 2019 IUSTI-Europe guideline for the management of anogenital warts. J Eur Acad Dermatol Venereol 2020;34(8):1644–53. https://doi.org/10.1111/jdv.16522.
- Кубанов А.А., Перламутров Ю.Н., Рахматулина М.Р., Плахова К.И., Чернова Н.И., Фролов С.А. и др. Клинические рекомендации. Аногенитальные (венерические) бородавки. РОДВК 2020. 27 с. URL: https://www.rodv.ru/klinicheskierekomendacii/ [Kubanov A.A., Perlamutrov Yu.N., Rakhmatulina M.R., Plakhova K.I., Chernova N.I., Frolov S.A. et al. Clinical recommendations. Anogenital (venereal) warts. RODVK 2020. 27 p. URL: https://www.rodv.ru/klinicheskie-rekomendacii/ (In Russian)].
- Ackenzie-Wood A, Kossard S, De Launey J, Wilkinson B. Owens Ml. Imiquimod 5% cream in the treatment of Bowen’s disease. J Am Acad Dermatol 2001;44:462-70.
- Megyeri K, Au WC, Rosztoczy I, Raj NB, Miller RL, Tomai MA, et al. Stimulation of interferon and cytokine gene expression by imiquimod and stimulation by Sendai virus utilize similar signal transduction pathways. Mol Cell Biol 1995;15:2207–2218.
- Gibson SJ, Imbertson LM, Wagner TL, et al. Cellular requirements for cytokine induction in response to the immunomodulators imiquimod and S-27609. Interferon Cytokine Res 1995;15:537–545.
- Schofer H, Van Ophoven A, Henke U, Lenz T, Eul A. Randomized, comparative trial on the sustained efficacy of topical imiquimod 5% cream versus conventional ablative methods in external anogenital warts. Eur J Dermatol 2006;16(6):642-8.
- Рахматулина М.Р., Большенко Н.В., Кучеров В.А., Киселев А.В., Багаева М.И. Оценка эффективности и безопасности комбинированной терапии больных с клиническими проявлениями аногенитальной папилломавирусной инфекции. Российский вестник акушера-гинеколога 2019;19(2):84-87. https://doi.org/10.17116/ rosakush20191902183. [Rakhmatulina M.R., Bolshenko N.V., Kucherov V.A., Kiselev A.V., Bagaeva M.I. Evaluation of the efficiency and safety of combined therapy in patients with clinical manifestationsof anogenital human papillomavirus infection. Rossiyskii Vestnik Akushera-Ginekologa = Russian Bulletin of Obstetrician-Gynecologist 2019;19(2):84-87. https://doi.org/10.17116/rosakush2019190218. (In Russiasn)].
- Молочков А.В., Баграмова Г.Э., Гуреева М.А. Препарат панавир в терапии новообразований кожи, ассоциированных с папилломавирусной инфекцией. Альманах клинической медицины 2018;46(1): XXIV – XXVIII. [ Molochkov A.V., Bagramova G.E., Gureeva M.A. Panavir in the treatment of skin neoplasms associated with human papillomavirus infection. Al'manakh klinicheskoy meditsiny = Almanac of Clinical Medicine 2018;46(1): XXIV – XXVIII. (In Russian)].
- Conley LJ, Ellerbrock TV, Bush TJ, Chiasson MA, Sawo D, Wright TC. HIV-1 infection and risk of vulvovaginal and perianal condylomata acuminata and intraepithelial neoplasia: a prospective cohort study. Lancet 2002;359(9301):108–113. https://doi.org/10.1016/S0140-6736(02)07368-3.
- Drapkin AL, Livingston EG, Dodge R, Coogan AC, Herbert WN. Cervical intraepithelial neoplasia in HIV-infected women in a southastern UB population. South Med J 1997;90(9):893-6.
- Cusini M, Salmaso F, Zerboni R, Carminati G, Vernaci C, Franchi C, et al. 5% Imiquimod cream for external anogenital warts in HIV-infected patients under HAART therapy. Int J STD AIDS 2004;15(1):17–20.
- Viazis N, Vlachogiannakos J, Vasiliadis K, Theodoropoulos I, Saveriadis A, Karamanolis DG. Earlier eradication of intra-anal warts with argon plasma coagulator combined with imiquimod cream compared with argon plasma coagulator alone: a prospective, randomized trial. Dis Colon Rectum 2007;50:2173–2179.
- Maw RD. A comparison of interferon alpha-2a and podophyllin in the treatment of primary condylomata acuminate. The Condylomata International Collaborative Study Group. Genitourin Med 1991;67(5):394–9.3
- Yang J, Pu YG, Zeng ZM., Yu ZJ, Huang N, Deng QW. Interferon for the treatment of genital warts: a systematic review. BMC Infect Dis 2009;9:156. https://doi.org/10.1186/1471-2334-9-156.
- Корсунский В.Н., Брускин А.Б., Денисов Л.А., Иванов Р.А. Сравнительное изучение фармакокинетики различных лекарственных форм интерферона. Вестник последипломного медицинского образования 2009;(1):53–6. [Korsunsky V.N., Bruskin A.B., Denisov L.A., Ivanov R.A. Comparative study of the pharmacokinetics of various dosage forms of interferon. Vestnik poslediplomnogo meditsinskogo obrazovaniya = Journal of postgraduate medical education 2009;(1):53-6.
- Колобухина Л.В., Носик Н.Н., Меркулова Л.Н., Брагинский Д.М., Лаврухина Л.А., Калинина Т.С., и др. Динамика индукции лейкоцитарного интерферона при однократном и повторном применении Панавира. Цитокины и воспаление 2009;(2):49-52. [Kolobukhina L.V., Nosik N.N., Merkulova L.N., Braginskii D.M., Lavrukhina L.A., Kalinina T.S., et al. Time course of leukocyte interferon induction after single and repeated application of panavir. Tsitokiny i vospaleniye = Cytokines and Inflammation 2009;(2):49-52. (In Russian)].
- Довлетханова Э.Р., Прилепская В.Н., Минаева Е.А. Эффективность и приемлемость лечения ВПЧ-ассоциированных заболеваний шейки матки с применением неспецифического противовирусного препарата растительного происхождения. Эффективная фармакотерапия 2018;(26):20-3. [Dovletkhanova E.R., Prilepskaya V.N., Letunovskaya A.B. Efficacy and acceptability of treatment of hpvassociated diseases of the cervix uteri with the use of a non-speci c antiviral drug of plant origin. Effektivnaya farmakoterapiya = Effective pharmacotherapy 2018;(26):20-3. (In Russian)].
- Human papillomavirus vaccines: WHO position paper, October 2014. Weekly epidemiological record. 2014;43(89):465-492. URL: http://www.who.int/wer .
- Schiller JT, Castellsagué X, Garland SM. A review of clinical trials of human papillomavirus prophylactic vaccines. Vaccine 2012;30 (5): F123-38.


