Параметры гемодинамики почечного трансплантата с разной степенью интерстициального фиброза и тубулярной атрофии в отдаленном посттрансплантационном периоде у детей
Автор: Пыков М.И., Эктов Д.Б., Васильев К.Г., Кушнир Б.Л., Мартыненкова А.В.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Урология
Статья в выпуске: 4 т.21, 2021 года.
Бесплатный доступ
Введение. Интерстициальный фиброз и тубулярная атрофия являются одной из причин приводящей к дисфункции почечного трансплантата (ПТ) в отдаленном послеоперационном периоде. Цель исследования. Оценка допплерографических показателей кровотока трансплантированной почки с сохраненной азотовыделительной функцией и морфологическими признаками интерстициального фиброза и тубулярной атрофии (ИФТА). Материалы и методы. Исследование включает анализ истории болезни 130 детей, которым была выполнена аллогенная трансплантация трупной почки. Проанализированы результаты231 чрескожной пункционной биопсии и ультразвуковых исследований (УЗИ) почечных трансплантатов. УЗИ проводилось ультразвуковым сканером B&K Pro Focus 2202 с применением конвексного и линейного датчиков с частотой 3-5 МГц и 8-10 МГц соответственно. Чрескожная биопсия паренхимы ПТ проводилась под эхографическим контролем автоматической биопсийной системой BARD MAGNUN с пункционной иглой размером G16, G18.Данные морфологических исследований разделены на 3 группы в соответствии со степенью ИФТА.Результаты . Выявлены различия (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Почечный трансплантат, допплерография, гемодинамика, чрескожная биопсия, морфология почки
Короткий адрес: https://sciup.org/149139203
IDR: 149139203
Текст научной статьи Параметры гемодинамики почечного трансплантата с разной степенью интерстициального фиброза и тубулярной атрофии в отдаленном посттрансплантационном периоде у детей
В настоящее время трансплантация почки является терапией выбора у детей c хронической болезнью почек 5 степени (ХБП 5). Качество жизни пациентов с функционирующим трансплантатом значительно выше, чем у детей, находящихся на заместительной терапии диализом. Современные протоколы терапии, разработанные для предупреждения и лечения острого отторжения, и своевременная диагностика позволили значительно увеличить выживаемость почечных трансплантатов (ПТ) [1, 2].
Несмотря на совершенствование протоколов иммуносупрессивной терапии, применение которых значительно снизило частоту острого отторжения в течение первого года после трансплантации, в долгосрочной перспективе результаты выживаемости ПТ практически не улучшились [3]. Прогрессивное снижение функции почки в отдаленном посттрансплантационном периоде связано с развитием нефросклероза, причинами которого являются острое или хроническое отторжение, а также острая и хроническая нефротоксичность ингибиторов кальцинейрина [4, 5].
Для обозначения хронического необратимого процесса в трансплантированной почке, морфологически проявляющегося нефросклерозом, в патологии почечного трансплантата был принят термин интерстициальный фиброз и тубулярная атрофия (ИФТА).
В соответствии с Banff-классификацией распространенность интерстициальных изменений при нефросклерозе любой этиологии оценивается полуколичественно по площади почечной паренхимы, занимаемой участками фиброза интерстиции и атрофии канальцев [6, 7]. В Banff-классификации 2005 г. ИФТА характеризуется как хроническое повреждение аллотрансплантата без определенной этиологии, объединяя общую конечную точку различных (иммунологических и неиммунологических) этиологий фиброза [8].
Ранняя диагностика ИФТА важна для эффективного лечения потенциального хронически прогрессирующего повреждения пересаженной почки путем минимизации факторов риска, связанных с повреждением трансплантата [9]. Широкое распространение для оценки анатомоморфологического состояния ПТ получило УЗИ. УЗИ является первичным диагностическим методом, позволяющим неинвазивно и оперативно выявить большинство осложнений, приводящих к дисфункции ПТ [10]. Для мониторинга функционального состояния ПТ используется допплерография, которая дает информацию о сосудистой архитектонике и особенностях кровообращения почки [11, 12]. Метод цветовой допплерографии (ЦД) позволяет провести качественную оценку перфузии ПТ, однако наиболее информативным для исследователя является метод импульсно-волновой допплерометрии (ИД), при котором проводится количественная оценка кровотока в сосудах по кривой, отражающей спектр допплеровского сдвига частот.
Количественная оценка допплерометрической кривой включает две группы показателей: абсолютные и относительные. К абсолютным показателям относятся такие величины, как максимальная скорость кровотока в систолу и конечная минимальная диастолическая скорость. Абсолютные показатели являются угол-зависимыми, т. е. правильность их определения зависит от точности коррекции угла между направлением распространения ультразвуковой волны и продольной осью сосуда. Если в крупных сосудах коррекция угла относительно несложна, то при исследовании мелких извитых сосудов соблюдение этого условия вызывает значительные затруднения. Учитывая это, были разработаны многочисленные относительные «угол-независимые» показатели. К наиболее распространенным в клинической практике индексам, позволяющим косвенно судить о величине периферического сопротивления, относятся индекс резистентности (RI) и пульсационный индекс (PI) [13].
Индексы периферического сопротивления являются важными показателями для количественной оценки изменений почечного кровотока при развитии патологических процессов в ПТ. Допплерографические исследования, выполненные в посттрансплантационном периоде с расчетом RI и PI, имеют большое значение для прогнозирования исходов аллотрансплантации почки. Однако чувствительность и специфичность этих показателей для диагностики острых эпизодов отторжения остаются спорными, поскольку эти индексы могут повышаться вследствие различных причин нарушения функции почек [14, 15].
В настоящее время основным методом оценки структурных изменений трансплантированной почки является гистологическое исследование биопсийного материала, полученного с помощью пункционной биопсии [16]. Хотя биопсия остается «золотым стандартом» диагностики дисфункции почечного аллотрансплантата, она несет в себе риски и осложнения любого инвазивного исследования, включая кровотечение, формирование артериовенозных фистул или псевдоаневризм [17].
Так как биопсия сопряжена с определенными рисками, большое значение для принятия клинических решений имеют неинвазивные методы, особенно во время амбулаторного наблюдения за реципиентами [18, 19]. Ранняя диагностика повреждения аллотрансплантата позволяет правильно провести лечение и предотвратить дальнейшее повреждение пересаженной почки.
Цель исследования: оценка допплерографических показателей кровотока трансплантированной почки с сохраненной азотовыделительной функцией, а также их изменение у трансплантатов с разной степенью интерстициального фиброза и тубулярной атрофии.
Материалы и методы
Исследование включает анализ истории болезни 130 детей с хронической болезнью почек 5 степени, которым в 2009-2019 гг. было выполнено 130 аллогенных трансплантаций почек от посмертного донора. Возраст пациентов был в диапазоне 5-17 лет, группу исследования составили 80 мальчиков (62%) и 50 девочек (38%).
Первое место среди причин, приведших к развитию ХБП 5, занимает врожденная патология мочевыводящих путей (29%), далее следуют гипоплазия и дисплазия почек (18%), кистозные заболевания (16%), гемолитико-уремический синдром (10%), наследственный нефрит (6%), системные заболевания соединительной ткани (5%), хронический гломерулонефрит (9%), другие причины (7%).
Трансплантация донорской почки выполнялась забрюшинно в подвздошную область реципиента. Артериальный анастомоз формировался между почечной артерией трансплантата и наружной или внутренней подвздошной артерией реципиента. Венозный анастомоз накладывался между почечной веной донорской почки и наружной подвздошной веной реципиента. Для восстановления экскреторного тракта формировался уретероцистоанастомоз по экстравезикальной методике Lich - Gregoir или J. Barry.
Все дети получали трехкомпонентную иммуносупрессивную терапию, включающую ингибитор кальцинейрина (циклоспорин А, такролимус), глюкокортикостероид (преднизолон, метилпреднизолон) и препарат микофеноловой кислоты (майфортик) или микофенолата мофетил (селлсепт).
Проанализированы результаты 231 чрескожной пункционной биопсии и УЗИ почечных трансплантатов, которые были выполнены от 0,7 до 78,9 мес. после трансплантации. На момент УЗИ и биопсии, проводилась лабораторная диагностика, позволяющая оценить функциональное состояние трансплантата. Исследование включало определение уровня сывороточного креатинина, суточной протеинурии, определение скорости клубочковой фильтрации, рассчитанной по формуле Schwartz. Интервал между инструментальной, лабораторной диагностикой и биопсией почки составлял менее 3 дней.
Обследование пациента осуществлялось в положении лежа. Оценивался контур почки, однородность, эхогенность, толщина паренхимы, четкость кортикомедуллярной дифференцировки, состояние коллекторной системы.
ЦД позволяла оценить адекватность перфузии паренхимы ПТ и выявить участки обеднения сосудистого рисунка. При ИД определялись пиковая систолическая и конечная диастолическая скорости, IR и PI. Проводилось измерение линейной скорости кровотока в почечной вене (V ven.). Кровоток исследовали на уровне основного ствола почечной артерии и в междольковых артериях в нижнем, среднем и верхнем сегментах с последующим вычислением среднего показателя. Угол инсонации был в интервале от 30 до 600. При проведении допплерометрии показатели кровотока анализировались в 3–6 циклах сердечных сокращений с последующим усреднением показателей.
Все биопсии были выполнены после УЗИ, чтобы исключить интраренальные артериовенозные фистулы и псевдоаневризмы.
Чрескожная биопсия паренхимы ПТ проводилась в положении пациента лежа на спине под эхографическим контролем автоматической биопсийной системой BARD MAGNUN с пункционной иглой размером G16, G18.
Морфологические изменения в трансплантате оценивались по данным световой микроскопии и иммунофлюоресценции. Верификация морфологических изменений производилась в соответствии с международной классификацией Banff патологии аллотрансплантата почки в модификации от 2016 г.
Обработку полученных данных проводили с помощью статистического пакета SPSS 21 и Microsoft Office Exel. Для количественных переменных вычисляли медиану (Ме), 25-й и 75-й процентили (25%; 75%). На первом этапе проводили сравнение показателей с помощью критерия Манна-Уитни, различия считали значимыми при p < 0,05. Для определения диагностической точности исследованных показателей при выявлении различных состояний трансплантата провели ROC-анализ (Receiver Operator Characteristic). Представление об аналитической точности показателя даёт площадь под ROC-кривой (area under curve, AUC), которая принимает значение в диапазоне от 0 до 1. Чем больше значение AUC, тем выше точность показателя при выявлении искомого состояния: AUC от 0,9 до 1 соответствует отличной дискриминирующей способности показателя, от 0,8–0,9 – очень хорошей, 0,7–0,8 – хорошей, 0,6–0,7 – средней, 0,5–0,6 – неудовлетворительной, меньше 0,5 – отсутствует. Для значений AUC вычисляли 95% доверительный интервал (95% ДИ). Для оценки связи между двумя номинальными переменными использовали таблицы сопряженности и критерий независимости хи-квадрат (χ2). Две номинальные переменные считали зависимыми друг от друга при p < 0,05.
Результаты и обсуждение
В соответствии с поставленными целями нами проведено изучение параметров гемодинамики ПТ по данным ультразвуковой допплерографии у пациентов с ИФТА.
Проанализированные данные морфологических исследований, согласно Banff классификации, были нами разделены на 3 группы в соответствии со степерью ИФТА.
Количество трансплантатов с гистологическими признаками ИФТА составляло: 1-ой степени – 107 (46%), 2-ой степени –104 (45%) и 3-ьей степени – 20 (9%).
Количество пациентов, которым была выполнена первичная или повторная биопсия
ПТ в отдаленном посттрансплантационном периоде, представлено в таблице 1.
Таблица 1. Количество пациентов с первичными и повторными биопсиями
|
Количество биопсий |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
|
|
Количество пациентов (n) |
n=77 |
n=23 |
n=19 |
n=6 |
n=4 |
n=1 |
Все трансплантаты имели сохраненную депурационную функцию; рассчитанная СКФ в группах была больше 40 мл/мин/1,73 м2.
Показатели суточной протеинурии, сывороточного креатинина и скорости клубочковой фильтрации представлены в таблице 2.
Таблица 2. Лабораторные показатели у пациентов в зависимости от степени ИФТА
|
Лабораторные показатели |
Степень интерстициального фиброза и тубулярной атрофии |
||
|
1-я |
2-я |
3-я |
|
|
Me (25%; 75%) |
|||
|
Протеинурия_мг/сут |
104 (65; 172) |
192,5 (106,5; 348) |
450 (247; 917) |
|
Креатинин мкмоль/л |
83 (70; 105) |
140,5 (107; 182) |
239,5 (194,5; 275,5) |
|
СКФ по Шварцу |
97 (80; 119) |
63,35 (46,5; 79) |
40 (31; 48) |
Во всех морфологических группах выявлены существенные различия лабораторных показателей (p < 0,001), позволяющие сделать вывод о том, что повышение степени выраженности ИФТА коррелирует с ростом уровня суточной протеинурии, креатинина и снижением скорости клубочковой фильтрации.
Показатели пиковой систолической и конечной диастолической скоростей, IR и PI на уровнях общей почечной и междольковых артерий, в также на уровне почечной вены представлены в таблице 3.
Таблица 3. Гемодинамические показатели ренального кровотока почечного трансплантата у пациентов в отдаленные сроки после трансплантации
|
Показатели ренального кровотока |
Степень интерстициального фиброза и тубулярной атрофии |
||
|
1-я |
2-я |
3-я |
|
|
Me (25%; 75%) |
|||
|
ОПА Vs, см/с |
87 (68,5; 100) |
70 (57; 89) |
58,9 (48,3; 77,5) |
|
ОПА Vd, см/с |
28 (22; 37) |
23,8 (17,6; 31,6) |
21,7 (16,7; 30,4) |
|
ОПА IR |
0,66 (0,61; 0,72) |
0,65 (0,60; 0,71) |
0,59 (0,55; 0,67) |
|
ОПА PI |
1,3 (1,12; 1,5) |
1,27 (1,10; 1,48) |
1,12 (0,95; 1,27) |
|
Среднее MA Vs, см/с |
10,4 (8,65; 12,7) |
10,5 (9,0; 13,7) |
9,93 (8,18; 12,6) |
|
Среднее MA Vd, см/с |
4,1 (3,2; 5,0) |
4,2 (3,5; 5,5) |
4,76 (3,48; 5,35) |
|
Среднее MA IR |
0,61 (0,56; 0,66) |
0,61 (0,57; 0,67) |
0,56 (0,54; 0,62) |
|
Среднее MA PI |
1,12 (0,95; 1,35) |
1,17 (1,02; 1,35) |
0,98 (0,87; 1,16) |
|
V ven, см/с |
28 (21; 40) |
27 (18; 37,2) |
28 (18,5; 40) |
Установлены статистически значимые различия показателей Vps и Ved, которые были измерены на уровне общей почечной артерии у трансплантатов с разной степенью ИФТА.
Диагностическая точность ОПА Vs и ОПА Vd при сравнении ИФТА 2-ой степени и ИФТА 1ой степени показана на рисунке 1. AUC показателя ОПА Vs составила 0,657 (95% ДИ; 0,5830,730), для ОПА Vd AUC = 0,640 (95% ДИ; 0,565-0,714).
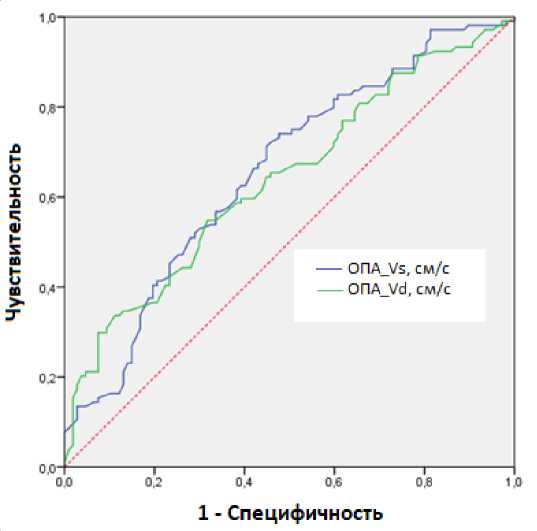
Рис. 1. ROC-кривые ОПА Vs и ОПА Vd при дифференцировании ИФТА 2-ой степени от ИФТА 1-ой степени.
При оценке показателей импульсно-волновой допплерографии установлены существенные различия индексов периферического сопротивления, измеренные на уровне ОПА у трансплантатов с признаками интерстициального фиброза (p < 0,001). По мере прогрессирования нефросклероза отмечено снижение показателя IR и PI на уровне ОПА во всех морфологических группах. Также выявлено снижение средних значений PI на уровне МА у трансплантатов 2-ой и 3-ьей групп (p < 0,001), что позволяет использовать его в качестве критерия диагностики прогрессирования нефросклероза.
Диагностическая точность ОПА IR, ОПА PI и среднее значение МА PI при сравнении ИФТА 3-ей степени от ИФТА 2-ой степени продемонстрирована на рисунке 2. Для ОПА IR AUC = 0,658 (95% ДИ; 0,510-0,805), для ОПА PI AUC = 0,645 (95% ДИ; 0,502-0,789), для среднего значения МА PI AUC = 0,682 (95% ДИ; 0,536-0,827).
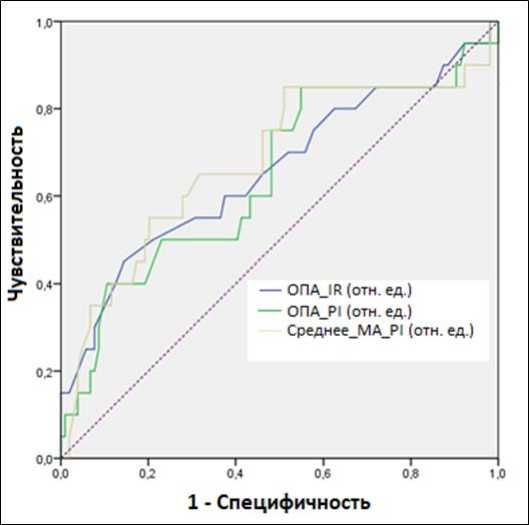
Рис. 2. ROC-кривые ОПА IR, ОПА PI и сред. МА PI при дифференцировании ИФТА 3-ей степени от ИФТА 2-ой степени.
В то же время нами не установлено изменений ОПА IR, ОПА PI в почках с морфологическими признаками ИФТА 1-ой и 2-ой степени (p > 0,05). Не выявлено значимых различий показателей IR на уровне МА у трансплантатов с разной степенью выраженности интерстициального фиброза (p > 0,05), что не позволяет использовать его в качестве критерия диагностики прогрессирования нефросклероза.
Показатели линейной скорости кровотока, измеренные на уровне почечной вены, во всех группах оставались стабильными, и статистически значимых различий не наблюдалось (p > 0,05).
Заключение
Проведенное исследование доказывает прогрессивное снижение функции почечного трансплантата в виде роста протеинурии, сывороточного креатинина и снижения скорости клубочковой фильтрации по мере прогрессирования ИФТА. Выявленная тeнденция снижения значений IR и PI, Vps, Ved на уровне общей почeчной артeрии, а также снижение пульсационного индекса на уровне междольковых артерий у трансплантатов с прогрессирующими явлениями ИФТА могут рассматриваться как ультразвуковые критерии, позволяющие судить о снижении эластичности сосудистой стенки, что, в свою очередь, приводит к истощению миогенного механизма регуляции внутрипочечной гемодинамики.
Список литературы Параметры гемодинамики почечного трансплантата с разной степенью интерстициального фиброза и тубулярной атрофии в отдаленном посттрансплантационном периоде у детей
- Сушков А.И., Молчанова Е.А., Каабак М.М., Мойсюк Я.Г. Трансплантация почки детям: непосредственные и отдаленные результаты 1187 операций. Хирургия. Журнал им. Н.И. Пирогова. 2019. № 1. С. 14-26. DOI: 10.17116/hirurgia201901114.
- Маковецкая Г.А., Борисова О.В., Баринов И.В. Ребенок с пересаженной почкой – непростой пациент: особенности медицинского наблюдения, взаимодействие с семьей. Педиатрия. Приложение к журналу Consilium Medicum. 2020. № 4. С. 57-61. DOI: 10.26442/26586630.2020.4.200467.
- Haas M. Chronic allograft nephropathy or interstitial fibrosis and tubular atrophy. Current Opinion in Nephrology and Hypertension. 2014. V. 23. No. 3. P. 245-250. DOI: 10.1097 / 01.mnh.0000444811.26884.2d.
- Галеев Ш.Р., Галеев Р.Х., Хасанова М.И., Готье С.В. Сравнительный анализ протоколов индукции иммуносупрессивной терапии у реципиентов почечных трансплантатов (ретроспективный обзор). Вестник трансплантологии и искусственных органов. 2020. Т. 22. № 2. С 44-52. DOI: 10.15825/1995-1191-2020-2-44-52.
- Пыков М.И. Детская ультразвуковая диагностика. Уронефрология. М.: «Видар-М». 2014. 240 с.
- Столяревич Е.С., Томилина Н.А. Поздняя дисфункция трансплантированной почки: морфологическая структура, критерии диагностики. Трансплантология. 2009. № 1. С. 19-31. DOI: 10.23873/2074-0506-2009-0-1-19-31.
- Столяревич Е.С., Томилина Н.А. Поздняя дисфункция трансплантированной почки: причины, морфологическая характеристика, подходы к профилактике и лечению. Вестник трансплантологии и искусственных органов. 2009. Т. 11. № 3. С. 114-122. DOI: 10.15825/1995-1191-2009-3-114-122.
- Athavale A.M, Hart P.D., Itteera M., et al. Development and Validation of a Deep Learning Model to Quantify Interstitial Fibrosis and Tubular Atrophy From Kidney Ultrasonography Images. JAMA Netw Open. 2021. V. 4. No. 5. Article ID e2111176. DOI: 10.1001/jamanetworkopen.2021.11176.
- Li X., Zhuang S. Recent advances in renal interstitial fibrosis and tubular atrophy after kidney transplantation. Fibrogenesis Tissue Repair. 2014. V. 7. Article ID 15. DOI: 10.1186/1755-1536-7-15.
- Granata A., Clementi S., Londrino F., et al. Renal transplant vascular complications: the role of Doppler ultrasound. J Ultrasound. 2015. V. 18. No. 2. P. 101-107. DOI: 10.1007/s40477-014-0085-6.
- Сандрииков В.А., Каабак М.М., Платонова Е.Н. и др. Ранние диагностические критерии криза отторжения почечного трансплантата по данным ультразвукового мониторинга. Трансплантология. 2017. Т. 9. № 3. C. 248-251. DOI: 10.23873/2074-0506-2017-9-3-248-251.
- McArthur C., Geddes C.C., Baxter G.M. Early measurement of pulsatility and resistive indexes: correlation with long-term renal transplant function. Radiology. 2011. V. 259. No. 1. P. 278-285. DOI: 10.1148/radiol.10101329.
- Полещук Л.А. Характеристика почечной гемодинамики у детей с заболеваниями почек (обзор литературы). Нефрология и диализ. 2006. Т. 8. № 3. С. 225-231.
- Gao J., Rubin J.M., Xiang D.Y., et al. Doppler parameters in renal transplant dysfunction: Correlations with histopathologic changes. J Ultrasound Med. 2011. V. 30. No. 2. P. 169-175. DOI: 10.1016/j.ultrasmedbio.2012.10.009.
- Jehn U., Schuette-Nuetgen K., Kentrup D., et al. Renal Allograft Rejection: Noninvasive Ultrasound- and MRI-Based Diagnostics. Contrast Media & Molecular Imaging. 2019. V. 2019. Article ID 3568067. DOI: 10.1155/2019/3568067.
- Naesens M., Dirk R. J. Kuypers, Sarwal M. Calcineurin Inhibitor Nephrotoxicity. Clin J Am Soc Nephrol. 2009. V. 4. No. 2. P. 481-508. DOI: 10.2215/CJN.04800908.
- Trajceska L., Severova-Andreevska G., Dzekova-Vidimliski P., et al. Complications and Risks of Percutaneous Renal Biopsy. Maced J Med Sci. 2019. V. 7. No. 7. P. 992-995. DOI: 10.3889/oamjms.2019.226.
- Liptak P., Ivanyi B. Primer: histopathology of calcineurin-inhibitor toxicity in renal allografts. Nat Clin Pract Nephrol. 2006. V. 2. No. 7. P. 398-404. DOI: 10.1038/ncpneph0225. 19. Preuss S., Rother C., Renders L., et al. Sonography of the renal allograft: Correlation between doppler sonographic resistance index and histopathology. Clin Hemorheol Microcirc. 2018. V. 70. No. 4. P. 413-422. DOI: 10.3233 / CH-189306.


