Параметры качества жизни, тяжесть симптомов и концентрация малонового диальдегида в сыворотке крови у пациентов с множественной миеломой в посттрансплантационном периоде
Автор: Жернякова А.А., Кострома И.И., Рыбакова Л.П., Алексанян Л.Р., Никитина Т.П., Порфирьева Н.М., Ионова Т.И., Бессмельцев С.С., Чечеткин А.В., Грицаев С.В.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Оригинальные статьи
Статья в выпуске: 2 т.16, 2020 года.
Бесплатный доступ
Существенное улучшение выживаемости больных множественной миеломой (ММ), которое отмечается в последние годы, является, прежде всего, результатом внедрения в клиническую практику новых лекарственных препаратов: ингибиторов протеасом, иммуномодуляторов и моноклональных антител. Другая, не менее важная, причина - включение в алгоритм лечения пациентов этапа высокодозной терапии с поддержкой гемопоэтическими стволовыми клетками, т.е. аутологичной трансплантации гемопоэтических стволовых клеток (аутоТГСК). Развитие осложнений на фоне проводимой терапии приводит к снижению качества жизни (КЖ) пациентов. Не исключена роль свободнорадикального окисления (СРО) в формировании тяжести симптомов Цель. Выявить сопряженность параметров КЖ и тяжести симптомов у пациентов с ММ в посттрансплантационном периоде с активностью СРО. Материалы и методы. Проведен ретроспективный анализ результатов обследования 24 больных с медианой возраста 58 лет. Тяжесть симптомов и КЖ оценивали по результатам заполнения опросников SF-36 и MDASI. Концентрацию малонового диальдегида (МДА) в сыворотке крови изучали колориметрическим методом [5]. Обработка данных и статистический анализ выполнялись с использованием программ Microsoft Excel 2013 и StatSoft Statistica 10. Результаты. При анализе изменений показателей КЖ выявлено ухудшение симптомов в раннем посттрансплантационном периоде с наибольшей их интенсивностью в день+7; р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Множественная миелома, аутологичная трансплантация гемопоэтических стволовых клеток, качество жизни, тяжесть симптомов, малоновый диальдегид
Короткий адрес: https://sciup.org/170172542
IDR: 170172542
Текст научной статьи Параметры качества жизни, тяжесть симптомов и концентрация малонового диальдегида в сыворотке крови у пациентов с множественной миеломой в посттрансплантационном периоде
Введение. Существенное улучшение выживаемости больных множественной миеломой (ММ), которое отмечается в последние годы, является, прежде всего, результатом внедрения в клиническую практику новых лекарственных препаратов: ингибиторов протеасом, иммуномодуляторов и моноклональных антител. Другая, не менее важная, причина — включение в алгоритм лечения пациентов этапа высоко-дозной терапии с поддержкой гемопоэтическими стволовыми клетками, т. е. аутологичной трансплантации гемопоэтических стволовых клеток (аутоТГСК) [1, 2].
Современный алгоритм лечения пациентов с ММ предполагает обязательную стратификацию пациентов на группы риска и решение вопроса о возможности проведения аутоТГСК. Такой подход позволяет для пациентов с минимальной коморбидностью и сохранным соматическим статусом подобрать адекватную схему терапии, спланировать длительность индукционной терапии, определить сроки проведения аутоТГСК в качестве консолидации полученного ответа и инициировать поддерживающую терапию. Аутологичная ТГСК в настоящее время является стандартом терапии пациентов с ММ [1, 2].
differences between pts with and without MDA level decrease.
Conclusion. Detected association between symptom severity decrease and MDA level decrease may be used as an important rationale for clinical application of supportive therapy with anti-oxidant activity in post-transplantation period.
Эффективность аутоТГСК зависит от большого количества пред- и посттрансплантационных факторов. Немаловажным является вариант индукционной терапии, сроки выполнения аутоТГСК. Первоочередную роль играет режим предтрансплантационной подготовки (режим кондиционирования), интенсивность которого определяет степень редукции объема патологического клона. Эффективность высо-кодозной химиотерапии обусловлена чувствительностью клональных клеток к мелфалану, который используется в качестве стандарта предтрансплантационной подготовки, что сопровождается существенным снижением объема патологического клона. Развивающаяся одновременно с этим аплазия костного мозга является показанием для инфузии ГСК, способствующих быстрому и надежному восстановлению кроветворения, что предупреждает развитие инфекционных и/или геморрагических осложнений.
Вместе с тем,несмотря на достигнутые результаты, ММ остается неизлечимым заболеванием, т. е. характеризуется сменяемостью периодов снижения активности патологического процесса и прогрессирования заболевания. Следствием этого является необходимость постоянного клинико-лабораторного мониторинга и длительного лечения с эпизодами госпитализаций для внутривенных инфузий лекарственных препаратов, нарушение функции жизненно важных органов и, прежде всего, почек, персистирование и/или возобновление оссалгий, увеличение частоты и тяжести побочных эффектов от специфической терапии, включая периферическую нейропатию, инфекционные и тромботические осложнения. К неблагоприятным последствиями следует также отнести глубокую инвалидизацию пациентов со снижением социальной и физической активности. Тем самым, вполне оправданным представляется акцент на то,что целью лечения пациентов с ММ должно быть не только увеличение длительности беспрогрессивной и общей выживаемости,но и одновременное улучшение качества жизни (КЖ) и снижение проявлений симптомов заболевания [3].
Несомненно,развитие осложнений на фоне терапии приводит к снижению качества жизни (КЖ) пациентов. Вполне закономерно было бы рассматривать достижение ответа как принципиальное условие повышения КЖ пациентов с ММ. Тем не менее, в большинстве исследований не удалось продемонстрировать улучшения отдельных показателей КЖ и снижения тяжести симптомов после успешной терапии и/или выполнения аутоТГСК [4]. Не исключено, что отсутствие ожидаемого эффекта отчасти может быть обусловлено также продуктами свободнорадикального окисления (СРО), инициированного медикаментами, назначаемыми в индукционном,пред- и посттрансплантационном периодах и входящими, в частности, в состав режима кондиционирования. Исходя из этого предположения,вполне оправданным может быть назначение антиоксидантных препаратов (АОП) для снижения тяжести симптомов и улучшения КЖ после высокодозной терапии, каковой является аутоТГСК. Таким образом, наибольший интерес представляет выявление сопряженности динамики показателей КЖ, тяжести симптомов ММ и показателей СРО.
Цель исследования. Выявить сопряженность КЖ и тяжести симптомов с содержанием малонового диальдегида (МДА) в сыворотке крови больных ММ в посттрансплантационном периоде и выделить клинико-гематологические показатели,ассоциированные с персистированием повышенной концентрации МДА, которые возможно было бы использовать в ка- честве критериев, свидетельствующих о целесообразности начала терапии АОП.
Материалы и методы. Проанализированы результаты обследования 24 больных ММ, из которых 9 (37,5 %) мужчин и 15 (62,5 %) женщин в возрасте от 44 до 66 лет, медиана 58 лет. Миелома G, А и Бенс-Джонса установлены у 12 (50,0 %), 9 (37,5 %) и 3 (12,5 %) больных соответственно. В дебюте заболевания миеломная нефропатия была диагностирована у 8 (33,3 %) больных, деструкция костей с помощью рентгенографии выявлена у 22 (91,7 %) больных.
В индукционном периоде все больные (100,0 %) получали лечение по схемам с бор-тезомибом (PAD, CVD, VD). В связи с отсутствием ответа 10 (41,7 %) больных в последующем были переведены на схемы,включающие леналидомид: RVD и/или KRD.
Оценка КЖ и заготовка крови были проведены у 16 (66,7 %) больных во время первой и у 8 (33,3 %) — при повторной аутоТГСК.
Режим кондиционирования с введением ал-керана в дозе 200 мг/м2 был использован у 11 (45,8 %) больных: у 9 при первой и у 2 при повторной аутоТГСК. Мелфалан в дозе 140 мг/м2 получили 9 (37,5 %) больных: четверо при первой и пятеро при повторной трансплантации. Комбинация мелфалана с тиотепой была назначена 4 (16,7 %) больным: трем при выполнении первой и одному при повторной аутоТГСК.
Перед проведением трансплантации полный (ПО), очень хороший частичный (ОХЧО) и частичный (ЧО) ответы были констатированы у 9 (37,5 %), 5 (20,8 %) и 10 (41,7 %) больных соответственно.
Девятнадцати (79,1 %) больным в посттрансплантационном периоде однократно назначалась подкожная инъекция пегилированного гранулоцитарного колониестимулирующего фактора (Г-КСФ) в дозе 6 мг. Другим 5 (20,9 %) больным ростовые факторы не вводились.
Для оценки сроков приживления трансплантата использованы следующие критерии. Абсолютное число нейтрофилов (АЧН) ≥ 0, 5 × 109/л, сохраняющееся в течение трех последовательных дней. Содержание в крови тромбоцитов ≥ 20 × 109/л в течение не менее трех последовательных дней без трансфузий тромбоконцентрата в течение предшествующих 5–7 дней.
Для оценки КЖ и тяжести симптоматики больные самостоятельно заполняли общий опросник оценки качества жизни — RAND SF-36 и общий опросник оценки симптомов у онкологических больных — MDASI до проведения аутоТГСК и в сроки Д+1, Д+7 и Д+30. Также провели сравнительный анализ показателей качества жизни по опроснику SF-36 у больных с рефрактерной ММ до аутоТГСК с показателями условно-здоровых респондентов,соответствующих по полу и возрасту группе больных (данные популяционного исследования качества жизни, n = 11).
Концентрацию МДА в сыворотке крови изучали колориметрическим методом [5]. Заполнение опросников и заготовку крови осуществляли до режима кондиционирования, в период максимального снижения АЧН и при выписке больного из стационара.
Обработка данных и статистический анализ выполнялись с использованием программ Microsoft Excel 2013 и StatSoft Statistica 10. Статистический анализ проводили с использованием парного t-критерия, критерия Манна-Уитни (в зависимости от распределения данных) и критерия Вилкоксона. Корреляции анализировали с помощью коэффициента Спирмена. Для оценки различий выраженности симптомов проводили расчет величины эффекта — effect size, ES. Величина эффекта — разность между средними показателями, деленная на стандартное отклонение. Выделялись следующие градации величины эффекта: малый — 0,2 ≤ ES < 0,5; средний — 0,5 ≤ ES < 0,8 и большой эффект — ES ≥ 0,8.
Результаты. До проведения аутоТГСК показатели качества жизни у больных ММ значительно снижены по сравнению с контрольной группой условно-здоровых респондентов (n = 22). Статистически значимые различия получены для шкал опросника RAND SF-36 физическое функционирование (p < 0,001), ролевое физическое функционирование (p < 0,05) и социальное функционирование (p < 0,05) ( таблица 1 и рисунок 1 ).
До аутоТГСК все пациенты испытывали симптомы;при этом симптомы с выраженностью 4 и более баллов испытывали 50 % пациентов. Самые часто встречающиеся умеренно или значительно выраженные симптомы — слабость (у 37 % пациентов), онемение (у 37 % пациентов) и нарушение сна (у 24 % пациентов). В раннем посттрансплантационном периоде выявлено ухудшение симптомов. При этом наиболее интенсивными симптомы были в день +7; р < 0,0001. Среднее значение индекса симптомов в этот день составило 2,5 против 1,6 до трансплантации; p < 0,002. Наряду с этим в большей степени имело место нарастание сонливости (величина эффекта ES = 0,6), слабости (величина эффекта ES = 0,56), сухости во рту (величина эффекта ES = 0,57), нарушения аппетита (ES = 0,74) и тошноты (ES = 1,17).
Таблица 1.
|
Шкалы SF-36 |
Больные ММ, n = 22 |
Группа сравнения, n = 22 |
p |
||
|
Сред. знач. |
Станд. откл. |
Сред. знач. |
Станд. откл. |
||
|
ФФ |
52,50 |
28,48 |
87,42 |
10,46 |
p < 0,001 |
|
РФФ |
28,41 |
42,47 |
67,05 |
33,08 |
0,003 |
|
Б |
57,36 |
26,11 |
71,86 |
23,05 |
0,055 |
|
ОЗ* |
54,14 |
20,79 |
62,04 |
15,09 |
0,163 |
|
Ж* |
56,29 |
24,33 |
63,41 |
16,21 |
0,260 |
|
СФ |
57,95 |
29,01 |
80,68 |
15,30 |
0,005 |
|
РЭФ |
50,00 |
45,72 |
69,70 |
36,96 |
0,170 |
|
ПЗ |
68,86 |
18,91 |
61,55 |
15,42 |
0,225 |
Показатели качества жизни больных ММ до аутоТГСК и в контрольной группе
* Использовался t-критерий Стьюдента, для остальных — непараметрический критерий Манна-Уитни.
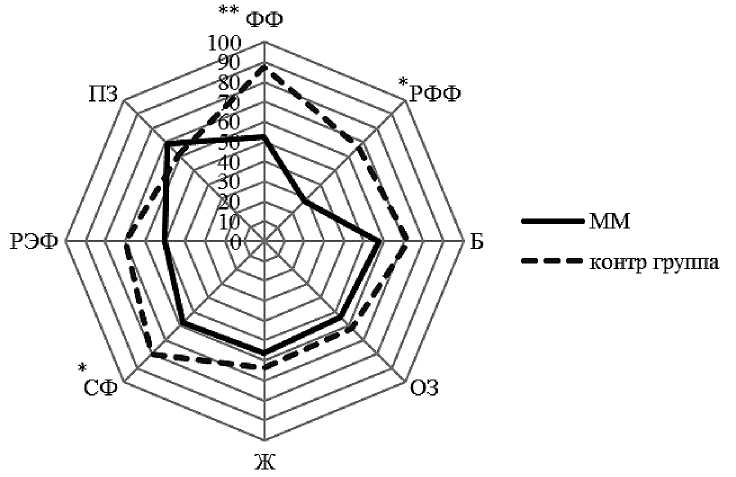
Рисунок 1. Показатели качества жизни у больных рефрактерной ММ в сравнении с контрольной группой по шкалам опросника SF-36.
Примечание . ФФ — физическое функционирование,РФФ — ролевое физическое функционирование, Б — боль, ОЗ — общее здоровье; Ж — жизнеспособность, СФ — социальное функ-ционирование,РЭФ — ролевое эмоциональное функционирование,ПЗ — психическое здоровье; *p < 0,05; **p < 0,001.
Уровень МДА был повышенным до аутоТГСК у всех больных: 15,0 +/–6,97мкмоль/л при норме < 1,2 × 104 мкмоль/л.
После трансплантации у 9 (37,5 %) больных наблюдалось снижение уровня МДА в среднем на 3,3 мкмоль/л. У этих пациентов индекс выраженности симптомов уменьшился незначительно (всего на 0,3, p > 0,05).
У остальных 15 (62,5 %) больных уровень МДА после аутоТГСК возрос в среднем на 4, 3 мкмоль/л. Одновременно у данной группы больных в среднем на 1, 5 балла увеличился индекс выраженности симптомов (p < 0,05), что нашло отражение в обнаружении корреляции между уровнем МДА и интенсивностью симптомов: rs = 0,44; p = 0,02.
Для выявления факторов, ассоциированных со снижением уровня МДА и тяжести симптомов в посттрансплантационном периоде, были проанализированы клинико-гематологические показатели больных со снижением (группа 1, n = 9) и без снижения (группа 2, n = 15) уровня МДА (таблица 2) .
Как видно из данных, представленных в таблице 2 , больных миеломой G больше в группе
2 (60 % против 33,3 %), а больных миеломой А — в первой группе (66,7 % против 20 %; р = 0, 056).
Число больных с ПО было больше в группе без снижения уровня МДА в посттрансплантационном периоде: 46,7 % против 22,2 % в группе со снижением МДА. Напротив,ОХЧО был зарегистрирован преимущественно в группе больных со снижением уровня МДА: 33,3 % против 12,3 % соответственно. В группе больных, у которых было зарегистрировано снижение уровня МДА, чаще назначался режим кондиционирования с введением мелфалана в дозе 200 мг/м2 (66,7 %), а в группе без снижения — преимущественно режим Mel120 (46,7 %). Различие по двум из вышеприведенных показателей не достигало значимых величин.
По другим показателям,включая применение леналидомида и карфилзомиба в индукционном периоде, число выполненных трансплантаций,назначение Г-КСФ и сроки приживления трансплантата, а также частоту инфекционных осложнений и потребность в трансфузиях компонентов крови,различий не выявлено.
Таблица 2.
Клинико-гематологические показатели больных ММ в зависимости от динамики уровня МДА в посттрансплантационном периоде
|
Показатели, n ( %) |
Группа 1 n = 9 |
Группа 2 n = 15 |
р |
|
Возраст, Ме (диапазон), лет |
59 (44–66) |
55 (44–66) |
|
|
Миелома G |
3 (33,3) |
9 (60,0) |
0,056 |
|
Миелома А |
6 (66,7) |
3 (20,0) |
|
|
Миелома Бенс-Джонса |
— |
3 (20,0) |
|
|
Почечная нефропатия |
2 (22,2) |
6 (40,0) |
|
|
Леналидомид до аутоТГСК |
3 (33,3) |
7 (46,7) |
|
|
Карфилзомиб до аутоТГСК |
1 (11,1) |
3 (20,0) |
|
|
Полный ответ |
2 (22,2) |
7 (46,7) |
|
|
Очень хороший частичный ответ |
3 (33,3) |
2 (12,3) |
|
|
Частичный ответ |
4 (44,4) |
6 (40,0) |
|
|
Первая аутоТГСК |
7 (77,8) |
9 (60,0) |
|
|
Повторная аутоТГСК |
2 (22,2) |
6 (40,0) |
|
|
Режим кондиционирования «Mel200» |
6 (66,7) |
5 (33,3) |
|
|
Режим кондиционирования «Mel140» |
2 (22,2) |
7 (46,7) |
|
|
Режим кондиционирования «Thio/Mel» |
1 (11,1) |
3 (20,0) |
|
|
Г-КСФ после аутоТГСК |
7 (77,8) |
12 (80,0) |
|
|
День максимального снижения лейкоцитов, Ме (диапазон) |
5 (3–8) |
6 (3–8) |
|
|
Без лихорадки после аутоТГСК |
4 (44,4) |
6 (40,0) |
|
|
Фебрильная нейтропения |
1 (11,1) |
1 (6,7) |
|
|
Инфекционные осложнения |
1 (11,1) |
1 (6,7) |
|
|
Потребность в донорских эритроцитах |
— |
1 (6,7) |
|
|
Потребность в тромбоконцентрате |
9 (100) |
15 (100) |
|
|
Число доз тромбоконцентрата, Ме (диапазон) |
2 (1–3) |
2 (1–7) |
|
|
День восстановления АЧН, Ме (диапазон) |
10 (9–17) |
10 (9–15) |
|
|
День восстановления тромбоцитов, Ме (диапазон) |
13 (11–15) |
13 (10–20) |
|
|
Койко/дни от аутоТГСК до выписки, Ме (диапазон) |
17 (12–20) |
16 (12–24) |
Обсуждение. Проведенное исследование по количеству и составу больных является пилотным. Тем не менее,предварительные данные, а именно обнаруженная зависимость интенсивности симптомов от концентрации МДА,дают основание рассматривать СРО как одну из принципиальных, в данном случае — биохимическую, составляющих, которые формируют субъективный статус пациентов с ММ после аутоТГСК.
Несмотря на тот факт, что снижение уровня МДА в посттрансплантационном периоде было зафиксировано приблизительно у 40 % из 24 обследованных больных, представляется важным попытаться выделить их клинико-гематологические особенности, а также охарактеризовать больных из группы без снижения такового. Это послужило бы основанием для модификации исследовательского протокола путем дифференцированного назначения АОП.
Однако при сравнительном анализе доступных клинических и лабораторных данных не было установлено достоверной разницы между отдельными показателями, что, вероятно, является следствием малочисленности больных в исследовании. Этим же, возможно, объясняется и находка о преимущественном снижении уровня МДА в посттрансплантационном периоде у больных с продукцией моноклонального иммуноглобулина А, что на данном этапе исследования не может быть интерпретировано корректно (таблица 2) .
Не вызывает сомнения,что динамическая оценка качества жизни у больных хроническими онкогематологическими заболеваниями, к которым относится и ММ, должна быть обязательным элементом алгоритма обследования и лечения. Речь идет, в частности, о выборе лечебной опции для больных с далеко зашедшими рецидивными и рефрактерными вариантами ММ, когда поддержание достойного качества жизни при проведении сдерживающей низкотоксичной терапии может быть предпочтительнее тяжелых жизнеугрожающих осложнений при достижении краткосрочного ответа после агрессивных схем лечения. Более того, по мнению отдельных авторов, КЖ необходимо рассматривать в качестве основной цели клинических исследований [3]. Данный подход вполне оправдан и при выполнении аутоТГСК, когда улучшение качества жизни после высокодозной химиотерапии может послужить одним из условий для инициации сдерживающей терапии.
Качество жизни больных ММ — интегральный показатель,в формировании которого принимают участие факторы, ассоциированные как непосредственно c больным (возраст) и заболеванием,так и с проводимым лечением. Это болевой синдром по причине костных деструкций и нарушение функции почек из-за их поражения, а также осложнения, обусловленные специфической терапией и/или снижением показателей крови на фоне лечения [6]. Тем самым, вполне ожидаемым является предположение о возможном улучшении качества жизни и снижении интенсивности симптомов заболевания в случае достижения клинико-гематологического ответа [7–13]. Наряду с противомиеломным лечением немаловажную роль играет и сопутствующая терапия, назначение которой позволяет минимизировать, а в ряде случаев и полностью нивелировать негативные клинические проявления болезни и побочные эффекты лекарственных препаратов, как, например, периферическая нейропатия [14, 15]. Последний тезис мотивирован непосредственным влиянием тяжести симптомов на КЖ больных ММ. Так Jordan K. с соавт. [9] у больных с симптомами тяжелой и умеренной степени тяжести было обнаружено снижение качества жизни на 19 и 12 пунктов соответственно по сравнению с больными без симптомов. Jurczyszyn A. с соавт. [16] продемонстрировали значимое улучшение качества жизни больных ММ,которым с обезболивающей целью была выполнена вертебропластика. В то же время, по результатам анализа данных 21 больного симптоматической миеломой Sloot S. с соавт. [6] выявили, что 8 (38 %) больных связали ухудшение глобального качества жизни с осложнениями от применения анальгетиков, которые были представлены преимущественно в виде запоров, головокружения и усталости/ слабости.
Аутологичная ТГСК — это высокодозная химиотерапия, целью проведения которой является снижение объема клеток патологического клона. Осложнения аутоТГСК являются причиной ухудшения качества жизни больных в посттрансплантационном периоде. Это проявляется в виде усиления слабости и снижения физического функционирования, которые нередко персистируют до одного года, но не обязательно трансформируются в ухудшение глобального качества жизни [4].
В ряде исследований было продемонстрировано, что ухудшение качества жизни обусловлено нарушениями цитокинового статуса [17, 18]. Так, например, Pereira N. с соавт. [17] при анализе данных 82 больных, включая 23 больных ММ, обнаружили сопряженность концентрации интерлейкина-6 (ИЛ-6) с высокими, худшими, показателям по шкале PROMS (Patient-Reported Oral Mucositis Symptom), с помощью которой оценивали степень выраженности ощущений в ротовой полости при развитии мукозита после аутоТГСК. В свою очередь Boland E. с соавт. [18] выявили положительную корреляцию уровня ИЛ-6 в сыворотке крови с болью, бессонницей и потерей аппетита и, напротив, обратную корреляцию с физическим функционированием. Причина обнаруженной ассоциации не совсем ясна, однако, принимая во внимание роль ИЛ-6 в патогенезе ММ, нельзя исключить значение активности заболевания.
Заключение. Совокупность результатов собственного исследования с данными литературы позволяют высказать предположение о комплексном характере механизма формирования интенсивности симптомов после аутоТГСК, в котором наряду с изменением уровня цитокинов принимает участие и СРО. Тем самым вполне оправданным представляется назначение АОП в посттрансплантационном периоде. Учитывая небольшой процент пациентов с ММ, у которых было обнаружено снижение уровня МДА после выполнения аутоТГСК, отсутствие у них специфических клинико-гематологических характеристик и сохранность минимальных проявлений симптомов,назначение АОП может быть элементом сопутствующей терапии всем без исключения пациентам с ММ. Таким образом, коррекция сопутствующей терапии позволит снизить негативное влияние заболевания на КЖ пациентов.
Список литературы Параметры качества жизни, тяжесть симптомов и концентрация малонового диальдегида в сыворотке крови у пациентов с множественной миеломой в посттрансплантационном периоде
- Бессмельцев С. С., Абдулкадыров К. М. Множественная миелома: руководство для врачей. М.: МК, 2016.
- Менделеева Л. П., Вотякова О. М., Покровская О. С. и др. Национальные клинические рекомендации по диагностике и лечению множественной миеломы. Гематология и трансфузиология. 2016; 61 (1, Прил. 2): 1–24.
- Kvam A. K., Waage A. Health-related quality of life in patients with multiple myeloma — does it matter?
- Haematologica. 2015; 100(6): 704–705.
- Royle K. L., Gregory W. M., Cairns D. A. et al. Quality of life during and following sequential treatment of previously untreated patients with multiple myeloma: findings of the Medical Research Council Myeloma IX randomised study. Br J Haematol. 2018; 182(6): 816–829.
- Арутюнян А. В., Дубинина Е. Е., Зыбина Н. Н. Методы оценки свободнорадикального окисления и антиоксидантной системы организма. СПб., 2000.
- Sloot S., Boland J., Snowden J. A. et al. Side effects of analgesia may significantly reduce quality of life in symptomatic multiple myeloma: a cross-sectional prevalence study. Support Care Cancer. 2015; 23(3): 671–678.
- Balderas-Pena L. M., Miranda-Ruvalcaba C., Robles-Espinoza A. I. et al. Health-related quality of life and satisfaction with health care: relation to clinical stage in Mexican patients with multiple myeloma. Cancer Control. 2019; 26(1): 1–8.
- Osborne T. R., Ramsenthaler C., de Wolf-Linder S. et al. Understanding what matters most to people with multiple myeloma: a qualitative study of views on quality of life. BMC Cancer. 2014; 14: 496.
- Jordan K., Proskorovsky I., Lewis P. et al. Effect of general symptom level, specific adverse events, treatment patterns, and patient characteristics on health-related quality of life in patients with multiple myeloma: results of a European, multicenter cohort study. Support Care Cancer. 2014; 22(2): 417–426.
- Abonour R., Wagner L., Durie B. G. M et al. Impact of post-transplantation maintenance therapy on health- related quality of life in patients with multiple myeloma: data from the Connect® MM Registry. Ann Hematol. 2018; 97(12): 2425–2436.
- Dimopoulos M. A., Palumbo A., Hajek R. et al. Factors that influence health-related quality of life in newly diagnosed patients with multiple myeloma aged ≥ 65 years treated with melphalan, prednisone and lenalidomide followed by lenalidomide maintenance: results of a randomized trial. Leuk Lymphoma. 2014; 55(7): 1489–1497.
- Ludwig H., Moreau P., Dimopoulos M. A. et al. Health-related quality of life in the ENDEAVOR study: carfilzomib- dexamethasone vs bortezomib-dexamethasone in relapsed/refractory multiple myeloma. Blood Cancer J. 2019; 9(3): 23.
- Despiеgel N., Touboul C., Flinois A. et al. Health-related quality of life of patients with multiple myeloma treated in routine clinical practice in France. Clin Lymphoma Myeloma Leuk. 2019; 19(1): e13-e28.
- Wagner L. I., Robinson D. Jr., Weiss M. et al. Content development for the Functional Assessment of Cancer Therapy-Multiple Myeloma (FACT-MM): use of qualitative and quantitative methods for scale construction. J Pain Symptom Manage. 2012; 43(6): 1094–1104.
- Ramsenthaler C., Osborne T. R., Gao W. et al. The impact of disease-related symptoms and palliative care concerns on health-related quality of life in multiple myeloma: a multi-centre study. BMC Cancer. 2016; 16: 427.
- Jurczyszyn A., Czepko R., Banach M. et al. Percutaneous vertebroplasty for pathological vertebral compression fractures secondary to multiple myeloma — medium-term and long-term assessment of pain relief and quality of life. Adv Clin Exp Med. 2015; 24(4): 651–656.
- Pereira N. F., Silva P. V. R. D., Fukuoka C. Y. et al. Measurement of oral health quality of life among patients who underwent haematopoietic stem-cell transplantation. Braz Oral Res. 2018; 32: e78
- Boland E., Eiser C., Ezaydi Y. et al. Living with advanced but stable multiple myeloma: a study of the symptom burden and cumulative effects of disease and intensive (hematopoietic stem cell transplant-based) treatment on health-related quality of life. J Pain Symptom Manage. 2013; 46(5): 671–680.


