Патологоанатомический случай послекастрационных осложнений у барана
Автор: Баруздина Е.С., Морозова О.В., Логинова А.А.
Журнал: Молочнохозяйственный вестник @vestnik-molochnoe
Рубрика: Сельскохозяйственные и ветеринарные науки
Статья в выпуске: 3 (55), 2024 года.
Бесплатный доступ
Произведено патологоанатомическое вскрытие барана, павшего после проведенной кастрации открытым методом. Кроме этого, проводили гематологическое и копроовоскопическое исследование всех баранов одного возраста и условий содержания перед кастрацией (n = 4). В результате работы заключили, что обычная для кастрации открытым методом кровопотеря привела прооперированного барана к остановке дыхания и сердцебиения, а затем и к смерти из-за тяжелой нормохромной анемии. Анемия, связанная с инвазией нематод семейства Strongyloididae, регистрировалась у всех прооперированных животных, однако ее клинические проявления были менее выражены. У погибшего барана кроме нематод семейства Strongyloididae были обнаружены нематоды семейства Trichocephalidae, что в комплексе, стало причиной более тяжелого состояния и летального исхода.
Послекастрационные осложнения, овцы, анемия, нематоды, стронгилоидоз, трихоцефалез
Короткий адрес: https://sciup.org/149146371
IDR: 149146371 | УДК: 619:616.617 | DOI: 10.52231/2225-4269_2024_3_55
Текст научной статьи Патологоанатомический случай послекастрационных осложнений у барана
Кастрация является наиболее часто проводимой хирургической операцией, выполняемой в ветеринарной практике с целью коррекции поведения самцов, не предназначенных для разведения, для облегчения и улучшения их использования [1–4]. Послекастрационные осложнения обычно возникают вследствие нарушения техники операции, несоблюдения правил асептики и антисептики, плохого послеоперационного ухода за животными. Их принято подразделять на ранние (кровотечение, выпадение сальника, кишок, мочевого пузыря, общей влагалищной оболочки, культи семенного канатика) и поздние (вагиналиты, флегмоны, фуникулиты, гранулемы, абсцессы, перитониты и др.) [1]. Кровотечения при кастрации могут быть первичными, т. е. обнаруженными во время самой операции; вторичными – спустя некоторое время после операции, поздними – через несколько дней после кастрации. Основной причиной данного осложнения могут быть нарушениятехникикастрации,использованиенеисправногоинструмента и реже дряблость семенного канатика, слабая свертываемость крови, склероз кожи мошонки, варикозное расширение вен [2]. Однако в нашем случае кровотечение было стандартным для кастрации открытым методом, воспаление отсутствовало. Прооперированный баран успешно вышел из наркоза, но вечером того же дня погиб.
Цель работы – с помощью патологоанатомического вскрытия выяснить этиологию и патогенез осложнений у барана, павшего после кастрации открытым методом.
Задачи
-
1. Провести предоперационное гематологическое исследование баранов одного возраста и условий содержания.
-
2. Исследовать кал на паразитологию у баранов одного возраста и условий содержания.
-
3. Провести внешний осмотр трупа павшего барана.
-
4. Произвести вскрытие основных полостей трупа и осмотр внутренних органов.
-
5. Провести анализ полученных данных и составить заключение.
Материал и методы исследования
Работа выполнена в 2023–2024г. в Вологодской ГМХА имени Н.В. Верещагина. Объект исследования – баран в возрасте 6 месяцев, романовской породы, вес 30 кг. Рацион – сено (разнотравье) утром и вечером, замоченный комбикорм, вечером – овощи. Поение: водопроводная вода из автопоилки. Поведение активное, пробует делать садки, аппетит хороший, стул в норме, но не набирает вес и имеет бледные слизистые оболочки. Дегельминтизация проводилась в сентябре2023 г.
Гематологическое исследование проводили у всех баранов
(всего n = 4, погибший баран n = 1, выжившие бараны n = 3) одного возраста и условий содержания до кастрации. Определение количества гемоглобина проводилось гемоглобинцианидным методом на фотоэлектроколориметре [5]. Подсчёт лейкоцитов и эритроцитов проводился ручным способом в камере Горяева. Для составления лейкоцитарной формулы были приготовлены мазки цельной крови, окрашенные по Паппенгейму (Май-Грюнвальд-Гимза).
У всех кастрированных баранов (всего n = 4, погибший баран n= 1, выжившие бараны n = 3) мы отобрали пробы кала. Копроовоскопическое исследование проводили методом седиментации (последовательных промываний).
Кастрация проводилась четырем баранам одного возраста, кровавым открытым способом с полным удалением семенников и придатков на лигатуру [4]. Бараны были зафиксирован в крестцово-спинном положении. Шерстный покров на мошонке по линии разреза тщательно выстригли и обработали кожу 5%-м спиртовым раствором йода. В мошонку и толщу семенника ввели по 10 мл 3%-го раствора новокаина. Захватив левой рукой мошонку, напрягли ее на семеннике, затем был произведен разрез всех слоев мошонки разом брюшистым скальпелем, после чего рассекли общую влагалищную оболочку. Семенник извлекли из полости, легко надавив на мошонку, рассекли влагалищную связку. На семенной канатик наложили прочную лигатуру как можно ближе к наружному паховому кольцу, на расстоянии 2 см ниже лигатуры семенной канатик отсекли скальпелем. Края мошонки сблизили наложением по одному стежку узловатого шва, оставив центр раны открытым для стока крови и лимфы. Рану обработали антибактериальным спреем Террамицином. Три прооперированных барана выжили и составили контрольную группу, один погиб.
Смерть барана произошла вечером в течение суток после операции. Вскрытие производилось в секционнном зале факультета ветеринарной медицины и биотехнологий ВГМХА им. Н.В. Верещагина. После внешнего осмотра был проведен разрез кожи скальпелем по белой линии живота от подбородка до лонной кости, и проведено частичное снятие шкуры. Сначала проводилось вскрытие брюшной полости, затем грудной полости. Органы отделялись от туши и исследовались отдельно. Проводилась письменная фиксация обнаруженных изменений в протокол вскрытия, а также фотофиксация на камеру телефона Redmi Note 9.
Полученные в ходе исследования результаты обрабатывались с помощью программы Windows Exсel 2013. Значения полученных результатов контрольной группы представлены в виде средней величины и стандартной ошибки средней (M ± m). Сравнение между собой данных проводилось с применением критерия Стьюдента. Уровень значимости устанавливался равным 0,05.
Результаты собственных исследований
Гематологическое исследование
Клиническое исследование крови баранов показало, что у всех животных пониженное количество эритроцитов и гемоглобина, что может быть оценено как нормоцитарная нормохромная анемия. Однако у погибшего барана количество эритроцитов и гемоглобина достоверно ниже (p ≤ 0,05, p ≤ 0,01), что позволяет диагностировать анемию тяжелой степени. Кроме того, у погибшего барана выявлен сильный лейкоцитоз (p ≤ 0,01; табл. 1 ).
Таблица 1 – Гематологические показатели исследуемых животных
|
Показатель |
Погибший, n=1 |
Выжившие, n=3 |
Норма [6] |
|
Лейкоциты, WBC, 109/л |
28* |
8,72± 1,39 |
4-12 |
|
Гемоглобин, HGB, г/л |
39* |
76,14± 5,81 |
70-110 |
|
Эритроциты, RBC, 1012 /л |
4** |
6,806± 0,61 |
7,5-12,5 |
|
* Различия с аналогичным показателем контрольной группы достоверны (p ≤ 0,01). ** Различия с аналогичным показателем контрольной группы достоверны (p ≤ 0,05). |
|||
В норме у овец, как у других жвачных животных, лимфоцитарный профиль [5, 6], что показывают выжившие бараны из контрольной группы выживших (табл. 2).
Таблица 2 – Лейкограмма исследуемых животных, 109/л
|
Лейкоциты |
Результат |
Норма[6] |
|
|
Погибший, n = 1 |
Выжившие, n = 5 |
||
|
Базофилы |
0** |
0,0364±0,02 |
Редко |
|
Эозинофилы |
2,28** |
1,95±1,8 |
0,1-0,75 |
|
Сегментоядерные нейтрофилы |
15,9** |
3,97±0,87 |
1,0-5,0 |
|
Палочкоядерные нейтрофилы |
0,84** |
0,077±0,05 |
- |
|
Лимфоциты |
10,08** |
4,5±0,72 |
2,0-9,0 |
|
Моноциты |
0,84** |
0 |
0-0,75 |
|
** Различия с аналогичным показателем контрольной группы достоверны (p≤0,05). |
|||
В нашем случае у павшего барана по результатам прижизненной лейкограммы наблюдается нейтрофильный профиль – нейтрофилез, лимфоцитоз, моноцитоз и эозинофилия, что достоверно отличается от показателей баранов контрольной группы выживших (p≤0,05). Эозинофилия вероятнее всего связана с паразитарными заболеваниями. Лимфоцитоз в данном случае может быть вызван интоксикацией.
Мы также определили ядерный индекс по результатамлейкограммы. Ядерный индекс – соотношение количества нейтрофилов различной степени зрелости, оцененной по структуре их ядер [5]. В норме индекс колеблется от 0,06 до 0,1 [7, 8]. У павшего барана он составил 0,05, что несколько меньше нижней границы нормы. Это отражает снижение количества молодых нейтрофилов с преобладанием сегментоядерных, так называемый ядерный сдвиг вправо. Возникает он, как правило, при угнетении миелопоэза, функциональном угнетении костного мозга, встречается после кровопотери, у старых и истощенных животных.
Копроовоскопическое исследование
При копроовоскопическом исследовании животных обнаружены яйца нематод рода Strongyloides семейства Strongyloididae во всех образцах (рис. 1а) , и род Trichocephalus семейства Trichocephalidae только у павшего барана (рис. 1б) . Попытка инкубации не была успешна, поэтому точный вид стронгилят не был установлен.
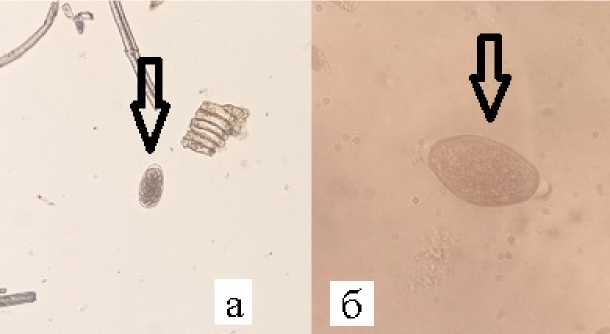
Рисунок 1 – а) яйцо нематоды семейства Strongyloididae, б) яйцо нематоды семейства Trichocephalidae
Патологоанатомическое исследование
Труп барана, возраст 6 месяцев, окрас серый, нос черный, самец, упитанность хорошая, телосложение правильное. Конъюнктива глаз молочно-белого цвета (рис. 2) , слизистые оболочки ротовой полости молочно-белого цвета, кожа и подкожная клетчатка очень бледного цвета, на мошонке разрез красного цвета, швы сохранены, с корочкой засохшей крови, в области мошонки кровоизлияния. Мышцы и сухожилия бледно-розового цвета.
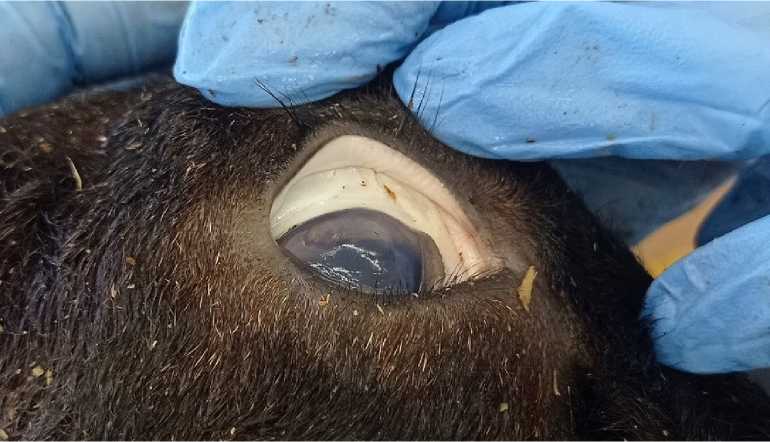
Рисунок 2 – Конъюнктива погибшего барана
Печень бледно коричневого цвета, в желчном пузыре бледножёлтое содержимое, поджелудочная железа бледно-розового цвета.
Селезёнка плоская, сморщенная, тестоватой консистенции, края острые, длина 11 см, ширина 7,5 см, истонченная, что может быть обусловлено анемией (рис. 3а).
Почки дряблые, капсула легко снимается, мозговой и корковый слой хорошо разделены: мозговой слой кремового цвета, корковый бледно-коричневого цвета (рис. 3б) , в мочевых путях моча бледно окрашена. Надпочечники бобовидной формы, бледно коричневые.
На семенных канатиках лигатура сохранена, ниже на культе кровоизлияния, прижизненный сгусток крови.
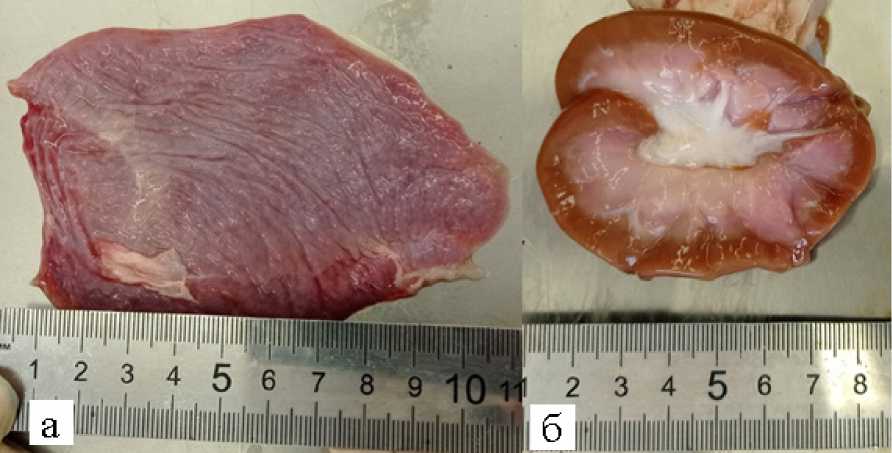
Рисунок 3 – а – селезенка, б – почка погибшего барана
Грудная полость – пищевод пустой, слизистая оболочка бледносерого цвета. В верхней части трахеи обнаружены кормовые массы предположительно вследствие аспирации при агональном состоянии (рис. 4а) . Лёгкие воздушные, отёчные, светло-розового цвета, задние доли тёмно-розового цвета, соединительнотканные прослойки и средостение наполнены отечной жидкостью (рис. 4б). В сердце соотношение правого и левого желудочка 1:3, миокард бледно-розового цвета, в полостях сердца и сосудах несвернувшаяся кровь.
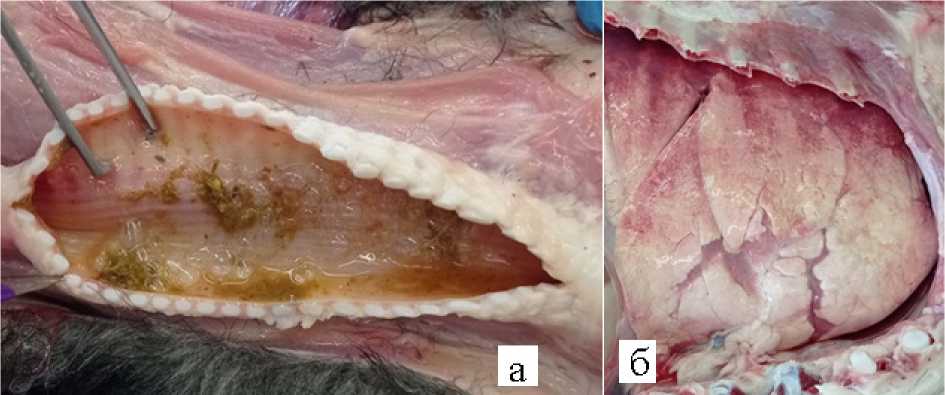
Рисунок 4 – а – трахея, б – легкие погибшего барана
Обсуждение результатов
Погибшего барана от группы выживших отличали не только низкие показатели красной крови, но и инвазия гельминтами рода Trichocephalus. Представители рода Trichocephalus вызывают заболеваниетрихоцефалез.Прислабойинтенсивностиинвазияпротекает субклинически с некоторым расстройством функции пищеварительного тракта. При остром течении трихоцефалеза у животных отмечают угнетение, слабость, судороги, истощение, анемичность слизистых оболочек, болезненность живота, упорные запоры или поносы, иногда с примесью крови. На территории РФ и стран ближнего зарубежья зарегистрированы у овец и коз – Т. ovis, T. skrjabini, T. Globulosa [9, 10]. К трихоцефалезу наиболее восприимчив молодняк текущего года рождения, как павший баран. Пик инвазии приходится на осеннезимнее время, что подтверждается и нашим случаем.
Патогенное действие власоглавов обусловлено внедрением личинок в подслизистый слой тощей кишки, а также внедрением взрослых нематод головным концом глубоко в слизистую оболочку кишечника, прошивая ее в нескольких местах. Гельминты питаются кровью, нарушая целостность кровеносных сосудов и секреторновсасывательную способность кишечника в местах локализации [10, 11]. У наблюдаемого барана это клинически проявлялось тяжелой анемией и потерей веса.
Характерных для трихоцефалеза патологоанатомических изменений не было обнаружено (катаральный колит с утолщением слизистой кишечника и точечными кровоизлияниями), из чего можно сделать вывод о быстроте развития инвазии.
Выводы
Анализируя полученные данные, мы можем заключить, что обычная для кастрации открытым методом кровопотеря привела прооперированного барана к остановке дыхания и сердцебиения, а затем и к смерти из-за тяжелой нормохромной анемии. Анемия, связанная с инвазией нематод семейства Strongyloididae, регистрировалась у всех прооперированных животных, однако ее клинические проявления были менее выражены. У погибшего барана кроме нематод семейства Strongyloididae были обнаружены нематоды семейства Trichocephalidae, что в комплексе стало причиной более тяжелого состояния и летального исхода.
Практические предложения
Опираясь на полученный опыт, мы рекомендуем включить в предоперационное обследование молодняка овец гематологическое и копроовоскопическое исследования для профилактики осложнений, связанных с инвазией паразитами, особенно осенью после пастбищного сезона.
Список литературы Патологоанатомический случай послекастрационных осложнений у барана
- Семёнов, Б.С. Анализ частоты послеоперационных осложнений при различных способах кастрации жеребцов / Б.С. Семёнов // Международный вестник ветеринарии. – 2020. – № 4. – С. 195-200.
- Ветеринарная хирургия (теория): учебное пособие по дисциплине ветеринарная, оперативная, общая и частная хирургия / В.А. Ермолаев, А.В. Сапожников, П.М. Ляшенко, Е.М. Марьни. – Ульяновcк: УлГАУ им. П.А. Столыпина. 2018. – 331 с.
- Частная хирургия животных / А.А. Стекольников, Б.С. Семенов, В.М. Руколь, В.А. Журба; под ред. А.А. Стекольникова, Б.С. Семенова. – 2-е изд., доп. – Санкт-Петербург: Лань, 2023. – 372 с.
- Оперативная хирургия у животных / Б.С. Семенов, В.Н. Виденин, А.Ю. Нечаев [и др.]. – 3-е изд., доп. – Санкт-Петербург: Лань, 2023. – 704 с.
- Полозюк, О.Н. Гематология: учебное пособие / О.Н. Полозюк, Т.М. Ушакова; Донской ГАУ. – Персиановский: Донской ГАУ, 2019. – 159 с.
- Майер, Д. Ветеринарная лабораторная медицина. Интерпретация и диагностика: пер. с англ. /Д. Майер, Дж. Харви. – М.: Софион, 2007. – 456 с.
- Дальнова, Т.С. Морфологическая диагностика анемий / Т.С. Дальнова, С.Г. Светлицкая, А.Б. Ходюкова // Медицинские новости. – 2011. № 9. – С. 56–58.
- Фомина, Л.Л. Общий клинический анализ крови у животных. Морфология и функция клеток. Патологические изменения морфологии клеток крови: учебное пособие / Л.Л. Фомина, Ю.Л. Ошуркова. – Вологда: ВГМХА им. Н.В. Верещагина, 2017. – 123 с.
- Паразитология и инвазионные болезни животных / Акбаев М. Ш., Васильевич Ф. И., Акбаев Р. М. и др. – М.: КолосС, 2013. – 776 с.
- Домацкий, В.Н. Распространение, терапия и профилактика гельминтозов овец в Российской Федерации / В.Н. Домацкий // Ветеринария Кубани. – 2021. – №2. – С. 15–20.
- Трихоцефалятозы жвачных и меры борьбы сними / А.И. Ятусевич, Л.А. Вербицкая, Е.О. Ковалевская, Е.Л. Братушкина, А.В. Минич // Международный вестник ветеринарии. – 2012. – № 2. – С. 6–9.
- Пасечник В.Е. Трихоцефалёз овец в Ростовской, Волгоградской и Астраханской областях России // Теория и практика борьбы с паразитарными болезнями. – 2019. – № 20. – С. 459–463.


