Перспективы использования культуры Leuconostoc lactis для управляемого процесса ферментации белокочанной капусты на предварительном этапе ферментации
Автор: Семенова Жанна Александровна, Колоколова Анастасия Юрьевна, Кондратенко Владимир Владимирович, Посокина Наталья Евгеньевна, Лялина Ольга Юрьевна
Рубрика: Биохимический и пищевой инжиниринг
Статья в выпуске: 4 т.6, 2018 года.
Бесплатный доступ
Работа посвящена изучению применения заквасочной культуры молочнокислых микроорганизмов Leuconostoc lactis для управляемого процесса ферментации белокочанной капусты на предварительном этапе ферментации. В настоящей работе рассмотрено влияние ключевых факторов (начальное количество внесенной культуры и химический состав модельных сред на основе белокочанной капусты) на динамику развития культуры в ходе предварительного этапа ферментации. Результаты исследований показали, что при использовании культуры Leuconostoc lactis достижение точки перехода положительных скоростей в отрицательные при сравнении образцов с низкими использованными начальными концентрациями микроорганизмов и образцов с высокими начальными концентрациями различается приблизительно в 1,5 раза. С точки зрения динамики скорости изменения концентраций микроорганизмов в модельных средах с различным химическим составом развитие культуры не зависит ни от состава субстрата, ни от начальной концентрации микроорганизмов, поскольку показатель сравнения скоростей развития микроорганизмов в процессе культивирования в базовой и модифицированной модельных средах в случае как низкой, так и высокой начальной концентрации микроорганизмов не выходит за пределы зоны инвариатности отклика за исключением двух незначительных областей. С точки зрения сравнения концентраций микроорганизмов в различных модельных средах, изменяя состав среды, мы можем влиять на динамику развития культуры при условии, что используется низкая начальная концентрация микроорганизмов. Как следствие, это имеет смысл для малотоннажных производств, у которых неоднородности среды будут малыми. В свою очередь, возможная выраженная неоднородность состава среды, проявляющаяся в разных областях объема, может сказаться на общей эффективности развития культуры. При этом высокая начальная концентрация молочнокислых микроорганизмов в силу своей установленной инвариантности нечувствительна к подобным условиям, что должно положительно сказаться на эффективности крупнотоннажного промышленного производства.
Молочнокислые бактерии, предварительный этап ферментации, белокочанная капуста сорта "парус", модельные среды, субстрат, динамика развития культуры, скорость, концентрация микроорганизмов, показатель сравнения
Короткий адрес: https://sciup.org/147233255
IDR: 147233255 | УДК: 664.843.52 | DOI: 10.14529/food180412
Текст научной статьи Перспективы использования культуры Leuconostoc lactis для управляемого процесса ферментации белокочанной капусты на предварительном этапе ферментации
Современное крупномасштабное промышленное производство ферментированных продуктов питания требует устойчивого качества готовой продукции. Для контроля и управления процессом ферментации, для повышения надежности и воспроизводимости этого процесса изготовители ферментированной пищевой продукции зачастую используют заквасочные культуры. Капуста – широко распространенное отечественное растительное сырье, а квашеная капуста потребляется как в России, так и за рубежом. В настоящее время требуется изучение вопроса возможности и условий реализации управляемого про- цесса ферментирования капусты с целью интенсификации и обеспечения гарантированно высокого качества [1–5].
К основным молочнокислым бактериям, участвующим в ферментации овощей, относятся лактобациллы, лейконостоки и пе-диококки. бактерии родов Lactobacillus, Leuconostoc и Pediococcus. Детали природы процесса ферментации капусты, в который вовлечены присутствующие естественным образом в сырье микроорганизмы, описаны уже давно. Процесс производства квашеной капусты зависит от преемственности микроорганизмов, которые присутствуют в сырье. Некоторые микроорганизмы размножаются в начале ферментации, выполняют определенную функцию, а затем исчезают, другие – начинают свое развитие позже, рост их зависит от условий, созданных ранее выросшими микроорганизмами. Эпифитная микрофлора капусты представлена не только молочнокислыми бактериями, но и другими родами и видами бактерий, поэтому в процессе изготовления квашеной капусты необходимо создавать благоприятные условия для развития преимущественно молочнокислых бактерий с целью подавления роста потенциальных возбудителей порчи. На первом (предварительном) этапе естественной ферментации капусты развиваются молочнокислые микроорганизмы рода Leuconostoc, затем на основном этапе ферментации развиваются Lactobacillus plantarum и Lactobacillus brevis [2, 4, 6].
С точки зрения хода развития микроорганизмов их рост наблюдается до тех пор, пока концентрации питательных компонентов не станут лимитирующими, или пока в ферментируемом продукте концентрация продуктов метаболизма не достигнет критического уровня, подавляющего микроорганизмы [7]. Качество и количество вносимой культуры в значительной мере определяют результат ферментации. Состав среды также немаловажен при выборе оптимального режима ферментации, он обуславливает скорость размножения и конечный выход продуктов [6, 8]. Понимание происходящих под действием микроорганизмов изменений в сырье позволяет воздействовать на биохимические процессы, происходящие в сырье и получать заданный продукт [9].
В нашем институте проведены работы по исследованию динамики развития культуры Leuconostoc lactis на модельных средах на основе белокочанной капусты сорта «Парус». Leuconostoc lactis – это грамположительные, каталазоотрицательные, гетероферментатив-ные кокки. Бактерии рода Leuconostoc обитают главным образом на растительных материалах, иногда в молоке. Гетероферментативные молочнокислые бактерии играют значительную роль при образовании соединений, способствующих получению продукта с хорошим вкусом и ароматом, являющимися важнейшими характеристиками пищи [4, 10, 11, 12].
Целью данной работы являлось изучение динамики развития молочнокислых бактерий Leuconostoc lactis ВКПМ B-12150 на овощном субстрате. Для выполнения поставленной це- ли необходимо было решить несколько задач: 1) изучить эффективность начального количества заквасочной культуры микроорганизмов для оптимального хода процесса ферментации; 2) изучить степень влияния химического состава субстрата на процесс ферментации.
Объекты и методы исследований
Для приготовления объектов исследования был взят субстрат, представлявший собой измельченную и стерилизованную белокочанную капусту сорта «Парус» с добавлением в нее NaCl из расчета 1,5 % и аскорбиновой кислоты из расчета 35 мг на 100 г сырья (модифицированная модельная среда (MMC)) или с отсутствием этих добавок (базовая модельная среда (БMC)).
В качестве культуры молочнокислых микроорганизмов была выбрана культура Leuconostoc lactis с регистрационным номером в коллекции ВКПМ: В 12150, происхождение штамма: NRRL B-3468, ATCC19256, DSM 20202. Штамм был приобретен из Всероссийской коллекции промышленных микроорганизмов ГосНИИгенетика. Для подготовки культуры для проведения исследования использовали оптимальные для этой культуры питательные среды MRS (жидкую и агаризованную), произведенные фирмой «HiMedia Laboratories Private Limited», Индия.
Были подготовлены два вида суспензий микроорганизмов, различающиеся по концентрации микроорганизмов (жизнеспособных клеток культуры). Подготовленные суспензии вносили в количестве 2 % от массы субстрата.
В результате были приготовлены четыре объекта исследования, а именно:
– объект 1: БМС, инокулированная культурой с низкой начальной концентрацией клеток;
– объект 2: ММС, инокулированная культурой с низкой начальной концентрацией клеток;
– объект 3: БМС, инокулированная культурой микроорганизмов с высокой начальной концентрацией клеток;
– объект 4: ММС, инокулированная культурой микроорганизмов с высокой начальной концентрацией клеток.
Из полученных инокулированных субстратов отбирали пробы в трех повторностях для определения концентрации жизнеспособных клеток культуры (число молочнокислых микроорганизмов, присутствующих в 1 г пробы (КОЕ/г)), а затем каждый вариант инокулированного субстрата расфасовывали по 20 г в 15 стерильных чашек Петри из расчета 5 точек отбора в трех повторностях и ферментировали в течение 7 суток при температуре (25 ± 1) °С (моделируя температуру процесса предварительного этапа ферментации при квашении капусты). Отбор проб для определения концентрации клеток микроорганизмов проводили по прошествии 3, 4, 5, 6 и 7 суток ферментирования (5 точек отбора).
Концентрации жизнеспособных клеток в отбираемых пробах сразу после инокуляции и в ходе ферментации определяли по формуле с учетом методик, изложенных в ГОСТ 10444.11-2013 [13], ГОСТ ISO 7218-2015 [14] и ГОСТ 26670-91 [15], на каждое разведение использовали две параллельные чашки:
N=I м , (1)
У^[П 1 + (0,1^П 2 )]^Й V 7
где N – концентрация жизнеспособных клеток культуры в ферментируемом продукте, КОЕ/г; ∑С – сумма среднеарифметических значений колоний из первого выбранного последовательного разведения первого, второго и третьего образцов (повторностей) и среднеарифметических значений из второго выбранного последовательного разведения первого, второго и третьего образцов; V – объем посевного материала, внесенного в каждую чашку, см3; d – коэффициент разведения, соответствующий первому выбранному разведению, n 1 – число, равное сумме числа чашек, отобранных для первого выбранного разведения всех трех образцов, деленной на 2; n 2 – то же, что n 1 , только для второго выбранного разведения.
Обработку результатов микробиологических исследований проводили в несколько этапов: 1) определение функций, которые наиболее адекватно аппроксимируют экспериментальные данные, с помощью программы TableCurve 2D; 2) аналитический расчёт функций скоростей изменения концентрации микроорганизмов в процессе ферментации; 3) расчет показателей сравнения концентраций микроорганизмов в базовой и модифицированной среде k (N) , а также показателей сравнения скоростей развития микроорганизмов в процессе культивирования в ММС и БМС k (v) .
Функцию скорости изменения концентрации микроорганизмов определяли путем нахождения первой производной функциональной зависимости концентрации микроорганизмов от продолжительности культивирования в соответствии с формулой:
u(t) —^'(t), (2)
где v(t) - функция скорости изменения концентрации микроорганизмов , [КОЕ/г·час]); N'(t) - первая производная функциональной зависимости концентрации микроорганизмов от продолжительности культивирования, [КОЕ/г·час]) .
Для правильного сопоставления полученных данных скорости были преобразованы, а именно сначала были рассчитаны удельные скорости (т.е. темпы изменения этого показателя в расчете на 1 КОЕ), а затем были рассчитаны приведенные скорости (т. е. темпы изменения показателя в расчете на эталонное значение концентрации микроорганизмов). Формула для расчета приведенной скорости представлена ниже:
_ ui ^ эталон /о\
U i привед — N. , (3)
где U i - скорость изменения концентрации микроорганизмов в i -й момент времени, КОЕ/г·час; N i – концентрация микроорганизмов в i -й момент времени, КОЕ/г; ^эталон -эталонное значение концентрации микроорганизмов, равное 108 КОЕ/г.
Для наглядности отображения на графиках функции изменения скоростей были преобразованы в соответствии с выражением:
^^ ^ / ^ привед ("), еСЛи иП р Иве д (Т) > 0\
\|^ привед (")|, если ^ привед (") < 0/
Для оценки продуктивности использования изучаемых сочетаний концентраций микроорганизмов и сред были введены показатель сравнения концентраций микроорганизмов в базовой и модифицированной среде k (N) , положительное значение которого характеризует преимущество концентрации микроорганизмов в ММС по сравнению с БМС, а также показатель сравнения скоростей развития микроорганизмов в процессе культивирования в ММС и БМС k (v) , положительное значение которого характеризует преимущество скорости в ММС перед скоростью в БМС. Эти два показателя сравнения рассчитываются согласно формулам:
k (N) = ^ (^) , (5)
с " 1БМС7
где k (N) – показатель сравнения концентраций микроорганизмов в базовой и модифицированной среде; N i ММС – концентрация жизнеспособных клеток L. lactis в ММС в i -й момент времени; N i БМС – концентрация жизнеспособных клеток L. lactis в БМС в i -й момент времени.
Ч) = '
lg (
lg(
v l привед ММС < ^ t привед БМС, ^ t привед БМС
)•
V t привед ММС > 0 и V t привед БМС > 0
.^ t привед ММС,
V t привед ММС < 0 и V i привед БМС < 0
lg(|^ t привед ММС ^ t привед БМС |) , V t привед ММС
lg (
|^ t привед ММС" (^ 1 привед БМС |
") , V t привед ММС
>
<
0 и V t привед БМС < 0
0 и V t привед БМС > 0
к
lg (^ t привед ММС ) , V t привед ММС lg ( |v t привед ММС | ) ' Vt привед ММС lg (С ТЙЙс) , V t привед ММС lg(|v t приведБМС |) , V t привед ММС 0 , V t привед ММС
>
<
0 и V t привед БМС
0 и V t привед БМС
0 и V t привед БМС
0 и V t привед БМС
0 и V t привед БМС
= 0
= 0
> 0
< 0
= 0
где k (v) – показатель сравнения скоростей развития микроорганизмов в процессе культивирования в ММС и БМС; υ i привед ММС – приведенная скорость изменения концентрации микроорганизмов при культивировании в ММС в i -й момент времени; υ i привед БМС – приведенная скорость изменения концентрации микроорганизмов при культивировании в БМС в i -й момент времени.
Нами принято условие, что на графиках динамик показателей сравнения диапазоны от –1,0 до +1,0 говорят об инвариантности отклика в сравниваемых вариантах.
Результаты и их обсуждение
Выработанные четыре объекта исследования (а именно два образца на основе БМС и ММС с низкими начальными концентрациями жизнеспособных клеток культуры (варианты 1 и 2), а также два образца на основе БМС и ММС с высокими начальными концентрациями (варианты 3 и 4) имели следующие концентрации жизнеспособных клеток L. lactis :
вариант 1: БМС с начальной концентрацией жизнеспособных клеток L. lactis 2,0·103 КОЕ/г;
вариант 2: ММС с начальной концентрацией жизнеспособных клеток L. lactis 2,4·104 КОЕ/г;
вариант 3: БМС с начальной концентрацией жизнеспособных клеток L. lactis 3,4·105 КОЕ/г;
вариант 4: ММС с начальной концентрацией жизнеспособных клеток L. lactis 2,2·106 КОЕ/г.
Данные по концентрациям микроорганизмов на протяжении предварительного этапа ферментации представлены в табл. 1.
Анализ полученных данных показал, что для всех вариантов исследования наиболее адекватно данные могут быть аппроксимиро- ваны функцией вида:
N(T') = е (а+ст)/(1+Ьт+йт2) ,
где a – константа; b, c и d – коэффициенты уравнения; e – основание натурального логарифма; τ – продолжительность культивирования, часы.
Характеристики функций для каждого варианта исследований представлены в табл. 2.
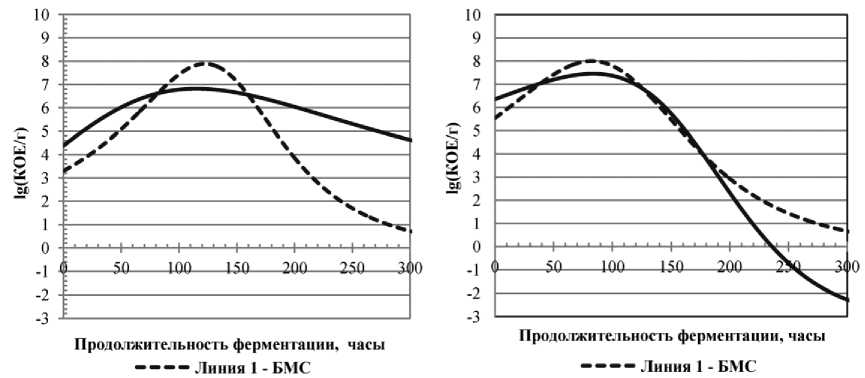
На основе полученной зависимости (формула (7)) и коэффициентов уравнения (см. табл. 2) были получены динамики концентраций микроорганизмов, которые представлены на рис. 1.
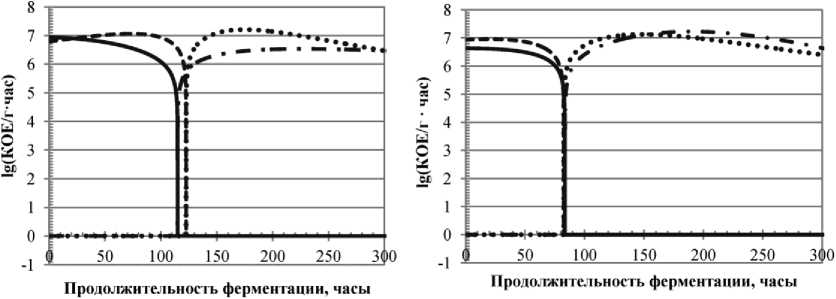
Скорости нарастания и убывания концентраций жизнеспособных клеток L. lactis, рассчитанные по формуле (3) и для удобства восприятия преобразованные по формуле (4), представлены на рис. 2.
Как видно из рис. 2, скорости одинаковы во всех четырех вариантах исследования с той лишь разницей, что при использовании низких начальных концентраций микроорганизмов скорости в БМС и ММС положительны до 120 часов ферментации, а при использовании высоких начальных концентраций скорости положительны до 82 часов, т. е. достижение точки перехода положительных скоростей в отрицательные у образцов с низкими начальными концентрациями микроорганизмов и образцов с высокими концентрациями различается приблизительно в 1,5 раза.
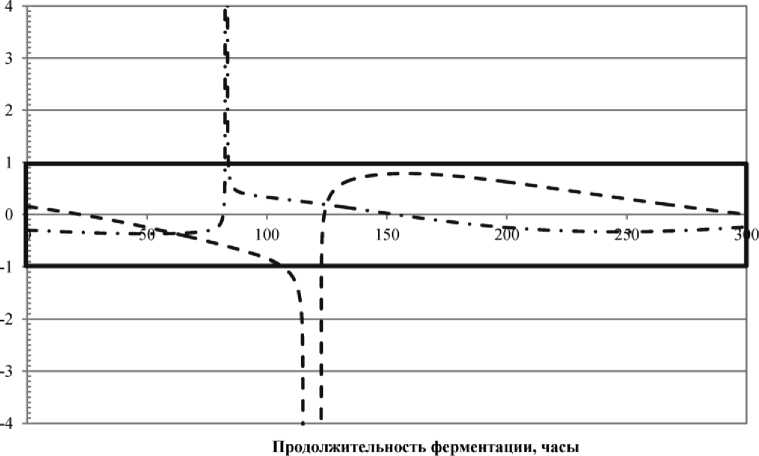
Показатели сравнения скоростей развития культуры в процессе культивирования в ММС и БМС, рассчитанные по формуле (6), представлены на рис. 3.
Таблица 1
Концентрации микроорганизмов, выраженные в КОЕ/г, на протяжении предварительного этапа ферментации
|
Время ферментации, часы |
Низкие начальные концентрации жизнеспособных клеток L. lactis , КОЕ/г |
Высокие начальные концентрации жизнеспособных клеток L. lactis, КОЕ/г |
||
|
БМС |
ММС |
БМС |
ММС |
|
|
0 |
2,0·103 |
2,4·104 |
3,4·105 |
2,2·106 |
|
72 |
1,4·106 |
1,1·107 |
8,4·107 |
2,6·107 |
|
96 |
5,2·108 |
5,6·106 |
6,1·108 |
4,1·107 |
|
120 |
7,6·107 |
3,6·106 |
1,2·107 |
9,6·106 |
|
144 |
4,5·107 |
3,6·106 |
8,7·104 |
1,4·105 |
|
168 |
1,0·107 |
2,8·106 |
2,8·104 |
4,1·104 |
Таблица 2
|
Вид модельной среды |
На-чаль-ная кон-цент-рация L. lactis |
Коэффициенты уравнения |
r2 |
P>|t| |
|||
|
а |
b |
с |
d |
||||
|
MMC |
Высо- |
14.61751 |
–0.00715 |
–0.06196 |
0.00002 |
1.00000 |
0.00000 |
|
БМС |
кая |
12.74646 |
–0.00912 |
–0.03063 |
0.00004 |
1.00000 |
0.00000 |
|
ММС |
Низ- |
10.08581 |
–0.00186 |
0.06844 |
0.00003 |
1.00000 |
0.00000 |
|
БМС |
кая |
7.60090 |
–0.01047 |
–0.01791 |
0,00004 |
1.00000 |
0.00000 |
Характеристики функций для всех вариантов исследования
Примечание: r2 - множественный коэффициент детерминации; P>|t| - вероятность ошибки коэффициента по критерию Стьюдента.
Линия 2 - ММС
Линия 2 - ММС
а)
b)
Рис. 1. Динамики концентраций жизнеспособных клеток культуры L. lactis , на различных модельных средах, а) низкие начальные концентрации микроорганизмов, b) высокие начальные концентрации микроорганизмов
— - — - Линия 1 - ВМС ^—^— Линия 2 - ММС
• ••••• Линия 3-ВМС — ■ —Линия 4-ММС
— — — —Линия 1 - ВМС Линия 2 - ММС
• ••••• Линия 3 - ВМС
— • — Линия 4-ММС
а)
b)
Рис. 2. Динамики скоростей нарастания (линии 1 и 2) и убывания (линии 3 и 4) концентрации жизнеспособных клеток L. lactis на различных модельных средах, a) низкие начальные концентрации жизнеспособных клеток культуры, b) высокие начальные концентрации жизнеспособных клеток культуры
— — — Линия 1 - Начальные низкие концентрации микроорганизмов
— ■ — Линия 2 - Начальные высокие концентрации микроорганизмов
Рис. 3. Динамики показателей сравнения скоростей развития микроорганизмов в процессе культивирования в ММС и БМС низмов в БМС и ММС, рассчитанные по формуле (5).
Как видно из рисунка, в образцах с низкой начальной концентрацией микроорганизмов культура в пределах 120 часа показывает чувствительность (вариативность), которая выражается в том, что культура находится в стрессе к натрию хлорид и витамину С, а в начале ферментации и после 180 часа показы-
Как видно из рис. 3, в случае использования L. lactis с точки зрения сравнения скоростей в ММС и БМС наблюдается инвариантность динамики развития культуры как в отношении состава субстрата, так и в отношении начальной концентрации жизнеспособных клеток культуры.
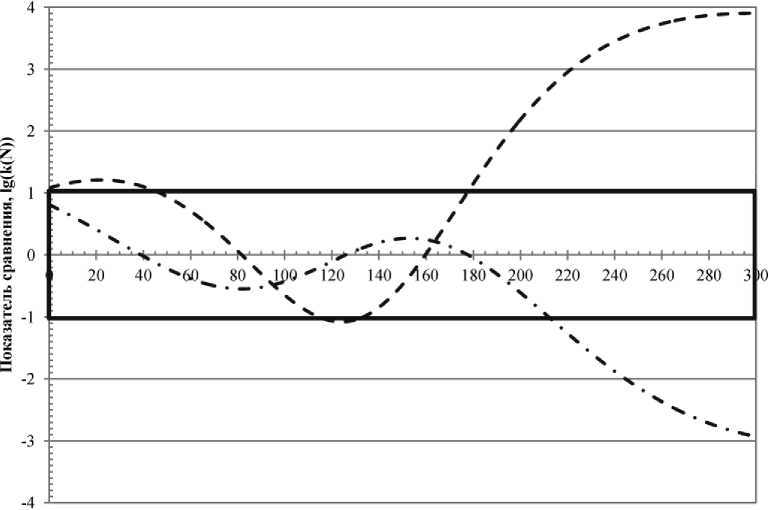
На рис. 4 представлены динамики показателей сравнения концентраций микроорга- вает чувствительность (вариативность), кото- крупнотоннажного промышленного произ-
Продолжительность ферментации, часы
Линия 1 - Начальные низкие концентрации клеток
Линия 2 - Начальные высокие концентрации клеток
Рис. 4. Динамики показателей сравнения концентраций микроорганизмов в БМС и ММС рая выражается в том, что культура находится в стрессе при их отсутствии. Культура с высокой начальной концентрацией микроорганизмов инвариантна к среде вплоть до 210 часа, и только потом проявляет чувствительность (вариативность), выражающуюся в том, что культура находится в стрессе в присутствии соли и витамина С. Таким образом можно сделать вывод о том, что с точки зрения концентраций микроорганизмов в ММС и БМС, изменяя состав среды, мы можем влиять на динамику развития культуры при условии, что используется низкая начальная концентрация микроорганизмов. Как следствие, это имеет смысл для малотоннажных производств, у которых неоднородности среды будут малыми. В свою очередь, возможная выраженная неоднородность состава среды, проявляющаяся в разных областях объема, может сказаться на общей эффективности развития культуры. При этом высокая начальная концентрация микроорганизмов в силу своей установленной инвариантности нечувствительна к подобным условиям, что должно положительно сказаться на эффективности водства.
Выводы
-
1. При использовании культуры Leuco-nostoc lactis достижение точки перехода положительных скоростей в отрицательные у образцов с низкими начальными концентрациями микроорганизмов и образцов с высокими концентрациями различается приблизительно в 1,5 раза.
-
2. С точки зрения сравнения скоростей изменения концентраций микроорганизмов в модельных средах с различным химическим составом развитие культуры не зависит ни от состава субстрата, ни от начальной концентрации микроорганизмов.
-
3. С точки зрения сравнения концентраций жизнеспособных клеток культуры, изменяя состав среды, мы можем влиять на динамику развития микроорганизмов при условии, что используется низкая начальная концентрация микроорганизмов. Как следствие, это имеет смысл для малотоннажных производств, у которых неоднородности среды будут малыми. В свою очередь, возможная выраженная неоднородность состава среды, проявляющаяся в разных областях объема, может
сказаться на общей эффективности развития культуры. При этом высокая начальная концентрация микроорганизмов в силу своей установленной инвариантности нечувствительна к подобным условиям, что должно положительно сказаться на эффективности крупнотоннажного промышленного производства.
Список литературы Перспективы использования культуры Leuconostoc lactis для управляемого процесса ферментации белокочанной капусты на предварительном этапе ферментации
- Совершенствование методологии выявления вида взаимодействия молочнокислых микроорганизмов в консорциумах на разных этапах культивирования / А.Ю. Грачева [и др.] // Современные подходы к получению и переработке сельскохозяйственной продукции - гарантия продовольственной независимости России: материалы X Международной конференции молодых ученых и специалистов (Москва, 27 октября 2016 г.). - М.: ФГБНУ «ВНИИМП им. В.М. Горбатова», 2016. - С. 61-67.
- Настольная книга производителя и переработчика плодоовощной продукции / Н.К. Синха [и др.]; под ред. Н.К. Синха, И.Г. Хью; перевод с англ. яз. - СПб.: Профессия, 2013. - 896 с.
- Евдокимова, О.В. Методология создания и продвижения на потребительский рынок функциональных пищевых продуктов: автореф. дис. … д-ра техн. наук: 05.18.15 / О.В. Евдокимова. - Краснодар, 2011. - 40 с. - Режим доступа: https://dlib.rsl.ru/01005007548, свободный (дата обращения: 19.07.2018).
- Hutkins, R.W. Microbiology and technology of fermented foods / R.W. Hutkins. - 1-е изд. - IFT Press Blackwell Publishing, 2006. - 473 с.
- Абдрахманова, Р.Н. Стартовые культуры микроорганизмов в технологии производства мясопродуктов / Р.Н. Абдрахманова, Т.Н. Зайцева // Вестник Ижевской государственной сельскохозяйственной академии. - 2012. - № 1(30). - С. 71-73.
- Пищевая биотехнология продуктов из сырья растительного происхождения: учебник / О.А. Неверова [и др.]. - М.: ИНФРА-М, 2017. - 318 с.
- Сироткин, А.С. Теоретические основы биотехнологии: учебно-методическое пособие / А.С. Сироткин, В.Б. Жукова. - Казань: Казан. гос. технол. ун-т, 2010. - 87с.
- Бывалец, О.А. Современные технологии дрожжевого производства / О.А. Бывалец, Е.Р. Грачева // Технологии производства пищевых продуктов питания и экспертиза товаров: сборник научных статей Международной научно-практической конференции. - Курск, 2015. - С. 38-42.
- Разработка технологии пищевых продуктов на основе нестандартного сельскохозяйственного сырья, биотрансформированного консорциумами микроорганизмов / В.В. Хорольский [и др.] // Пища. Экология. Человек: материалы пятой междунар. науч.-технической конф. - М.: МГУПБ, 2003. - С. 55-56.
- Джей, Дж.М. Современная пищевая микробиология / Дж. М. Джей, М. Дж. Лëсснер, Д.А. Гольден. - 7-е изд.; пер. с англ. - М.: БИНОМ. Лаборатория знаний, 2017. - 886 с.
- Емцев, В.Т. Микробиология: учебник для бакалавров / В.Т. Емцев, Е.Т. Мишустин. - 8-е изд., испр. и доп. - М.: Юрайт, 2012. - 445 с.
- Вкусо-ароматические компоненты пищевых рецептур, формируемые в присутствии бактериальных культур / А.Н. Иванкин [и др.] // Известия вузов. Прикладная химия и биотехнология. - 2017. - Т. 7, № 3 (22). - С. 124-136.
- DOI: 10.21285/2227-2925-2017-7-3-124-136
- ГОСТ 10444.11-2013. Микробиология пищевых продуктов и кормов для животных Методы выявления и подсчета количества мезофильных молочнокислых микроорганизмов. - М.: Стандартинформ, 2014.
- ГОСТ ISO 7218-2015. Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям. - М.: Стандартинформ, 2016.
- ГОСТ 26670-91. Продукты пищевые. Методы культивирования микроорганизмов. - М.: Стандартинформ, 2008.


