Пневмонии у пациентов с множественной миеломой: результаты проспективного исследования клинического эффекта пневмококковой вакцинации
Автор: Стома И. О., Искров И. А., Лендина И. Ю., Усс А. Л.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Оригинальные статьи
Статья в выпуске: 3 т.16, 2020 года.
Бесплатный доступ
Среди групп высокого риска развития инвазивных пневмококковых инфекций пациенты с множественной миеломой (ММ) выделяются одними из самых высоких показателей первичной заболеваемости и летальности по причине наличия глубокой иммуносупрессии. В статье представлены современные данные, а также результаты оригинального исследования клинических аспектов пневмококковой вакцинации у пациентов с ММ. Обозначены результаты проспективного клинического исследования по оценке эффективности применения коньюгированной пневмококковой вакцины у пациентов на фоне лечения ММ бортезомибом, леналидомидом, иксазомибом. Установлено независимое защитное влияние пневмококковой вакцинации, при этом абсолютное снижение риска пневмоний составило 33,3%, а индекс NNT составил 3,0, что говорит о высокой эффективности вакцинации как меры профилактического воздействия. ClinicalTrials. gov ID: NCT03619252
Пневмококковая инфекция, вакцинация, множественная миелома, пневмония
Короткий адрес: https://sciup.org/170172545
IDR: 170172545
Текст научной статьи Пневмонии у пациентов с множественной миеломой: результаты проспективного исследования клинического эффекта пневмококковой вакцинации
Введение. Инвазивные формы пневмококковой инфекции являются жизнеугрожающими, при этом вакциноуправляемыми осложнениями у пациентов с иммуносупрессией.Среди групп высокого риска,восприимчивых к инвазивным инфекциям, вызванным S. pneumoniae, выде- ляются пациенты с онкогематологическими заболеваниями,а также реципиенты гемопоэтических стволовых клеток.В последнее время отмечается увеличение количества пациентов, получающих таргетные лекарственные средства,моноклональные антитела и новые агенты в схемах лечения аутоиммунных, ревматологических заболеваний и злокачественных новообразований. Важно отметить, что инвазивные пневмококковые инфекции обычно протекают более тяжело в обозначенных группах высокого риска, в сравнении с общей популяцией иммунокомпетентных лиц [1–5].
На сегодняшний день показатели инфекционной заболеваемости и летальности среди пациентов с множественной миеломой (ММ) продолжают впечатлять. Например, в объёмной исследованной когорте из Великобритании,1 из 10 пациентов с ММ погибал от инфекционных осложнений в течение 10 недель с момента постановки диагноза [6]. Кроме того, в не менее значительном по объёму шведском исследовании было показано, что из 9253 выявленных пациентов с ММ 22 % погибают от инфекций в течение первого года после постановки диа-гноза,в то время как основной нозологической формой инфекционных осложнений являются внебольничные пневмонии [7].
На фоне этих цифр впечатляют новые данные о фармакотерапии множественной миело-мы.Революция в иммунотерапии рака привела к переписыванию клинических характеристик и течения этого заболевания.Продолжитель-ность жизни пациентов с ММ сегодня значительно увеличена именно за счёт эффективного иммунологического воздействия на заболевание, являющегося основой функционального излечения,что оценивается как реалистичная и захватывающая перспектива на ближайшие годы. Однако эти действительно впечатляющие успехи на самом деле не принесут пользы для одного из каждых 10 пациентов, которые и сегодня продолжают погибать от инфекционных осложнений на ранних стадиях лечения. Более того,по мере повышения непосредственного эффекта иммунотерапии и таргетной терапии ММ, относительный вклад инфекций в структуру летальности при данной нозологии будет увеличиваться.Одно из наиболее интересных исследований по профилактике инфекций во время циклов терапии ММ новыми агентами посвящено вопросу рутинной антибиотикопро-филактики. Авторы клинического исследования TEAMM, проведённого в Великобритании, оценили эффективность однократной ежесуточной дозы 500 мг левофлоксацина в течение 12 недель интенсивного лечения ММ новыми агентами.В качестве основных исходов в исследовании были приняты частота эпизодов фебрильной нейтропении и общая выживае- мость пациентов. К 12 неделям в исследовании была достигнуты статистически значимые различия в выживаемости в пользу группы с антибиотикопрофилактикой по сравнению с контрольной группой [8]. Однако стоит подчеркнуть, что данный подход несёт в себе ряд опасных последствий в связи с увеличением числа побочных эффектов такого длительного применения антибиотиков,а также риска роста устойчивости к антибиотикам.Именно поэтому вакцинация может быть наиболее безопасной и эффективной мерой для профилактики внебольничных пневмоний у пациентов гематологического профиля с ММ,тем более, что именно пневмококки занимают лидирующее место в структуре инфекционной заболеваемости дыхательной системы у пациентов, получающих иммуносупрессивную терапию [9].
Иммунный ответ на пневмококковые вакцины
Невысокая иммуногенность полисахаридных пневмококковых вакцин у детей младшего возраста и взрослых с иммуносупрессией связана с Т-независимым характером иммунного ответа на данный тип вакцин.Характеристики рецепторов антител и Т-клеток у взрослых и детей младшего возраста существенно различаются. Кроме того, антипневмококковые антитела ассоциированы со специфическими линиями В-клеток определённых участков селезёнки, которые, как известно, не развиты у детей в возрасте до 2-х лет. Описанная потребность в функционально развитой активной селезёнке объясняет как повышенную восприимчивость к пневмококковой инфекции у детей младшего возраста,так и у взрослых пациентов с аспленией во всех возрастах, а также у гематологических пациентов с иммуносупрессией. Усилия исследователей по решению проблемы низкой иммуногенности полисахаридной вакцины в описанных группах привели к разработке пневмококковой конъюгированной вакцины.В рамках этой работы было установлено,что ковалентное связывание полисахарида с белковым носителем эффективно превращает Т-независимый тип полисахарида в Т-зависимый антиген, что имеет долгосрочные преимущества в иммуногенности [10]. Таким образом, пневмококковая конъюгированная вакцина,в составе которой капсульные полисахариды связаны с белком-носителем, приводит к включению Т-клеток в иммунный ответ и улучшению продукции В-клеток, повышению иммунологической памяти, а также к смене классов антител и повышению уровней Ig . Технологический процесс создания коньюгированных вакцин весьма сложен, и требует, чтобы каждый полисахарид пневмококка был индивидуально конъюгирован с белком-носителем, что, таким образом, ограничивает количество серотипов, которые могут быть включены в вакцину [10–13]. Кроме того,в экспериментальной модели исследователи продемонстрировали роль CD4 + Т-клеток (Th2 и Th17) в иммунном контроле инфекции, вызванной S. pneumoniae; а Th2 и Th17 являются субпопуляциями CD4 + Т-лимфоцитов [14, 15]. Итак, иммунный ответ на вакцинацию полисахаридной пневмококковой вакциной опосредуется Т-независимым В-клеточным путём.Напротив,иммунный ответ на конъюгированную пневмококковую вакцину основан на Т-зависимой (CD4 + ) активации В-клеток.
Таргетные лекарственные средства и новые агенты
Среди новых агентов в лечении множественной миеломы выделяют ингибиторы протеасом (бортезомиб, как первый доступный препарат), иммуномодулирующие средства (леналидомид) и моноклональные антитела.Ингибиторы про-теасом нового поколения (карфилзомиб и икса-зомиб), иммуномодулирующие средства нового поколения (помалидомид) и моноклональные антитела (элотузумаб и даратумумаб) были одобрены для лечения множественной миеломы совсем недавно, в 2015–2016 годах, в то время как бортезомиб был одним из первых препаратов, войдя в клиническую практику чуть более десятилетия назад [16]. При этом, практически у всех из приведённых новых агентов среди описанных побочных эффектов отмечаются инфекционные осложнения, и в первую очередь пневмонии,что особенно характерно для ингибиторов протеасом и иммуномодулирующих средств [17–20]. Несмотря на то, что уже имеются данные относительно профилей безопасности таргетной и иммунотерапии с точки зрения инфекционных рисков [21], до настоящего времени отсутствовало полное понимание клинической эффективности пневмококковой вакцинации у пациентов с множественной миеломой,получаю-щих лечение новыми агентами и таргетными лекарственными средствами, в частности, ингибиторами протеасом (иксазомиб, борте-зомиб) и иммуномодулирующими препаратами (леналидомид, талидомид, помалидомид). В связи с этим,целью выполняемого исследования была оценка клинической эффективности новой предложенной трёхдозовой схемы вакцинации 13-валентной пневмококковой конъюгированной вакциной (PCV13) в отношении профилактики пневмоний у пациентов с множественной миеломой на фоне лечения новыми агентами.
Материалы и методы. В данное проспективное клиническое исследование были включены взрослые пациенты с установленным диагнозом множественной миеломы на базе Республиканского центра гематологии и пересадки костного мозга (г. Минск, Республика Беларусь) в период 2017–2019 гг. В схемах лечения множественной миеломы все включённые пациенты получали препараты из группы новых агентов.Вакцинация производилась 13-валентной пневмококковой вакциной (PCV13) в соответствии с инструкцией по применению в интервалах между блоками лечения новыми агентами (бортезомиб, леналидомид, иксазомиб в сочетании или без дексаметазона). Схемы вакцинации были основаны на 3-х дозах пневмококковой вакцины с минимальным интервалом в 1 месяц.Введение вакцины планировалось в середине 2-х недельного интервала между блоками лечения новыми агентами, что представлено на рис. 1, в рамках дизайна исследования.В общей сложности 18 пациентов с ММ были вакцинированы на фоне лечения новыми агентами.В составе контрольной группы наблюдения были 18 пациентов, сопоставимых по возрасту, полу, основному диагнозу и схемам лечения,со стандартными мерами профилактики инфекций.В качестве первичного исхода в исследовании была принята частота клинико-радиологически подтверждённых пневмоний в течение одного года наблюдения. Клинико-радиологически подтверждённая пневмония определялась как наличие лёгочного инфильтрата или консолидации у пациентов с клиническими данными в пользу пневмонии (наличие лихорадки, кашля, болей в груди, одышки, хрипов, крепитации, тахикардии и тахипноэ). Основываясь на допущении,что большая часть внеболь-ничных пневмоний в исследуемой категории пациентов вызывается S. pneumoniae,в исследовании ожидалось получение различий в первичной заболеваемости пневмониями, несмотря на отсутствие микробиологического подтверждения этиологии в вакцинированной и не вакцинированной группах.Известная сложность микробиологического подтверждения пневмококковых инфекций послужила основанием для определения в качестве способа оценки первичного исхода именно клинико-радиологической дихотомической точки (наличие пневмонии) [22]. У всех пациентов было получено информированное согласие, а также была обозначена осознанная приверженность вакцинации. Дизайн исследования был предварительно утверждён и зарегистрирован в базе данных Национального института здравоохранения США (ClinicalTrials. gov ID: NCT03619252). Нежелательные явления определялись и оценивались с помощью критериев CTCAE версии 4.0. Критерии включения в исследование были следующие: подтверждённый диагноз множественной миело-мы;лечение новыми агентами (бортезомиб или леналидомид или иксазомиб);клиренс креатинина выше 30 мл/мин на день начала участия.Критериями исключения были: противопоказания к использованию одного из исследуемых препаратов или компонентов (включая аллергический анамнез); клиренс креатинина ниже 30 мл/мин в день участия; психическое расстройство или неспособность понять или следовать инструкциям;актив-ная бактериальная, вирусная, грибковая или протозойная инфекция в день начала участия в исследовании. Методы непараметрической статистики (критерий χ2-квадрат, точный тест Фишера) были использованы для оценки различий между группами, статистическая значимость была установлена значением p = 0,05, при этом мультивариантный анализ проводился последовательно с помощью логистической регрессии с порогом p < 0,2 в моновариантном анализе. Среди статистических пакетов, использованных в исследовании, были: свободная программная среда R (v.3.5.3) и MedCalc (v.19.2.0).
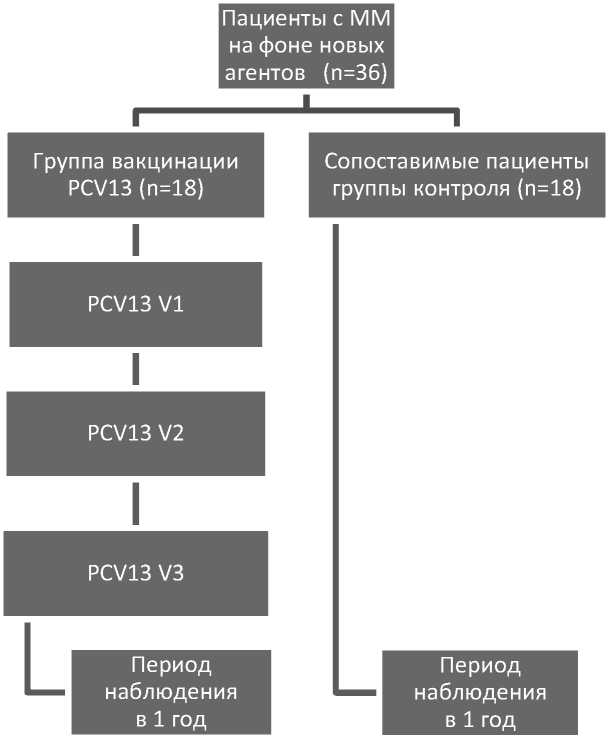
Рисунок 1. Схема дизайна проспективного клинического исследования в соответствии с руководящими принципами CONSORT.
Результаты и обсуждение. Базовые клинические и демографические характеристики пациентов групп в исследовании приведены в таблице 1.
Таблица 1.
|
Характеристика |
Показатель |
Пациенты с ММ на фоне новых агентов (n = 36) |
p |
|
|
PCV13 вакцинация (n = 18) |
Группа контроля (n = 18) |
|||
|
Возраст (годы) |
> 65 |
3 (16.7 %) |
4 (22.2 %) |
1 |
|
Пол |
Ж |
5 (27.8 %) |
6 (33.3 %) |
0.725 |
|
М |
13 (72.2 %) |
12 (66.7 %) |
||
|
Подгруппа множественной миеломы |
IgG |
16 (88.9 %) |
15 (83.3 %) |
1 |
|
Non-IgG1 |
2 (11.1 %) |
3 (16.7 %) |
||
|
Гипогамма-глобулинемия |
Глубокая2 |
9 (50 %) |
10 (55.6 %) |
1 |
|
Лейкоциты |
> 1000/ мкл |
15 (83.3 %) |
16 (88.9 %) |
1 |
|
Стадия ММ по ISS |
1 |
4 (22.2 %) |
3 (16.7 %) |
1 |
|
2 |
7 (38.9 %) |
9 (50.0 %) |
||
|
3 |
5 (27.8 %) |
6 (33.3 %) |
||
|
Гемоглобин |
< 10 г/дл |
4 (22.2 %) |
5 (27.8 %) |
1 |
|
Креатинин |
> 2 мг/дл |
3 (16.7 %) |
5 (27.8 %) |
0.691 |
|
Новые агенты |
Бортезомиб |
11 (61.1 %) |
9 (50.0 %) |
0.738 |
|
Леналидомид |
5 (27.8 %) |
4 (22.2 %) |
1 |
|
|
Иксазомиб |
2 (11.1 %) |
5 (27.8 %) |
0.402 |
|
|
Случаи пневмонии, абс. ( %) |
3 (16.7 %) |
9 (50 %) |
0.037 |
|
Базовые характеристики пациентов в исследовании
-
1 Non-Ig включают IgA и IgM, здесь и далее.
-
2 Определён как уровень не-ММ иммуноглобулинов менее одной четверти от нижнего нормального предела.
Всего в исследуемой группе было описано 12 случаев (33,3 %) подтверждённых пневмоний (n = 36), с распределением между вакцинированной и контрольной группами: 3 (16,7 %) и 9 (50 %) соответственно (p = 0,037, точный тест Фишера). Установленная высокая частота пневмоний объясняется сочетанием иммуносупрессивного эффекта основного заболевания и ранее описанных побочных эффектов новых агентов [7, 17]. В трёх случаях в контрольной группе сравнения было получено микроскопическое подтверждение грамположитель-ных диплококков в мокроте, и только в одном случае был отмечен непосредственный рост S.
pneumoniae на питательной среде с последующим подтверждением автоматическим бактериальным анализатором (VITEK 2, Biomerieux, Франция).В исследовании не было зарегистрировано ни летальных исходов, связанных с пневмониями,ни нежелательных явлений при вакцинации согласно CTCAE v. 4.0. Первоначальная эмпирическая антибактериальная терапия пневмоний у пациентов с множественной миеломой включало схемы, основанные на цефепиме, цефтазидиме, линезолиде на усмотрение лечащего врача. Характеристики пациентов с наличием пневмонии/без пневмонии в исследовании приведены в таблице 2 ниже.
Таблица 2.
|
Характеристика |
Показатель |
Пациенты с ММ (n = 36): 1 год наблюдения |
|
|
С пневмонией (n = 12) |
Без пневмонии (n = 24) |
||
|
Возраст (годы) |
> 65 |
4 (33.3 %) |
3 (12.5 %) |
|
Пол |
Ж |
6 (50.0 %) |
6 (25.0 %) |
|
M |
6 (50.0 %) |
18 (75.0 %) |
|
|
Характеристика |
Показатель |
Пациенты с ММ (n = 36): 1 год наблюдения |
|
|
С пневмонией (n = 12) |
Без пневмонии (n = 24) |
||
|
Подгруппа множественной миеломы |
IgG |
12 (100 %) |
19 (79.2 %) |
|
Non-IgG |
— |
5 (20.8 %) |
|
|
Гипогамма-глобулинемия |
Глубокая |
7 (58.3 %) |
12 (50.0 %) |
|
Лейкоциты |
> 1000/ мкл |
11 (91.7 %) |
20 (83.3 %) |
|
Стадия ММ по ISS |
1 |
3 (25.0 %) |
4 (16.7 %) |
|
2 |
8 (66.7 %) |
8 (33.3 %) |
|
|
3 |
4 (33.3 %) |
7 (29.2 %) |
|
|
Гемоглобин |
< 10 г/дл |
1 (8.3 %) |
8 (33.3 %) |
|
Креатинин |
> 2 мг/дл |
5 (41.7 %) |
3 (12.5 %) |
|
Новые агенты |
Бортезомиб |
5 (41.7 %) |
15 (62.5 %) |
|
Леналидомид |
4 (33.3 %) |
5 (20.8 %) |
|
|
Иксазомиб |
3 (25.0 %) |
4 (16.7 %) |
|
|
Вакцинация |
PCV13 |
3 (25.0 %) |
15 (62.5 %) |
Характеристики пациентов с/без пневмоний в исследовании
В качестве следующего шага обработки данных был проведён мультивариантный анализ с использованием логистической регрессии с порогом p < 0,2 в моновариантном анализе для оценки независимоcти влияния вакцинации PCV13 на риск развития пневмонии у пациентов, получающих новые препараты в качестве лечения множественной миеломы (табл. 3).
Таблица 3.
Предикторы развития пневмонии у пациентов с множественной миеломой, получающих лечение новыми агентами
|
Предиктор |
Моновариантный этап |
Мультивариантный этап |
||
|
ОШ (95 % ДИ) |
p |
ОШ (95 % ДИ) |
p |
|
|
Возраст (> 65 лет) |
3.50 (0.64–19.24) |
0.150 |
||
|
Пол (женский) |
3.00 (0.70–12.93) |
0.141 |
3.91 (0.66–23.39) |
0.135 |
|
MM подгруппа IgG |
7.05 (0.36–138.96) |
0.200 |
||
|
ISS стадия 3 |
1.21 (0.27–5.38) |
0.798 |
||
|
Креатинин > 2 мг/дл |
5.00 (0.94–26.50) |
0.059 |
5.63 (0.82–38.74) |
0.079 |
|
Hb < 10 г/дл |
0.18 (0.02–1.67) |
0.132 |
0.14 (0.01–1.70) |
0.123 |
|
Глуб. гипогаммаглемия |
1.40 (0.35–5.67) |
0.637 |
||
|
Лейкоциты > 1000 кл/мкл |
2.20 (0.22–22.20) |
0.504 |
||
|
Бортезомиб |
0.43 (0.10–1.76) |
0.240 |
||
|
Леналидомид |
1.90 (0.40–8.98) |
0.418 |
||
|
Иксазомиб |
1.67 (0.31–9.04) |
0.554 |
||
|
Вакцинация PCV13 |
0.20 (0.04–0.94) |
0.041 |
0.14 (0.02–0.93) |
0.041 |
Таким образом, только пол, уровень креатинина крови свыше 2 мг/дл, уровень гемоглобина крови ниже 10 г/дл и вакцинация коньюгированной пневмококковой вакциной показали статистически значимые эффекты в моновариантном этапе анализа,поэтому они были включены в мультивариантный этап, где только вакцинация показала неза- висимый защитный эффект, в то время как остальные переменные являлись зависимыми побочными факторами в исследова-нии.Абсолютное снижение риска развития пневмонии у пациентов,прошедших схему вакцинации против пневмококковой инфекции, составило 33,3 %. Кроме того, было рассчитано число, необходимое для получения одного дополнительного благоприятного исхода при вакцинации (NNT = 3,0; 95 % ДИ 1,609–22,104; p = 0,0571). Итак, по результатам логистической регрессии наблюдалось статистически значимое независимое влияние предложенного 3-дозового режима вакцинации коньюгированной 13-валентной пневмококковой вакциной на заболеваемость пневмониями у пациентов с ММ. В рамках обсуждения отметим, что ранее были опубликованы некоторые исследования в области пневмококковой вакцинации при множественной миеломе,однако они имели серьёзные ограничения,и в первую очередь это касалось небольшого числа пациентов с ММ и отсутствия клинической оценки эффекта вакцинации.Так, в одном из исследований была выполнена оценка титров Ig к серотипам пневмококков, что показало снижение длительности иммунного ответа на вакцинацию у пациентов с множественной миеломой по сравнению с контрольной группой общей популяции [23]. Исследование, выполненное L. Renaud и соавт. [24], показало, что с иммунологической точки зрения пациенты с ММ способны продемонстрировать адекватный ответ на пневмококковую вакцинацию, независимо от имеющейся гипогаммаглобулинемии, с ожидаемым снижением иммунного ответа непосредственно после аутологичной трансплантации ГСК.В обоих приведённых в обсуждении исследованиях отсутствовали клинические данные о влиянии вакцинации на развитие пневмонии у пациентов с ММ, в то время как считается, что жёсткие точки клинических исходов, такие как пневмония, во многом определяет эффективность профилактической меры воздействия в реальных условиях.
Выводы . Дальнейшее внедрение программ вакцинопрофилактики инфекций у взрослых пациентов с иммуносупрессией в онкологии, гематологии и трансплантологии может послужить основой для снижения частоты жизнеугрожающих инфекционных осложнений в данной высокотехнологичной и экономически затратной области медицины.В настоящей работе мы впервые установили статистически значимый независимый клинический защитный эффект вакцинации коньюгированной пневмококковой вакциной в отношении риска развития пневмонии у гематологических паци-ентов,получающих новые таргетные агенты. Эти новые таргетные и иммунопрепараты уже показали блестящие результаты в лечении множественной миеломы, в то время как инфекции, особенно пневмонии, зачастую остаются нерешённой проблемой.Несмотря на возможное снижение иммунного ответа на вакцинацию во время химиотерапии и таргетной терапии, в исследовании была доказана клиническая эффективность новой схемы вакцинации, основанной на 3-х дозах коньюгированной пневмококковой вакцины у пациентов с множественной миеломой.
Конфликты интересов
Источник финансирования
Исследование выполнено на базе и при поддержке государственного учреждения «Минский научно-практический центр хирургии, трансплантологии и гематологии», других источников финансирования исследования не имелось.
Вклад авторов
Концепция и дизайн: И. О. Стома, А. Л., Усс, И. А. Искров
Сбор и обработка данных: И. А. Искров, И. Ю. Лендина, И. О. Стома
Представление материалов исследования: И. О. Стома, И. А. Искров, И. Ю. Лендина
Анализ и интерпретация: И. О. Стома, А. Л., Усс, И. А. Искров
Подготовка рукописи: И. О. Стома
Окончательное одобрение рукописи: И. О. Стома, А. Л., Усс
Список литературы Пневмонии у пациентов с множественной миеломой: результаты проспективного исследования клинического эффекта пневмококковой вакцинации
- Kamboj, M. & Shah, M. K. Vaccination of the Stem Cell Transplant Recipient and the Hematologic Malignancy Patient / M. Kamboj, M. K. Shah // Infectious Disease Clinics of North America. — 2019. — Vol. 33, № 2. — P. 593–609.
- Meroni, P. L. Zavaglia, D. & Girmenia, C. Vaccinations in adults with rheumatoid arthritis in an era of new disease-modifying anti-rheumatic drugs / P. L. Meroni, D. Zavaglia, C. Girmenia // Clinical and Experimental Rheumatology. — 2018. — Vol. 36, № 2. — P. 317–328.
- Monier, A. et al. Observational study of vaccination in cancer patients: How can vaccine coverage be improved? / A. Monier et al. // Medecine Et Maladies Infectieuses. — 2020. — Vol. 50, № 3. — P. 263–268.
- Klugman, K. P. Madhi, S. A. & Feldman, C. HIV and pneumococcal disease / K. P. Klugman, S. A. Madhi, C. Feldman // Current Opinion in Infectious Diseases. — 2007. — Vol. 20, № 1. — P. 11–15.
- Shatz, D. V. Vaccination considerations in the asplenic patient / D. V. Shatz // Expert Review of Vaccines. — 2005. — Vol. 4, № 1. — P. 27–34.
- Augustson, B. M. et al. Early mortality after diagnosis of multiple myeloma: analysis of patients entered onto the United kingdom Medical Research Council trials between 1980 and 2002—Medical Research Council Adult Leukaemia Working Party / B. M. Augustson et al. // Journal of Clinical Oncology: Offi cial Journal of the American Society of Clinical Oncology. — 2005. — Vol. 23, № 36. — P. 9219–9226.
- Blimark, C. et al. Multiple myeloma and infections: a population-based study on 9253 multiple myeloma patients / C. Blimark et al. // Haematologica. — 2015. — Vol. 100, № 1. — P. 107–113.
- Hallam, S. TEAMM Work Saves Lives in Myeloma / S. Hallam // HemaSphere. — 2018. — Vol. 2, № 1. — P. E24.
- Zarco-Márquez, S. et al. Invasive and Complicated Pneumococcal Infection in Patients with Cancer / S. Zarco-Márquez et al. // Revista De Investigacion Clinica; Organo Del Hospital De Enfermedades De La Nutricion. — 2016. — Vol. 68, № 5. — P. 221–228.
- Westerink, M. A. J. Schroeder, H. W. & Nahm, M. H. Immune Responses to pneumococcal vaccines in children and adults: Rationale for age-specifi c vaccination / M. A. J. Westerink, H. W. Schroeder, M. H. Nahm // Aging and Disease. — 2012. — Vol. 3, № 1. — P. 17.
- Black, S. B. et al. Effi cacy in infancy of oligosaccharide conjugate Haemophilus infl uenzae type b (HbOC) vaccine in a United States population of 61,080 children. The Northern California Kaiser Permanente Vaccine Study Center Pediatrics Group / S. B. Black et al. // The Pediatric Infectious Disease Journal. — 1991. — Vol. 10, № 2. — P. 97–104.
- Stein, K. E. Thymus-independent and thymus-dependent responses to polysaccharide antigens / K. E. Stein // The Journal of Infectious Diseases. — 1992. — Vol. 165 Suppl 1, — P. S49–52.
- Käyhty, H. & Eskola, J. New vaccines for the prevention of pneumococcal infections. / H. Käyhty, J. Eskola // Emerging Infectious Diseases. — 1996. — Vol. 2, № 4. — P. 289–298.
- Mccool, T. L. et al. B- and T-Cell Immune Responses to Pneumococcal Conjugate Vaccines: Divergence between Carrier- and Polysaccharide-Specific Immunogenicity / T. L. Mccool et al. // INFECT. IMMUN. — 1999. — Vol. 67, — P. 8.
- Pletz, M. W. et al. Pneumococcal vaccines: mechanism of action, impact on epidemiology and adaption of the species / M. W. Pletz et al. // International Journal of Antimicrobial Agents. — 2008. — Vol. 32, № 3. — P. 199–206.
- Chim, C. S. et al. Management of relapsed and refractory multiple myeloma: novel agents, antibodies, immunotherapies and beyond / C. S. Chim et al. // Leukemia. — 2018. — Vol. 32, № 2. — P. 252–262.
- Ludwig, H. et al. Prevention and management of adverse events of novel agents in multiple myeloma: a consensus of the European Myeloma Network / H. Ludwig et al. // Leukemia. — 2018. — Vol. 32, № 7. — P. 1542–1560.
- Gay, F. et al. From transplant to novel cellular therapies in multiple myeloma: European Myeloma Network guidelines and future perspectives / F. Gay et al. // Haematologica. — 2018. — Vol. 103, № 2. — P. 197–211.
- Ludwig, H. & Zojer, N. Supportive care in multiple myeloma / H. Ludwig, N. Zojer // Best Practice & Research. Clinical Haematology. — 2007. — Vol. 20, № 4. — P. 817–835.
- Rajkumar, S. V. Multiple Myeloma: 2018 update on Diagnosis, Risk-stratifi cation and Management / S. V. Rajkumar // American journal of hematology. — 2018. — Vol. 93, № 8. — P. 981–1114.
- Fernández-Ruiz, M. et al. ESCMID Study Group for Infections in Compromised Hosts (ESGICH) Consensus Document on the safety of targeted and biological therapies: an infectious diseases perspective (Introduction) / M. Fernández-Ruiz et al. // Clinical Microbiology and Infection: The Offi cial Publication of the European Society of Clinical Microbiology and Infectious Diseases. — 2018. — Vol. 24 Suppl 2, — P. S2–S9.
- Azzari, C. et al. Molecular detection methods and serotyping performed directly on clinical samples improve diagnostic sensitivity and reveal increased incidence of invasive disease by Streptococcus pneumoniae in Italian children / C. Azzari et al. // Journal of Medical Microbiology. — 2008. — Vol. 57, № Pt 10. — P. 1205–1212.
- Mustafa, S. S. et al. Response to PCV13 vaccination in patients with multiple myeloma versus healthy controls / S. S. Mustafa et al. // Human Vaccines & Immunotherapeutics. — 2019. — Vol. 15, № 2. — P. 452–454.
- Renaud, L. et al. Response to pneumococcal vaccination in multiple myeloma / L. Renaud et al. // Cancer Medicine. — 2019. — Vol. 8, № 8. — P. 3822–3830.


