Подбор оптимальной питательной среды для культивирования микроводоросли Chlorella kessleri ВКПМ AI-11 ARW в лабораторных условиях
Автор: Афонин А.А., Ляпунова Е.Р., Комарова Л.Н.
Журнал: Принципы экологии @ecopri
Рубрика: Оригинальные исследования
Статья в выпуске: 1 (55), 2025 года.
Бесплатный доступ
Проведен подбор оптимальной питательной среды для культивирования микроводоросли Chlorella kessleri в лабораторных условиях. Согласно патентной информации, для выращивания микроводоросли C. kessleri штамма ВКПМ АI-11 ARW (РФ, НПО «Алгобиотехнология») необходимо использовать комплексную питательную среду, состоящую из растворов четырех составов химических реактивов и фугата послеспиртовой барды. Результаты выращивания водоросли на предлагаемой среде продемонстрировали хорошие показатели роста с минимальными сроками для достижения оптимальной оптической плотности (5 суток) и выхода на экспоненциальную фазу (3 суток). Исходя из полученных в ходе исследования данных, наиболее подходящей для культивирования в лаборатории, с учетом практических аспектов, таких как простота и стоимость, оптимальной будет среда Тамия в концентрации 30 % без дополнительного внесения в нее микроэлементов, при культивировании на которой были получены аналогичные результаты: время до достижения оптимальной оптической плотности составило 5 суток, а время выхода на экспоненциальную фазу – 3 суток.
Протококковые водоросли, хлорелла, питательная среда, штамм, фитопланктон, альголизация, культивирование, среда Тамия
Короткий адрес: https://sciup.org/147250768
IDR: 147250768 | УДК: 574.22, 574.6, 57.083.13 | DOI: 10.15393/j1.art.2025.15842
Текст научной статьи Подбор оптимальной питательной среды для культивирования микроводоросли Chlorella kessleri ВКПМ AI-11 ARW в лабораторных условиях
Микроводоросль хлорелла – удобный объект биологического мониторинга состояния природных экологических систем, поскольку имеет широкий ареал распространения и присутствует как в водоемах, так и на почвах. Благодаря этому она стала объектом массового культивирования для применения в самых разных направлениях. С использованием хлореллы была получена информация о мутагенных и летальных эффектах высоких доз внешнего облучения, продуктов ядерно-го деления 235U разного возраста, 232Th, неорганических и органических соединений в модельных растворах, компонентов природных и промышленных вод (Шевченко и др., 1969; Векшина и др., 1970; Wong, 1980; Шевченко и др., 1996; Евсеева и др., 2008)
Первые теоретические и экспериментальные исследования биорегенеративных систем были проведены на водорослях рода Chlorella . Подробное изучение этой водоросли позволило выявить и решить ряд проблем, связанных со специфическими требованиями биологических систем жизнеобеспечения человека.
В данном исследовании использовался штамм микроводоросли Chlorella kessleri ВКПМ АI-11 ARW (РФ, НПО «Алгобиотехноло-гия»). 15 января 2022 г. вступил в силу ГОСТ Р 59977-2022, содержащий технологию биологической реабилитации водных объектов данным штаммом хлореллы.
Применение эталонной питательной среды для выращивания данного штамма, представленной в патенте № RU2585523C1, приводит к высоким результатам роста водорослей, однако ее приготовление в малых объемах требует значительных усилий и точных дозировок, что увеличивает время и сложность процесса (Богданов, 2016). По сравнению с оригинальным составом, среда Тамия характеризуется более простой методикой приготовления, что делает ее более удобной для лабораторного применения. Сама по себе среда Тамия – это стандартная культуральная среда для выращивания протококковых водорослей, таких как хлорелла. Эта среда была разработана для стабильного и эффективного культивирования водорослей в лабораторных условиях. Она используется для различных исследований в области микробиологии и биотехнологии, обе- городской пруд (780 га), пруд на реке Вязов-ка (3.5 га) и Леневское водохранилище (2300 га). По данным компании-производителя, в 2011 г. было предотвращено цветение водоемов общей площадью 22344.5 га (Список предприятий…, 2025).
Штамм C. kessleri , согласно патентной информации, в лабораторных условиях растет на комплексной питательной среде, состоящей из растворов четырех составов химических реактивов на один литр водопроводной воды и фугата послеспиртовой барды, причем последний вводится в питательную среду до получения уровня pH не ниже 7.0. Штамм не требует подачи углекислого газа и барботирования культуры воздухом (Богданов, 2016).
Составы питательной среды, согласно патенту:
-
• состав № 1: азотно-фосфорный – 0.30 мл;
-
• состав № 2: железисто-натриевый – 0.15 мл;
-
• состав № 3: медно-кобальтовый – 0.15 мл;
-
• состав № 4: сернокислого калия – 0.33 мл.
Методы
В ходе работы были приготовлены различные варианты среды, в т. ч. стандартная для протококковых водорослей среда Тамия, и были опробованы различные комбинации сред для поиска наиболее оптимального варианта.
Состав среды Тамия с концентрацией 100 % указан в табл. 1 (Ляпунова, 2015).
Таблица 1. Состав среды Тамия
|
Компоненты среды |
Масса, г/л |
|
KNO3 |
5 |
|
MgSO4 |
2.5 |
|
KH 2 PO 4 x 3H 2 O |
1.25 |
|
FeCAO7 |
0.003 |
Для возможности параллельного культивирования сразу на нескольких средах был использован многокюветный культиватор водорослей КВМ-05. Данный культиватор способен поддерживать температуру культивирования водоросли в диапазоне от 25 до 40 °С, точность поддержания температуры при этом составляет ±1 °С. Постоянная температура поддерживается автоматическим включением и выключением встроенного вентилятора по команде блока термостабилизации прибора. Исходя из патентной информации и технических возможностей культиватора, температура культивирования составляла 28 ± 1 °С.
Углекислотное насыщение фотосинтеза наблюдается при концентрации его в растворах в пределах 0.01-0.027 %. Следовательно, 0.03%-ное количество углекислоты в воздухе вполне достаточно для обеспечения питания водорослей (Музафаров и др., 1972).
В процессе культивирования суспензия водоросли облучается светом лампы накаливания 40 Вт, 220 В. Режим освещенности составлял 12 часов в сутки, что обеспечивалось с помощью реле, автоматически срабатывающего по времени, с погрешностью отсчета не более 2 с/сут.
Для исследования были приготовлены:
-
1. Среда Тамия в различных концентрациях (15, 30, 50, 65 и 80 %) без добавления дополнительных растворов микроэлементов;
-
2. Среда Тамия в различных концентрациях (15, 30, 50, 65 и 80 %) с добавлением дополнительных растворов микроэлементов;
-
3. Культуральная среда, указанная в патенте;
-
4. Комбинации патентной культуральной среды и среды Тамия (1:1, 2:1, 3:1).
Дополнительные растворы микроэлементов состоят из двух частей, состав которых приведен в табл. 2.
Различные концентрации питательной среды получены путем разбавления исходного 100 % раствора питательной среды Та-мия дистиллированной водой. В вариантах питательной среды с добавлением микроэлементов их внесение осуществлялось из расчета 0.5 мл каждого раствора на 1 л среды (Ляпунова, 2015).
Засев водоросли производился с начальной плотностью 0.20 единицы оптической плотности. После засева на среду проводилось ежедневное наблюдение динамики на-
Таблица 2. Состав дополнительных растворов микроэлементов
Согласно основному закону светопогло-щения, существует прямопропорциональная зависимость между оптической плотностью и концентрацией растворенного вещества в растворе. Подобная связь наблюдается и между оптической плотностью и числом клеток в водорослевой суспензии. Таким образом, величина оптической плотности позволяет оперативно и с высокой точностью оценивать изменения в численности клеток на протяжении роста водорослевой культуры.
В работе были исследованы:
-
• динамика нарастания культуры;
-
• удельная скорость роста;
-
• время достижения максимальной оптической плотности (ОП), принятой за 1.45 ед., при первоначальном внесении культуры в среду;
-
• время выхода на экспоненциальную фазу роста;
-
• время достижения максимальной оптической плотности (ОП) при пересеве культуры в фазу экспоненциального роста.
Определение удельной скорости роста (1) позволяет оценить, насколько эффективно культура микроорганизмов, в частности водорослей, использует ресурсы среды. При измерении удельной скорости роста с использованием оптической плотности в водных культурах водорослей удельная скорость роста будет характеризовать, как быстро меняется оптическая плотность (косвенно, количество клеток) в единицу времени. Наиболее эффективно рассчитывать удельную скорость роста в экспоненциальной фазе, когда организм активно делится и скорость роста зависит от доступных ресурсов. Для расчета достаточно любых двух экспериментальных точек:
Д = (ln(D2) - ln(D 1)) / (t2-tj (1), где д - удельная скорость роста (сут-1); In (D 1) - натуральный логарифм оптической плотности в момент времени 11; In (D 2) - натуральный логарифм оптической плотности в момент времени 12; 11 и 12 - моменты времени, на которых проводятся замеры.
Обработка полученной информации осуществлялась с использованием пакета приложений Microsoft Excel 2016. Оценки средних и доверительных интервалов проводили стандартными методами математической статистики. На диаграммах представлены средние значения и стандартные ошибки. Результаты
Согласно полученным результатам по динамике роста микроводоросли C. kessleri на питательной среде Тамия различных концентраций без внесения дополнительных микроэлементов (рис. 1), наилучший вариант для культивирования водоросли - концентрация среды Тамия в 30 %. При концентрации в 15 % переходная фаза занимает на одни сутки больше, что может быть вызвано недостатком питательных веществ, из-за чего клетки водоросли имеют более низкую активность и им необходимо больше времени для усвоения ресурсов и активации ферментов для повышения метаболических процессов и начала активного деления. Низкая концентрация таких питательных веществ, как азот и углерод, необходимые для синтеза белков и углеводов, а также фосфор, необходимый для синтеза нуклеотидов, не дает клеткам возможности быстро начать деление с высокой скоростью. Таким образом, переход из лаг-фазы в фазу экспоненциального роста замедляется.
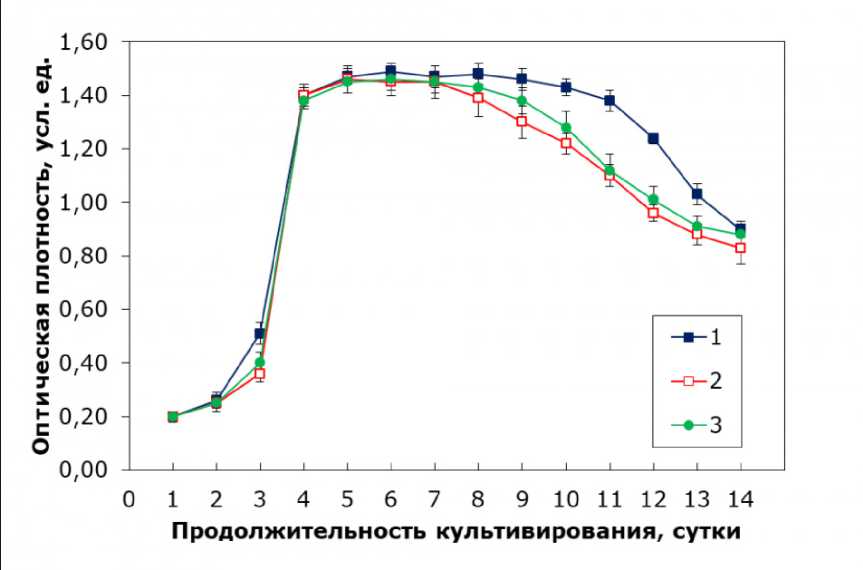
Рис. 1. Кривые роста C. kessleri в зависимости от используемой концентрации среды Тамия (без внесения дополнительных микроэлементов): 1 - среда Тамия с концентрацией 15 %, 2 - среда Тамия с концентрацией 30 %, 3 – среда Тамия с концентрацией 50 %, 4 – среда Тамия с концентрацией 65 % Fig. 1. Growth curves of C. kessleri depending on the concentration of Tamya medium used (without additional trace elements): 1 – Tamiya medium with a concentration of 15 %, 2 – Tamiya medium with a concentration of 30 %, 3 – Tamiya medium with a concentration of 50 %, 4 – Tamiya medium with a concentration of 65 %
При больших концентрациях увеличивается непосредственно лаг-фаза, что особенно хорошо заметно при концентрации среды Тамия в 65 %. Это может быть связано с несколькими факторами, такими как токсичность продуктов метаболизма, осмотический стресс и нарушение осморегуляции из-за избыточных концентраций некоторых ионов (например, фосфор и/или магний).
Обобщенные результаты по выходу на фазу экспоненциального роста и достижения оптической плотности в 1.45 ед. приведены в табл. 3.
Таблица 3. Рост водорослей при различных концентрациях среды Тамия без внесения в среду дополнительных микроэлементов
|
Среда Тамия без микроэлементов |
|||||
|
0.15 |
0.3 |
0.5 |
0.65 |
0.8 |
|
|
Время достижения ОП 1.45 ед. при полном жизненном цикле, сут |
9 |
5 |
6 |
11 |
- |
|
Время, необходимое для выхода на фазу экспоненциального роста, сут |
5 |
3 |
4 |
8 |
- |
|
Время достижения ОП 1.45 ед. при пересеве в экспоненциальную фазу, сут |
4 |
3 |
4 |
6 |
- |
При 15 % концентрации время достижения оптимальной оптической плотности составило 9 суток, а выход на экспоненциальную фазу занял 5 суток, что указывает на замедленный рост культуры. Наилучшие результаты были получены при 30 % концентрации среды, где время до достижения ОП уменьшилось до 5 суток, а время выхода на экспоненциальную фазу составило 3 суток. При повышении концентрации до 50 % рост микроводоросли также улучшался, однако наблюдалось замедление роста в фазах выхода на экспоненциальную фазу и пересева. Высокие концентрации (65 % и 80 %) привели к значительному ухудшению результатов, при 80 % концентрации среды Тамия клетки водорослей практически не выживали. Таким образом, оптимальными для культивации являются концентрации среды Тамия в пределах 30–50 %. Удельная скорость в фазе экспоненциального роста составила 0.86 сут-1 для концентрации 30 % и 0.65 сут-1 для концентрации 50 %.
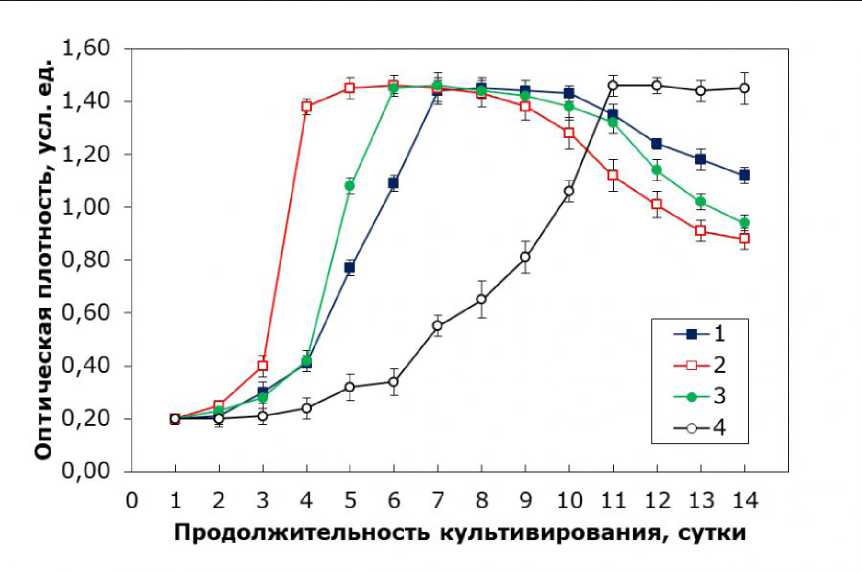
При использовании питательной среды Тамия с внесением дополнительных микроэлементов (рис. 2) можно увидеть более продолжительное нахождение культуры в стационарной фазе для всех концентраций среды, однако общая зависимость остается схожей.
. 1,60 J 1,40 -* 1,20 -§ too о 0,80 с к 0,60 га а У 0,40 - ь 0,20 О 0,00 J
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Продолжительность культивирования, сутки
Рис. 2. Кривые роста C. kessleri в зависимости от используемой концентрации среды Тамия (с внесением дополнительных микроэлементов): 1 - среда Тамия с концентрацией 15 %, 2 - среда Тамия с концентрацией 30 %, 3 - среда Тамия с концентрацией 50 %, 4 - среда Тамия с концентрацией 65 %
Fig. 1. Growth curves of C. kessleri depending on the concentration of Tamiya medium used (with additional trace elements): 1 – Tamiya medium with a concentration of 15 %, 2 – Tamiya medium with a concentration of 30 %, 3 – Tamiya medium with a concentration of 50 %, 4 – Tamiya medium with a concentration of 65 %
Из приведенных в табл. 4 данных, где к среде Тамия в тех же концентрациях дополнительно добавляли растворы микроэлементов, видно, что время достижения оптимальной оптической плотности при концентрации среды 15 % составило 7 суток, время выхода на экспоненциальную фазу – 4 суток, а при пересеве – 3 суток. При 30 % концентрации результаты улучшились (5, 3 и 3 суток соответственно). При 50 % концентрации время до ОП увеличилось до 6 суток, но остальные параметры остались на уровне 4 суток. При 65 % наблюдается замедление роста (11 суток для достижения ОП и 7 суток для выхода на экспоненциальную фазу). При
80 % концентрации среды клетки водорослей не выжили. Таким образом, добавление микроэлементов улучшает рост при всех изученных концентрациях, но при слишком высоких концентрациях (80 %) происходит гибель клеток. Оптимальными вариантами вновь оказались концентрации среды Тамия 30-50 %. Удельная скорость роста для концентрации среды Тамия 30 % составила 0.85 сут-1, для 50 % - 0.62 сут-1.
В результате сравнения применения культуральной среды из патента и ее комбинаций со средой Тамия были получены следующие результаты (рис. 3).
Таблица 4. Рост водорослей при различных концентрациях среды Тамия с внесением в среду дополнительных микроэлементов
|
Среда Тамия с микроэлементами |
|||||
|
15 |
(%) |
80 |
|||
|
30 |
50 |
65 |
|||
|
Время достижения ОП 1.45 ед. при полном жизненном цикле, сут |
7 |
5 |
6 |
11 |
- |
|
Время, необходимое для выхода на фазу экспоненциального роста, сут |
4 |
3 |
4 |
7 |
- |
|
Время достижения ОП 1.45 ед. при пересеве в экспоненциальную фазу, сут |
3 |
3 |
4 |
6 |
- |
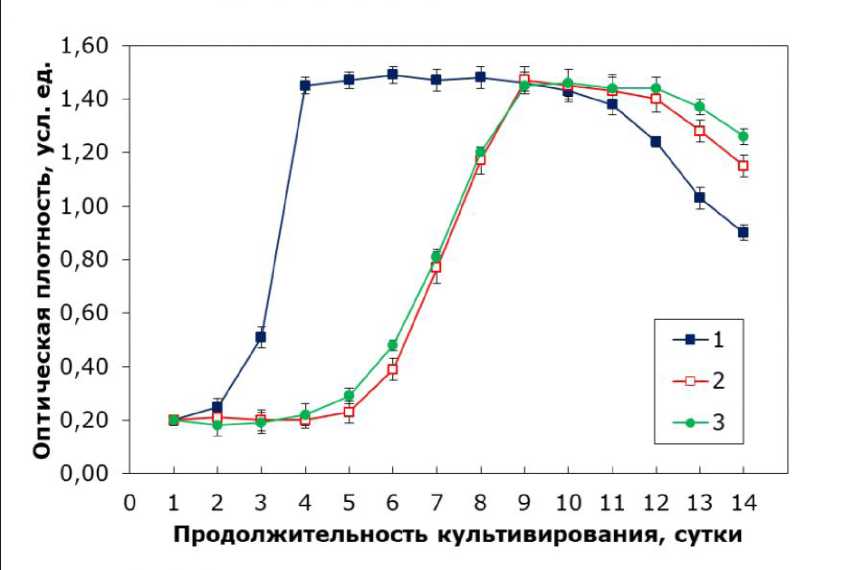
Рис. 3. Кривые роста C. kessleri при культивировании на эталонной питательной среде и ее комбинациях со средой Тамия в различных соотношениях: 1 – питательная среда из патента, 2 – комбинация среды Тамия и патентной среды в соотношении 2:1, 3 – комбинация среды Тамия и патентной среды в соотношении 3:1
Fig. 3. Growth curves of C. kessleri when cultivated on a reference nutrient medium and its combinations with Tamiya medium in various ratios: 1 – the nutrient medium from the patent, 2 – a combination of Tamiya medium and patent medium in a ratio of 2:1, 3 – a combination of Tamiya medium and patent medium in a ratio of 3:1
При использовании питательной среды, указанной в патенте, кривая роста ожидаемо показывает хорошие результаты по выходу из лаг-фазы, росту культуры и времени нахождения в стационарной фазе, а удельная скорость роста в экспоненциальной фазе равна 0.88 сут-1. Комбинация питательной среды Тамия и патентной питательной среды в соотношении 1:1 привела к гибели культуры, а в соотношениях 2:1 и 3:1 можно было увидеть продолжительную лаг-фазу и довольно короткую стационарную фазу. Данные эффекты можно объяснить измененным соотношением макроэлементов, например азота, фосфора и калия, из-за чего клеткам необходимо переключаться на другой механизм потребления транспортных веществ, также избыток отдельных элементов, таких как фосфаты, может быть токсичными. Комбинирование двух сред увеличивает концентрацию солей в растворе, что может вызывать осмотический стресс и/или дегидратацию, и клеткам необходимо длительное время для адаптации. Токсичные метаболиты, например аммиак, органические кислоты, кислородные радикалы и др., которые токсичны сами по себе, также могут взаимодействовать с различными компо- нентами питательной среды, создавая тем самым дополнительные стрессовые условия.
В табл. 5 приведены обобщенные резуль таты по культивированию хлореллы на культуральной среде, указанной в патенте, и различных ее комбинациях со средой Тамия.
Таблица 5. Рост водорослей при культивировании на культуральной среде, указанной в патенте, и различных ее комбинациях со средой Тамия
|
Культуральная среда, указанная в патенте |
Комбинация сред |
||
|
1:1 2:1 • |
3:1 |
||
|
Время достижения ОП 1.45 ед. при полном жизненном цикле, сут |
5 |
- 9 |
9 |
|
Время, необходимое для выхода на фазу экспоненциального роста, сут |
3 |
- 7 |
6 |
|
Время достижения ОП 1.45 ед. при пересеве в экспоненциальную фазу, сут |
3 |
- 6 |
5 |
Для среды из патента время достижения оптимальной оптической плотности составило 5 суток, выход на экспоненциальную фазу – 3 суток, а при пересеве – 3 суток. Для комбинации 1:1 результаты не были получены, т. к. культура погибла. При комбинациях 2:1 и 3:1 время до ОП составило 9 суток, что свидетельствует о замедлении роста по сравнению с эталонной средой, но осталь ные параметры (выход на экспоненциальную фазу и пересев) оставались в пределах 6–7 суток. Таким образом, комбинации среды из патента со средой Тамия показали ухудшение роста, особенно при соотношении 1:1. На рис. 4 отображены кривые роста, показавшие лучшие результаты при культивировании.
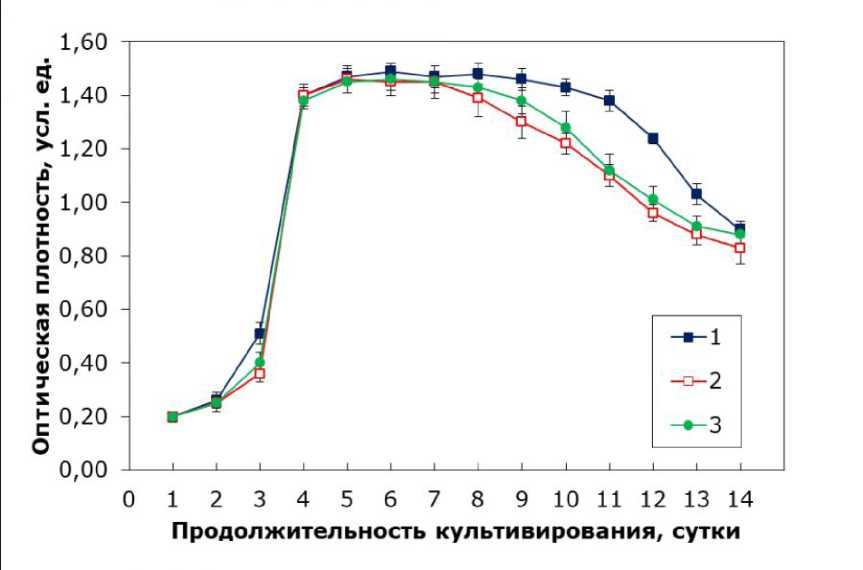
Рис. 4. Наилучшие кривые роста C. kessleri при культивировании на различных вариантах среды: 1 - питательная среда из патента, 2 - среда Тамия с концентрацией 30 % (без внесения дополнительных микроэлементов), 3 – среда Тамия с концентрацией 30 % (с внесением дополнительных микроэлементов)
Fig. 4. The best growth curves of C. kessleri when cultivated on various media variants: 1 – nutrient medium from the patent, 2 – Tamiya medium with a concentration of 30 % (without additional trace elements), 3 – Tamiya medium with a concentration of 30 % (with additional trace elements)
Кривая 1 на рис. 4 представляет эталонный вариант, который демонстрирует наилучшие результаты среди исследованных условий. На ней наблюдается более выраженный переход от лаг-фазы к фазе роста, что свидетельствует о быстром приспособлении культуры к новой среде и эффективном начале роста. Кроме того, эта среда обеспечивает более длительное нахождение культуры в стационарной фазе, что является индикатором стабильности метаболической активности клеток в условиях насыщения питательными веществами.
Кривые 2 и 3, хотя и имеют некоторые показатели, уступающие эталонному варианту, в целом не демонстрируют существенных отличий по сравнению с ним. Удельные скорости роста не имеют явно выраженных различий: 0.88 сут-1 для кривой 1, 0.86 сут-1 для кривой 2 и 0.85 сут-1 для кривой 3. Основными отличиями являются замедленный преход от лаг-фазы к фазе роста, а также сокращенная продолжительность стационарной фазы. Однако эти различия не оказывают значительного влияния на общую динамику


