Получение клеточных линий пшеницы, устойчивых к грибу Fusarium solani
Автор: Кудиярова Ж.С., Лесова Ж.Т., Жардемали Ж.К., Гильманов М.К.
Журнал: Вестник Алматинского технологического университета @vestnik-atu
Рубрика: Естественные науки
Статья в выпуске: 3 (99), 2013 года.
Бесплатный доступ
Наиболее перспективным путем борьбы с фитопатогенами является клеточная селекция на устойчивость растений к грибковым заболеваниям. В данной работе ставилась задача получения устойчивых клеточных сомаклонов пшеницы, проявляющих устойчивость к фитопатогену гриба Fusarium solani. Были изучены активности ферментов катаболизма глютамата. Отработка условий клеточной селекции растений позволит в дальнейшем расширить возможности биотехнологии в получении устойчивых форм к заданным стрессовым факторам внешней среды.
Фитопатогены, клеточная селекция, культуральный фильтрат (кф), ферментный комплекс (фк), активность ферментов, регенеранты
Короткий адрес: https://sciup.org/140204667
IDR: 140204667 | УДК: 576.3
Текст научной статьи Получение клеточных линий пшеницы, устойчивых к грибу Fusarium solani
Заболевания пшеницы, вызываемые фитопатогенными грибами, приводят к потере до 30-40% урожая во всех регионах Казахстана [1]. Наиболее распространенными возбудителями болезней пшеницы являются грибы семейства фузариум (Fusarium solani) [2].
Наиболее перспективным путем борьбы с фитопатогенами является клеточная селекция на устойчивость растений к грибковым заболеваниям. К сожалению, применение традиционных селекционных методов выведения устойчивых сортов занимает десятки лет. Введение современных методов биотехнологии, как клеточная инженерия позволяет ускорить селекционный процесс в несколько раз [3-4].
В данной работе ставилась задача получения устойчивых клеточных сомаклонов пшеницы, проявляющих устойчивость к фитопатогену гриба Fusarium solani. Вовлечение полученных устойчивых клеточных линий пшеницы и их сомаклонов в селекционные программы ведущих селекционных центров Республики Казахстан позволит значительно повысить урожайность пшеницы.
Материалы и методы
Скрининг генотипов пшеницы с разной устойчивостью к грибу фузариуму (Fusarium solani) был проведен на сортах селекции
КазНИИ земледелия и Красноводопадской селекционно-семеноводческой станции (ЮКО: «Красноводопадская-210», «Наз», «Стекловидная - 24» и «Казахстанская - 10»).
Для изучения способности к каллусоге-незу исследуемых сортов были использованы незрелые зародыши, высаженные на питательную среду Мурасиге и Скуга (МС) [5] с разной концентрацией использования 2,4-дихлорфеноксиуксусной кислоты (2,4-Д).
По результатам экспериментов сорт пшеницы “Наз” проявил более высокую активность образования каллусов (95-100%), тогда как каллусообразующая способность остальных сортов была ниже (85-90%). Увеличение концентрации фитогормона 2.4-Д с 2,0 мг/л до 2,5 мг/л и добавление в питательную среду аминокислоту глицин (2 мг/л) и аспарагиновой кислоты (150 мг/л) привело к увеличению биомассы каллусов.
Для получения первичной суспензионной культуры клеток пшеницы были использованы ярко-желтые глобулярные каллусы с рыхлой структурой, инициированные из незрелых зародышей на агаризованной питательной среде МС. Брали по 2 г каллусной массы и вносили в плоскодонные колбы объемом 250 мл, куда предварительно наливали жидкую питательную среду Гамборга - В5 [6]. Суспензия клеток культивировалась на качалке при 120 об./мин и температуре 27+1ОС. Эксперимент проводили по разработанной в лаборатории методике [7].
Для культивирования гриба фузариума использовалась агаризованная картофельно-сахарозная питательная среда. Культуральную жидкость гриба получали из мицелия, выращенного на жидкой питательной среде Ричарда. Культивирование проводили при комнатной температуре (24 + 1ОС), в термостате. После окончания инкубационного периода – 24-25 суток, гриб образовывал мицеллиальную пленку на поверхности среды. Содержимое колбы фильтровали через бумажный фильтр, а затем полученный раствор пропускали через миллипоровский фильтр с диаметром пор 0,45 мкм. Отфильтрованную жидкость хранили при температуре 4оС в холодильнике.
Токсичность культурального фильтрата (КФ) определяли на 3-й, 6-ой и 12-й день прорастания семян пшеницы, помещая их в чашки Петри со стерильной дистиллированной водой, содержащей КФ. По размеру проростка и главного корня определяли токсичность культурального фильтрата.
Для экспериментов по клеточной селекции на устойчивость к КФ гриба концентрации 5%, 10%, 15% и 20% являются наиболее оптимальными.
Результаты и обсуждение
Для проведения клеточной селекции пшеницы к КФ гриба на каллусных культурах сорта «Наз» использовали питательную среду МС с добавлением различных концентраций КФ: 5%, 10%, 15% и 20%. Для проведения эксперимента каллусы были предварительно размножены. Опыты прово-дили в 3-х кратной повторности. Клеточные культуры еженедельно просматривались под микроскопом для визуального определения роста каллусов, проводилось взвешивание и определение прироста биомассы. Были использованы средние значения массы каллусов. Результаты эксперимента показаны в таблице 1.
В работе было применено 2 схемы селекции:
Первая схема: 4 пассажа - на селективной среде, 1 пассаж - без селективного фактора, 2 пассажа - на селективной среде, 1 пассаж - без селективного фактора и отбор устойчивых клонов.
Изначальная средняя масса каллусов, использованных в эксперименте для каждой концентрации КФ, была 250 мг. Выявлено, что при использовании концентрации КФ 5% и 10% в питательной среде наблюдался рост каллусов (130,9-118,4%), тогда как при концентрациях 15% и 20% наблюдалось резкое угнетение роста каллусов (39,421,22%). Клеточные линии, полученные на питательной среде с 10-15% КФ, были отобраны для дальнейших работ по клеточной селекции.
Таблица 1 - Изучение влияния КФ гриба Fusarium solani на прирост биомассы каллусов пшеницы
|
№ п/п |
Концентрация КФ,% |
Масса каллусов, мг 1-ый пассаж на без-селективной среде |
Прирост биомассы, % |
Масса каллусов, мг 2-ой пассаж на без-селективной среде |
Прирост биомассы, % |
|
1 |
К |
340,62 |
136,24 |
362,86 |
145,14 |
|
2 |
5 |
310,09 |
124,03 |
327,44 |
130,97 |
|
3 |
10 |
286,00 |
114,40 |
296,00 |
118,4 |
|
4 |
15 |
144,20 |
57,68 |
98,74 |
39,4 |
|
5 |
20 |
92,38 |
36,52 |
53,06 |
21,22 |
Вторая схема эксперимента состояла из культивирования каллусов на селективной среде с постепенным увеличением концентрации КФ от 5% до 20% при каждом субкультивировании с промежуточным культивированием на безселективной среде. Данная схема оказалась менее эффективной из-за того, что при 3-ем пассаже с КФ 15% происходила некротизация основной массы каллусов. По-видимому, длительное, последовательное культивирование каллусов с возрастанием концентрации КФ от 5% до 20% недостаточно для восстановления каллусов, подвергшихся действию КФ. При первой схеме каллусы возвращались после культивирования вначале на безселективную среду, затем на среду с исходной концентрацией КФ, что способствовало большему выходу интактных каллусов.
Таким образом, проведенная клеточная селекция на уровне каллусной культуры пшеницы подтвердила рабочие концентрации
КФ для отбора клеток на уровне суспензионной культуры.
Известно, что для получения истинной суспензии из первичной суспензионной культуры необходимо 4-6 месяцев. На начальном этапе формировалась гетерогенная суспензия клеток представленная одновременно клетками самых различных в морфологическим отношении типов. По мере субкультивирования в подобранных нами условиях имело место преимущественное деление клеток меристе-моидного типа. Каллусы и крупные агрегаты удалялись при просеивании суспензии через сито (диаметр пор около 200 мкм) [8]. На этой стадии проводилась селекция клеток меристемоидного типа. Для этого суспензия отстаивалась в высоких пробирках, затем отбирался средний слой, преимущественно состоящий из меристемоидных клеток, для дальнейшего культивирования. Клеточную суспензию экспонировали с КФ в течение 30 суток. Результаты опыта по влиянию КФ гриба Fuzarium solani на рост суспензионной культуры пшеницы приведены в таблице 2.
Таблица 2 - Влияние КФ гриба на рост суспензионной культуры пшеницы
|
Концентрация КФ,% |
Прирост клеток, % |
Кол-во живых клеток, % |
|
0,0 (контроль) |
100,0 |
89,0 |
|
5 |
87,0 |
80,0 |
|
10 |
66,0 |
69,0 |
|
20 |
34,0 |
30,0 |
Показано, что клетки, отселектирован-ные при КФ 5%, показали довольно высокий прирост и выход живых клеток (87,0-80,0, соответственно). При концентрации КФ 10% наблюдали стимулирующее влияние КФ на рост клеток (66,0-69,0, соответственно), а при увеличении концентрации КФ до 20% выявлено уменьшение прироста почти в 3 раза роста и количества живых клеток.
Отбор устойчивых клеточных линий проводили из суспензии, культивированной с КФ 10% и 20%. Далее клетки культивировали на среде МС с добавлением кинетина и индолилуксусной кислоты (ИУК) для наращивания биомассы. После 4-х кратного пересева устойчивые клеточные клоны были перенесены на агаризованную питательную среду МС для размножения. Через 2 недели каллусы были перенесены на среду МС для регенерации растений.
Полученные результаты исследования свидетельствуют о реальной возможности повышения устойчивости клеточной культуры к инфекционным заболеваниям на основе клеточной селекции с использованием культуральных фильтратов патогенов.
Совместно с лабораторией «Структуры и регуляции ферментов» Института молекулярной биологии и биохимии им. М.А.Айтхожина был проведен биохимический анализ клеточных культур пшеницы, полученных при культивировании на питательной среде МС, содержащей КФ гриба. Данной лаборатории принадлежит приоритет обнаружения ферментного комплекса (ФК), осуществляющего необратимое расщепление глютамата.
ФК представляет собой прочный комплекс двух ферментов – малатдегидрогеназы (МДГ) и глютаматоксалоацетатамино-трансферазы (ГОАТ), который катализирует следующую последовательность реакций: малатдегидрогеназа окисляет малат до оксалоацетата, при этом восстанавливается НАД до НАДН; далее происходит трансаминирование оксалоацетата глютаматом с участием фермента глютаматоксалоацетата-минотрансферазы (ГОАТ). Продуктами реакции являются НАДН, 2-оксоглутарат и аспартат.
Выявлено, что ФК осуществляет основной путь катаболизма глютамата, и его значение для азотного обмена трудно переоценить. Так было установлено, что более 90%-тов катаболизма глютамата осуществляет ФК глютаматдегидрогеназа (ГДГ) [9].
Таким образом, был обнаружен эффективный путь катаболизма глютамата в растениях. Известно, что стресс резко усиливает процессы деградации. Поэтому интересным было изучение активности ФК, осуществляющего катаболизм глютамата при стрессовых воздействиях на клеточную суспензионную культуру.
Данные наших результатов по изучению активности ферментного комплекса представлены на диаграммах 1-3.
Как видно из данных рисунка 1, КФ гри- ба Fusarium solani оказал негативное воздействие на содержание общего белка в суспензии.
Содержание общего белка определяли микробюретовым методом по Бейли [10].
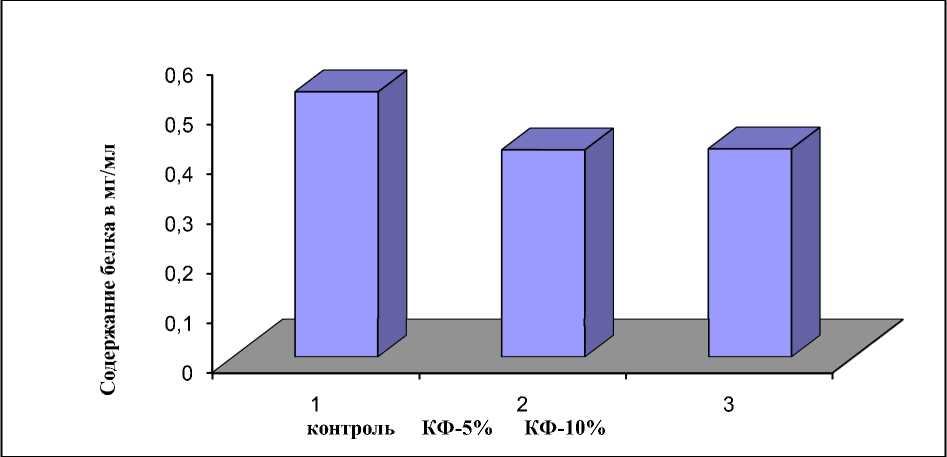
Рисунок 1 – Влияние КФ гриба F. solani на содержание белка в суспензионной культуре пшеницы.
В варианте с 10%- ным КФ гриба фузариума концентрация белка не уменьшилась, хотя уменьшение концентрации белка в данном варианте имело место. В данном случае убыль белка компенсировалось белком фильтрата.
Известно, что малатдегидрогеназа (МДГ) является одним из главных ферментов аэробного дыхания. Его активность характе- ризует энергообеспеченность клеток [11]. Нами было изучено действие КФ гриба на изменение активности этого фермента в клеточной культуре пшеницы.
Как видно из данных рисунка 2, воздействие КФ оказало сильное негативное воздействие на активность МДГ в суспензионной культуре, что указывает на ухудшение энергетики клеток в условиях биостресса.
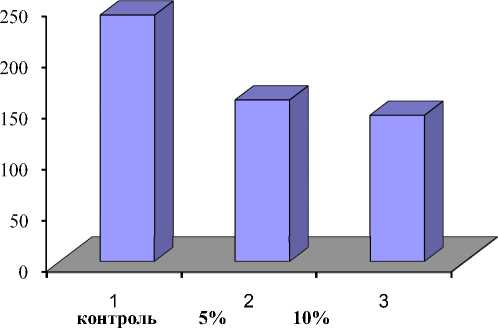
Рисунок 2 – Влияние КФ гриба F. Solani на суспензионной культуре пшеницы.
Весьма интересным явилось изучение активности ключевых ферментов катаболизма глютамата в присутствии КФ. Результаты активность ферментного комплекса МДГ-ГОАТ в изучения активности глютаматдегидрогеназы в условиях биостресса представлены на рисунке 3.
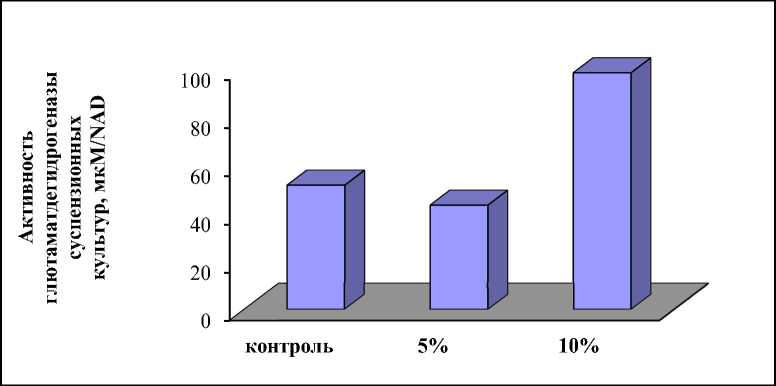
Рисунок 3 – Влияние КФ гриба F. solani на активность глютаматдегидрогеназы в суспензионной культуре пшеницы.
Показано, что активность этого фермента возрастает при концентрации КФ гриба -10%, что говорит об усилении процессов катаболизма глютамата. Так как в ходе реакции катализируемой ГДГ выделяется токсический аммиак, то повышение активности этого фермента говорит об усилении процессов деградации в суспензионной культуре.
Наиболее интересным явилось изучение активности ФК в условии биостресса. Как видно из данных таблицы 3, даже при концентрации КФ 5% полностью подавляется активность ФК, что говорит о наличии в фильтрате веществ, сильно подавляющих активность ФК, т.е. воздействие патогенов.
Таблица 3 - Влияние КФ гриба Fusarium solani на активность ферментного комплекса в суспензионной культуре пшеницы
|
№ п/п |
Концентрация КФ гриба, % |
Активность ферментного комплекса суспензионных культур, мкМ/ NADН |
|
1 |
Контроль |
163 |
|
2 |
5% |
- |
|
3 |
10% |
- |
Таким образом, в результате проведения клеточной селекции пшеницы на селективных питательных средах, содержащих культуральный фильтрат гриба Fusarium solani, выявлена возможность получения устойчивых к фитопатогену клеточных линий и растений – регенерантов пшеницы. Отработка условий массовой регенерации растений позволит в дальнейшем расширить возможности биотехнологии в получении устойчивых форм к заданным стрессовым факторам внешней среды.
Заключение
По результатам экспериментов при введении в культуру in vitro сорт пшеницы “Наз” проявил более высокую активность по частоте образования каллусов (95-100%), тогда как каллусообразующая способность остальных сортов была ниже (85-90%). Увеличение концентрации фитогормона в питательной среде для культивирования 2.4-Д с 2,0 мг/л до 2,5 мг/л и добавление в питательную среду аминокислоты глицина (2 мг/л) и аспарагиновой кислоты (150 мг/л) привело к увеличению биомассы каллусов.
Выявлено, что при добавлении в питательную среду для культивирования КФ гриба фузариума концентраций 5% и 10%, наблюдался рост каллусов (130,9-118,4%), тогда как при концентрациях 15% и 20%, наблюдалось резкое угнетение роста каллусов (39,4-21,22%).
Показано, что клетки, отселектированные при использовании КФ гриба концентрации 5%, показали довольно высокий прирост биомассы и выход живых клеток в суспензионной культуре (87,0-80,0, соответственно). При использовании концентрации КФ гриба 10%, наблюдали стимулирующее влияние КФ на рост клеток (66,0-69,0, соответственно), а при увеличении концентрации КФ до 20%, выявлено уменьшение прироста биомассы почти в 3 раза и снижение количества живых клеток.
Воздействие КФ гриба фузариума оказало сильное негативное воздействие на активность МДГ в суспензионной культуре, что указывает на ухудшение энергетики клеток в условиях биостресса.
В результате проведения клеточной се- лекции пшеницы на селективных питательных средах, содержащих культуральный фильтрат гриба Fusarium solani, выявлена возможность получения устойчивых к фитопатогену клеточных линий и растений - регенерантов пшеницы.
Отработка условий массовой регенерации растений позволит в дальнейшем расширить возможности биотехнологии в получении устойчивых форм к заданным стрессовым факторам внешней среды.
Список литературы Получение клеточных линий пшеницы, устойчивых к грибу Fusarium solani
- Кудиярова Ж.С. Изучение ключевых фер-ментов обмена глютамата в связи с морфогенезом и устойчивостью генотипов злаковых культур к засолению и ржавчине. -Алматы, 2009. -93 с.
- Vega-Sanchez M.E., Erselius L.J., Rodri-quez A.M., Bastidas O., Hohl H.R., Ojiambo P.S., Mukalazi J., Vermeulen T., Fry W.E., Forbes G.A. Host adaptation to potato and tomato within the US-1 clonal lineage of Phytophthora infestans in Uganda and Kenya.//Plant Pathol. -2000. -49:531-539.
- McDonald, B.A., and Linde C. Pathogen population genetics, evolutionary potential, and durable resistance. Annu Rev Phytopathol. -2002.-40: 349-79.
- Erwin D.C. and Ribeiro O.K. 1996. Phytophthora diseases worldwide. American Phytopathological Society Press: St. Paul, Minnesota.
- Murashige, T., Skoog, F. A Revised Medium for Rapid Growth and Bioassays with Tobacco Tissue Cultures//Physiol. Plant. -1962. -V.15. -P. 473-496.
- Gamborg O.L., Eveleigh D.E. Culture methods and detection of glucanesis in cultures of wheat and barley//Can. J. Biochem. 1968. -V. 46. -N5. P. 417-421.
- Джардемалиев Ж.К., Карабаев М.К., Мухаметкалиев М.Т., Бутенко Р.Г. Деление прото-пластов, выделенных из клеток суспензионной культуры гексаплоидной пшеницы Triticum aestivum L.//Физиол. раст. -Т.39. -Вып.1. -М, 1992. -С. 135-142.
- Лесова Ж.Т., Уразалиев Р.А Использование клеточных технологий в селекции.//Сборник статей «КазНИИЗиР», Алмалыбак, 2010. -С.167-173.
- Колдасова А.М., Гильманов М.К., Шалахметова Г.А., Цветкова В.М., Колдасова, Ш.М. Методы изучения ферментного комплекса МДГ-ГОАТ необратимого катаболизма глютамата семян пшеницы. -Алматы, 1999. -93с.
- Bailey J.L., 1962. Techniques in Protein Chemistry, p. 300. London: Elsevier Publishing Co.
- Гильманов М.К., Фурсов О.В. и Францев А.П. Методы очистки и изучения ферментов растений. -Алма-Ата: Наука, 1981. -91 c.


