Послеоперационная дистанционная лучевая терапия при раке слюнных желез у взрослых и подростков. Клинические случаи
Автор: Петровский В.Ю., Смыслов А.Ю., Сидибе Н., Полушкин П.В.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Клиническое наблюдение
Статья в выпуске: 4 т.25, 2025 года.
Бесплатный доступ
Опухоли слюнных желез составляют от 1 до 5% всех случаев рака и 3% опухолей головы и шеи. Чаще всего они возникают у людей в возрасте от 15 до 39 лет, причём около 5% случаев приходится на возраст до 20 лет. Наиболее часто опухоли поражают околоушные железы (до 72% случаев), а самой распространённой злокачественной опухолью в этой области является мукоэпидермоидная карцинома. Лечение первичных злокачественных опухолей слюнных желез обычно начинается с операции, после чего проводится лучевая терапия в зависимости от результатов гистологического исследования. В последние годы большое внимание уделяется факторам, которые могут повлиять на прогноз заболевания при опухолях головы и шеи. Благодаря развитию современных методов лучевой терапии стало возможным снизить частоту тяжёлых побочных эффектов и повреждений. В ходе исследования мы сравнили эффективность лучевой терапии с использованием технологии IMRT и 3D-конформной химиолучевой терапии. Не было обнаружено значимых различий в частоте возникновения острых лучевых реакций (р = 0,83). Наши клинические наблюдения за пациентами, прошедшими послеоперационную лучевую терапию по поводу мукоэпидермоидного рака околоушной слюнной железы, показали, что проведение лучевой терапии при наличии неблагоприятных прогностических факторов (близкие края резекции, стадия Т3-Т4 по TNM, периневральная инвазия) в соответствии с современными рекомендациями отечественных и зарубежных руководств по лечению рака слюнных желёз является необходимым компонентом современного лечения этого заболевания. При этом применение современных радиотерапевтических технологий (VMAT) с соблюдением дозиметрических характеристик на критические структуры не приводит к ухудшению качества жизни пациентов и сопровождается минимальными явлениями комбинированных реакций при многокомпонентном лечении (хирургия, лучевая терапия, химиотерапия).
Мукоэпидермоидный рак, слюнные железы, факторы прогноза, лучевая терапия, послеоперационная лучевая терапия, 3D CRT, IMRT, VMAT
Короткий адрес: https://sciup.org/149150006
IDR: 149150006 | DOI: 10.24412/1999-7264-2025-4-187-204
Текст научной статьи Послеоперационная дистанционная лучевая терапия при раке слюнных желез у взрослых и подростков. Клинические случаи
Опухоли слюнных желез — это редкое и разнообразное явление, которое может возникнуть как у подростков, так и у взрослых [1]. Они составляют примерно 1-5% от всех злокачественных опухолей и 3% от всех опухолей головы и шеи. Заболеваемость достигает своего пика в возрасте от 15 до 39 лет, причем около 5% случаев приходится на детей младше 20 лет [2–5]. Среди детей и подростков до 75–80% поражений слюнных желез являются доброкачественными, а наиболее распространенной разновидностью является плеоморфная аденома [6,7]. Важно отметить, что злокачественные опухоли слюнных желез чаще встречаются у детей (25-50% случаев), чем у взрослых 15–25% [8,9].
В соответствии с рекомендациями ВОЗ (2022) и САР (College of American Pathologists) трехступенчатая система градации злокачественности (высоко-, умеренно-, низкодифференцированная карцинома) применима к следующим гистологическим типам новообразований слюнных желез: мукоэпидермоидный рак, полиморфная аденокарцинома, аденокарцинома, плоскоклеточный рак. Двухступенчатая система градации (low/high grade) используется для внутрипротоковой карциномы слюнных желез. Для аденокистозного рака, ацинарноклеточной карциномы, гиалинизирующей светлоклеточной карциномы и низкодифференцированной аденокарциномы учитывается доля солидного компонента, и наличие более 30% солидных структур ассоциируется с неблагоприятным течением болезни.
Основную группу новообразований слюнных желез составляют опухоли эпителиального происхождения (95%), и в 80–90% случаев они развиваются в больших слюнных железах, в 10% — в малых слюнных железах. Самой распространённой локализацией при злокачественных новообразованиях являются околоушные железы (до 72%) [10], а самой частой злокачественной опухолью данной области является мукоэпидермоидная карцинома [11,12]. Мукоэпидермоидная карцинома представляет от 10% до 15% среди всех новообразований слюнных желез и до 30% среди злокачественных [13].
Хирургическое вмешательство рекомендуется рассматривать как основной метод радикального лечения пациентов с эпителиальными злокачественными новообразованиями слюнных желез [14,15]. Лечение первичных злокачественных новообразований слюнных желез в большинстве случаев начинают с хирургического лечения и затем проводится послеоперационная лучевая терапия в зависимости от данных гистологического заключения [16,17,18]. В последние годы большое внимание отводится неблагоприятным фактором прогноза течения заболевания при новообразованиях головы и шеи [19–22]. Так факторами риска рецидива новообразования слюнных желез являются категория pT (pT3/T4), дифференцировка опухоли, лимфоваскулярная/периневральная инвазия и положительные края резекции [20]. По данным некоторых авторов, пациентам раком слюнных желез ранней стадии, низкой степени злокачественности без признаков лимфогенного метастазирования и отрицательными краями послеоперационная лучевая терапия не дает улучшение выживаемости [20]. По отечественным и зарубежным клиническим рекомендациям послеоперационная лучевая терапия показана при наличии одного или нескольких неблагоприятных гистологических признаков (низкодифференцированная опухоль, положительные или близкорасположенные края резекции, периневральная инвазия, сосудистая эмболия, метастазы в регионарные лимфоузлы, стадия Т3-4а по системе TNM, аденокистозный рак, нарушение целостности опухолевого узла во время удаления). Некоторые авторы указывают на значительную роль в прогнозе степени дифференцировки опухоли. Рекомендована дистанционная лучевая терапия в следующем режиме: на ложе удаленной опухоли, с формированием дополнительного объема при наличии периневральной инвазии, включающего канал лицевого нерва до коленчатого ганглия, язычного и подъязычного нерва вплоть до основания черепа - суммарная очаговая доза (СОД) 50–66 Грей (Гр). Рекомендуемый интервал между оперативным вмешательством и сроком начала послеоперационной лучевой терапии 6–8 недель. Лучевая терапия проводится в режиме разовой очаговой дозы (РОД) 2 Гр/фракция, 5 раз в неделю в течение 5–6,5 недель (Клинические рекомендации Минздрава России ID 116 от 2024). Профилактическая послеоперационная лучевая терапия на регионарные зоны (уровень I-III) проводится при всех злокачественных опухолях подчелюстной слюнной железы (кроме ацинозно -клеточной и аденокистозной опухоли в стадии Т1) — СОД 50 Гр. Во всех остальных случаях необходимость профилактического облучения зависит от стадии, гистологического подтипа и локализации опухоли. При наличии клинически определяемых метастазов в область облучения включают лимфатические узлы I-V уровней, общая доза составляет 50-60 Гр. С развитием современных радиотерапевтических технологий частота возникновения тяжелых лучевых реакций и повреждений значительно снизилась [19,23,24]. Например, при сравнении лучевой терапии по технологии IMRT (intensity modulated radiation therapy) с 3D конформным химиолучевым лечением не было выявлено различий в частоте возникновения острых лучевых реакций (33,33% против 36,5%; p = 0,83) и поздних лучевых реакций (8,3% против 6,3%; p = 0,79) [19].
В данной статье мы представляем клинические случаи применения послеоперационной лучевой терапии при мукоэпидермальном раке околоушной железы. Следует отметить, что эта патология является редким заболеванием, и на данный момент отсутствуют многоцентровые научные исследования с анализом большого количества больных, позволяющие сделать однозначные выводы о целесообразности применения послеоперационной лучевой терапии в этой группе пациентов. Ни в отечественных, ни в зарубежных рекомендациях по послеоперационной лучевой терапии при раке слюнных желез нет четких указаний относительно объема облучения и суммарных доз с учетом конкретных факторов, влияющих на прогноз заболевания, стадии по TNM, а также иммуногистохимических и гистологических характеристик опухоли.
Клинический случай 1
Пациентка З., 18 лет
По месту жительства пациентка наблюдалась по поводу кисты околоушной железы справа. В ходе наблюдения было выявлено увеличение размеров кисты, и челюстно-лицевой хирург рекомендовал её удаление. При осмотре в околоушной области не было выявлено видимых изменений кожных покровов. В правой заушной области пальпировалось округлое образование плотноэластической консистенции, которое не вызывало болезненных ощущений. Периферические лимфатические узлы шеи не были увеличены и свободно перемещались при пальпации. Магнитно-резонансная томография (МРТ) с контрастным усилением, проведенная 23 октября 2024 года, показала неоднородную структуру правой околоушной железы. Было выявлено дополнительное включение размерами 27 × 17,5 × 27 мм с мультикистозной структурой. В Т1 ВИ МР-сигнал от образования был диффузно снижен. Также были обнаружены увеличенные внутрижелезистые лимфоузлы в верхнем и нижнем полюсах правой околоушной железы. Пациентка была госпитализирована в Республиканскую детскую клиническую больницу (РДКБ) в г. Москве для дальнейшего лечения, и 23 октября 2024 года была проведена операция по субтотальной резекции правой околоушной слюнной железы с сохранением ветвей лицевого нерва.
Макроскопическое описание гистологического препарата: участок ткани плотной консистенции, частично покрыт капсулой, размерами 4,0 × 3,0 × 2,2 см. На разрезе образование белесоватого цвета с единичными кистозными полостями. Микроскопически: фрагменты ткани слюнной железы с инвазивным ростом образования солидно-кистозного строения. Неопластический эпителий представлен крупными полигональными и округлыми клетками. Кистозные полости немногочисленны, выстланы эпидермоидными, призматическими и муцинозными клетками. В ткани опухоли выраженная лимфоцитарная инфильтрация с примесью нейтрофилов. Определяются очаги периневральной инвазии. Маркированные края резекции проходят по неизмененной ткани. При проведении иммуногистохимического исследования была выявлена экспрессия CK7, p63 и p16 в эпидермоидном компоненте, а также фокально эпителиальный мембранный антиген (EMA). При этом реакция с антителами к СК20, S100 и Androgen оказалась отрицательной. Согласно гистологическому заключению, у пациентки обнаружена мукоэпидермоидная карцинома высокой степени злокачественности. Послеоперационный диагноз звучит как рT2сNoсMo.
29 октября 2024 года было проведено ультразвуковое исследование мягких тканей, которое показало выраженный отек паренхимы околоушной слюнной железы справа. В проекции среднего и нижнего сегмента было обнаружено скопление эхо-негативной жидкости размером 29 × 16 × 37 мм, объемом 9 мл. 1 ноября 2024 года состоялся мультидисциплинарный консилиум с участием врача-онколога. Было решено, что для оценки распространенности процесса и определения стадии заболевания необходимо провести следующие обследования:
-
- МРТ мягких тканей лица и шеи с контрастом;
-
- мультиспиральную компьютерную томографию (МСКТ) мягких тканей шеи и органов грудной клетки;
-
- лимфодиссекцию подчелюстных и передне-шейных узлов с двух сторон.
В последующем показано проведение позитронно-эмиссионной томографии с компьютерной томографией с 18-фтордезоксиглюкозой (ПЭТ-КТ с 18-ФДГ).
МРТ головы и шеи с контрастным усилением от 5 ноября 2024 года показало, что в правой околоушной железе имеются послеоперационные изменения в виде кисты. При этом метастатического поражения лимфатических узлов выявлено не было. МСКТ органов грудной клетки с контрастным усилением, проведенное 6 ноября 2024 года, также не выявило метастатического поражения лимфатических узлов и легких. 11 ноября 2024 года в Российской детской клинической больнице (РДКБ) было проведено повторное хирургическое вмешательство: расширенная шейная лимфаденоэктомия, невролиз и декомпрессия ветвей лицевого нерва, а также пластика раны местными тканями. Послеоперационное гистологическое исследование выявило реактивные изменения в лимфатических узлах, но без признаков метастазирования. В ткани слюнной железы и окружающих мягких тканях обнаружены рубцовые и атрофические изменения, а также лимфоцитарная инфильтрация, что свидетельствует о процессе заживления без опухолевого роста. ПЭТ-КТ с 18F-ФДГ, проведенное в ноябре 2024 года, показало референсные значения: для печени — SUVmax 2,4, для пула крови — SUVmax 1,5. Отмечается неоднородная гиперфиксация по ходу хирургического доступа в мягких тканях околоушной области справа без убедительно дифференцируемого патологического субстрата по данным КТ (SUVmax5,2). На этом фоне определяются единичные верхние яремные лимфатические узлы справа до 5 мм по короткой оси с повышенным накоплением радиофармпрепарата (SUVmax 2,2). Остальные лимфатические узлы не увеличены, без повышенного накопления. Согласно данным анамнеза, хирургическое лечение было проведено менее восьми недель назад. Вероятно, изменения носят реактивный характер, но для точной оценки ситуации рекомендуется МРТ органов головы и шеи. В декабре 2024 года было проведено МРТ головы и шеи с контрастированием. В результате было выявлено, что в правой околоушной железе имеются послеоперационные изменения, включая фиброзно-спаечный процесс. В январе 2025 года было проведено контрольное МРТ головы и шеи с контрастированием. Исследование показало положительную динамику: отек и интенсивность контрастирования паренхимы правой околоушной железы уменьшились. В январе 2025 года пациентка была проконсультирована врачом-радиотерапевтом в ФГБУ РНЦРР МЗ РФ. В ходе консультации было установлено, что, учитывая проведенное лечение, гистологический диагноз, фактор неблагоприятного прогноза — очаги периневральной инвазии, а также данные диагностических обследований, пациентке показана 3D конформная дистанционная лучевая терапия на ложе опухоли.
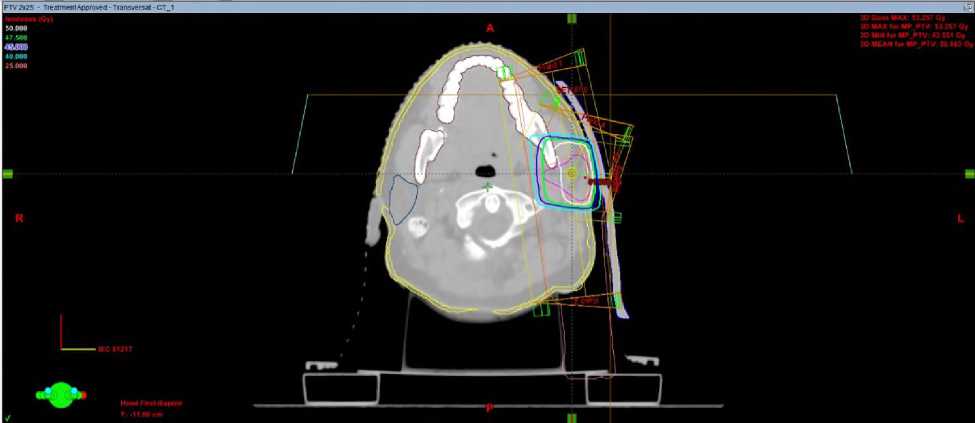
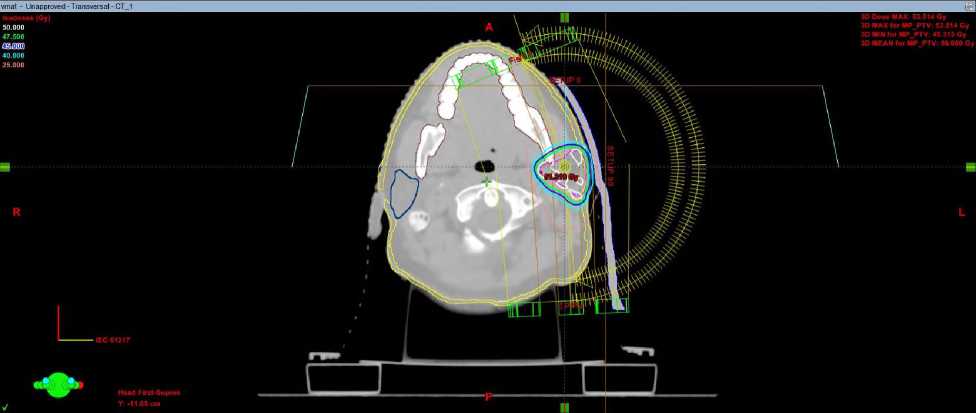
Настоящее состояние при госпитализации: положение активное, общее состояние удовлетворительное, ECOG 1, телосложение правильное, кожа и видимые слизистые нормальной окраски, лимфатические узлы нормальных размеров, костно-мышечный аппарат без патологии, щитовидная железа не увеличена, молочные железы не изменены. Локальный статус: в околоушной области определяется постоперационный рубец без признаков воспаления., Неврологический статус: пациентка контактна, в пространстве, времени и собственной личности ориентирована, черепные нервы без особенностей. С февраля по март 2025 на базе отделения лучевой терапии детей ФГБУ РНЦРР МЗ РФ проведен курс дистанционной лучевой терапии на линейном ускорителе электронов (ЛУЭ) с оптимизацией дозного распределения по технологии VMAT (volumetric modulated arc therapy/объемно модулированное облучение) на ложе опухоли правой околоушной железы с РОД 2 Гр до СОД 50 Гр (Рис.1). При дозиметрическом планировании также был создан план лучевой терапии по технологии 3D-CRT (трехмерная конформная лучевая терапия) для дозиметрического сравнения с планом по технологии VMAT (для всех трех клинических случаев, представленных в данной статье) и при планировании лучевого лечения исходили из дозовых рекомендаций для объемов облучения и критических органов по RTOG и QUANTEC.
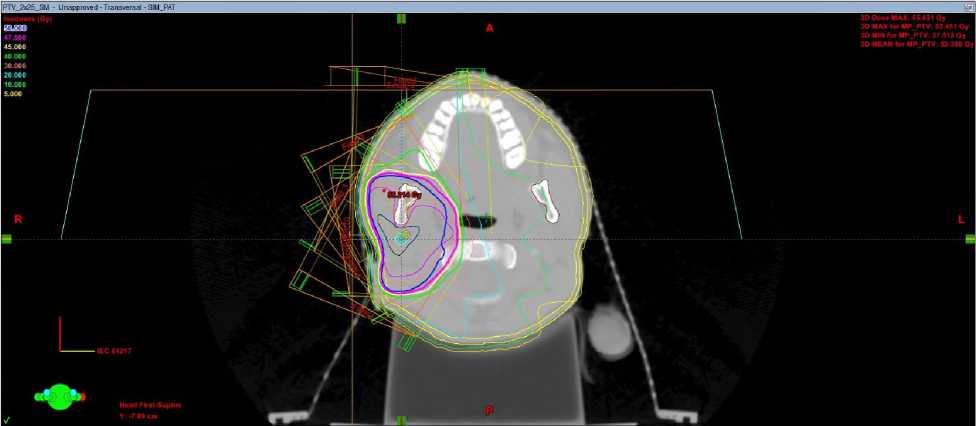
а
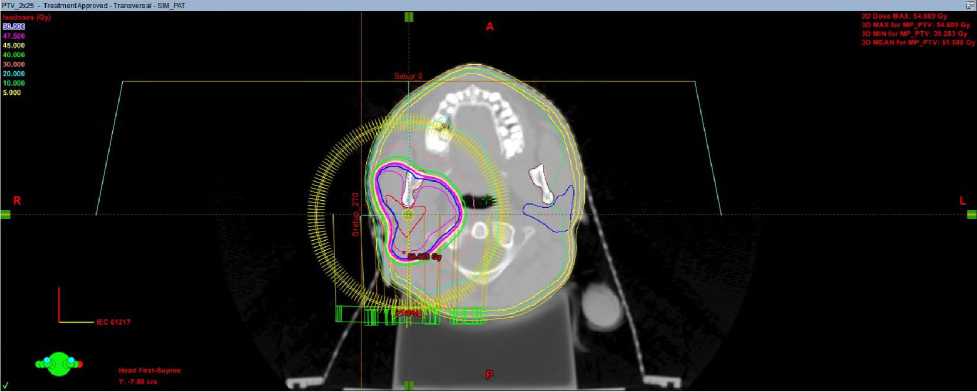
б
Рис. 1. Дозное распределение в аксиальной плоскости при плане 3D-CRT (а) и VМAT (б) у больной З., 18 лет.
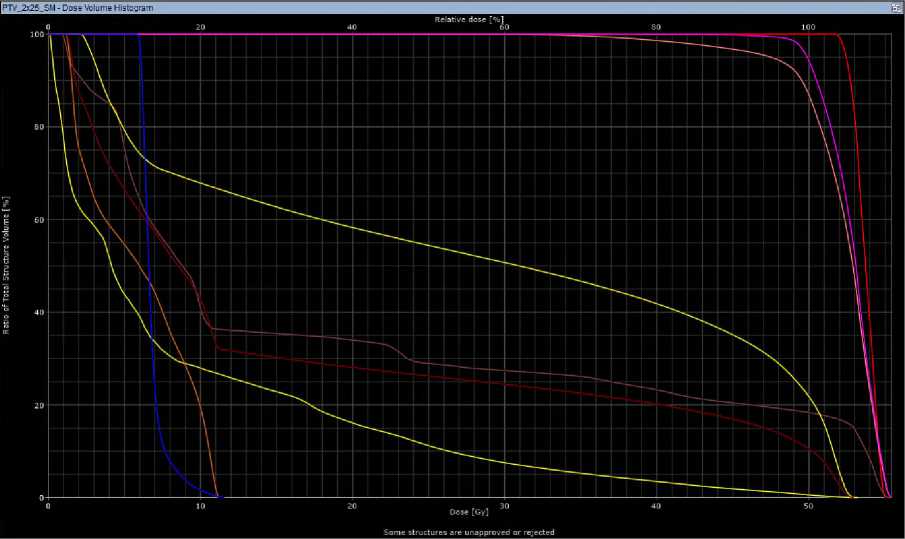
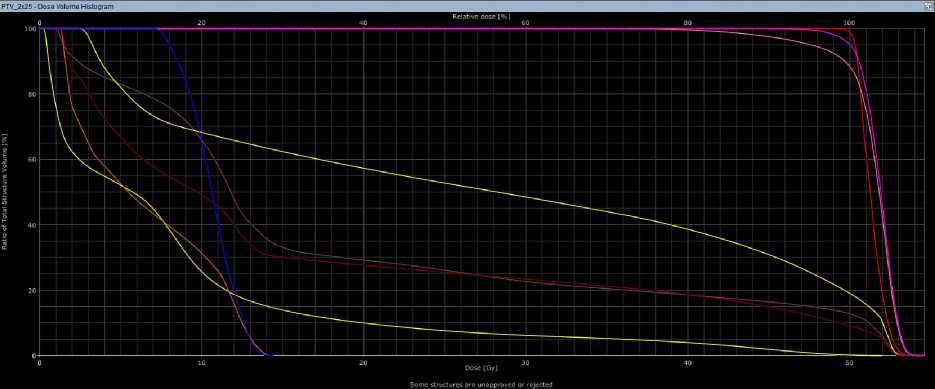
б
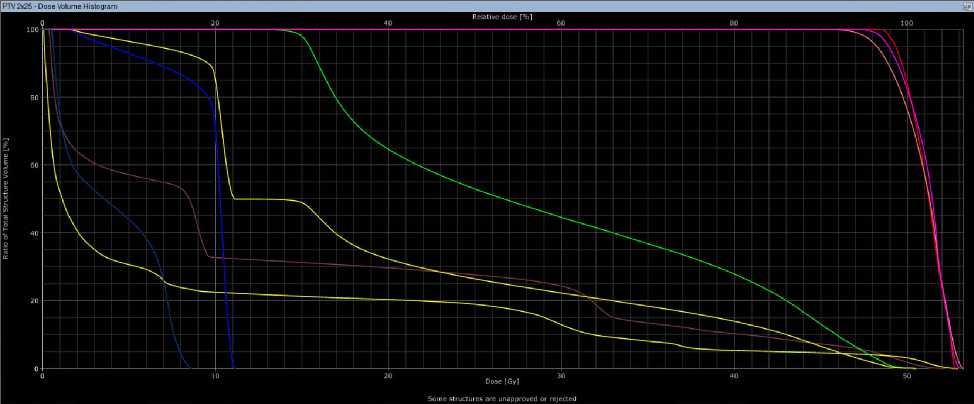
Рис 2. Гистограммы при 3D-CRT (а) и VМAT (б) у больной З.,18 лет.
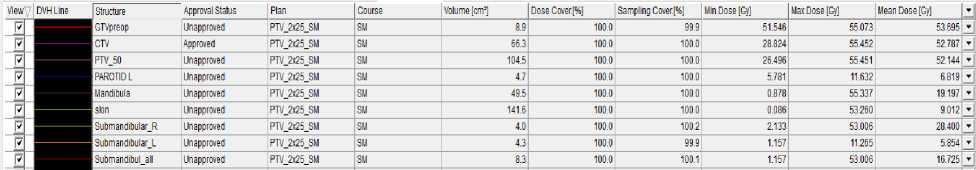
Согласно гистограмме DVH (Рис. 2), при использовании 3D-CRT были достигнуты следующие значения: средняя доза облучения (PTV50 mean) — 52,1 Гр; максимальная доза облучения (PTVmax) — 55,4 Гр;доза облучения, превышающая 98% (D98) — 46,2 Гр; средняя доза облучения (D50) — 50,0 Гр; доза, воздействующая на нижнюю челюсть (Dmean) — 19,2 Гр; доза для подчелюстной железы справа (на стороне облучения) (Dmean) — 28,4 Гр, а также объем облученной ткани (V26) — 53,6%;доза для кожи (Dmean) — 9 Гр, а максимальная доза (Dmax) — 53,2 Гр. В случае использования технологии VMAT были получены следующие значения: средняя доза облучения (PTV50 mean) — 51,3 Гр;
максимальная доза облучения (PTVmax) — 54,6 Гр;доза облучения, превышающая 98% (D98) — 46,2 Гр; средняя доза облучения (D50) — 50,0 Гр; доза на нижнюю челюсть (Dmean) — 18,7 Гр; доза на подчелюстную железу справа (на стороне облучения) (Dmean) — 27,7 Гр; объем облученной ткани (V26) — 51,8%; доза для кожи (Dmean) — 8,3 Гр, а максимальная доза (Dmax) — 52,0 Гр. Лечение пациентка перенесла удовлетворительно, была выявлена лучевая реакция в виде дерматита I степени по критериям CTCAE v.4.0 (Common Terminology Criteria for Adverse Events, версия 4.0). Пациентка выписана с рекомендациями, на данный момент срок наблюдения составляет 7 месяцев, и мы не зафиксировали ранних лучевых повреждений.
Клинический случай 2
Пациент М., 16 лет
В марте 2023 года у пациента впервые появилось безболезненное образование в области угла нижней челюсти с левой стороны. В апреле он обратился к хирургу по месту жительства, который предположил, что это лимфаденит, и назначил антибактериальную терапию в сочетании с местным противомикробным лечением. Однако улучшение было незначительным. В мае того же года в городе Твери была проведена пункционная биопсия образования. Результаты цитологического исследования показали, что на фоне воспаления и скопления слизи присутствуют элементы слюнной железы. 5 июля 2023 года в Люберецком центре охраны здоровья и медицинской помощи (МОЦОМД) было проведено удаление кисты околоушной железы. Гистологическое исследование подтвердило, что у пациента сформировалась киста, вызванная расширением протока слюнной железы и хроническим неспецифическим воспалением. Через три месяца после операции в том же месте вновь появилось образование. 18 октября 2023 года в МОЦОМД было проведено повторное удаление кисты левой околоушной железы. Результаты гистологического исследования подтвердили, что это действительно киста слюнной железы. После этого пациент не обращался к врачам в течение года. В октябре 2024 года было проведено контрольное МРТ околоушных желез с контрастным веществом. В результате исследования было обнаружено, что в левой околоушной железе имеется многокамерное кистозное образование неправильной формы, которое имеет размеры 26 × 21 × 22 мм. Контур образования неровный и нечеткий, а толщина стенки неравномерная. Внутри кисты находится жидкость. Образование деформирует кожу, а подкожная жировая клетчатка истончена или отсутствует. Также были выявлены многочисленные неспецифически увеличенные лимфатические узлы, некоторые из которых достигают в поперечнике 13 мм. 18 декабря 2024 года в Российской детской клинической больнице (г. Москва) было проведено удаление образования левой околоушной слюнной железы.
Гистологическое исследование показало следующее:
Макроскопически образование имело размеры 55 × 40 × 40 мм. На разрезе ткань была белесоватого цвета, с кистами, заполненными зеленоватым содержимым. Микроскопически были выявлены фрагменты ткани слюнной железы, пораженные инвазивным ростом образования кистозно-солидного строения, в котором кистозный компонент составлял более 75%. Кистозные полости были выстланы полигональными эпидермоидными и муцинозными клетками. Ядерная атипия была слабо выражена, а митотическая активность отсутствовала. Неопластический эпителий активно размножался, образуя железистые и гнездные структуры. В просвете кистозных полостей был обнаружен муцин и десквамированный эпителий. На периферии опухоли отмечалась умеренно выраженная лимфоцитарная 194
инфильтрация. Признаков лимфоваскулярной и периневральной инвазии выявлено не было. Края резекции проходили по неизмененной ткани. Лимфатические узлы пациента имели реактивные изменения, липоматоз и эктопию ткани слюнной железы, но без признаков метастатического поражения. В результате был установлен диагноз: мукоэпидермоидная карцинома низкой степени злокачественности. Послеоперационный диагноз был следующим: pT2 сN0 сM0.
В декабре 2024 года при контрольной МСКТ мягких тканей шеи с контрастным усилением были обнаружены послеоперационные изменения в области левой околоушной слюнной железы. Регионарные лимфатические узлы как справа, так и слева были увеличены в количестве и размере, достигая максимальной величины 15 × 8 мм, без признаков накопления контрастного препарата. УЗИ лимфатических узлов в области головы и шеи, проведенное также в декабре 2024 года, показало следующее: справа — увеличение переднешейных и подчелюстных лимфатических узлов до 18 × 8 мм, без каких-либо особенностей в структуре и васкуляризации; слева — увеличение переднешейных, заднешейных и подчелюстных лимфатических узлов до 18 × 7 мм.
Детский онколог рекомендовал провести ПЭТ-КТ с 18ФДГ. Исследование было выполнено 26 декабря 2024 года, и результаты показали, что референсные зоны включают печень (SUVmax 3,5) и пул крови (SUVmax 2,5). В левой околоушной области наблюдаются послеоперационные изменения мягких тканей с повышенным накоплением радиофармпрепарата (SUVmax 5,3). Однако патологические образования не удается четко различить. В верхних яремных лимфатических узлах также наблюдается повышенное накопление радиофармпрепарата: слева — до 8 мм без нарушения дифференцировки (SUVmax 2,7), а справа — до 10 мм (SUVmax 3,0). Средние яремные лимфатические узлы с обеих сторон достигают 10 мм по короткой оси с аналогичным уровнем накопления (SUVmax 3,0).
Поскольку хирургическое вмешательство было проведено менее 8 недель назад, рекомендуется выполнить МРТ для сопоставления с данными ПЭТ. 14 января 2025 года было проведено МРТ мягких тканей шеи с контрастным веществом. Согласно заключению, в зоне вмешательства обнаружены отечно-рубцово-фиброзные изменения и дефицит левой околоушной железы.
Пациент был направлен на консультацию к радиотерапевту. В рамках консультации в ФГБУ РНЦРР Министерства здравоохранения Российской Федерации пациенту было рекомендовано проведение дистанционной лучевой терапии на область новообразования с охватом послеоперационного шва и реактивных лимфатических узлов.
Перед началом лучевой терапии пациенту была назначена биопсия реактивного подчелюстного лимфатического узла, которая была проведена в РДКБ (г. Москва). Согласно гистологическому заключению, лимфатические узлы имели реактивные изменения, но без признаков метастатического поражения.
На момент госпитализации пациент находится в активном положении, его общее состояние оценивается как удовлетворительное, по шкале ECOG 1. Телосложение правильное, кожа и видимые слизистые оболочки имеют нормальную окраску. Лимфатические узлы имеют нормальные размеры, костно-мышечный аппарат без патологий, щитовидная железа не увеличена. В области послеоперационных рубцов не выявлено признаков воспаления. Неврологический статус: общемозговой, очаговой и менингеальной симптоматики не обнаружено, черепные нервы без особенностей. В период с марта по апрель 2025 года на базе отделения лучевой терапии детей ФГБУ РНЦРР Минздрава РФ был проведён курс дистанционной лучевой терапии на линейном ускорителе (ЛУЭ) с болюсом диаметром 5 мм по технологии VMAT на ложе опухоли левой околоушной железы. В процессе терапии были охвачены также послеоперационный рубец и область изменённых реактивных лимфоузлов слева. Радиоактивное облучение проводилось с разовой очаговой дозой (РОД) 2 Гр и суммарной очаговой дозой (СОД) 50 Гр (Рис. 3).
а
б
Рис. 3. Дозное распределение в аксиальной плоскости при плане 3D-CRT (а) и VМAT (б) у больного М, 16 лет.
а
|
йел |
ИН Line |
StruduFE Approve Satus |
Plan |
Course |
Volume [cm3] |
Oose Cover [%] |
SamplingCover.pt] |
Un Dose [Eft |
Mai Dose [Gy] Mean Dose [Gj| |
• |
|
|
7 |
5ЙП UnappIMd |
ma |
HSNJIJEJD |
24s ■ |
100.0 |
100.0 |
0,092 |
51253 6 459 |
• |
||
|
- |
GlVprwp Unapproved |
ma |
HiN_C1_U2_3D |
14 |
100.0 |
100.2 |
48.800 |
51.598 50,032 |
■ |
||
|
CIV Approved |
vmal |
H1N_C1_U2_3D |
42.7 |
100.0 |
100.0 |
47167 |
52158 : 50014 |
■ |
|||
|
PTV50 Unapproved |
ma! |
H4N_C1_U2_3D |
75.0 |
100.0 |
100.1 |
43.318 |
53.514 49 920 |
■ |
|||
|
1? |
PAROTIDS Unapproved |
vmal |
HiNC1_U23D |
171 |
100.0 |
100.1 |
2015 |
5 420 3.454 |
• |
||
|
Subman |
vmal |
HANC1.U2.3D |
M |
100.0 |
100.0 |
11.392 |
51,126 29.271 |
■ |
|||
|
Sr>™napul_R Unapproved |
vmal |
HM_C1_U2_3D |
6.4 |
100.0 |
100.0 |
3468 |
10 002 6 654 |
• |
|||
|
- |
Мой Unapproved |
vmal |
HiN_C1_U2_3D |
109.5 |
100.0 |
100.0 |
2521 |
52353 11142 |
■ |
||
|
* |
Sub№Hiiul_ail Unapproved |
vmal |
HiN_C1_U2_3D |
128 |
100.0 |
100.0 |
34Й |
51126 17943 |
б
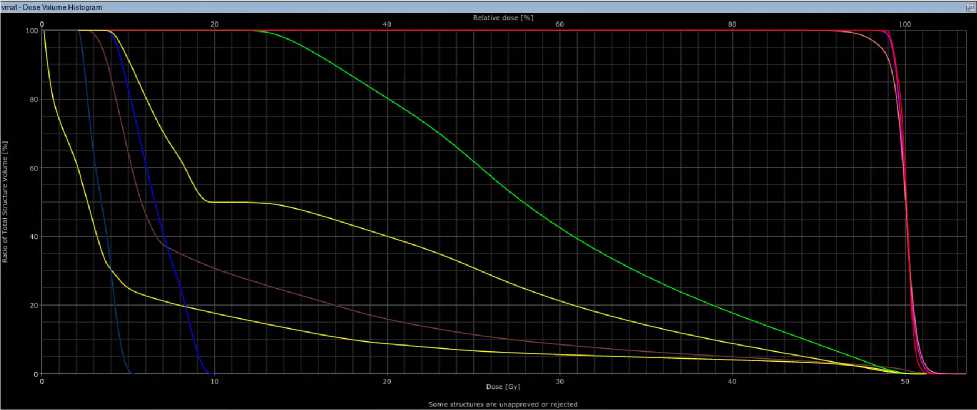
Рис 4. Гистограммы при 3D-CRT (а) и VМAT (б) у больного М, 16 лет.
Гистограмма DVH (Рис. 4) показывает, что при 3D-CRT средние показатели PTV50 составили 50,9 Гр, PTVmax — 53,2 Гр, D98 — 39 Гр, D50 — 50 Гр. На нижнюю челюсть было направлено среднее облучение в 13,9 Гр, на подчелюстную железу слева — 29,2 Гр, а V26 — 53,5%. На кожу пришлось среднее облучение в 8,7 Гр и максимальное — 52,9 Гр. В случае применения технологии VMAT эти показатели составили: 49,9 Гр, 53,5 Гр, 46 Гр, 50 Гр, 11,1 Гр, 29,2 Гр, 57%, 6,4 Гр и 51,2 Гр соответственно. После завершения лучевой терапии у пациента наблюдался дерматит первой степени по шкале CTCAE v.4.0. Он хорошо перенес лечение и был выписан с рекомендациями. В течение семи месяцев после лечения у него не было выявлено признаков ранних лучевых повреждений.
Клинический случай 3
Больная Н., 49 лет
Больная стала отмечать онемение и подергивание мимической мускулатуры слева с апреля 2024, данные жалобы медленно прогрессировали. По данным МРТ с контрастным усилением в августе 2024 г. выявлена опухоль левой околоушной слюнной железы. Выполнена биопсия, верифицирована плеоморфная аденома слюнной железы. УЗИ л/узлов от августа 2024 г.: увеличенных, патологически измененных лимфоузлов в исследуемых областях не определяется. В клинике ФМБА 24.10.2024 выполнена резекция левой околоушной слюнной железы с микрохирургическим невролизом лицевого нерва. Послеоперационное гистологическое заключение: морфологические признаки соответствуют инфильтративной карциноме слюнной железы с периневральной инвазией, распространением на лицевой нерв. В крае резекции височной ветви лицевого нерва -инфильтративный опухолевый рост, в 7 регионарных л/у без опухолевого роста. Установлен поcлеоперационный диагноз - мукоэпидермоидный рак левой околоушной слюнной железы pT4рNосMо R1, low-grade. Гистологическое заключение № 14424-49/24: низкодифференцированный мукоэпидермоидный рак слюнной железы. При ИГХ-исследовании в клетках мукоэпидермоидного рака обнаружена экспрессия р63, цитокератина 7, Ki-67 в 20% клеток. Не обнаружена экспрессия S100 и гладкомышечного актина.
Пациентка обратилась в ФГБУ РНЦРР МЗ России. Была проконсультирована химиотерапевтом, который отметил, что ей не требуется дополнительная полихимиотерапия, а рекомендуется одновременное химиолучевое лечение с радиохимиомодификацией препаратом платины. МРТ после операции, проведённой в ноябре 2024 года, показало, что состояние пациентки удовлетворительное, а в области удалённой левой околоушной слюнной железы наблюдаются послеоперационные изменения. Также были обнаружены фиброзные изменения в подкожно-жировой клетчатке возле левой жевательной мышцы. Сцинтиграфия костей не выявила признаков метастатического поражения костной системы. На междисциплинарном онкологическом консилиуме было рекомендовано провести специализированное медицинское лечение в виде 3D конформной дистанционной лучевой терапии на ложе удалённой слюнной железы слева.
В настоящее время состояние пациентки оценивается как активное, общее самочувствие удовлетворительное, ECOG 1. Она находится в ясном сознании и хорошо ориентируется в пространстве и времени, у нее не выявлено очаговой и общемозговой симптоматики. Пациентка способна самостоятельно передвигаться без посторонней помощи. Ее телосложение соответствует норме, кожа и видимые слизистые оболочки имеют обычную окраску. Лимфатические узлы не увеличены, костно-мышечная система функционирует без отклонений. Щитовидная железа и молочные железы не имеют патологических изменений. В области хирургического вмешательства отмечается рубец, который не воспаляется и не прогрессирует. После хирургического лечения выявлен парез лицевого нерва слева, в то время как остальные черепные нервы функционируют без отклонений. После изготовления индивидуальной фиксирующей термомаски, проведения КТ-топометрии и 3D дозиметрического планирования был назначен послеоперационный курс дистанционной лучевой терапии по технологии VMAT. Он проходил с декабря 2024 года по февраль 2025 года. Лучевая терапия была направлена на лимфоузлы, уши и околоушную слюнную железу слева с болюсом 5 мм.
Лечение проводилось с использованием следующих режимов: регионарный лимфоколлектор слева — с разовой очаговой дозой (РОД) 2 Гр и суммарной очаговой дозой (СОД) 50 Гр; ложе околоушной слюнной железы слева — с РОД 2 Гр и СОД 60 Гр; область ложа опухоли — с РОД 2 Гр и СОД 66 Гр. Во время лучевой терапии проводилась химиорадиомодификация с использованием цисплатина в дозировке 80 мг, в соответствии с рекомендациями химиотерапевта (Рис.5).
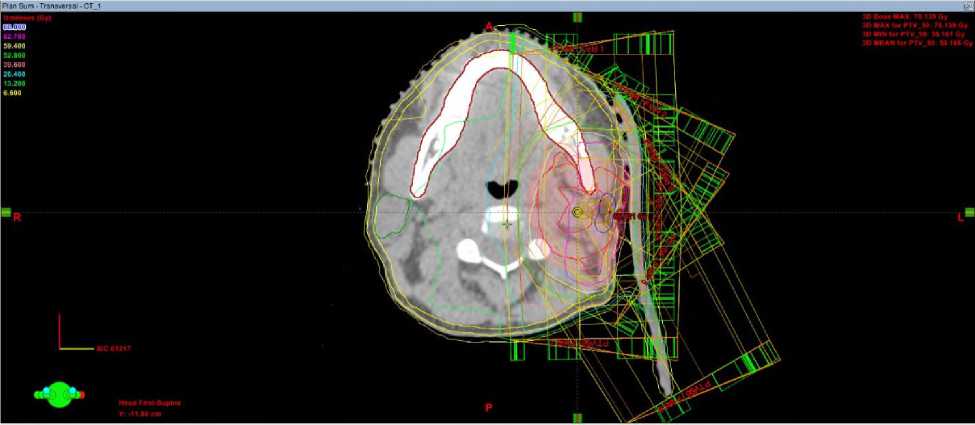
а
б
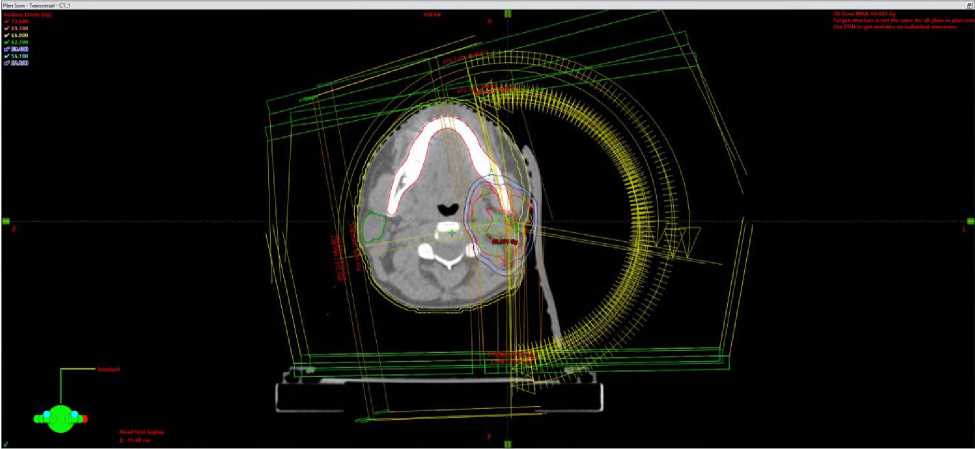
Рис. 5. Дозное распределение в аксиальной плоскости при плане 3D-CRT (а) и VМAT (б) у больной Н, 49 лет.
а
б
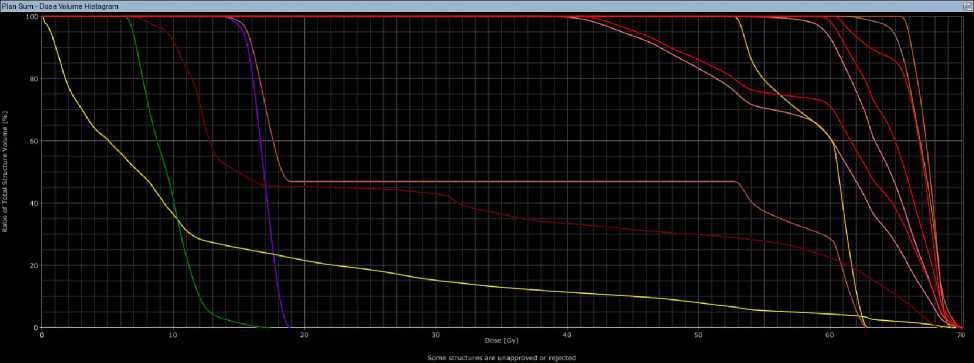
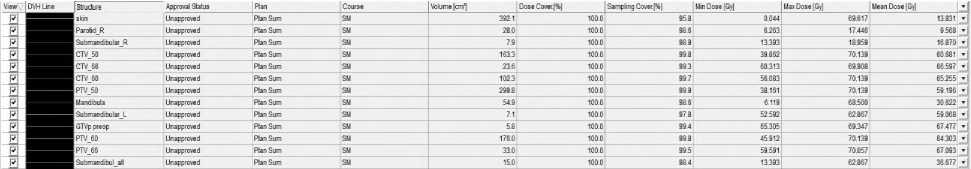
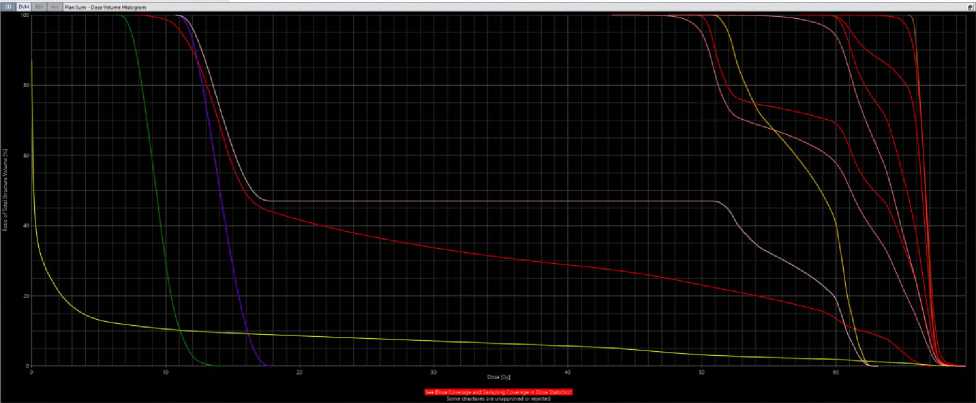
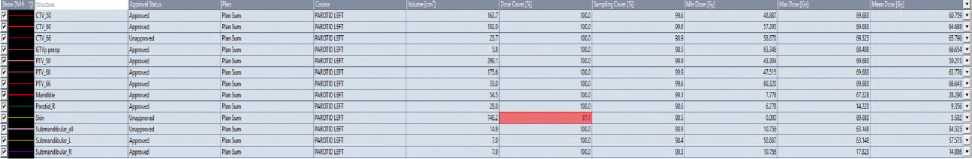
Рис 6. Гистограммы при 3D-CRT (а) и VМAT (б) у больной Н, 49 лет.
Согласно гистограмме DVH (Рис. 6), при использовании 3D-CRT PTV66, Dmean составила 67,1 Гр, PTVmax — 70,1 Гр, доза 98% (D98) — 41,5 Гр, доза 50% (D50) — 50 Гр. На нижнюю челюсть была направлена средняя доза 30,6 Гр, на подчелюстную железу слева — 59 Гр, а V26 составила 100%. На кожу были получены средние дозы 13,8 Гр и максимальная доза 69,6 Гр. При использовании технологии VMAT были достигнуты следующие результаты: 66,6 Гр, 69,6 Гр, 49,5 Гр, 50 Гр, 28,2 Гр, 57,2 Гр, 100%, 5,5 Гр и 69,6 Гр, соответственно. Пациентка перенесла лечение удовлетворительно. При выписке были выявлены острые химиолучевые реакции согласно классификации CTCAE v.4.0: мукозит I степени (обнаружен после 40 Гр), дерматит II степени (после 60 Гр), нефротоксичность I степени (креатинин — 104 мкмоль/л), а также гематотоксичность — анемия I степени (гемоглобин — 118 г/л) (после суммарной очаговой дозы (СОД) 60 Гр) и тромбоцитопения I степени (140х10 9 /л, после СОД 30 Гр).
В процессе лечения и после его завершения пациентке была назначена комплексная сопроводительная терапия, направленная на снижение выраженности нежелательных явлений, связанных с комплексным лечением, включающим хирургию, лучевую терапию и химиотерапию. В настоящее время срок наблюдения составляет 7 месяцев. Ранние лучевые повреждения отсутствуют, все проявления химической токсичности прошли. Однако сохраняется парез лицевого нерва слева, что является осложнением хирургического лечения. У всех пациентов, о которых говорится в данной статье, наблюдается ремиссия заболевания.
При анализе лучевых нагрузок наиболее важных органов риска (костная ткань нижней челюсти, слюнные железы, кожа) при данной патологии с проведением послеоперационной лучевой терапии можно отметить, что использование технологии VMAT в основном имело преимущества в сравнении с 3D-CRT. Представляем основные дозовые нагрузки на значимые критические органы для всех трех клинических случаев по двум проведенным технологиям лучевой терапии (Табл. 1).
Табл. 1. Дозовые нагрузки на основные органы риска
|
Органы риска |
1 клин. случай |
2 клин. случай |
3 клин. случай |
|
|
Доза максимальная |
55,3 |
52,2 |
68,5 |
|
|
нижняя челюсть (Гр) |
||||
|
Средняя доза |
19,2 |
13,9 |
30,6 |
|
|
Доза максимальная |
53.2 |
52.9 |
69.6 |
|
|
Кожа (Гр) |
||||
|
Средняя доза |
9,0 |
8,7 |
13,8 |
|
|
3D CRT |
ипсилатеральная * Доза максимальная |
53,0 |
50,5 |
62,8 |
|
Средняя доза |
28,4 |
29,2 |
59.0 |
|
|
Подчелюстная контралатеральная** Доза максимальная |
11,2 |
11,2 |
18,9 |
|
|
Средняя доза |
5,8 |
9,5 |
16,8 |
|
|
обе железы Доза максимальная |
53,0 |
50,5 |
62,8 |
|
|
Средняя доза |
16,7 |
19,3 |
36,6 |
|
|
Околоушная железа*** (Гр) Доза максимальная |
11,6 |
8,6 |
17,4 |
|
|
Средняя доза |
6,8 |
3,9 |
9,5 |
|
|
нижняя челюсть (Гр) Доза максимальная |
53,9 |
52,3 |
67,2 |
|
|
Средняя доза |
18,7 |
11,1 |
28,2 |
|
|
Кожа (Гр) Доза максимальная |
52,0 |
51,2 |
69,6 |
|
|
Средняя доза |
8,2 |
6,4 |
5,5 |
|
|
ипсилатеральная * Доза максимальная |
53,3 |
51,1 |
63,1 |
|
|
Средняя доза |
27,7 |
29,2 |
57,5 |
|
|
контралатеральная** Доза максимальная |
14,2 |
10,0 |
17,8 |
|
|
VH/Г А Т |
||||
|
Железа (Гр) Средняя доза |
6,4 |
6,6 |
14,0 |
|
|
обе железы Доза максимальная |
53,3 |
51,1 |
63,1 |
|
|
Средняя доза |
16,7 |
17,9 |
34,5 |
|
|
Околоушная железа*** (Гр) Доза максимальная |
14,4 |
5,4 |
14,2 |
|
|
Средняя доза |
10,5 |
3,4 |
9,3 |
Примечание: *подчелюстная железа на стороне опухолевого поражения, ** подчелюстная железа на противоположной стороне опухолевого поражения, *** околоушная железа на противоположной стороне опухолевого поражения.
В первом клиническом случае при использовании 3D-CRT были достигнуты более низкие дозовые нагрузки на контралатеральную околоушную железу по сравнению с VMATс применением «полной» арки. Dmax была снижена на 19,5%. Однако, при сравнении со вторым клиническим случаем, когда использовались две «полу-арки» в VMAT, преимущества были на стороне последней. Dmean и Dmax были уменьшены на 12,8% и 37,2% соответственно. Кроме того, средняя доза на нижнюю челюсть во втором клиническом случае также снизилась на 20,1% при использовании VMAT (две «полу-арки») по сравнению с 3D-CRT. Таким образом, мы можем рекомендовать применение двух «полу-арок» при планировании методики VMAT в рамках послеоперационной лучевой терапии при раке околоушных желез. Этот подход позволяет значительно снизить уровень облучения критически важных органов, таких как костная ткань нижней челюсти и противоположная околоушная слюнная железа.
Заключение
Мы представили клинические случаи, в которых послеоперационная лучевая терапия была проведена пациентам с мукоэпидермальным раком околоушной слюнной железы. Эти случаи показывают, что даже при наличии неблагоприятных факторов прогноза, таких как положительные края резекции, стадия Т2 или Т4 по TNМ, а также периневральная инвазия, проведение лучевой терапии остаётся необходимым этапом современного лечения. Мы следовали современным рекомендациям отечественных и зарубежных руководств по лечению рака слюнных желез и использовали современные радиотерапевтические технологии. Дозиметрические характеристики были соблюдены для критических структур. Важно отметить, что это лечение не ухудшило качество жизни пациентов и сопровождалось минимальными комбинированными реакциями.
Таким образом, многокомпонентное лечение, включающее хирургию, лучевую терапию и химиотерапию, остаётся неотъемлемой частью современной медицины при лечении рака слюнных желез. Однако в ближайшем будущем необходимо внести изменения в клинические рекомендации по лечению рака слюнных желез. Это касается и персонализированного подхода к проведению послеоперационной лучевой терапии. Важно учитывать все клинико-морфологические особенности каждого пациента, чтобы улучшить качество лечения и повысить уровень жизни после завершения терапии.
Вклад авторов. Петровский В.Ю., Полушкин П.В., Смыслов А.Ю.: разработка дизайна исследования, написание текста рукописи; Петровский В.Ю., Полушкин П.В.: получение и анализ данных, обзор публикаций по теме статьи; Сибиде Н.: обзор публикаций по теме статьи, анализ полученных данных. Все авторы прочли и одобрили финальную версию перед публикацией.
Финансирование. Источник финансирования отсутствует.
Соблюдение прав пациентов и правил биоэтики. Это исследование было проведено ретроспективно на основе данных, полученных в клинических целях, и соответствовало принципам Хельсинкской декларации. Конфиденциальность пациентов была защищена. Все пациенты подписали информированное согласие на обработку и использование персональных данных, включая медицинскую информацию.


