Применение метода линейного дискриминантного анализа спектров отражения в ближней инфракрасной области для видовой идентификации рыб семейства Лососёвые (Salmonidae)
Автор: Новиков В. Ю., Рысакова К. С., Барышников А. В.
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Технология пищевых продуктов
Статья в выпуске: 4 т.24, 2021 года.
Бесплатный доступ
Общеизвестно, что рыбы, принадлежащие к семейству Лососёвые, неодинаковы по своей пищевой ценности. Анатомо-морфологические признаки разных видов лососёвых имеют определенное сходство, поэтому представители этого семейства наиболее часто фальсифицируются. Ассортиментная фальсификация продуктов из рыб этого семейства обычно осуществляется путем подмены более ценных видов дешевыми с пониженной пищевой ценностью. Чаще всего встречается подделка атлантических лососей (семга) дальневосточными (кета, горбуша, чавыча, кижуч). Спектроскопия в ближней инфракрасной области (БИК) в настоящее время находит все большее применение для идентификации и аутентификации близких организмов, в некоторых случаях являясь экспресс-методом, заменяющим генетический анализ. Получены спектры диффузионного отражения БИК излучения для трех видов рыб Северного бассейна, принадлежащих семейству Лососёвые. Наилучшая классификация по видам рыб получена при анализе БИК спектров предварительно высушенных обезжиренных образцов мышечной ткани. В случае влажных образцов наблюдаемые различия были менее верны, вплоть до недостоверных различий отдельных значений из соседних кластеров. Показана возможность использования метода линейного дискриминантного анализа БИК спектров отражения мышечных белков для видовой идентификации рыб.
Спектральный анализ, ближняя инфракрасная область (БИК область), морская рыба, таксонометрическая принадлежность, метод классификации, спектроскопия в ближней области спектра (БИК спектроскопия), spectra analysis, near infrared region (NIR), sea fish, classification method, taxon affiliation, falsification, near infrared spectroscopy (NIS)
Короткий адрес: https://sciup.org/142230560
IDR: 142230560 | УДК: 664.951.014:543.42 | DOI: 10.21443/1560-9278-2021-24-4-450-460
Текст статьи Применение метода линейного дискриминантного анализа спектров отражения в ближней инфракрасной области для видовой идентификации рыб семейства Лососёвые (Salmonidae)
Новиков В. Ю. и др. Применение метода линейного дискриминантного анализа спектров отражения в ближней инфракрасной области для видовой идентификации рыб семейства Лососёвые (Salmonidae). Вестник МГТУ. 2021. Т. 24, № 4. С. 450–460. DOI:
Идентификация продуктов питания, лекарственных средств, фармацевтических и косметических препаратов, промышленных материалов в настоящее время используется в различных областях человеческой деятельности. Она необходима при контроле технологических операций, определении качества конечной продукции, для установления фальсификации отдельных видов товаров. Интенсификация промышленного производства требует внедрения быстрых аналитических методов, преимущественно используемых в условиях добычи сырья или фабричного производства. В пищевой промышленности, в частности в рыбной отрасли, надежная и оперативная идентификация продукции актуальна в связи с наблюдаемой подменой дорогих ценных пород рыб низкосортными.
Одним из современных инструментальных экспресс-методов количественного и качественного анализа различных объектов является спектроскопия в ближней инфракрасной (БИК) области ( Zhuang et al., 2017 ).
В некоторых публикациях возможности БИК спектроскопии продуктов занижаются. Например, подчеркивается, что "…возможность применения указанных методов для идентификации видов рыб весьма сомнительна. Дифференцирование здесь проводится с помощью анализа различий в жирно-кислотном составе, составе белков и содержании влаги. Обычно проблема установления идентичности вида рыбы сводится к различению видов в рамках семейства, а показатели видов в рамках семейства практически идентичны" ( Куприна, 2015 ).
Тем не менее БИК спектроскопия в настоящее время находит все большее применение для идентификации и аутентификации близких организмов, в некоторых случаях являясь экспресс-методом, заменяющим генетический анализ. Замена такого дорогостоящего и имеющего большую продолжительность аналитического метода как генетический анализ альтернативным экспресс-методом является весьма актуальной.
Наибольшее число научных исследований посвящено применению БИК спектроскопии для идентификации различных растений ( Jiang et al., 2017; Sedjoah et al., 2020; Spectroscopic methods…, 2017; Sun et al., 2020 ), лекарственных трав ( Li et al., 2018 ), сортов древесины ( Lazarescu et al., 2017; Ma et al., 2019 ). Описано применение БИК спектроскопии для классификации и идентификации сельскохозяйственных растений и плодов, например, образцов яблок разного географического происхождения и сортов ( Luo et al., 2011; Wu et al., 2016 ), нектаринов ( Munera et al., 2018 ), сортов чая ( Ning et al., 2012; Wu et al., 2016 ), кофе ( Okubo et al., 2019 ). Метод применяется также для идентификации видов насекомых и их географических штаммов ( Cao et al., 2015; De Azevedo et al., 2019 ).
Имеются данные об эффективности применения БИК спектроскопии для распознавания мяса и выявления фальсификации продукции при замене одних сортов мяса другими, более дешевыми. Авторы показали эффективность применения БИК спектроскопии для идентификации замороженного и термически обработанного мяса ( Downey et al., 2007 ). Сообщается об идентификации и количественной оценке фальсификации говяжьего фарша мясом индейки ( Alamprese et al., 2016 ), идентификации и аутентификации различных видов мясных мышц на примере мышц говядины, баранины, свинины и курицы. Показаны достоверные отличия белого мяса по сравнению с красным, мяса птицы и свинины, говядины и баранины, а также мяса курицы и индейки ( Cozzolino et al., 2004 ).
Спектроскопия отражения в ближней ИК области предложена для выявления продуктов из генно-модифицированных организмов в основном растительного происхождения ( Alishahi et al., 2010; Zhang et al., 2015 ), что говорит об эффективности метода.
Не вдаваясь в детальную связь БИК спектров диффузионного отражения с химическим строением тканей организмов, авторы исследований анализируют наблюдаемые отличия в тонкой структуре спектра и устанавливают их связь с принадлежностью организма к определенному таксону.
В нашей предыдущей работе была показана возможность использования БИК спектроскопии для идентификации таксонов морских рыб с точностью до отряда на примере 25 образцов морских рыб Северного промыслового бассейна ( Новиков и др., 2020 ). Используя дискриминантный анализ БИК спектров отражения, удалось сгруппировать в неперекрывающиеся кластеры рыб разных видов, но принадлежащих одному отряду. Наибольший интерес представляет попытка классификации представителей одного семейства, но относящихся к разным видам. Видовые различия обычно менее заметны. Разные виды близки по строению тела, химическому составу, среде обитания. Поэтому их различение, особенно в пищевых продуктах, представляет определенную сложность. Обычно для идентификации применяется генетический анализ, а также используются некоторые другие биохимические и физико-химические методы: хроматографические, электрофоретические и спектральные ( Куприна, 2015 ).
В настоящей работе для идентификации представителей разных видов рыб в пределах одного семейства мы использовали метод линейного дискриминантного анализа спектров отражения в ближней инфракрасной области. Во-первых, мы стремились подтвердить возможность применения этого метода в качестве альтернативы генетической идентификации видов рыб, во-вторых, показать целесообразность БИК спектроскопии для выявления фальсификации рыбной продукции, полученной из биологически близких видов рыб.
Для исследований было выбрано семейство Лососёвые (Salmonidae), представители которого являются наиболее привлекательными для фальсификаторов. Ассортиментная фальсификация продуктов из рыб этого семейства обычно осуществляется путем подмены более ценных видов (например, атлантических лососей – семги) дешевыми видами с пониженной пищевой ценностью, такими как горбуша, кета, чавыча и кижуч или другими видами рыб после их специальной обработки. В случае полной разделки рыб даже профессионалам ихтиологам и товароведам трудно распознать подделку одних видов лососей другими.
Цель исследования заключается в видовой идентификации промысловых рыб семейства Лососёвые – семги, форели и горбуши – с помощью дискриминантного анализа спектров отражения в ближней инфракрасной (БИК) области мышечной ткани этих видов.
Материалы и методы
В качестве объектов исследования использовали образцы рыб, принадлежавших к трем видам семейства Лососёвые: форель Salmo trutta morpha fario , семга Salmo salar и горбуша Oncorhynchus gorbuscha .
Подготовку проб для анализа, регистрацию БИК спектров диффузионного отражения, их статистическую обработку и многомерный дискриминантный анализ выполняли в лаборатории химико-аналитических исследований Центра экологического мониторинга Полярного филиала Всероссийского научноисследовательского института рыбного хозяйства и океанографии ("ПИНРО" им. Н. М. Книповича).
Общий химический состав определяли по ГОСТ 7636-85 "Рыба, морские млекопитающие, морские беспозвоночные и продукты их переработки. Методы анализа"1. Концентрацию общего азота определяли методом Кьельдаля на анализаторе KjeltecTM 8400 фирмы Foss Tecator.
Подготовку сухих обезжиренных образцов мышечной ткани рыб и регистрацию БИК спектров осуществляли с применением Фурье ИК-спектрофотометра IRTracer-100 (Shimadzu, Япония) с модулем для измерения диффузионного отражения DRS-8000A, как описано ранее в работе ( Новиков и др., 2020 ). Диапазон измерения составлял от 700 до 7 000 см–1.
Влажные образцы получали путем измельчения мышечной ткани на мясорубке с диаметром отверстий 3 мм с последующим перетиранием через капроновое сито c размером ячеи 0,1 мм до образования гомогенной пастообразной массы.
Для влажных образцов спектры диффузионного отражения получали с использованием спектрофотометра UV-3101PC (Shimadzu, Япония) с модулем для измерения диффузионного отражения (интегрирующей сферы) LISR-3100. Диапазон измерения – 850–2 500 нм.
Для каждого образца кратность измерения составляла от 3 до 5 повторов.
Построение графиков и математическую обработку БИК спектров осуществляли с помощью компьютерных программ Excel (Microsoft, США) и MagicPlot Pro ver. 2.9.0.0 (Magicplot Systems, LLC, Россия).
Статистический и многомерный дискриминантный анализ результатов, заключающийся в проверке нормальности и однородности распределения данных в экспериментальных выборках, расчете доверительных интервалов, коэффициентов дискриминантных функций и расстояния Махаланобиса, проводили с помощью программы для статистических расчетов IBM SPSS Statistics ver. 26 (IBM Corp., США). Каноническая корреляция составила 0,999.
Результаты и обсуждение
В образцах мышечной ткани исследуемых видов рыб определяли содержание воды, жира, белковых веществ и золы. Результаты исследования приведены в табл. 1.
Таблица 1. Технохимический состав мышечной ткани рыб, массовая доля, % Table 1. Technochemical composition of fish muscle tissue, mass fraction, %
|
Объект |
Вода |
Жир |
Белок |
Зола |
|
Горбуша |
72,0–76,6 |
3,10–8,51 |
17,0–17,8 |
0,44–1,06 |
|
Семга |
66,4–68,3 |
8,80–11,00 |
18,6–19,0 |
0,51–1,04 |
|
Форель |
72,0–78,0 |
3,78–8,51 |
14,8–17,6 |
0,38–0,90 |
Данные показывают широкие пределы изменения каждого показателя в исследованных образцах, особенно массовой доли воды и жира.
В настоящем исследовании, в отличие от предыдущей работы ( Новиков и др., 2020 ), БИК спектры были получены как для высушенных обезжиренных, так и для влажных исходных образцов тканей рыб. Использование спектрофотометра UV-3101PC позволило расширить волновой диапазон измерения БИК спектров до 12 000 см–1. Данная часть спектра является недоступной для инфракрасного спектрофотометра IRTracer-100, кроме того, конструкция модуля для измерения диффузионного отражения LISR-3100 сделала возможным исследование влажных образцов.
БИК спектры диффузионного отражения высушенных обезжиренных и влажных образцов приведены на рис. 1. Каждая кривая представляет собой усредненный спектр от 6 до 9 параллельных измерений.
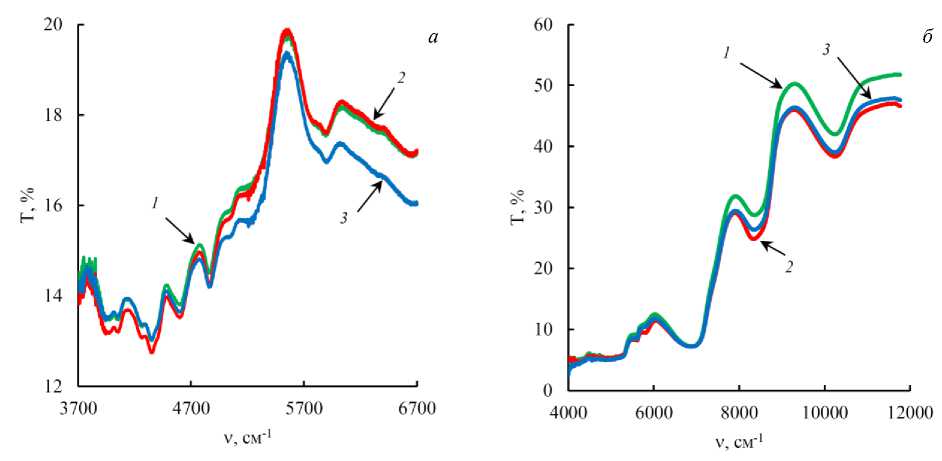
Рис. 1. Усредненные БИК спектры отражения высушенных обезжиренных ( a ) и влажных образцов ( б ) мышечной ткани горбуши (1), семги (2) и форели (3) Fig. 1. The averaged NIR reflectance spectra of dried fat-free ( a ) and wet samples ( б ) of muscle tissue of pink salmon (1), salmon (2) and trout (3)
Для точного определения пиков поглощения мы использовали предварительную математическую обработку спектров.
БИК спектры диффузионного отражения перевели в спектры поглощения, используя соотношение
A = – log (T / T0), где A – оптическая плотность, ед. опт. пл.; T и T0 – пропускание в максимуме поглощения и полное пропускание, соответственно, %.
Затем спектры поглощения разложили на составляющие функции Гаусса (гауссианы), используя известный алгоритм, реализованный в программе MagicPlot.
Использованный нами способ обработки спектров позволил выделить из общего спектра поглощения отдельные пики и измерить их высоту. При этом было исключено общее фоновое поглощение, которое зависело от условий приготовления образцов.
БИК спектры поглощения сухих обезжиренных образцов были разложены на 19 пиков. На рис. 2 в качестве примера приведен БИК спектра отражения тканей горбуши и его разложение на несколько гауссиан.
БИК спектры поглощения влажных образцов приведены к одинаковому с предыдущими спектрами представлению в единицах волновых чисел и разложены на 17 пиков. На рис. 3 в качестве примера также приведено разложение БИК спектра отражения тканей горбуши во влажном состоянии.
Средние значения оптической плотности в максимумах пиков поглощения и доверительные интервалы волновых чисел и значений максимумов поглощения отдельных гауссиан приведены в табл. 2 для сухих обезжиренных и влажных образцов трех видов рыб: горбуши, семги и форели.
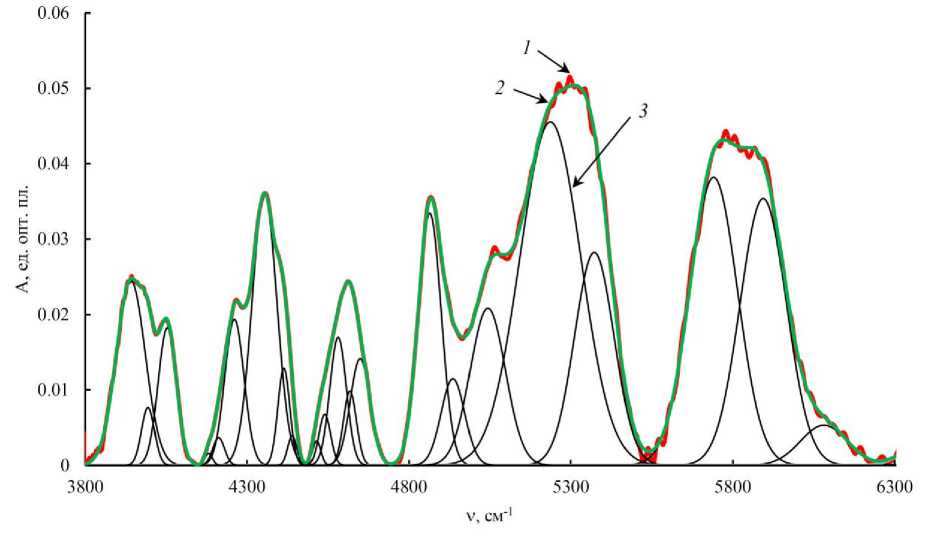
Рис. 2. Разложение БИК спектра поглощения высушенных обезжиренных образцов тканей горбуши на составлявшие гауссианы: 1 – исходный спектр; 2 – сумма составляющих гауссиан;
3 – пики, описываемые функцией Гаусса
Fig. 2. Decomposition of the NIR absorption spectrum of dried fat-free tissue samples of pink salmon into constituent Gaussians: 1 – the original spectrum; 2 – the sum of the constituent Gaussians;
3 – peaks described by the Gaussian function
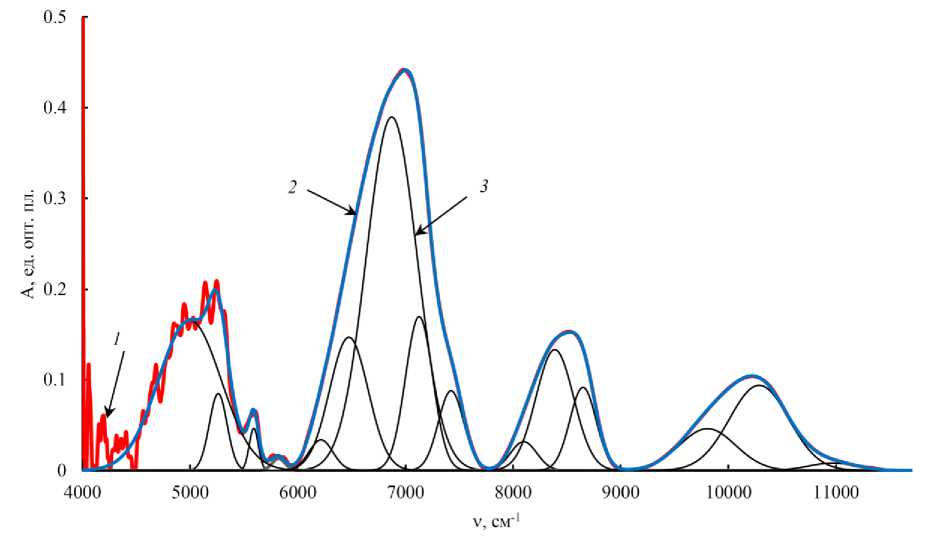
Рис. 3. Разложение БИК спектра отражения влажных образцов тканей горбуши на составлявшие гауссианы: 1 – исходный спектр; 2 – сумма составляющих гауссиан;
3 – пики, описываемые функцией Гаусса
Fig. 3. Decomposition of the NIR absorption spectrum of wet tissue samples of pink salmon into constituent Gaussians: 1 – the original spectrum; 2 – the sum of the constituent Gaussians;
3 – peaks described by the Gaussian function
Таблица 2. Волновые числа и оптические поглощения максимумов пиков, выбранных для дискриминантного анализа
Table 2. Wavenumbers and optical absorbances of the maxima of the peaks selected for discriminant analysis
|
№ пика |
ν , см–1 |
Сухие, обезжиренные образцы |
ν , см–1 |
Влажные образцы |
||||
|
Горбуша |
Семга |
Форель |
Горбуша |
Семга |
Форель |
|||
|
1 |
3940 ± 1 |
0,024 ± 0,001 |
0,026 ± 0,001 |
0,023 ± 0,001 |
4237 ± 37 |
0,074 ± 0,102 |
– |
– |
|
2 |
3990 ± 4 |
0,007 ± 0,002 |
0,006 ± 0,001 |
0,002 ± 0,001 |
4341 ± 84 |
0,063 ± 0,022 |
0,074 ± 0,026 |
0,054 ± 0,031 |
|
3 |
4053 ± 1 |
0,017 ± 0,001 |
0,018 ± 0,001 |
0,013 ± 0,002 |
4891 ± 96 |
0,157 ± 0,042 |
0,106 ± 0,028 |
0,136 ± 0,088 |
|
4 |
4179 ± 1 |
0,002 ± 0,001 |
0,001 ± 0,001 |
0,001 ± 0,001 |
5201 ± 28 |
0,113 ± 0,026 |
0,097 ± 0,023 |
0,123 ± 0,047 |
|
5 |
4209 ± 1 |
0,003 ± 0,001 |
0,002 ± 0,001 |
0,002 ± 0,001 |
5520 ± 44 |
– |
0,022 ± 0,011 |
0,018 ± 0,011 |
|
6 |
4259 ± 1 |
0,018 ± 0,001 |
0,019 ± 0,001 |
0,017 ± 0,001 |
5597 ± 9 |
0,040 ± 0,004 |
0,038 ± 0,007 |
0,043 ± 0,007 |
|
7 |
4354 ± 1 |
0,034 ± 0,001 |
0,034 ± 0,001 |
0,031 ± 0,001 |
5818 ± 23 |
0,016 ± 0,002 |
0,034 ± 0,008 |
0,027 ± 0,015 |
|
8 |
4406 ± 2 |
0,008 ± 0,004 |
0,008 ± 0,003 |
0,009 ± 0,001 |
6241 ± 11 |
0,038 ± 0,012 |
0,041 ± 0,004 |
0,058 ± 0,015 |
|
9 |
4430 ± 2 |
0,008 ± 0,003 |
0,010 ± 0,002 |
0,007 ± 0,001 |
6541 ± 38 |
0,206 ± 0,074 |
0,144 ± 0,020 |
0,254 ± 0,062 |
|
10 |
4513 ± 3 |
0,002 ± 0,001 |
0,004 ± 0,001 |
0,002 ± 0,001 |
6924 ± 37 |
0,388 ± 0,042 |
0,372 ± 0,020 |
0,346 ± 0,050 |
|
11 |
4531 ± 3 |
– |
– |
0,005 ± 0,001 |
7131 ± 4 |
0,132 ± 0,060 |
0,181 ± 0,040 |
0,094 ± 0,044 |
|
12 |
4553 ± 6 |
0,006 ± 0,001 |
0,009 ± 0,001 |
0,011 ± 0,001 |
7425 ± 5 |
0,082 ± 0,010 |
0,084 ± 0,003 |
0,081 ± 0,010 |
|
13 |
4600 ± 9 |
0,013 ± 0,003 |
0,023 ± 0,002 |
0,020 ± 0,001 |
8110 ± 22 |
0,032 ± 0,003 |
0,041 ± 0,039 |
0,031 ± 0,003 |
|
14 |
4639 ± 12 |
0,015 ± 0,005 |
0,007 ± 0,003 |
0,001 ± 0,001 |
8390 ± 22 |
0,132 ± 0,002 |
0,146 ± 0,020 |
0,134 ± 0,008 |
|
15 |
4664 ± 5 |
0,012 ± 0,002 |
0,003 ± 0,003 |
0,006 ± 0,002 |
8652 ± 8 |
0,090 ± 0,002 |
0,098 ± 0,020 |
0,090 ± 0,011 |
|
16 |
4710 ± 2 |
– |
– |
0,001 ± 0,001 |
9817 ± 20 |
0,051 ± 0,004 |
0,045 ± 0,009 |
0,049 ± 0,005 |
|
17 |
4865 ± 1 |
0,033 ± 0,002 |
0,037 ± 0,001 |
0,033 ± 0,001 |
10284 ± 15 |
0,085 ± 0,008 |
0,087 ± 0,009 |
0,084 ± 0,010 |
|
18 |
4936 ± 1 |
0,010 ± 0,002 |
0,013 ± 0,002 |
0,010 ± 0,002 |
||||
|
19 |
5041 ± 1 |
0,022 ± 0,002 |
0,024 ± 0,001 |
0,027 ± 0,002 |
||||
Центры гауссиан для сухих образцов практически полностью совпадают для всех изученных видов. Абсолютная погрешность составляет от 1 до 9 см–1. Это свидетельствует в пользу выбранного нами метода обработки БИК спектров.
Центры гауссиан БИК спектров влажных образцов получены с большей ошибкой и менее точным определением волновых чисел. Абсолютная погрешность достигала 100 см–1. Меньшая разрешенность спектров объясняется присутствием большого количества воды (массовая доля около 80 %), которая приводит к экранированию и размыванию слабых полос БИК поглощения белков.
Максимумы поглощения в выбранных пиках во всех пробах близки по значениям. Статистическая обработка показала, что различия некоторых пиков для всех трех видов рыб являются незначимыми с доверительной вероятностью 0,05. Но некоторые пики демонстрируют достоверные различия как в сухих обезжиренных, так и во влажных образцах.
Образцы рыб были разделены на группы по видам:
-
1 – горбуша Oncorhynchus gorbuscha ;
-
2 – семга Salmo salar ;
-
3 – форель Salmo trutta morpha fario .
На основе полученных данных были составлены матрицы отдельно для высушенных обезжиренных и влажных образцов, в которых столбцы соответствовали номерам выбранных пиков, а строки – видам исследованных рыб.
Для каждой группы была проведена оценка близости БИК спектров по расстоянию Махаланобиса и получены канонические дискриминантные функции. При расчетах использовались два метода: пошаговый выбор значимых переменных и принудительное включение всех использованных переменных.
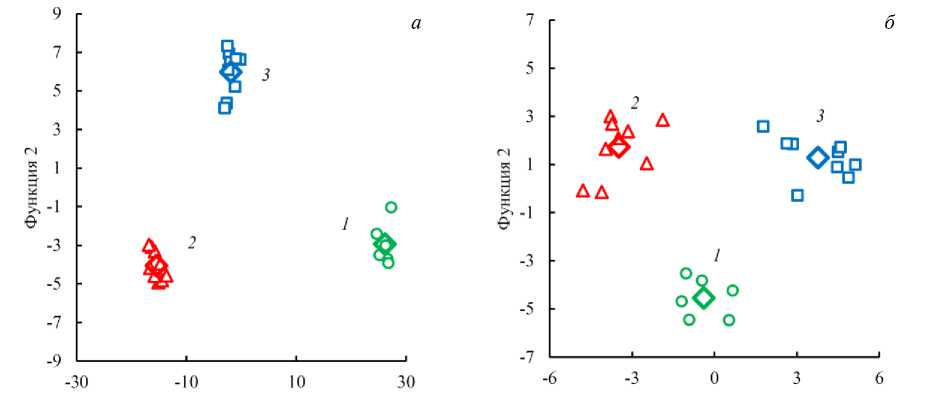
Для высушенных обезжиренных образцов при пошаговом выборе в результате расчета было отобрано 5 значимых переменных, соответствующих волновым числам 4 209, 4553, 4865, 5 041 и 5233 см–1. Диаграмма рассеяния (рис. 4, b ) показывает практически неперекрывающиеся кластеры, каждый из которых соответствует только одному из трех видов рыб.
Функция 1 функция 1
Рис. 4. Диаграммы рассеяния канонических дискриминантных функций для высушенных обезжиренных образцов в случае принудительного включения всех переменных (a); при пошаговом выборе значимых переменных (б). Номера групп соответствуют номерам выбранных видов рыб: 1 – горбуша; 2 – семга; 3 – форель; – центроид группы
Fig. 4. Scatter diagrams of canonical discriminant functions for dried defatted samples in case of forced inclusion of all variables ( a ); with a step-by-step selection of significant variables ( б ). The group numbers correspond to the numbers of the selected fish species: 1 – pink salmon; 2 – salmon;
3 – trout; ф – centroid of the group
Минимальное расстояние Махаланобиса между ближайшими кластерами составило 33,2 (кластеры 1 и 2), 29,7 (кластеры 1 и 3) и 28,3 (кластеры 2 и 3), следовательно, различие между группами было достоверным (расстояние Махаланобиса превышает 3). В этом варианте расчета 100 % исходных сгруппированных наблюдений и перекрестно проверенных сгруппированных наблюдений оказались классифицированы правильно.
В случае принудительного включения в расчет всех переменных (19 значимых пиков) (рис. 4, a) был получен гораздо лучший результат. Минимальное расстояние Махаланобиса между ближайшими кластерами было значительно больше и составило 778,2 (кластеры 1 и 3) и 220,7 (кластеры 2 и 3). Все исходные сгруппированные наблюдения были классифицированы правильно, но из перекрестно проверенных сгруппированных наблюдений правильно классифицированными оказались только 75,0 %. Последнее значение указывает на увеличение статистической ошибки (статистического шума) при увеличении числа переменных, роль которых в межгрупповых различиях незначительна или полностью отсутствует.
При анализе БИК спектров влажных образцов дискриминантный анализ дал заметно худший результат классификации по видам рыб.
При принудительном включении всех переменных (17 значимых пиков) были получены три непересекающихся кластера (рис. 5, a ). Минимальное расстояние Махаланобиса между ближайшими кластерами составило 31,2 (кластеры 1 и 2) и 8,3 (кластеры 1 и 3). Результат классификации показал, что классифицированы правильно 100,0 % исходных сгруппированных наблюдений и только 41,7 % перекрестно проверенных сгруппированных наблюдений.
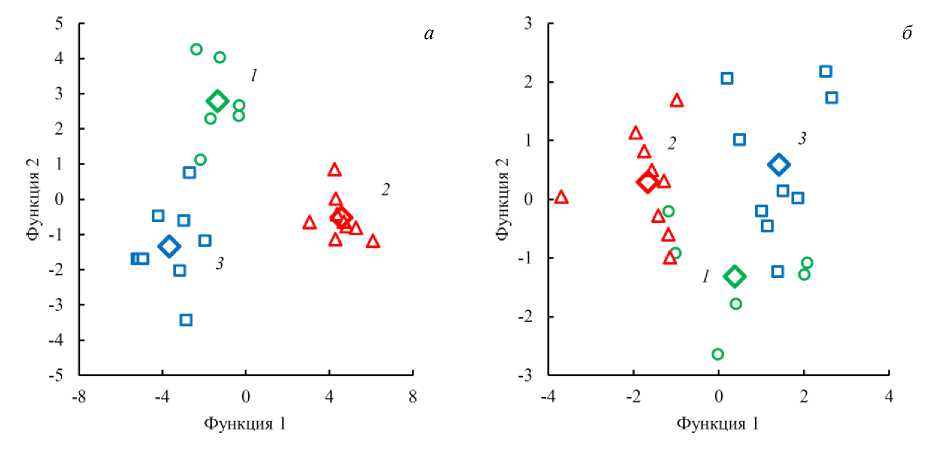
Рис. 5. Диаграммы рассеяния канонических дискриминантных функций для влажных образцов в случае принудительного включения всех переменных ( a ); при пошаговом выборе значимых переменных ( б ). Номера групп соответствуют номерам выбранных видов рыб:
1 – горбуша; 2 – семга; 3 – форель; – центроид группы
Fig. 5. Scatter diagrams of canonical discriminant functions for wet samples in case of forced inclusion of all variables ( a ); with a step-by-step selection of significant variables ( б ). The group numbers correspond to the numbers of the selected fish species: 1 – pink salmon; 2 – salmon; 3 – trout; о – centroid of the group
При пошаговом выборе переменных для анализа программа отобрала только 3 значимых переменных, соответствующих волновым числам 4 237, 5 818 и 6424 см–1. Кластеры оказались перекрывающимися (рис. 5, b ). Минимальное расстояние Махаланобиса между ближайшими кластерами составило 2,4 (кластеры 1 и 2), 1,3 (кластеры 1 и 3) и 5,2 (кластеры 2 и 3). Правильно классифицированы были 87,5 % исходных сгруппированных наблюдений и 66,7 % перекрестно проверенных сгруппированных наблюдений. Исключение переменных, вклад которых в межгрупповые различия отсутствует или является незначительной, привел к увеличению качества разделения групп, хотя кластеры 1 и 2, 1 и 3 оказались перекрывающимися.
Заключение
Таким образом, дискриминантный анализ позволяет с достаточной достоверностью по БИК спектрам классифицировать рыб семейства Лососёвые по трем промысловым видам – горбуша, семга и форель. Наилучшая классификация по видам рыб была получена при анализе БИК спектров предварительно высушенных обезжиренных образцов мышечной ткани. В случае влажных образцов наблюдаемые различия были менее достоверны, вплоть до недостоверных различий отдельных значений из соседних кластеров. Наилучшее разделение кластеров оказалось в случае принудительного включения всех переменных, но при низком качестве перекрестно проверенных группированных наблюдений. Комбинация метода спектроскопии в БИК области и дискриминантного анализа может быть использована для видовой идентификации и выявления фальсификации готовой продукции из лососёвых видов рыб.


