Протеолиз белковых компонентов растительного сырья с высоким аллергенным потенциалом
Автор: Соколова Елена Николаевна, Шариков Антон Юрьевич, Юраскина Татьяна Владимировна, Серба Елена Михайловна
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Технология продовольственных продуктов
Статья в выпуске: 10, 2022 года.
Бесплатный доступ
Приведены новые данные о состоянии проблемы непереносимости глютена. Представлены данные об эффективности биокаталитического воздействия на аллергенные белки зернового сырья. Получены результаты исследований активностей ферментных препаратов гидролитического действия для деструкции высокобелковых полимеров-аллергенов зернового сырья. Исследован фракционный состав образцов зернового сырья и их гидролизатов и установлено, что подобранные ферменты, полученные на основе мицелиального гриба Aspergillus oryzae, и ферментная система, состоящая из ферментных препаратов, полученных на основе мицелиальных грибов Aspergillus oryzae и Aspergillus niger., позволяют эффективно модифицировать аллергенные фракции до низкомолекулярных пептидов и аминокислот. Выявлено снижение уровня молекулярных масс гидролизатов с 97 до 30-25 кДа. Изучен состав свободных аминокислот в полученных гидролизатах и выявлено, что в результате ферментолиза происходит значительное увеличение (от 2,5 до 9 раз) таких аминокислот, как серин, глутамин, глицин и пролин. Проведена сравнительная оценка действия ферментного препарата Амилопротооризин и ферментной системы, содержащей ферменты амилолитического и протеолитического действия, и установлено, что представленные ферментные препараты могут быть использованы для получения низкомолекулярных гидролизатов пшеницы. Данные гидролизаты будут использованы для составления рецептур безглютеновых продуктов.
Ферментолизат, глютен, аллергенные фракции, аминокислоты, ферменты, молекулярная масса, пептидаза, пшеница, безглютеновые продукты
Короткий адрес: https://sciup.org/140295994
IDR: 140295994 | УДК: 663.18:664.47 | DOI: 10.36718/1819-4036-2022-10-207-214
Текст научной статьи Протеолиз белковых компонентов растительного сырья с высоким аллергенным потенциалом
Введение. В последнее время распространенность целиакии приобретает значительные масштабы. Это одно из немногих наследственных заболеваний, которое значительно снижает качество жизни. Для снижения рецидивов и увеличения длительности ремиссии разработка программ диагностики и назначение безглюте-новой диеты крайне актуально [1]. Значимость рационов безглютенового питания с составленными рецептурами необходимо законодательно утвердить, поскольку от этого зависит здоровье и качество жизни больных целиакией [2, 3].
В литературе имеется множество публикаций по модификации глютена, приводящей к снижению его аллергенных свойств [4–6]. Есть сведения по снижению аллергенности до низкомолекулярных пептидов и аминокислот растительными, животными, микробными пептидазами [7–12]. Применение пептидаз из пророщенного зерна, пепсина или трипсина, микробных пептидаз на основе Aspergillus, молочнокислых бактерий имеет возможность получения низко-глютеновых продуктов с содержанием глютена от 20 до 100 мг/кг [13–15].
Грибы рода Aspergillus – чрезвычайно разнообразная и метаболически гибкая группа мик-ромицетов. У семи различных видов рода Aspergillus (A. nidulans, A. niger, A. oryzae, A. terreus, A. flavus, N. fischeri и A. fumigatus) идентифицированы 133 возможные пептидазы [16]. По ре- зультатам сравнения геномов в грибах рода Aspergillus составляют гены, кодирующие сериновые пептидазы. Проведенные исследования биокаталитических активностей ферментов подтверждают эти результаты, так как сериновые пептидазы действительно представляют наиболее крупный класс протеолитических ферментов [17, 18].
Среди пептидаз грибного происхождения пептидаза из Aspergillus niger (AN-PEP) очень эффективно разрушает белки и пептиды глютена [16–18]. Представленный фермент оптимально работает при нейтральном рН, остается стабильным при кислом и полностью устойчив к перевариванию пепсином. Он разрушает неповрежденные белки глютена, а также стимулирующие Т-клетки пептиды гораздо быстрее, чем микробные пептидазы на основе бактериальных культур. Еще одним преимуществом является то, что некоторые штаммы рода Aspergillus являются непатогенными, и ферменты на их основе могут быть произведены с невысокими затратами в промышленных условиях. Также известно, что пептидазы из Aspergillus oryzae (в основном дипептидилпептидаза IV) способны детоксифицировать достаточное количество глютена [19, 20].
Но очевидно, что до сих пор существует актуальность разработки новых методик снижения глютеновых фрагментов и получения продуктов на их основе. Одним из эффективных методов является метод биокаталитической деградации глютена [21–23].
Цель исследования – изучение возможностей использования протеиназ грибного происхождения для блокирования механизмов возникновения и развития целиакии путем гидролиза глютеновых белков, являющихся основой развития данного заболевания.
Объекты и методы . В качестве объектов исследований были использованы мука и экструдат пшеницы из цельнозерновой муки. Для проведения гидролиза муки и экструдата были использованы ферментные препараты: КФПА (комплексный ферментный препарат Амилопро-тооризин) и ферментные препараты, содержащие ферменты амилолитического и протеолитического действия. Уровень протеолитической активности анализировали по степени гидролиза гемоглобина [24], амилолитической и глюкоамилазной – по степени гидролиза крахмала
[25], ксиланазной – по степени гидролиза ксила-на [26], целлюлазной – по степени гидролиза карбоксиметилцеллюлозы [27]. Cостав и концентрацию свободных аминокислот определяли на высокоэффективном жидкостном хроматографе фирмы KNAUER (Германия) [28].
Процесс гидролиза высокомолекулярных полимеров белковых веществ осуществляли ФП в подобранных ранее условиях: в течение 2 ч при 50 °С, при рН 5,5 [14], гидромодуль суспензии 1:2. Для исследования белковых фракций фер-ментолизатов и исходного сырья использовали метод ДДС-электрофореза в полиакриламидном геле [29]. Статистическую обработку экспериментальных данных проводили методом однофакторного дисперсионного анализа с помощью компьютерной программы Excel.
Результаты и их обсуждение . Как известно, для гидролиза пшеницы необходимо осуществить подбор ферментов или ферментных систем для максимальной деструкции высокомолекулярных белков до низкомолекулярных пептидов и свободных аминокислот.
На первом этапе исследований изучали состав ферментов, входящих в состав ферментного комплекса.
В таблице 1 в качестве ферментов для гидролиза глютена использовали ферментные препараты протеолитического и амилолитического действия (ФС), включающие ферментные препараты: ФП Flavourzyme, содержащий две аминопептидазы, две дипептидилпептидазы, три эндопептидазы; ФП Neutrase, содержащий нейтральную протеазу; ФП Fyngamyl, содержащий альфа-амилазу производства компании Novozymes. В качестве сравнения с импортными аналогами использовали ферментный препарат отечественного производства КФПА, содержащий в своем составе ферменты аминопептидазу, эндопептидазу, нейтральную протеазу и альфа-амилазу для гидролиза белковых и крахмалистых веществ зернового сырья.
Далее исследовали ФП КФПА и комплекс ферментов Flavourzyme + Neutrase + Fyngamyl на степень гидролиза полимеров белковых веществ. Для этого был проведен электрофорез в ПААГ с маркером от 14,4 до 97,4 кДа. Объектами служили прогидролизованные цельнозерновая пшеничная мука и экструдат,полученный на основе этой муки.
Таблица 1
Характеристика используемых ферментных препаратов
97,4
75,0
50,0
37,0
31,0
20,0
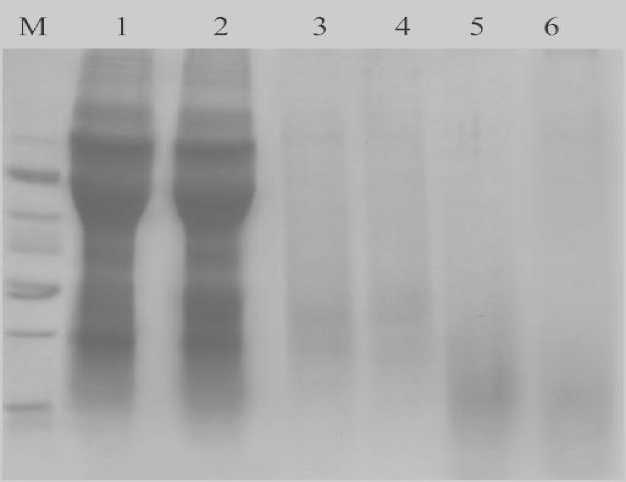
14,4
ДДС-электрофорез исследуемых гидролизатов:
М – маркер; 1 – мука пшеничная (контроль); 2 – экструдат муки (контроль);
3 – мука пшеничная + КФПА; 4 – экструдат муки + КФПА
5 – мука пшеничная + ФС; 6 – экструдат муки + ФС
На ДДС-электрофореграмме показана возможность применения ферментов для гидролиза муки и экструдата (см. рис.). Результаты подтверждают, что использование ФП КФПА и ФС, содержащей протеазу, эндопептидазу и альфа-амилазу, эффективно для гидролиза аллергенных высокомолекулярных белков.
Аминокислотный состав белков пшеницы (глиадина и глютена) придает определенные свойства ферментолизату на основе данного вида сырья. По литературным данным известно, что ферментный гидролиз «разрывает» связи между аминокислотами так, что в конце ами- нокислотной цепочки остается глутаминовая кислота.
Кроме глутаминовой кислоты белок клейковины пшеницы содержит в большем количестве пролин, серин и глицин. Результаты электрофореза демонстративно свидетельствуют о снижении в процессе гидролиза молекулярной массы белков, что говорит о наличии в составе фер-ментолизатов аминокислот и низкомолекулярных пептидов.
Поэтому полученные ферментолизаты пшеницы исследовали на состав свободных аминокислот (табл. 2).
Таблица 2
|
Аминокислота, г/100 г образца |
Образец 1 (пшеница без ФП) |
Образец 2 (гидролизат с КФПА) |
Образец 3 (гидролизат с ФС) |
|
Аспарагин |
0,168 |
0,190 |
0,187 |
|
Треонин |
0,272 |
0,660 |
0,559 |
|
Серин |
0,057 |
0,350 |
0,288 |
|
Глутаминовая кислота |
0,141 |
0,370 |
0,390 |
|
Пролин |
0,044 |
0,380 |
0,395 |
|
Глицин |
0,022 |
0,080 |
0,077 |
|
Аланин |
0,027 |
0,160 |
0,240 |
|
Цистеин |
– |
– |
– |
|
Валин |
0,340 |
0,420 |
0,410 |
|
Метионин |
0,190 |
0,270 |
0,284 |
|
Изолейцин |
0,094 |
0,240 |
0,233 |
|
Лейцин |
0,380 |
0,620 |
0,590 |
|
Тирозин |
– |
0,100 |
0,099 |
|
Фенилаланин |
– |
0,300 |
0,287 |
|
Гистидин |
0,304 |
0,890 |
0,778 |
|
Лизин |
0,063 |
0,150 |
0,142 |
|
Триптофан |
0,290 |
0,580 |
0,520 |
|
Аргинин |
– |
– |
0,010 |
|
Всего |
2,392 |
5,760 |
5,489 |
Состав свободных аминокислот гидролизатов пшеницы
Анализ аминокислотного состава показал увеличение в процессе гидролиза свободных аминокислот – глутаминовой кислоты, серина, пролина и глицина от 2,5 до 9,0 раза соответственно по сравнению с контрольным вариантом.
Заключение. В результате проведенных исследований была показана возможность применения ферментного препарата КФПА и ферментной системы с тем же комплексом ферментов на степень гидролиза высокомолекулярных белков клейковины. Результаты экспериментов демонстрируют использование ФП КФПА и ферментной системы, что подтверждено материалами исследований. Также увеличение в процессе гидролиза показателей свободных аминокислот играет ключевую роль при составлении рецептур сбалансированных безглютено-вых продуктов за счет повышенной усвояемости низкомолекулярных белков.
Список литературы Протеолиз белковых компонентов растительного сырья с высоким аллергенным потенциалом
- Natural history of celiac disease autoimmunity in a USA cohort followed since 1974 / C. Catas-si [et al.] // Ann. Med. 2010.Vol. 42. P. 530-538.
- Комплаентность к безглютеновой диете у детей при целиакии / Д.С. Фуголь [и др.] // Русский медицинский журнал: 2013. № 24. С. 1206-1210.
- Non-celiac gluten sensitivity: a work-in-progress entity in the spectrum of wheat-related disorders / U. Volta [et al.] // Best Pract Res Clin Gastroenterol. 2015 Jun. 29(3). P. 477-491.
- Skin tests with native, depigmented and glutaraldehyde polymerized allergen extracts / M. Casanovas [et al.] // J. Invest. Allergol. Clin. Immunol. 2005. Vol. 15 (1). P. 30-36.
- Mechanisms of immune suppression by inter-leukin-10 and transforming growth factor-p: the role of T regulatory cells / А. Taylor [et al.] // Immunology. 2006. Vol. 117. Issue 4. P. 433.
- Mechanisms of allergen specific immune-therapy - T-cell tolerance and more / M. Jutel [et al.] // Allergy. 2006. Vol. 61. N 7. P. 796807.
- Получение ферментативных гидролизатов белков молочной сыворотки с использованием протеолитических ферментов / А.Ю. Просеков [и др.] // Фундаментальные исследования. 2013. № 6. С. 1089-1093.
- Экструзионная технология переработки рисовой муки и деглютенизированного гидролизата пшеницы в технологии безглютено-вых снеков / М.В. Амелякина [и др.] // Мат-лы пула науч.-практ. конф. Керчь, 2022. С. 89-92.
- Биодеструкция белков зернового сырья для получения новых хлебобулочных изделий / Л.В. Римарева [и др.] // Вопросы питания. 2018. Т. 87. № 6. С. 67-75.
- Barrett A.J. Proteolytic enzymes: serine and cysteine peptidases // Methods Enzymol. 1994. Vol. 244. N 1. P. 1-15.
- A genomic survey of proteases in Aspergillus / S.O. Budak [et al.] // BMC Genomics. 2014. Vol. 15: 523.
- Sequencing and functional annotation of the whole genome of the filamentous fungus Aspergillus westerdijkiae / X. Han [et al.] // BMC Genomics. 2016. Vol. 17: 633.
- Sedolisins, a new class of secreted proteases from Aspergillus fumigatus with endoprotease or tripeptidyl-peptidase activity at acidic pHs / U. Reichard [et al.] // Appl. Environ. Microbiol. 2006. Vol. 72. № 3. P. 1739-1748.
- Production and partial characterization of serine and metallo peptidases secreted by Aspergillus fumigatus Fresenius in submerged and solid state fermentation / R.R. Da Silva [et al.] // Braz. J. Microbiol. 2013. Vol. 44. № 1. P. 235243.
- Яхяева М.А., Ахмедова З.Р. Некоторые свойства протеолитических ферментов гриба Aspergillus oryzae-5 // Universum: технические науки. 2020. № 9 (78). URL: https://7universum.com/ru/tech/archive/item/10 730 (дата обращения: 28.04.2022).
- Меркурьева Г.Ю., Камаева С.С., Шайхулли-на Л.Ф. Сравнительная характеристика ферментных препаратов с пищеварительной активностью // Международный журнал прикладных и фундаментальных исследований. 2022. № 2. С. 5-10.
- Шестакова Е.А., Галстян Г.Р. Ингибиторы дипептидилпептидазы-4: сравнительный анализ представителей группы // Проблемы эндокринологии. 2012. № 1. С. 61-66.
- Процесс биосинтеза лизина штаммом Cory-nebacterium glutamicum B-11167 на основе сред, содержащих гидролизат пшеничного глютена / А.А. Сиротин [и др.] // Современные проблемы науки и образования. 2012. № 6. С. 38-39.
- Esposito K., Cozzolino D., Bellastella G. et al. Dipeptidyl peptidase-4 inhibitors and HbA1c target of 4. Craddy P., Palin H-J., Johnson K.I. Comparative Effectiveness of Dipeptidylpepti-dase-4 Inhibitors in Type 2 Diabetes: A Systematic Review and Mixed Treatment Comparison. DiabetesTher., Jun., 2014, 5(1). P. 1-41.
- Krentz A.J., Patel M.B., Bailey C.J. New drugs for type 2 diabetes mellitus: what is their place in therapy? Drugs, 2008, 68 (15). P. 21312162.
- Разработка концепции производства снеков из пшеницы с элиминацией глютена биокаталитическим методом / А.Ю. Шариков [и др.] // Вестник ВГУИТ. 2020. Т. 82, № 4. С. 77-83.
- Бавыкина И.А., Попов В.И., Звягин А.А. Безглютеновая диета в терапии внекишечных форм непереносимости глютена // Вопросы питания. 2020. Т. 89, № 2. С. 21-25.
- Снижение аллергенных свойств белков молока. Технологические подходы / В.П. Курченко [и др.] // Молочная промышленность. 2012. № 4. С. 73-75.
- ГОСТ 34430-2018. Ферментные препараты для пищевой промышленности. Методы определения протеолитической активности. М., 2018.
- ГОСТ 34440-2018. Ферментные препараты для пищевой промышленности. Методы определения амилолитической активности. М., 2018.
- ГОСТ Р 55302-2012. Ферментные препараты для пищевой промышленности. Методы определения ксиланазной активности. М., 2012.
- ГОСТ Р 55293-2012. Ферментные препараты для пищевой промышленности. Методы определения целлюлазной активности. М., 2012.
- Шлейкин А.Г., Скворцова Н.Н., Бландов А.Н. Биохимия. Лабораторный практикум. Ч. 2. Белки. Ферменты. Витамины: учеб. пособие. СПб.: Ун-т ИТМО, 2015. 106 с.
- Стручкова И.В., Кальясова Е.А. Теоретические и практические основы проведения электрофореза белков в полиакриламид-ном геле. Н. Новгород, 2012. 60 с.


