Разработка и оценка эффективности программы профилактики и лечения радиоиндуцированного орального мукозита у пациентов с опухолями орофарингеальной области
Автор: Гвоздикова Е.Н., Аванесов А.М., Халиль Е.Ф., Кандакова Е.Ю., Аванесов К.А.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Медицинская практика
Статья в выпуске: 2 т.22, 2022 года.
Бесплатный доступ
Оральный мукозит - одно из самых частых и серьезных осложнений противоопухолевого лечения, возникновение и прогрессирование которого может негативно отразиться на общем прогнозе заболевания. Поиск методов и подходов к профилактике и лечению орального мукозита представляет как клинический, так и научный интерес. Данное исследование посвящено разработке и оценке эффективности программы профилактики и лечения орального мукозита, основанной на прогнозировании риска его развития. Исходные показатели стоматологического статуса пациентов и состояния гемомикроциркуляции слизистой оболочки рта могут быть взяты за основу при выборе методов и подходов для профилактики и лечения осложнений противоопухолевого лечения, возникающих во рту.
Оральный мукозит, программа профилактики и лечения, гемомикроциркуляция слизистой оболочки рта
Короткий адрес: https://sciup.org/149141307
IDR: 149141307
Текст научной статьи Разработка и оценка эффективности программы профилактики и лечения радиоиндуцированного орального мукозита у пациентов с опухолями орофарингеальной области
Опухоли головы и шеи (ОГШ) включают в себя группу злокачественных новообразований (ЗНО), которые объединены в общую анатомическую зону. К опухолям орофарингеальной области, согласно рекомендациям Всемирной организации здравоохранения (ВОЗ), относятся новообразования, которые локализуются в области губы, языка, полости рта, миндалины и ротоглотки [3]. В Российской Федерации в 2020 г. было зарегистрировано более 148 тыс. случаев ЗНО орофарингеальной области [3].
Наиболее эффективным методом лечения злокачественных новообразований орофарингеальной области считается комбинированный подход, включающий одновременное или последовательное применение хирургического, радиотерапевтического и химиотерапевтического лечения.
Учитывая анатомические особенности орофарингеальной области, высокий риск снижения показателей качества жизни пациента (приема пищи, разговора, косметических дефектов) при выборе тактики лечения все чаще отдается предпочтение нехирургическим методам. Следует отметить, что слизистая оболочка рта (СОР) чрезвычайно чувствительна к токсическому действию таких методов как радиотерапия и химиотерапия, и применение подобного противоопухолевого лечения, неизбежно приводит к реакциям и повреждениям со стороны окружающих здоровых тканей.
Радиоиндуцированный оральный мукозит (ОМ) или лучевой мукозит является одной из основных токсических реакций ионизирующего излучения и повреждений нормальной ткани в результате лучевой терапии (ЛТ) [11, 14].
ОМ встречается у 80% пациентов с опухолями в орофарингеальной области, получающих ЛТ и достигает 100% (на разных этапах) у пациентов, получающих сочетанное химиолучевое лечение. Наибольшую сложность представляют лучевые мукозиты 3-й и 4-й степени тяжести по RTOG (Radiation therapy oncology group). Такие повреждения регистрируются у 56% пациентов с опухолями в орофарингеальной области, получающих ЛТ [10, 11].
Клинические последствия радиоиндуцированного ОМ приводят к более длительным срокам госпитализации (за счет приостановки плана лучевого лечения) с парентеральным питанием, внутривенной анальгезией и антибиотикотерапией [8]. Подобные осложнения могут негативно отразиться на общем прогнозе онкологического пациента, привести к возникновению таких отдаленных последствий как продолженный рост опухоли, возникновение радиорезистентности и рецидивов.
Среди факторов, способствующих раннему развитию и отягощающих течение лучевого мукозита, имеются как общие, так и стоматологические факторы. Среди стоматологических факторов выделяются следующие: низкий уровень индивидуальной гигиены рта, высокий уровень распространенности и интенсивности кариеса зубов и его осложнений, заболевания пародонта, наличие металлических конструкций и имплантатов во рту [15–22]. Среди общих факторов, помимо распространенности опухолевого процесса, методов противоопухолевого лечения (только лучевая терапия или сочетанное химиолучевое лечение), наличия общесоматической патологии (сахарный диабет, кардиоваскулярная патология, инфекционные заболевания), отдельное внимание уделяется нарушению процессов гемомикроциркуляции (ГМЦ) слизистой оболочки рта. Снижение показателей ГМЦ расценивается, как фактор прогноза и клинического течения оральных мукозитов [5].
Профилактике и лечению орального мукозита посвящен ряд исследований [1, 2, 6, 9], которые проводятся как за рубежом, так и в России. Но описанные методы зачастую являются спорными, а порой противоречащими друг другу [12, 13]. Профилактика и лечение ОМ, в основном, строится на симптоматической терапии: используются обезболивающие, антисептические, противовоспалительные и кератопластические препараты. Предполагается, что в патогенезе развития орального мукозита ведущим пусковым механизмом является радикальное кислородное окисление и гипоксия тканей слизистой оболочки рта [14]. Проведение исследований по поиску, разработке и оценке эффективности этиопатогенетически обоснованных подходов к профилактике и лечению ОМ продолжает оставаться актуальной исследовательской задачей.
Цель исследования - разработать программу профилактики и лечения орального мукозита у пациентов со злокачественными новообразованиями орофарингеальной области с учетом факторов риска его развития и оценить ее эффективность, основываясь на клиническом опыте, приобретенном на базе Российского научного центра рентгенрадиологии с 2013 года по настоящее время.
Материалы и методы
В данное исследование были включены 60 пациентов, получающих ЛТ по поводу плоскоклеточного рака орофарингеальной области (суммарная очаговая доза СОД 66-68 Гр). Все пациенты проходили лечение на базе Российского научного центра рентгенорадиологии (ФГБУ «РНЦРР» Минздрава России) с 2017 года по 2021 год.
Среди пациентов, включенных в исследование, было 40 мужчин (66,67%) и 20 женщин (33,33%). Средний возраст пациентов составил 54,43±12,48 года. Наиболее частой локализацией опухоли являлась зона ротоглотки - 16 пациентов (26,67%), другие локализации составили опухоли языка - 8 (13,33%), дна полости рта - 7 (11,67%), верхней челюсти - 4 (6,67%), поражения губы, щеки, и альвеолярного отростка нижней челюсти -25 (41,66%).
Для предотвращения и снижения интенсивности лучевых реакций во рту у пациентов, получающих ЛТ по поводу ЗНО орофарингеальной области, была предложена программа профилактики и лечения оральных мукозитов, основанная на исходных показателях состояния рта и возрасте пациентов. В полости рта в качестве факторов риска развития ОМ рассматривались интенсивность кариеса зубов и его осложнений, наличие металлических конструкций, уровень индивидуальной гигиены рта, степень воспаления в тканях десны и показатели гемомикроциркуляции СОР (ПМ).
Для определения клинико-стоматологического статуса при первичном осмотре у всех онкологических пациентов проводился стоматологический осмотр с регистрацией уровня индивидуальной гигиены рта (индекс Green V.), степени воспаления в тканях десны с помощью индекса PMA (модификация Parma), наличия кариозных и разрушенных зубов (индекс КПУ), наличие ортопедических конструкций.
Исходное определение параметров гемомикроциркуляции проводилось при первичном осмотре в консультативно-поликлиническом отделении РНЦРР с помощью аппарата ЛАКК-М (2-е исполнение, производство Россия).
В зависимости от выявленных факторов риска пациенты (60 человек) были разделены на 6 групп:
I (n = 10) – возраст: 18–44 гг.; ПМ (среднее значение) = 43,7±5,8; стоматологические индексы: КПУ: 12,9±0,7; РМА: 23,1±0,8; Green V.: 0,6±0,5, металлические конструкции отсутствуют;
II (n = 10) – возраст: 18–44 гг.; ПМ (среднее значение) = 40,65±5,6; стоматологические индексы: КПУ: 13,3±0,6 – РМА: 24±2,8 – Green V.: 0,9±0,1, имеются металлические конструкции;
III (n = 10) – возраст: 45–59 гг.; ПМ (среднее значение) = 32,12±6,2; стоматологические индексы: КПУ: 14,2±0,4; РМА: 41,7±4,9; Green V.: 1,2±0,3 металлические конструкции отсутствуют;
IV (n = 10) – возраст: 45–59 гг.; ПМ (среднее значение) = 29,44±7,1 стоматологические индексы: КПУ: 16,3±0,3; РМА: 45,26±2,1; Green V.: 1,8±0,6, имеются металлические конструкции;
V (n = 10) – возраст: 60–74 гг.; ПМ (среднее значение) =25,23±4,2;
стоматологические индексы: КПУ: 17,4±0,5; РМА: 49,7±3,5; Green V.: 2,1±0,7, металлические конструкции отсутствуют.
VI (n = 10) – возраст: 60–74 гг.; ПМ (среднее значение) =18,19±5,23;
стоматологические индексы: КПУ: 19,3±0,2; РМА: 52,4±4,1; Green V.: 2,5±0,6, имеются металлические конструкции.
Каждой группе, имеющей различные факторы риска, рекомендована определенная программа профилактики и лечения ОМ, представленная на рисунке 1.
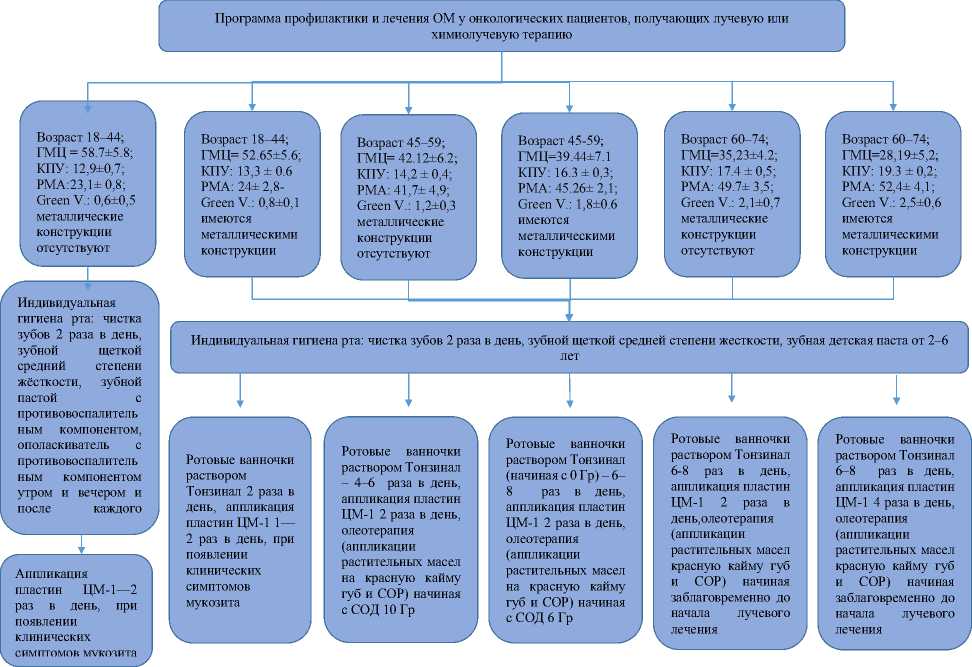
Рис. 1. Программа профилактики и лечения ОМ у онкологических пациентов, получающих лучевую терапию.
В основе данной программы (Рис. 1) проводилась коррекция индивидуальной гигиены рта пациента, применялись препараты локальной доставки веществ пролонгированного действия (преимущественно растительных препаратов с маклеей, шалфеем, шиповником и ромашкой). При первичном обращении, до лучевого лечения, врачом стоматологом определялось направление программы (Рис. 1) в зависимости от исходных данных (возраст пациента, значение индексов КПУ и РМА, показатели гемомикроциркуляции СОР). Выбранное направление определяет особенности индивидуальной гигиены рта, количество и продолжительность орошений и аппликаций противовоспалительных препаратов в зависимости от СОД. Далее проводится обучение пациента, все процедуры (индивидуальная гигиена рта, полоскания, аппликации препаратов пролонгированного действия на растительной основе) проводятся пациентом самостоятельно с еженедельным контролем в кабинете врача-стоматолога.
Все пациенты получали 3D конформную дистанционную лучевую терапию на область опухоли, зону субклинического распространения (+1,5 см), регионарные лимфоузлы с последующим локальным облучением зоны опухоли: I группа – СОД 65,8±1,13; II группа -СОД 67,4±1,34; III группа СОД 65,8±1,13; IV группа СОД 65,8±1,75; V группа СОД 65,8±1,47; VI группа СОД 66,4±1,86. Статистических различий между группами не было, P >0,05.
Для оценки эффективности программы применялись как объективные, так и субъективные критерии. В качестве объективных методов проводились клиническая оценка состояния слизистой оболочки рта с определением степени тяжести орального мукозита по классификации RTOG и динамическая оценка состояния ГМЦ слизистой оболочки рта методом лазерной допплеровской флоуметрии (ЛДФ) на аппарате ЛАКК-М. Субъективные методы включали оценку качества жизни пациентов с помощью опросника OHIP-14. Все исследования проводились до начала противоопухолевого лечения, на фоне (с периодичностью 1 раз в неделю) и после лечения (на протяжении 2-х месяцев, с периодичностью 1 раз в 14 дней).
Для определения результативности предложенной программы каждая группа была разделена на две подгруппы, одна подгруппа получала лечение в соответствии с предложенной программой соответственно I1, II1, III1, IV1, V1, VI1, а вторая подгруппа получала наиболее распространенное лечение, применяемое в лечебной практике -соответственно I2, II2, III2, IV2, V2, VI2 (Рис. 2).
Все обследуемые были проинформированы о характере исследования и письменно подтвердили свое согласие на участие. Обследования проводили в соответствии с этическими принципами проведения научных медицинских исследований с участием человека, определенными Хельсинской декларацией Всемирной медицинской ассоциации (1964–2000). Статистическая обработка данных осуществлялась по общей матрице данных Microsoft Word Document Word 97–2003 (Microsoft, USA), EXCEL 7.0 (Microsoft, USA) и пакета статистических программ SPSS IBM 20,0. Статистический анализ проводился методом вариационной статистики с определением средней величины (М), ее средней ошибки (±m), оценки достоверности различия по группам с помощью критерия Стьюдента (t).
подгруппы Ia1, II1, III1, IV1, V1, VI1


подгруппы I2, II2, III2 , IV2 , V2 , VI2

Лечение в соответствии с программой профилактики и лечения ОМ у онкологических пациентов, получающих ЛТ
Орошение рта отваром ромашки-3 раза вдень
Метрогил дента-2 раза в день
Олеотерапия-2 раза в день с момента появления первых признаков мукозита
Рис. 2. Схематичное изображение дизайна исследования по определению эффективности предложенной программы профилактики по сравнению с наиболее распространенным лечением, применяемом в клинической практике.
Результаты исследования
Результаты сравнительной оценки эффективности предложенной программы со стандартными методами (наиболее распространенными подходами) представлены в
Таблицах 1–3.
Таблица 1. Результаты оценки эффективности предложенной программы профилактики и лечения ОМ в зависимости от степени тяжести орального мукозита, длительности его течения и качества жизни пациентов
|
Группы |
Максимальная степень тяжести ОМ ( P <0,001) |
Длительность ОМ ( P <0,001) |
Субъективная оценка качества жизни пациентов на этапе максимально выраженных клинических проявлений ОМ согласно опроснику OHIP-14 ( P <0,05) |
|
Подгруппа I1 |
0,3±0,45 |
0,9±1,45 |
18±0,22 |
|
Подгруппа I2 |
0,5±0,50 |
1±1,05 |
22.85±0.72 |
|
Подгруппа II1 |
0,6±0,66 |
1,6±1,71 |
24,52±0,14 |
|
Подгруппа II2 |
0,8±0,78 |
2±1,76 |
29±0,44 |
|
Подгруппа III1 |
1,1±0,56 |
2,9±1,10 |
32.14±0.57 |
|
Подгруппа III2 |
1,4±0,84 |
3,5±1,77 |
37±0,88 |
|
Подгруппа IV1 |
1,5±1,85 |
3,2±1,22 |
44.28±0.64 |
|
Подгруппа IV2 |
1,4±0,17 |
2,9±2,28 |
48±0,26 |
|
Подгруппа V1 |
2,4±0,51 |
4,5±0,7 |
52,42±0,49 |
|
Подгруппа V2 |
2,3±0,48 |
4,7±0,94 |
54,42±0,66 |
|
Подгруппа VI1 |
2,0±0,94 |
4,7±1,41 |
59±0,65 |
|
Подгруппа VI2 |
2,5±0,7 |
6±1,33 |
61,32±0,24 |
В отношении определения максимальной степени тяжести ОМ (Табл. 1) полученные результаты демонстрируют, что в подгруппах пациентов I1, II1, III1, IV1, V1, VI1, следующих предложенной программе, течение ОМ менее интенсивное. Не выявлялось прогрессирование ОМ с I–II степени тяжести до III степени.
При сравнении групп I2, II2, III2, IV2, V2, VI2 между собой, в отношении максимальной степени тяжести ОМ, полученные результаты демонстрируют отсутствие статистически значимых различий ( P = 0,228).
При оценке длительности ОМ в группах I1, II1, III1, IV1, V1, VI1 (Табл. 1), следующих назначенной схеме, показатели лучше (ниже на 31%) чем в группах сравнения I2, II2, III2, IV2, V2, VI2 ( P <0,001). Предложенная схема позволяет снизить длительность течения ОМ на 4,7±3,8 дней.
Также (Табл. 1) наблюдались значимые различия в оценке качества жизни пациентов по шкале Oral Health Impact Profile (OHIP-14). Качество жизни пациентов групп I1, II1, III1, IV1, V1, VI1 в среднем составило 32,85 баллов, что на 13 % ниже, чем в группах I2, II2, III2, IV2, V2, VI2. В отношении затруднения при приеме пищи в группах I1, II1, III1, IV1, V1, VI1 показатели на 14% лучше ( P = 0,024), при оценке открывания рта - на 19% ( P = 0,001), при оценке стесненности в общении с людьми – на 23% ( P = 0,003) и болезненности – на 11% лучше ( P = 0,006).
Оценка частоты возникновения и тяжести течения ОМ представлена в Таблице 2.
Таблица 2. Результаты оценки эффективности предложенной программы профилактики и лечения ОМ в зависимости от частоты возникновения и тяжести течения ОМ
|
Степень тяжести ОМ |
Подгруппа IIa1, IIб1, IIв1, IIг1, IIд1, IIе1 |
Подгруппа IIa2, IIб2, IIв2, IIг2, IIд2, IIе2 |
Значение P |
|
I степень (% от общего случаев) |
53,16% |
16,45% |
0,009 |
|
II-III степень (% от общего случаев) |
29,11% |
74,68% |
0,003 |
|
IV степень (% от общего случаев) |
17.70% |
8.86% |
0,004 |
Как видно из Таблицы 2, большинство пациентов в группах I1, II1, III1, IV1, V1, VI1 (53,16%) имели I степень тяжести ОМ. В группах I2, II2, III2, IV2, V2, VI2 распространенность ОМ I степени составила 16,45%, а 74,66% пациентов отметили II–III степень (% от количество выявленных случаев). Т. е., полностью предотвратить развитие ОМ нам не удалось, однако данный подход позволил снизить интенсивность клинических проявлений.
Результаты сравнения показателей гемомикроциркуляции представлены в Таблице 3.
Таблица 3. Результаты оценки эффективности предложенной программы профилактики и лечения ОМ в зависимости от результатов оценки показателей гемомикроциркуляции СОР
|
Группы |
Показатель гемомикроциркуляции (ПМ) СОР, |
|
|
до лучевой терапии |
после лучевой терапии |
|
|
I1, II1, III1, IV1, V1, VI1 |
40,53±11,21 |
33,52±8,51 |
|
I2, II2, III2, IV2, V2, VI2 |
40,77±11,35 |
25,54±8,67 |
|
Значение P |
P >0,05 |
P <0,001 |
Как видно из Таблицы 3, до лучевой терапии показатели гемомикроциркуляции у подгрупп, следующих назначенной схеме, и подгрупп, не следующих ей, статистически не отличаются. После лучевой терапии показатели гемомикроциркуляции снижаются в обеих группах. Но в группах, следующих назначенной схеме – на 29%, в группах, не следующих назначенной схеме – на 46% по сравнению с первоначальными показателями ( P <0,001).
Таким образом, полученные результаты демонстрируют эффективность предложенной программы профилактики и лечения ОМ.
Обсуждение результатов
Вопросам профилактики и лечения орального мукозита уделяется большое внимание [4, 7, 15–22]. На основании проведенного нами анализа установлено, что за последние 20 лет более чем в 250 работах проведена оценка эффективности средств и методов профилактики и лечения оральных мукозитов. Всего несколько из исследованных подходов рассматриваются учеными как эффективные и включены в рекомендации по лечению ЗНО. Остальные рассматриваются как перспективные и требуют дальнейшего изучения на больших группах пациентов.
Полученные нами результаты демонстрируют значимость и результативность предложенной программы. При сравнении полученных данных с ранее проведенными исследованиями (введение палифермина, факторов роста кератиноцитов, применении низкоинтенсивного лазерного излучения, озона и др.) можно сделать вывод о том, что наши клинические результаты аналогичны [7, 18, 21, 22].
Заключение
Предложенная программа профилактики и лечения орального мукозита у пациентов со злокачественными новообразованиями орофарингеальной области, основанная на показателях гемомикроциркуляции слизистой оболочки рта, возрасте пациентов и стоматологических факторах риска, показала свою эффективность. У пациентов, получающих лечение по данной программе, отмечается менее интенсивное (на 29,11% реже встречаются ОМ II–III степени тяжести) и менее продолжительное (на 4,7±3,8 дней меньше) течение орального мукозита, P <0,001. Предложенная программа может быть рекомендована для применения как в условиях стационара или дневного стационара, так и в амбулаторных условиях.
Список литературы Разработка и оценка эффективности программы профилактики и лечения радиоиндуцированного орального мукозита у пациентов с опухолями орофарингеальной области
- Аванесов А.М., Гвоздикова Е.Н. Прогностические факторы, определяющие клиническое течение орального мукозита у пациентов с плоскоклеточным раком орофарингеальной области. Вестник РУДН. Серия: Медицина. 2018. Т. 22. № 1. С. 22-28. DOI: 10.22363/2313 -0245-2018-22-1 -22-28.
- Алымов Ю.В., Мудунов А.М., Алиева С.Б. и др. Роль препаратов гиалуроновой кислоты в профилактике и лечении лучевого мукозита полости рта и ротоглотки. Опухоли головы и шеи. 2019. Т. 9. № 3. С. 29-37. DOI: 10.17650/2222-1468-2019-9-3-29-37.
- Каприна А.Д., Старинский В.В., Шахзадова А.О. (ред.). Злокачественные новообразования в России в 2020 году (заболеваемость и смертность). М.: МНИОИ им. П. А. Герцена. 2021. С. 11-17.
- Геворков А.Р., Бойко А.В., Болотина Л.В., Шашков С.В. Основные принципы ведения пациентов с мукозитом и дерматитом при лучевом лечении с лекарственной модификацией больных плоскоклеточным раком орофарингеальной области. Опухоли головы и шеи. 2016. Т. 3. С. 12-21. DOI: 10.17650/2222-1468-2016-6-3-12-21.
- Нгуен З.Х. Гемомикроциркуляция слизистой оболочки рта как показатель прогноза развития и клинического течения орального мукозита у пациентов со злокачественными новообразованиями орофарингеальной области на фоне лучевой терапии. Дис. ... канд. мед. наук. М. 2021. 115 с.
- Ерёмина А.О., Задеренко И.А., Иванов С.Ю. и др. Оральные мукозиты у пациентов с онкологической патологией орофарингеальной области: обзор литературы. Опухоли головы и шеи. 2020. Т. 10. № 3. С. 72-80. DOI: 10.17650/2222-1468-2020-10-3-72-80.
- Седова Е.С. Эффективность фотобиомодуляции для профилактики и лечения осложнений лучевой и химиолучевой терапии у больных раком орофарингеальной области. Дис. ... канд. мед. наук. М. 2022. 105 с.
- Титова В.А., Харченко Н.В., Петровский В.Ю. и др. Фотодинамическая терапия в программах органосохраняющего лечения рака различных локализаций. Медицинская радиология и радиационная безопасность. 2006. Т. 51. № 3. С. 60-64.
- Liao C.T., Chang J.T., WangH.M., et al. Surgical outcome of T4a and resected T4b oral cavity cancer. Cancer. 2006. V. 107. No. 2. P. 337-344. DOI: 10.1002/cncr.21984.
- Elting L.S., Cooksley C.D., Chambers M.S., Garden A.S. Risk, outcomes, and costs of radiation-induced oral mucositis among patients with head-and-neck malignancies. Int J Radiat Oncol Biol Phys. 2007. V. 68. No. 4. P. 1110-1120. DOI: 10.1016/j.ijrobp.2007.01.053.
- Muanza T.M., Cotrim A.P., McAuliffe M., et al. Evaluation of radiation-induced oral mucositis by optical coherence tomography. Clin Cancer Res. 2005. V. 11. No. 14. P. 51215127. DOI: 10.1158/1078-0432.CCR-05-0403.
- Richard J.M., Sancho-Garnier H., Pessey J.J., et al. Randomized trial of induction chemotherapy in larynx carcinoma. Oral Oncol. 1998. V. 34. No. 3. P. 224-228. DOI: 10.1016/s1368-8375(97)00090-0.
- Wasserman T.H., Brizel D.M., Henke M., et al. Influence of intravenous amifostine on xerostomia, tumor control, and survival after radiotherapy for head-and-neck cancer: 2-year follow-up of a prospective, randomized, phase III trial. Int J Radiat Oncol Biol Phys. 2005. V. 63. No. 4. P. 985-990. DOI: 10.1016/j.ijrobp.2005.07.966.
- Sonis S.T.The Chicken or the Egg? Changes in Oral Microbiota as Cause or Consequence of Mucositis During Radiation Therapy. EBioMedicine. 2017. V. 18. P. 7-8. DOI: 10.1016/j.ebiom.2017.03.017.
- Maria O.M., Eliopoulos N., Muanza T. Radiation-Induced Oral Mucositis. Front Oncol. 2017. V. 7. Article ID 89. DOI: 10.3389/fonc.2017.00089.
- Buentzel J., Bauer C., Buentzel J. How to bridge the gap? European medical plants used for treating oral mucositis: on the search for evidence. J Cancer Res Clin Oncol. 2020. V. 146. No. 4. P. 985-1001. DOI: 10.1007/s00432-020-03124-x.
- Sant Ana G., Normando A.G.C., De Toledo I., et al. Topical Treatment of Oral Mucositis in Cancer Patients: A Systematic Review of Randomized Clinical Trials. Asian Pac J Cancer Prev. 2020. V. 21. No. 7. P. 1851-1866. DOI: 10.31557/APJCP.2020.21.7.1851.
- Shuai T., Tian X., Shi B., et al. Prophylaxis with Oral Zinc Sulfate Against Radiation Induced Oral Mucositis in Patients with Head and Neck Cancers: A Systematic Review and Meta-Analysis of Four Randomized Controlled Trials. Front Oncol. 2019. V. 9. Article ID 165. DOI: 10.3389/fonc.2019.00165.
- Liu S., Zhao Q., Zheng Z., et al. Status of Treatment and Prophylaxis for Radiation-Induced Oral Mucositis in Patients with Head and Neck Cancer. Front Oncol. 2021. V. 11. Article ID 642575. DOI: 10.3389/fonc.2021.642575.
- Dharman S., G.M., Shanmugasundaram K., Sampath R.K.. A Systematic Review and Meta-Analysis on the Efficacy of Curcumin/Turmeric for the Prevention and Amelioration of Radiotherapy Radiochemotherapy Induced Oral Mucositis in Head and Neck Cancer Patients. Asian Pac J Cancer Prev. 2021. V. 22. No. 6. P. 1671-1684. DOI: 10.31557/APJCP.2021.22.6.1671.
- Agha-Hosseini F., Pourpasha M., Amanlou M., Moosavi M.S. Mouthwash Containing Vitamin E, Triamcinolon, and Hyaluronic Acid Compared to Triamcinolone Mouthwash Alone in Patients with Radiotherapy-Induced Oral Mucositis: Randomized Clinical Trial. Front Oncol. 2021. V. 11. Article ID 614877. DOI: 10.3389/fonc.2021.614877.
- Arakelyan K.A., Romanenko I.G., Golubinskaya E.P., et al. Possibilities of correcting iatrogenic mucositis with cyanides in experiment. Russian Open Medical Journal. 2020. V. 9. No. 4. Article ID e0405.


