Разработка методического подхода к оценке качества и безопасности тромбоцитов методом динамического светорассеяния
Автор: Касьянов А.Д., Бессмельцев С.С., Левин А.Д.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Оригинальные статьи
Статья в выпуске: 4 т.20, 2024 года.
Бесплатный доступ
Донорская кровь и ее компоненты могут содержать клеточные фрагменты из различных клеток, в первую очередь из активированных тромбоцитов. Выполняя роль врожденных иммунных клеток и основных участников процесса свертывания крови, тромбоциты меняют форму и генерируют микрочастицы. Тромбоцитарные микрочастицы усиливают формирование межклеточных контактов и способствуют развитию воспалительных реакций. Взаимодействуя с лейкоцитами, микрочастицы тромбоцитов повышают их адгезивность, активируют процесс взаимодействия нейтрофильных гранулоцитов как с эндотелиальными клетками, так и с тромбоцитами. При воспалительных и тромботических состояниях количество образуемых микрочастиц существенно увеличивается. Образование тромбоцитарных микрочастиц способствует иммунным реакциям из-за высокого содержания в них провоспалительных цитокинов, различных хемокинов и липидных медиаторов. Обнаружение микрочастиц на основе динамического рассеяния света (ДРС) позволит отличать активированные (с высоким содержанием микрочастиц) от неактивированных (с низким содержанием микрочастиц) тромбоцитов при переливании и оптимизировать использование этого дефицитного компонента крови. Рациональный подход к переливанию концентрата тромбоцитов с учетом степени активации позволит сократить объем заготовки и общее количество профилактических трансфузий КТ, дифференцировать дефицитные компоненты для профилактических и лечебных трансфузий.
Концентрат тромбоцитов, микрочастицы, динамическое светорассеяние, рефрактерность
Короткий адрес: https://sciup.org/170206640
IDR: 170206640
Текст научной статьи Разработка методического подхода к оценке качества и безопасности тромбоцитов методом динамического светорассеяния
Введение. Среди всех микрочастиц, находящихся в крови, тромбоцитарные микрочастицы (ТМЧ) являются наиболее многочисленными [1]. ТМЧ состав- because of their high content of pro-inflammatory cytokines, various chemokines and lipid mediators.
The detection of microparticles based on dynamic light scattering (DLS) will allow us to distinguish activated (high microparticle content) from inactivated (low microparticle content) platelets during transfusion and optimize the use of this scarce blood component. Rational approach to platelet concentrates transfusion taking into account the degree of activation will allow to reduce the volume of procurement and the total number of prophylactic CT transfusions, to differentiate deficient components for prophylactic and therapeutic transfusions.
ляют около 70–90% от общего числа таковых. Растет научный и клинический интерес к физиологической роли, которую играют тромбоцитарные микроча- стицы [2]. ТМЧ представляют собой фрагменты размером 0,1–1 мкм, выделяемые из плазматических мембран тромбоцитов, которые подвергаются активации, стрессу или апоптозу. Они имеют структуру на основе фосфолипидов и экспрессируют функциональные рецепторы из мембран тромбоцитов. Являясь наиболее распространенными микрочастицами в крови, ТМЧ экспрессируют прокоагулянт фосфа-тидилсерин и, вероятно, дополняют, если не усиливают, функции тромбоцитов в гемостазе, тромбозе, онкологическом процессе и воспалении, но также действуют как стимуляторы регенерации тканей. Их размер и структура делают ТМЧ незаменимыми во взаимодействии между тромбоцитами и клетками в качестве инструмента доставки переносимых тромбоцитами биологически активных молекул, включая факторы роста, другие сигнальные молекулы и микро(ми)РНК. Таким образом, ТМЧ могут представлять патофизиологическую угрозу или пользу для клеточной среды при взаимодействии с кровеносной системой. Также появляется все больше доказательств того, что выработка ТМЧ запускается во время донации, разделения на компоненты и хранения крови, что может привести к тромботическим и воспалительным побочным эффектам у реципиентов. Оценка ТМЧ требует строгих преана-литических и аналитических процедур, чтобы избежать генерации артефактов и обеспечить точную оценку количества, перераспределения размера и функциональных свойств этих микрочастиц.
Точная характеристика ТМЧ требует тщательной подготовки образцов для исследования, чтобы избежать экспериментальных артефактов. Кроме того, при оценке ТМЧ должен быть сделан разумный выбор аналитических методов, сочетающих методики, характеризующие клеточное происхождение, численность, размер и функциональную активность микрочастиц [3].
Показатель содержания микрочастиц как фрагментации и гетерогенности тромбоцитов может соответствовать требованиям к универсальному показателю качества для производства, хранения, жизнеспособности, функции и совместимости тромбоцитов [4, 5]. Гетерогенность концентратов тромбоцитов с учетом степени активации по микрочастицам дает возможность корректировать процесс заготовки, а также дифференцировать КТ для профилактических и лечебных трансфузий.
В качестве экспресс-метода, позволяющего оперативно контролировать содержание микрочастиц в концентратах тромбоцитов, было предложено использовать динамическое рассеяние света (ДРС). Это достаточно эффективный метод измерения размеров и распределения по размерам частиц в жидкости. В анализаторах ДРС непосредственно измеряется зависимость от времени интенсивности лазерного излучения, рассеянного взвешенными в жидкости частицами. По этой зависимости восста- навливается распределение частиц в координатах «диаметр частиц – относительная интенсивность излучения, рассеянного частицами данного диаметра» (распределение по интенсивности). На таких распределениях выделяют две области – в интервале от 0,05 до 0,5 мкм, соответствующую микрочастицам и в области от 1 до нескольких мкм, соответствующую тромбоцитам. На этом принципе основана оценка концентратов тромбоцитов с помощью специализированного ДРС анализатора ThromboLUX, выпускавшегося канадской фирмой LightIntegra Technology. Показана хорошая корреляция оценок состояния тромбоцитов и микрочастиц, полученных по методике ThromboLUX, c данными проточной цитометрии и электронной микроскопии. В обзорной статье [6] на основании анализа большого количества экспериментальных и клинических данных сделан вывод, что содержание микрочастиц может быть достаточно универсальным индикатором, позволяющим оценить качество тромбоцитов в концентрате и правильно определить категорию больных, для которых данный концентрат является оптимальным. Методика ThromboLUX применялась в США и Канаде, в частности, для сравнительного анализа качества концентратов тромбоцитов, полученных у разных доноров или разными способами из крови одного донора.
Цель исследования. Разработка методического подхода с использованием динамического рассеяния света для анализа содержания микрочастиц в концентратах тромбоцитов.
Материалы и методы. Образцы КТ для исследований предоставлялись Центром крови ФМБА России. КТ получали из цельной донорской крови методом афереза в добавочном растворе, при этом проводили лейкоредукцию. Каждый образец передавался в двух аликвотвх – до и после патогенредук-ции. Объем каждого образца составлял около 210 мл, содержание тромбоцитов в образце превышало 2х1011 клеток.
Измерение размеров ТМЧ частиц в образцах концентратов тромбоцитов выполняли методом динамического рассеяния света, основанном на определении коэффициента диффузии микрочастиц в жидкости путем анализа характерного времени флуктуации интенсивности рассеянного света в объеме, содержащем микрочастицы в растворе.
На рисунке 1 приведена оптическая схема измерения размеров частиц в жидкости методом динамического рассеяния света.
Для измерений методом ДРС использовался анализатор «Zetasizer Nano ZS» фирмы «Malvern»), предназначенный для измерений размеров и дзета-потенциала частиц и макромолекул в жидких средах, приведенный на рисунке 2.
В этом анализаторе реализована схема обратного рассеяния, то есть угол рассеяния составляет 173º, при этом сбор рассеянного излучения осуществлял-
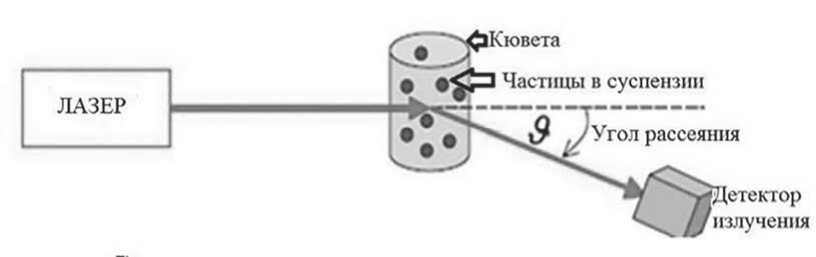
Рисунок 1 . Оптическая схема измерения размеров частиц методом динамического рассеяния света
ся вблизи передней поверхности кюветы. Это дает возможность работать с сильно поглощающими растворами, какими являются КТ. В этой связи была предложена методика определения микрочастиц в КТ с помощью динамического рассеяния света (ДРС) с помощью специализированного ДРС анализатора, разработанного компанией LightIntegra Technology Inc., Канада.
Методика предусматривает отбор пробы КТ в капиллярную кювету и измерение распределения частиц в координатах «диаметр-относительная интенсивность рассеяния». При использовании методики ThromboLUX c тестируемым концентратом тромбоцитов проводят три измерения при температуре 37 ℃, затем охлаждают до 20 ℃, затем снова нагревают до 37 ℃. По распределениям размеров частиц, полученным в результате этих измерений, вычисляют интегральный показатель TLScore, характеризующий долю микрочастиц в концентрате тромбоцитов, устойчивость концентрата к температурному стрессу и способность восстанавливаться после него.
Таким образом, фактор TLScore получается путем суммирования трех слагаемых, каждое из которых тем больше, чем больше тромбоцитов и меньше микрочастиц. Значения этого фактора находятся в пределах от 0 до 40 [7].
Результаты . Исследовано 22 образца аферезных
КТ. На рисунке 3 представлены примеры распределений размеров частиц в КТ в координатах «диаметр – интенсивность», измеренных в стандартной флуориметрической кювете и микрокювете. На каждом из графиков представлены результаты 5 параллельных измерений.
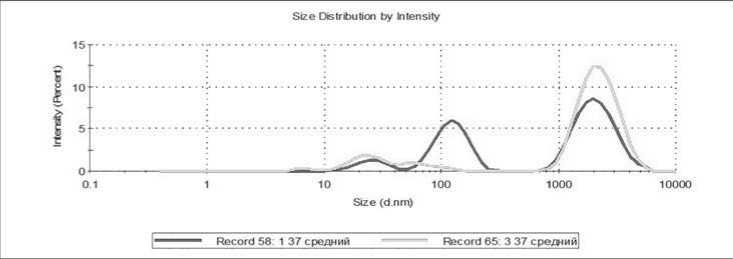
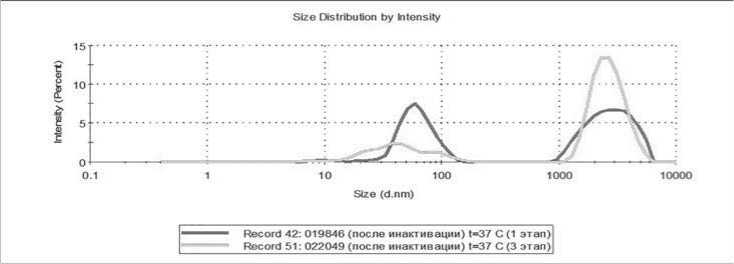
На этих рисунках на верхней кривой показаны распределения с малым числом микрочастиц, а нижней кривой – с достаточно большим числом микрочастиц. Видно, что на распределениях, измеренных в микрокювете, более явно видны пики трех ожидаемых видов: от экзосом (в интервале диаметров от 10 до 100 нм), от микрочастиц тромбоцитарного происхождения (в интервале от 50 до 500 нм) и от тромбоцитов (в интервале от 1000 до 5000 нм). С учетом перспектив практического использования разрабатываемого метода, основной объем измерений проводился с использованием микрокювет при объеме дозирования 100 мкл. При этом воспроизводимость получаемых результатов существенно зависела от исследуемого образца. На рисунке 4 в качестве примера хорошей воспроизводимости приведены результаты трех параллельных измерений распределений для образца КТ при температуре 37 ℃.
Среди исследованных образцов были КТ как с низким, так и с высоким относительным содержанием микрочастиц. Примеры таких распределений приведены на рисунках 5 и 6.

Рисунок 2 . Анализатор размера частиц и дзета-потенциала Malvern Zetasizer Nano ZS.
а) в стандартной флуориметрической кювете
б) в микрокювете
Рисунок 3. Примеры распределений коллоидных частиц в КТ
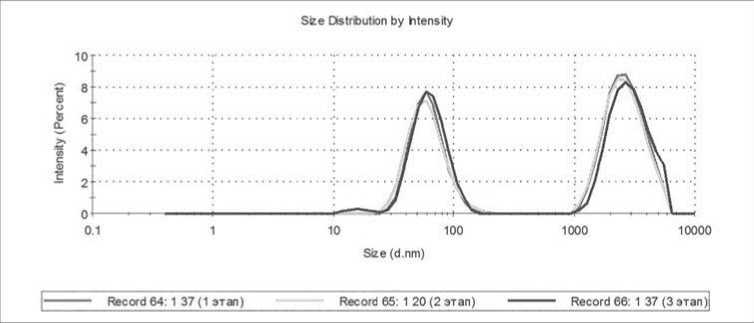
Рисунок 4. Результаты трех параллельных измерений распределений по интенсивности
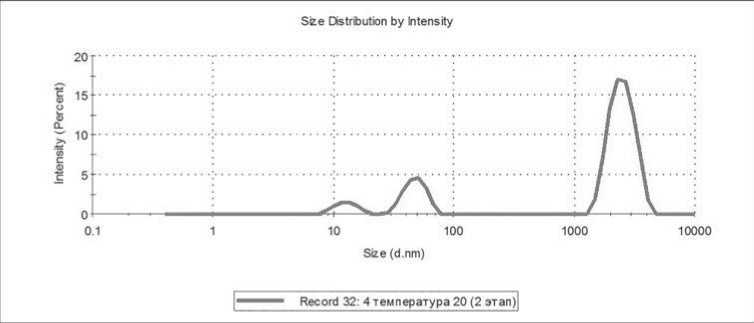
Рисунок 5. Пример распределения с относительно низким содержанием микрочастиц, измеренного при температуре 20 ℃, первый (слева) пик соответствует экзосомам, второй – микрочастицам тромбоцитарного происхождения, третий – тромбоцитам
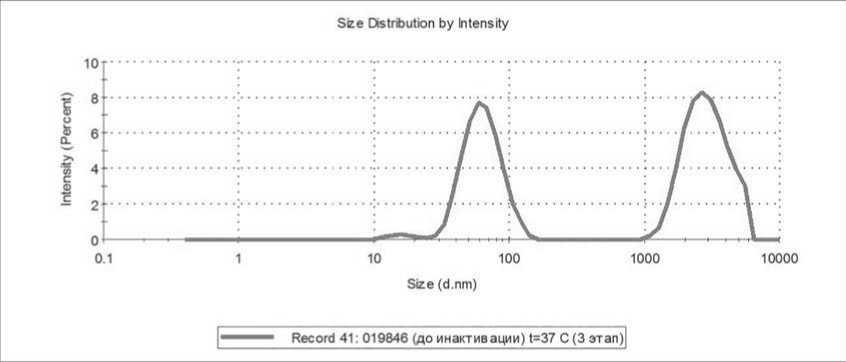
Рисунок 6. Пример распределения с относительно высоким содержанием микрочастиц, измеренного при температуре 37 ℃.
Методика ThromboLUX предусматривает вычисление по результатам трех измерений распределений частиц КТ методом ДРС показателя качества ThromboLUX Score. С учетом результатов проведенных измерений, указанный критерий имеет следующие недостатки:
-
1) Жестко заданные граничные значения по шкале радиусов (диаметров), соответствующие пику микрочастиц и пику тромбоцитов. Как показывают полученные результаты измерений, эти границы могут быть достаточно подвижными, игнорирование этого обстоятельства приведет к неправильной оценке относительного вклада микрочастиц и тромбоцитов в интенсивность рассеянного излучения;
-
2) При вычислении ThromboLUX Score для каждого пика используется только значение его максимума, при этом форма пика вообще не учитывается. Для разных распределений частиц формы пиков могут существенно различаться, что также необходимо учитывать при оценке относительных вкладов микрочастиц и тромбоцитов.
-
3) С учетом отмеченных недостатков предлагается более информативный критерий оценки содержания микрочастиц в КТ, по соотношению площадей пиков, соответствующих микрочастицам и тромбоцитам. Этот критерий описывается формулой
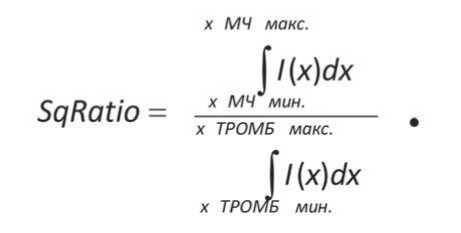
Здесь x – текущие значения диаметров, I – интенсивность рассеянного излучения, x_ТРОМБ_мин., и x_ТРОМБ_макс. – соответственно минимальные и максимальные значения диаметров, ограничивающие пик тромбоцитов, x_МЧ_мин. и x_МЧ_макс. – аналогичные значения диаметров, ограничивающие пик микрочастиц.
Значения SqRatio вычисляются на каждой из стадий измерения образца КТ, предусмотренных методикой ThromboLUX (в исходном состоянии при 37 ℃, при снижении температуры до 20 ℃ и после повторного нагрева до 37 ℃). Эти значения характеризуют, соответственно:
– содержание микрочастиц тромбоцитарного происхождения (ТМЧ) в образце КТ;
– устойчивость данного образца КТ к температурному стрессу;
– способность к восстановлению после стресса.
Чем больше значение SqRatio в данном образце КТ, тем больше в нем содержание ТМЧ, и, соответственно, тем выше гетерогенность и функциональная способность тромбоцитов.
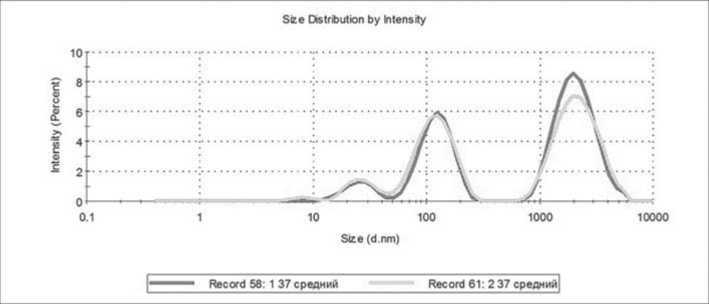
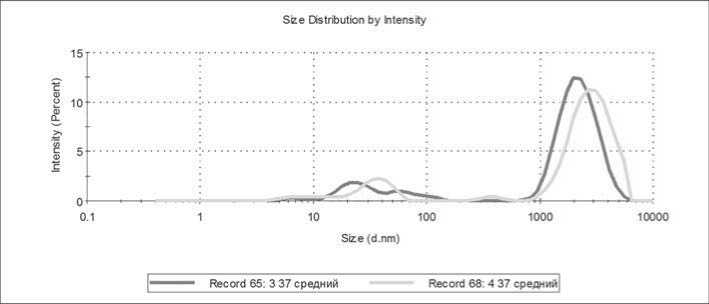
Для иллюстрации предложенного критерия ниже приводятся данные, полученные для образцов КТ, приготовленных из крови двух разных доноров, до и после процедуры патогенредукции (ПР). На рисунке 7 приведены распределения частиц, полученные в исходном состоянии КТ, при температуре 37 ℃.
-
а) донор 1, б) донор 2. На каждом из графиков красным цветом приведены данные, полученные для образца до патогенредукции, а зеленым – после этой процедуры.
В ходе работы составлена компьютерная программа, осуществляющая расчеты по предложенному критерию. На данной стадии граничные значения диаметров индивидуально выбирались для каждого распределения. В настоящее время это делается вручную, в дальнейшем будет выбран формализованный критерий, позволяющий осуществлять это выбор с помощью компьютерной программы.
В таблице 1 приведены результаты расчетов по данным, приведенным на рисунке 7, как крите-
а) донор 1
-
б) донор 2
Рисунок 7. Распределения частиц в КТ, полученных из крови двух доноров.
Примечание. На каждом из графиков приведены данные, полученные для образца до патогенредукции и после этой процедуры.
рия TLScore, так и предложенного выше критерия SqRatio. Из сопоставления распределений частиц, приведенных на рисунке 7, следует, что в КТ, приготовленном из крови донора 1, значительно больше ЧМТ, чем в КТ от донора 2. Следовательно, КТ от донора 1 более гетерогенен и менее функционален по клеточному составу, чем КТ от донора 2. Это подтверждается и сравнением критериев, приведенных в таблице.
Таблица 1.
Сопоставление критериев оценки КТ по распределениям частиц
|
Сведения об образце |
TLScore |
По соотношению площадей пиков SqRatio |
|||
|
37 0С первичный |
20 0С |
37 0С вторичный |
Среднее по трем температурам |
||
|
Донор 1 до ПР |
9,8 |
56,28 |
63,62 |
59,81 |
59,9 |
|
Донор 1 после ПР |
8,6 |
67,02 |
77,17 |
69,79 |
71,3 |
|
Донор 2 до ПР |
19,4 |
5,98 |
4,99 |
3,28 |
4,75 |
|
Донор 2 после ПР |
19,1 |
1,09 |
1,4 |
0,82 |
1,1 |
«Порог отсечки» по степени активации критерию TL Score составляет в разных лабораториях, от 12 до 16 [7]. Тромбоциты в КТ и низкими значениями TL Score гетерогенны, более функциональны, но менее жизнеспособны, чем клетки в КТ с высокими значениями этого показателя. Таким образом, КТ из крови донора 1 целесообразно использовать для лечебных трансфузий, а КТ донора 2 пригоден для профилактических переливаний. Такие же выводы следуют из оценок по критерию SqRatio – низкие значения этого критерия для образцов от донора 2 свидетельствуют о низкой гетерогенности и хорошей жизнеспособности, и, наоборот, высокие значения SqRatio для КТ от донора 1 показывают высокую функциональность, но низкую жизнеспособность тромбоцитов в этом компоненте.
Таким образом, нами проведено исследование с целью выяснения возможностей достоверной оценки содержания микрочастиц в КТ и экспресс-кон-троля качества этих концентратов методом ДРС. Воспроизведена используемая в этих целях в ряде стран (Канада, США) методика ThromboLUX. При этом использовался анализатор размеров частиц MalvernZetasizer NanoZS, в котором реализована схема обратного рассеяния (угол рассеяния 173º). Измерения проводились в стандартных флуорометрических кюветах и в микрокюветах при объеме дозирования 100 мкл.
На измеренных распределениях частиц в КТ надежно идентифицируются пики, обусловленные экзосомами, микрочастицами тромбоцитарного происхождения и самими тромбоцитами. Показана возможность оперативной оценки качества КТ по распределениям частиц.
Показаны ограничения критерия TL Score, используемого в методике ThromboLUX для оценки качества КТ по распределениям частиц, измеренным методом ДРС. Предложен новый критерий, использующий отношение площадей под пиками, соответствующими микрочастицам тромбоцитарного происхождения и тромбоцитам. При этом границы этих пиков не задаются как жестко фиксированные, а определяются, исходя из особенностей конкретного распределения частиц. Предложенный критерий позволяет более полно использовать информацию, со- держащуюся в измеренных распределениях частиц.
Заключение
Управление запасами тромбоцитов, основанное на анализе содержания тромбоцитов и тромбоцитарных микрочастиц в концентратах тромбоцитов, является перспективной стратегией в области повышения эффективности и безопасности трансфузионной терапии [8]. С помощью обнаружения микрочастиц на основе метода светорассеяния можно оперативно дифференцировать активированные компоненты (с высоким содержанием микрочастиц) и не активированные (с низким содержанием микрочастиц) при переливании, и тем самым оптимизировать использование высоко востребованного компонента крови – аферезного концентрата тромбоцитов.
Список литературы Разработка методического подхода к оценке качества и безопасности тромбоцитов методом динамического светорассеяния
- M. Diamant, M.E. Tushuizen, A. Sturk et al. Cellular microparticles: new players in the field of vascular disease? // Eur J Clin Invest. - 2004. - Vol. 34, No 6. - P. 392-401. EDN: FOZEKB
- T. Burnouf, H.A. Goubran, M.-L. Chou. Platelet microparticles: detection and assessment of their paradoxical functional roles in disease and regenerative medicine // Blood Rev. - 2014. - Vol. 28, No 4. - P.155-166. EDN: UQMPZL
- F. Momen-Heravi, L. Balaj, S. Alian et al. Alternative methods for characterization of extracellular vesicles // Front Physiol 2012. - Vol.3. - P. 354.
- L. Johnson, M.C. Reade, R.A. Hyland et al. In vitro comparison of cryopreserved and liquid platelets:potential clinical implications /// Hyland Transfusion. - 2015. - Vol. 55, No 4. - P. 838-847.
- L. Johnson, S. Tan, B. Wood et al. Refrigeration and cryopreservation of platelets differentially affect platelet metabolism and function: a comparison with conventional platelet storage conditions // Transfusion. 2016. -Vol. 56, No 7. - P. 1807-1818.
- Labrie A. et al. Characterization of platelet concentrates using dynamic light scattering //Transfusion Medicine and Hemotherapy. - 2013. - Vol. 40. - №. 2. - P. 93-100.
- Nicola Dewland. Does an Objective Laboratory Measurement of Platelet Quality Correlate with Clinical Efficacy?// Thesis, Oxford Brookes University, 2017. - P. 51-56.
- E. Maurer-Spurej, K. Chipperfield, Could Microparticles Be the Universal Quality Indicator for Platelet Viability and Function// Journal of Blood Transfusion, 2016: 140239.


