Редкий клинический случай заболевания нейробластомой у взрослого пациента
Автор: Солодкий В.А., Измайлов Т.Р., Машкова Ю.С.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Клинические наблюдения
Статья в выпуске: 1 т.19, 2019 года.
Бесплатный доступ
Вданной статье представлено редкое клиническое наблюдение взрослого пациента, мужчины 27 лет с клиническим диагнозом: нейробластома малого таза с интраканальным компонентом, метастазы в подвздошных лимфоузлах справа, костях и костном мозге. Данное клиническое наблюдение интересно тем, что являясь эмбриональной опухолью, нейробластома преимущественно встречается в раннем детском возрасте, примерно в 40% случаев - на первом году жизни. В 90% случаев нейробластома диагностируется в возрасте до 6 лет, когда происходит окончательное формирование симпатических ганглиев. У взрослых нейробластома встречается крайне редко, составляя 0,3 случая заболевания на миллион в год [1].
Нейробластома у взрослых, эмбриональная опухоль, опухоль центральной нервной системы
Короткий адрес: https://sciup.org/149132090
IDR: 149132090
Текст научной статьи Редкий клинический случай заболевания нейробластомой у взрослого пациента
Нейробластома – эмбриональная злокачественная опухоль, происходящая из симпатогониев (незрелых клеток-предшественников симпатической нервной системы), является самой частой экстракраниальной солидной опухолью у детей. Большинство опухолей локализуется забрюшинно, в надпочечнике – 32%, внеорганно паравертебрально – 28%, в средостении – 15%, в области таза – 5,6%, на шее – 2%. Число случаев неустановленных зон первичного развития опухоли – около 17%. Нейрообластома имеет тенденцию к метастазированию в определенные зоны: костный мозг – 81%, кости – 69%, лимфатические узлы – 65%, печень – 19%, легкие – 10%, ЦНС – 8% [1].
Этиология нейробластом до сих пор не ясна. Опухоли симпатической нервной системы характеризуются широким спектром дифференцировки от незрелых клеток предшественников до зрелых ганглионейронов. Эти опухоли имеют уникальные молекулярно-генетические характеристики. Примерно в 40% случаев наблюдается амплификация N-Myc онкогена и потеря гетерозиготности в виде делеции 1р. Эти изменения коррелируют с плохим прогнозом и, как правило, с распространенными стадиями заболевания. Важной цитогенетической особенностью нейробластомы является изменение плоидности ДНК в опухолевых клетках. Различают гиперплоидию с преимущественно триплоидным набором хромосом, коррелирующую с благоприятным прогнозом, и диплоидные, либо тетраплоидные формы, связанные с неблагоприятными исходами заболевания. Большое клиническое значение в последнее время приобретает определение экспрессии рецепторов к нейротрофинам (факторам роста вегетативной нервной системы). При этом экспрессия рецептора TrkA является благоприятным прогностическим фактором, в то время как высокая экспрессия TrkB отчётливо коррелирует с неблагоприятным прогнозом.
Стадирование нейробластомы осуществляется в 2 этапа. На первом этапе топографическая стадия определяется согласно критериям INSS (International Neuroblastoma Staging System). На втором этапе результаты определения топографической стадии анализируются совместно с данными молекулярно-генетических и лабораторных методов исследования, и определяется группа риска.
Определение топографической стадии нейробластомы согласно критериям INSS
Стадия I: локализованная опухоль с возможностью полной резекции (с или без микроскопических резидуальных очагов опухоли; в лимфатических узлах той же стороны при микроскопическом исследовании опухолевые клетки не обнаруживаются; лимфоузлы, прилежащие к первичной опухоли и удаляемые вместе с нею, могут содержать опухолевые клетки).
Стадия IIА: локализованная опухоль, макроскопически полностью не удаляемая; в лимфоузлах той же стороны, не примыкающих к опухоли, при микроскопическом исследовании опухолевые клетки не обнаруживаются, не прилежащие к опухоли лимфоузлы микроскопически не поражены.
Стадия IIВ: локализованная опухоль с возможностью макроскопической полной или частичной резекции; в лимфоузлах той же стороны, не примыкающих к опухоли, определяются опухолевые клетки. Увеличенные лимфоузлы на противоположной стороне не содержат опухолевых клеток.
Стадия III: локализованная опухоль с возможностью макроскопической полной или частичной резекции; в лимфоузлах той же стороны, не примыкающих к опухоли, определяются опухолевые клетки. Увеличенные лимфоузлы на противоположной стороне не содержат опухолевых клеток.
Стадия IV: любая первичная опухоль с поражением отдаленных лимфатических узлов, костей скелета, костного мозга, печени, кожи и/или других органов (за исключением органов, обозначенных в стадии IVS).
Стадия IVS: локализованная первичная опухоль (как при стадиях I, IIA или IIB) с диссеминацией в кожу, печень и/или костный мозг (строго у детей до 1 года) [1].
Стратификация больных по группам риска представлена в Таблице 1.
Таблица 1. Стратификация больных по группам риска
Возраст Амплификация гена N-myc Гистология по H. Shimada Плоидность ДНК Стадия I Стадия IIА-IIВ Стадия III Стадия IV Стадия IVS
<12 мес нет
благ.
неблаг.
есть
благ.
неблаг.
низкий
≥12 мес нет
благ.
неблаг.
есть
благ.
неблаг.
>1 =1
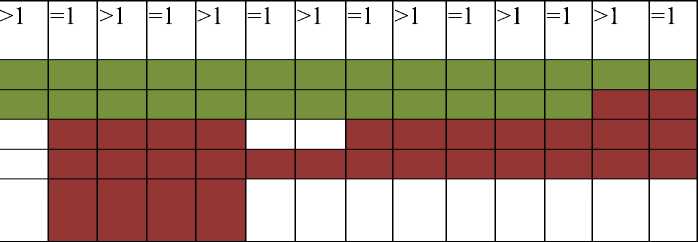
средний высокий
Клиническое наблюдение
Пациент К., мужчина 27 лет, обратился в Российский научный центр Рентгенорадиологии в январе 2019 г. с жалобами на тянущую боль в поясничном отделе позвоночника с иррадиацией в правую нижнюю конечность.
Анамнез заболевания. Со слов пациента и согласно представленной медицинской документации, в феврале 2017 г. появились жалобы на боли в области поясничного отдела позвоночника с иррадиацией в правую нижнюю конечность. В ноябре 2017 г. обследован в ЦИТО им. Н.Н. Приорова, по результатам КТ малого таза от 12.12.2017 г. пресакрально отмечается наличие опухоли размерами 7,8 х 7,4 х 4,5 см, с распространением ее в просвет правого крестцового отверстия S4-5 (Рис. 1–3). Опухоль тесно прилежит к прямой кишке, оттесняет ее кпереди. Также в теле L3 позвонка определяется новообразование, с формированием правостороннего паравертебрального внекостного компонента толщиной до 1,3 см, который заполняет просвет правого межпозвоночного отверстия L2-3 и прорастает в правое межпозвоночное отверстие L3-4. В полости малого таза паравазально в области бифуркации общих подвздошных сосудов определяются увеличенные лимфоузлы размерами до 3,0 х 1,7 см. Заключение: опухоль малого таза с метастазами в кости L3, S1, S5. Выполнена трепанбиопсия опухоли, установлен диагноз – нейрофиброматоз.
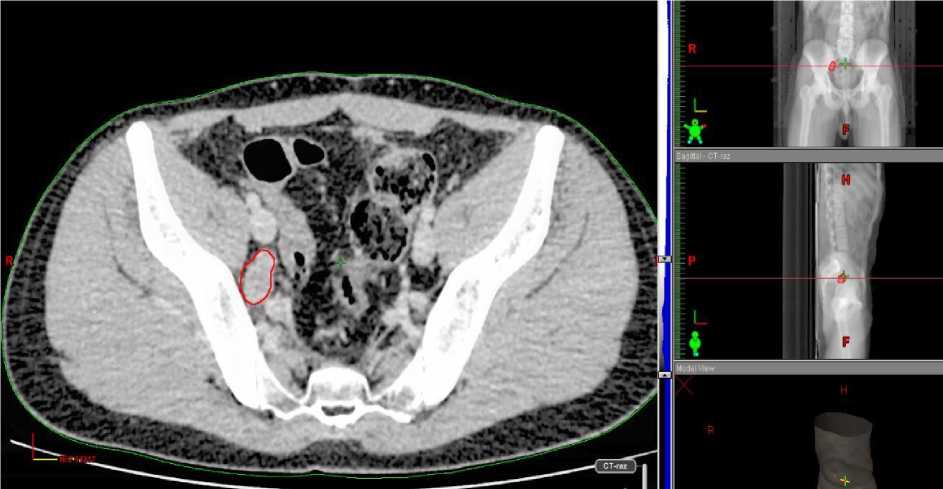
Рис.1. Паравазальные лимфоузлы в области бифуркации общих подвздошных сосудов справа.
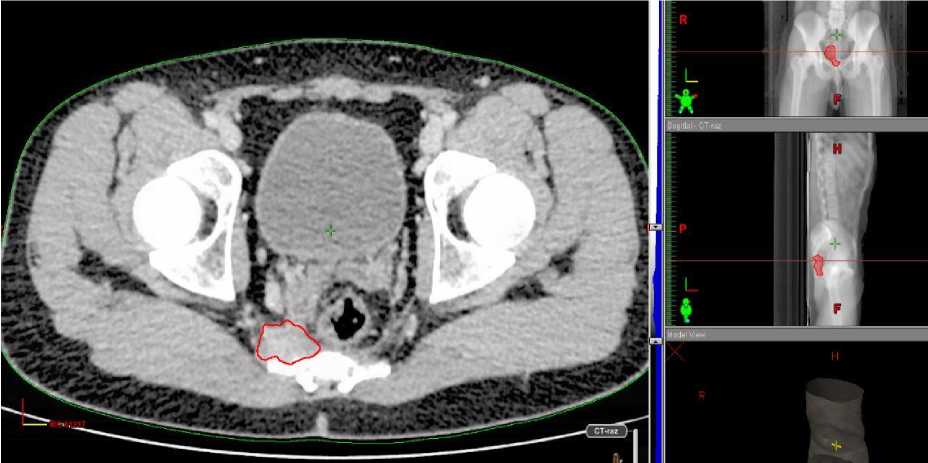
Рис. 2. Новообразование, расположенное пресакрально, с распространением в просвет правого крестцового отверстия S4-5.
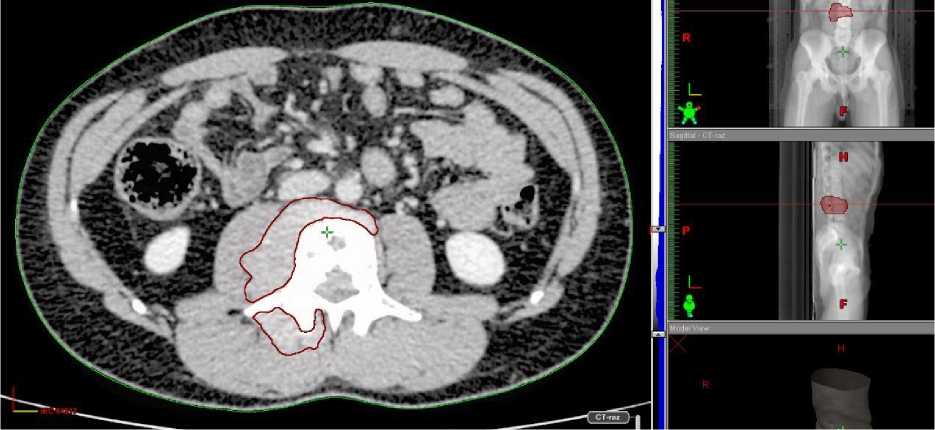
Рис. 3. Новообразование с формированием правостороннего паравертебрального внекостного компонента.
Направлен в НМИЦ им. Н.Н. Блохина МЗ РФ, где выполнена повторная трепанбиопсия опухоли, гистологическое заключение – мелкокруглоклеточная опухоль.
20.12.2017 г. выполнена открытая биопсия опухоли, гистологическое заключение: ганглионейробластома – рекомендовано дообследование. По результатам радиоизотопного исследования (РИД) с метайодбензилгуанидином (MIBG) от 31.01.2018
г. определяются множественные очаговые изменения в поясничном отделе позвоночника и костях таза, по передней поверхности крестца и копчика визуализируется объемное мягкотканое образование размерами 6,0 х 7,4 х 8,0 см, накапливающее радиофармпрепарат (РФП). Определяется группа парааортальных лимфоузлов слева на уровне позвонка L2 размерами до 0,9 х1,1 см, накапливающих РФП. Для уточнения гистогенеза опухоли проведено имунногистохимическое исследование № 51469 от 09.01.2018 г. Выявлена диффузная экспрессия синаптофизина и хромогранина A, что при отсутствии экспрессии опухолевыми клетками белка CD99, свидетельствует в пользу их нейробластной дифференцировки. Заключение: новообразование таза и позвоночника следует классифицировать как ганглионейробластому, с наличием немногочисленных зрелых ганглиозных клеток в мягкотканном компоненте опухоли таза (в трепанобиопсии опухоли таза без нейробластных клеток) и низкодифференцированного нейробластного компонента (90% нейробластов, диффузного типа) среди шванновских клеток (10%, в трепанобиопсии опухоли позвоночника). При пункции костного мозга от 25.01.2018 г. выявлено метастатическое поражение костного мозга. Установлен окончательный диагноз нейробластома малого таза с метастазами в кости и костный мозг, IV стадия, группа высокого риска.
Коллегиально было принято решение о проведении программного лечения в рамках научного протокола с использованием эпигенетической терапии. Показано проведение полихимиотерапии (ПХТ) по программе высокого риска с использованием препарата Вайдаза.
1-я госпитализация (14.02.2018 г. – 02.04.2018 г.). Состояние пациента относительно удовлетворительное по основному заболеванию. Жалобы на периодические боли в поясничной области с иррадиацией в правую паховую область и правую нижнюю конечность. Стул – склонность к запорам. Диурез адекватен введенной жидкости.
Анализ крови на опухолевые маркеры HCE от 15.02.2018 г. – 52,03 нг/мл (норма до 12,5 нг/мл).
С 15.02.2018 г. по19.02.2018 г. проведен 1-ый курс эпигенетической терапии: вайдаза 75 мг/м² 1 –5 дни, СД (суммарная доза) = 637,5 мг.
С 19.02.2018 г. по 23.02.2018 г. проведен 1-ый курс ПХТ препаратами: топотекан 1,2 мг/м² 1–5 дни, РД (разовая доза) = 2 мг, СД = 10 мг, циклофосфан 1г/м² 4– 5 дни, РД = 1700 мг, СД=3400 мг.
В постхимиотерапевтическом периоде отмечались лейкопения 4 степени, нейтропеническая лихорадка до 38,6 оС, тромбоцитопения 3 степени. Проводилась антибиотикотерапия препаратом Фортум с положительным эффектом. В анализе крови от 06.03.2018 г. отмечено снижение концентрации опухолевого маркера HCE с 52,03 нг/мл до 31,58 нг/мл. Согласно миелограмме от 06.03.2018 г., клеток опухоли в пределах исследованного материала не выявлено.
У пациента с IV стадией нейробластомы, на фоне проведения программного лечения, отмечена положительная динамика в виде купирования боли в поясничной области и восстановление функции тазовых органов, снижение уровня опухолевого маркера HCE, санация костного мозга. С 07.03.2018 г. по 11.03.2018 г. проведен 2-ой курс эпигенетической терапии (вайдаза, топотекан, циклофосфан) в тех же дозировках.
В постхимиотерапевтическом периоде с 10-го дня отмечена лейкопения (0,6 г/л), тромбоцитопения (45 г/л), подъем температуры до 38,1 оС. Проведена соответствующая терапия с положительным эффектом, показатели крови восстановились.
Далее продолжено лечение по программе ультравысокого риска: курс индукционной ПХТ препаратами этопозид и цисплатин, стимуляция и сбор стволовых клеток, хирургический этап лечения, 2 курса послеоперационной ПХТ, высокодозная химиотерапия с аутотрансплантацией стволовых кроветворных клеток, лучевая терапия.
2-я госпитализация (05.04.2018 г. – 14.05.2018 г.). Состояние пациента удовлетворительное по основному заболеванию. Стул нормализовался, регулярный. Мочится самостоятельно. Диурез адекватен введенной жидкости.
Анализ крови на опухолевые маркеры от 06.04.2018 г.: HCE – 39,45 нг/мл (норма до 12,5 нг/мл).
Миелограмма от 06.04.2018 г. – специфического поражения костного мозга не выявлено.
С 06.04.2018 г. по 09.04.2018 г. проведен 3-ий курс ПХТ препаратами: цисплатин 30 мг/м² 1–4 дни, РД = 51 мг, СД = 204 мг, этопозид 150 мг/м² 1–3 дни, РД = 255 мг, СД = 765 мг.
Введение ПХТ перенес с симптомами тошноты, рвоты не отмечено.
По данным комплексного обследования:
-
1. МРТ от 11.04.2018 г. Заключение: в сравнении с данными предыдущего исследования МРТ от 20.11.2017 г. МР – картина злокачественной опухоли с поражением костей и правых подвздошных лимфоузлов, существенной динамики не отмечено.
-
2. В анализе крови на опухолевые маркеры HCE от 20.04.2018 г. – 21,9 нг/мл (норма до 12,5 нг/мл).
-
3. ОФЕКТ/КТ c MIBG от 19.04.2018 г.: в сравнении с данными от предыдущего исследования ОФЕКТ/КТ c MIBG 31.01.2018 г. динамики не отмечается.
-
4. УЗИ вен нижних конечностей – без особенностей. Патологии не выявлено.
27.04.2018 г. – операция в объеме нижнесрединной лапаротомии, удаление опухоли пресакральной области с подвздошной лимфодиссекцией справа. В анализе крови на опухолевые маркеры HCE от 04.05.2018 г. –17,66 нг/мл.
Тактика ведения пациента обсуждена на клиническом обходе; планируется хирургический этап лечения в рамках программного лечения.
С 04.05.2018 г. по 07.05.2018 г. проведен 4-ый курс ПХТ препаратами: цисплатин 30 мг/м² 1– 4 дни, РД = 51 мг, СД = 204 мг, этопозид 150 мг/м² 1– 3 дни, РД= 255 мг, СД = 765 мг.
Введение ПХТ перенес с симптомами интоксикации. Проводилась инфузионная терапия и антиэмическая терапия. Курс лечения завершен. 14.05.2018 г. выписан. Даны рекомендации продолжить введение 5-ого курса ПХТ.
Дальнейшее лечение проводилось в Европейской онкологической больнице (выписки не предоставлены), и в АО Медицина 24/7 (выписки не предоставлены): проводилась системная ХТ (иринотекан 50 мг/ м² 1– 5 дни в/в + темодал 150 мг/ м² 1–5 дни per os – 6 курсов). Последний курс ХТ завершен в декабре 2018 .
При ОФЭКТ/КТ от 17.12.2018 г. по сравнению с исследованием от апреля картина стабильна.
МСКТ органов брюшной полости от 09.01.2019 г. – образование в предкрестцовом пространстве таза справа размерами 25 х 15 х 32 мм в правой подвздошной ямке, л/у 28 х 16 мм, в телах 1,4 и 5 крестцовых позвонков склеротические изменения прежних размеров. Паравертебрально на уровне L3 сохраняется мягкотканное образование, накапливающее контрастное вещество, размером 78 х 25 х 47 мм. Данные изменения ранее не описывались, но при оценке в динамике – без существенных изменений.
Обратился в РНЦРР 16.01.2018 г. С 22.01.2019 г. по 26.02.2019 г. проведен курс 3D конформной дистанционной лучевой терапии с использованием MLC и портальной визуализации на ЛУЭ TrueBeam по методике RapidArc в режиме классического фракционирования с РОД 2 Гр 5 раз в неделю на область поражения мягких тканей таза, поясничной области и лимфоузел подвздошной ямки справа до СОД 54 Гр.
Обсуждение
В современной литературе частота случаев заболевания нейробластомой у взрослых составляет 0,3 на 1 миллион в год, а локализация в малом тазу составляет 5% от числа всех нейробластом. В 2011 г. был описан случай заболевания нейробластомы малого таза у пациента 52-х лет [2]. С учетом результатов гистологического исследования, ИГХ и данных КТ (размер опухоли 187×145×104 мм), было принято решение о проведении 6 циклов адъювантной полихимиотерапии (винкристин 2 мг, дакарбазин 600 мг/м² в день в 1-й и 2-й дни и циклофосфамид 800 мг/м² в первый день) с последующей резекцией опухоли, лучевая терапия не проводилась. При дальнейшем наблюдении в течение 6-ти лет результаты ОФЕКТ/КТ с MIBG оставались отрицательными.
Заключение
Нейробластома – редкое злокачественное заболевание у взрослых, имеющие серьезные последствия для жизни и здоровья пациентов. Редкость заболевания определяет несвоевременную диагностику и запоздалое лечение пациентов, следовательно, важно включать его в дифференциальный ряд заболеваний с неясным поражением центральной нервной системы у взрослых пациентов. Несмотря на редкость заболевания, важным направлением исследований должна стать разработка протоколов лечения нейробластомы у взрослых. Дальнейшее изучение для более глубокого понимания биологии нейробластомы во взрослой популяции, возможно, позволит создать более эффективные методы лечения, находящиеся на данный момент на этапе доклинических и клинических испытаний [3].
Список литературы Редкий клинический случай заболевания нейробластомой у взрослого пациента
- Бойченко Е.И., Глеков И.В., Казанцев А.П. и др. «Диагностика и лечение детей, больных нейробластомой» Клинические рекомендации Общероссийского союза общественных объединений Ассоциация онкологов России. Москва. 2014. 9 с.
- Kajbafzadeh A.M., Sadeghi Z., Shadi A. et al. Adult pelvic neuroblastoma: long-term survival and review of the literature. Tehran University of Medical Sciences, Pediatric Urology Research Center, Urology Department, Tehran, Iran Royal Marsden Hospital, Pathology Department, Sarcoma Unit, London, England. 2011. V. 37. No. 2. P. 167-171. DOI: 10.5152/tud.2011.032
- Park J.R., Eggert A., Caron H. Neuroblastoma: biology, prognosis, and treatment. Hematol Oncol Clin North Am. 2010. V. 24. No. 1. Р. 65-86. 0.1016/j.hoc.2009.11.011. DOI: 10.1016/j.hoc.2009.11.011


