Результаты изучения культуральных свойств мезенхимальных клеток стромы костного мозга доноров
Автор: Бутолина М.А., Ветошкин К. А., Минаева Н.В., Зорина Н.А., Исаева Н.В., Хоробрых М. Н.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Оригинальные статьи
Статья в выпуске: 4 т.15, 2019 года.
Бесплатный доступ
Целью исследования являетсяизучение культуральных свойств мезенхимальных клеток стромы костного мозга доноров. Показано, что выделенные культурыотносятся к мезенхимальным стромальнымклеткам согласно критериям Международного общества клеточной терапии. Определеныследующие параметры клеточных культур:морфологические признаки пластикадгезивных клеток и формируемых ими колоний,степень экспрессии основных иммунологических маркеров, время достижения клеткамипервичного посева и последующих пассажейконфлюэнтного монослоя, время удвоенияколичества клеток. Дана характеристика динамики ростовых свойств полученных культур клеток.
Костный мозг, мезенхимальные клетки, культуральные свойства
Короткий адрес: https://sciup.org/170172534
IDR: 170172534
Текст научной статьи Результаты изучения культуральных свойств мезенхимальных клеток стромы костного мозга доноров
МСК представляют собой популяцию плюрипотентных клеток, способных дифференцироваться в направлении хондроцитов, остеобластов,адипоцитов и ряда других клеток соединительной ткани [1]. В результате объединения усилий множества групп авторов Международным обществом клеточной терапии (International Society for Cell Therapy, ISCT) сформулированы критерии, позволяющие идентифицировать МСК. Согласно этим критериям, МСК проявляют адгезию к пластику при стандартных условиях культивирования, имеют определённый набор поверхностных антигенов, а также обладают полипотентностью. Большая часть МСК экспрессирует такие маркеры, как CD105, CD73, CD90 и CD44, на их поверхности отсутствуют маркеры CD45, CD34, CD31, CD54, CD117, CD133, HLA класса II [3].
Клетки, соответствующие описанным критериям,содержатся в костном мозге,жи- ровой ткани [4, 5], стенках сосудов, надкостнице, пульпе зуба, пуповинной крови [6, 7], синовиальной мембране [8], мышцах [9]. МСК в костном мозге присутствуют в количестве 0,001–0,01 % от всех клеточных элементов [1]. В тоже время для целей терапии требуется количество МСК в клеточном продукте не менее 1 х 106/кг (в среднем 50-100 х 106) [10]. Указанное число клеток может быть получено путем их культивирования (наращивания) в условиях ex vivo.
Цель работы . Оценить культуральные особенности МСК костного мозга доноров ГСК.
Материалы и методы. МСК выделяли из костного мозга доноров (n = 10), полученного при стандартной операции миелоэк-сфузии. Медиана возраста составила 31 год (14–38лет). Выделениеядерных клеток костного мозга осуществляли путем фракционирования на градиенте плотности (ρ = 1,077 при температуре 22 °C). МСК культивировали в полной питательной среде,содержащей следующие компоненты: среду αMEM (StemCells), богатую тромбоцитами плазму (4 %), гепарин (Sigma, 2 Ед/мл), L-глутамин 2 мМ (StemCells).
Плотность клеток при первичном посеве составляла 4-10 х 104/см2 культуральной поверхности. МСК культивировали в СО2-инкубаторе при содержании 5 % углекислого газа при температуре 37 °C. Полную замену среды производили через 4–5 сут. После формирования конфлюэнтного монослоя клетки обрабатывали 0,25 % раствором трипсина. Жизнеспособные клетки подсчитывали в камере Горяева с использованием красителя трипанового синего и рассевали по флаконам из расчета 1,5-2,0 х 10 3 /см2.
МСК идентифицировали согласно критериям ISCT: адгезии к пластику веретеновидных клеток, наличия иммунологических маркеров CD44, CD105, CD73, CD90, отсутствия экспрессии CD34, CD45, CD31, CD54, CD117, CD133 и HLA-DR. Иммунофенотипи-
Иммунофенотипическая характеристика мезенхимальных клеток костного мозга доноров (n = 10)
ческие характеристики МСК определяли методом лазерной проточной цитометрии на анализаторе BD FACS Canto II. Оценивали количество колониеобразующих единиц фибробластов (КОЕ-Ф), время достижения культурой конфлюэнтного монослоя и время удвоения клеток. Подсчет КОЕ-Ф производили на 7 сут. от начала культивирования с использованием инвертированного микроскопа. Время удвоения рассчитывали по формуле:
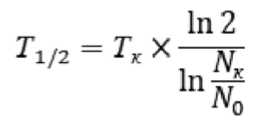
где T1/2 — время удвоения;
Тк — длительность культивирования (в часах);
Nк — количество полученных клеток;
N0 — количество посеянных клеток.
При сравнении результатов применяли непараметрический критерий(Уилкоксона), коэффициент корреляции Пирсона.Значения р менее 0,05 рассматривали как достоверные .
Результаты и обсуждение. Полученные культуры при оценке методом световой ми-кроскопиипредставлены однотипнымиклет-ками веретеновидной формы. Выделенные из костного мозга,прикрепленные к поверхности пластикового флакона клетки формировали дискретные клеточные колонии.При дальнейшем культивировании (в среднем 7 сут.) колонии образовывали монослой, занимающий всю поверхность культуральной посуды.
Среднее количество КОЕ-Ф в полученных культурах составило 11,72 ± 5,13 (n = 10) на 1 х 10 6 внесенных в культуру миелокарио-цитов. При анализе иммунофенотипа клеточной культуры отмечена экспрессия в высокой степени ( > 60 %) таких маркеров, как CD90,CD73,CD44, и в более низкой степени — CD105 ( таблица 1 ).
Таблица 1.
|
Иммунологический маркер |
Номер пассажа |
|||
|
Первичный посев |
1 |
2 |
3 |
|
|
CD90 |
85,4 ± 14,5 |
85,1 ± 14,3 |
74,5 ± 20,8 |
88,3 ± 13,7 |
|
CD105 |
15,4 ± 4,8 |
24,7 ± 13,1 |
31,6 ± 6,4 |
31,6 ± 4,6 |
|
CD73 |
85,3 ± 12,9 |
83,7 ± 13,2 |
66,1 ± 25,1 |
78,7 ± 12,7 |
Продолжение таблицы
|
CD44 |
86,3 ± 14,0 |
86,5 ± 9,6 |
61,6 ± 20,5 |
77,4 ± 15,6 |
|
CD34 |
4,0 ± 3,7 |
1,9 ± 0,9 |
1,1 ± 0,6 |
1,1 ± 0,5 |
|
CD45 |
5,2 ± 4,4 |
0 |
0 |
0,3 ± 0,1 |
|
CD31 |
0 |
6,3 ± 5,3 |
0,7 ± 0,3 |
0 |
|
CD54 |
14,3 ± 1,1 |
10,9 ± 6,6 |
2,6 ± 2,2 |
0 |
|
CD117 |
0 |
2,6 ± 2,3 |
0,2 ± 0,1 |
0 |
|
CD133 |
1,1 ± 1,0 |
3,8 ± 2,8 |
0,2 ± 0,2 |
0,8 ± 0,1 |
|
HLA-DR |
10,9 ± 7,8 |
4,9 ± 2,6 |
4,9 ± 4,6 |
5,9 ± 5,8 |
Степень экспрессии основных позитивных иммунологических маркеров культур МСК соответствует данным, представленным в литературе [11]. Иммунофенотипическая характеристика не изменялась на протяжении четырех пассажей,что свидетельствовало об однородности полученных клеточных продуктов. При оценке популяции клеток первичного посева уровень примеси ГСК (CD34+) составил 3,5 ± 1,8 % от общего количества клеток,а к концу первого пассажа данный показатель снизился до 0,5–1 % от всех клеток.Отмечено снижение экспрессии антигенов гистосовместимости HLА класса II ко 2–3 пересевам (не более 6 %). Таким образом, по иммунологическим характеристикам вы- деленные культуры пластикадгезивных клеток можно расценивать как мезенхимальные с минимальной примесью гемопоэтических элементов.
Изучено время достижения клетками первичного посева конфлюэнтного монослоя, косвенно отражающее количество мезенхимальных стволовых элементов в костном мозге [12]. Период, за который клетки первичного посева образовывали конфлюэнтный монослой, для изученных культур составил 13,4 ± 2,3 сут (n = 10). Длительность каждого последующего пассажа образцов МСК определялась временем, необходимым для достижения конфлюэнтного клеточного слоя в культуральном флаконе ( таблица 2 ).
Таблица 2.
|
Показатель |
Номер пассажа |
|||
|
Первичный посев |
1 |
2 |
3 |
|
|
Время достижения конфлюэнтного монослоя, сут. |
13,4 ± 2,3 |
9,7 ± 2,3 |
11,6 ± 2,3 |
15 ± 1,7 |
|
Время удвоения культуры, час |
— |
59,9 ± 18,5 |
77,0 ± 12,7 |
106,6 ± 19,2 |
Показатели скорости роста культуры мезенхимальных клеток костного мозга доноров (n = 10)
Время достижения 90–95 % покрытия клетками поверхности флакона варьировало от 9(пассаж № 1)до 15 сут. (пассаж № 3). В целом указанные временные характеристики роста МСК костного мозга доноров соответствуют данным, представленным в литературе [12, 13]. Длительность каждого пассажа в определенной мере зависит от плотности посева. В связи с этим для более полной характеристики пролиферативного потенциала МСК нами определено время удвоения количества клеток культуры (таблица 2), не зависящее от числа взятых на посев элементов. Отмечена тенденция к увеличению данного показателя от 59,9 ± 18,5 (пассаж № 1) до 106,6 ± 19,2 часов (пассаж № 3), что свидетельствует о снижении пролифератив- ной активности клеток и старении культуры [14]. Выявленное снижение скорости роста статистически достоверно (p < 0,05).
Корреляционный анализ выявил прямую зависимость между возрастом донора и временем удвоения культуры (коэффициент Пирсона для Р1–0,6, Р2–0,76, Р3–0,83). Наблюдаемую тенденцию можно интерпретировать следующим образом: чем старше до-нор,костный мозг которого использован для получения культуры МСК, тем ниже скорость роста клеток.
Заключение. Полученные культуры отвечали критериям ISCT, позволяющим идентифицировать их как мезенхимальные. Установлено снижение митотической активности МСК при каждом последующем пассаже. При планировании сроков получения клеточного культивирования и зависимость скорости их продукта следует учитывать снижение про- роста от возраста донора.
лиферативной активности МСК в процессе
Список литературы Результаты изучения культуральных свойств мезенхимальных клеток стромы костного мозга доноров
- Мезен Н. И., Квачева Н. И., Сычик Л. М. Стволовые клетки: учеб.— метод. пособие. 2-е изд., доп. Минск: БГМУ, 2014.— 62 с.
- Шигина Ю. В. Иммунология: учеб. пособие. М.: РИОР, 2007.— 39 с.
- Бигильдеев А. Е. Устройство и регуляция отдела стволовых мезенхимных клеток: дис. ... докт. биол. наук.— Москва, 2017.— 270 с.
- Loncar D. Ultrastructural analysis of differentiation of rat endoderm in vitro, Adipose vascular-stromal cells induce endoderm differentiation, which in turn induces differentiation of the vascular-stromal cells into chondrocytes // Journal of submicroscopic cytology pathology.— 1992.—N24.— P. 509-519.
- Park S. R., Oreffo R. O., Triffit J. T. Interconversion potential of cloned human marrow adipocytes in vitro // Bone.— 1999.—N24.— P. 549-554.
- Erices A., Conget P., Minguell J. J. Mesenchymal progenitor cells in human umbilical cord blood // British Journal of Haematolgy.— 2000.—N109.—P. 235-242.
- Gutierrez-Rodriguez M., Reyes-Maldonado E., Mayani H. Characterization of the adherent cells developed in Dexter-type long-term cultures from human umbilical cord blood // Stem Cells.— 2000.—N18.—P. 46-52.
- H. Ohnishi, Y. Oda, T. Aoki [et. al.] A comparative study of induced pluripotent stem cells generated from frozen, stocked bone marrow- and adipose tissue-derived mesenchymal stem cells // Journal of tissue engineering and regenerative medicine.— 2012—N. 6 — P. 261-271.
- Nathanson M. Bone matrix-directed chondrogenesis of muscle in vitro // Clinical Orthopeadic.— 1985.— N200.— P. 142-158.
- Т. В. Шаманская, Е. Ю. Осипова, Б. Б. Пурбуева [и др.] Культивирование мезенхимальных стволовых клеток ex vivo в различных питательных средах (обзор литературы и собственный опыт) // Онкогематоло-гия.— 2010.— № 3.—С. 65-71.
- A. Harichandan, K. Sivasubramaniyan, H.—J. Buhring Prospective isolation and characterization of human bone marrow-derived MSCs // Advances in biochemical engineering and biotechnology.— 2013.—N129.—P. 1-17. DOI: 10.1007/10_2012_147.
- T. Sorokina, I. Shipounova, A. Bigildeev [et. al.] Alterations of the bone marrow stromal microenvironment in adult patients with leukemia before and after the treatment // Blood.—Vol. 128.—N22.— 2016.—P. 2668.
- И. Н. Шипунова, Н. А. Петинати, Н. В. Сац [и др.] Стромальные клетки-предшественники при остром лимфобластном лейкозе // Гематология и трансфузиология.— Том 59.— № S1.— 2014.— С. 31.
- Супотницкий М. В., Еланов А. А., Меркулов В. А. [и др.] Основные технологические процессы, используемые при производстве биомедицинских клеточных продуктов // Биопрепараты. — 2015.—Т. 2.—С. 36-45


