Роль микроокружения костного мозга и сигнального пути CXCR4/CXCL12 в развитии множественной миеломы
Автор: Семенова Н. Ю., Артюхина З. Е., Бессмельцев С. С.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Обзор литературы
Статья в выпуске: 1 т.17, 2021 года.
Бесплатный доступ
Множественная миелома (ММ) — неизлечимое злокачественное заболевание, характеризующееся клональной пролиферацией плазматических клеток в костном мозге. В обзоре освещаются современные данные, свидетельствующие о важной роли микроокружения костного мозга и сигнальных путей в развитии и прогрессии ММ. Среди многочисленных факторов микроокружения при развитии ММ значимую роль играют молекулы адгезии и сигнальные пути, связанные с ними. Комплекс рецептор-лиганд CXCR4/ CXCL12 играет существенную роль в пролиферации, инвазии, распространении и лекарственной устойчивости при ММ. Сигналинг CXCR4/CXCL12 играет патологическую роль на разных стадиях ММ, участвует в метастазировании, ангиогенезе и активации антиапоптотических путей. Получены противоречивые данные о прогностической значимости уровней экспрессии сигнальных молекул. Дальнейшее изучение функционирования сигнального пути CXCR4/CXCL12 перспективно с точки зрения выявления новых эффективных методов лечения и комбинирования их с существующими стратегиями.
Множественная миелома, костный мозг, ниша гемопоэтических стволовых клеток, микроокружение, сигнальные пути, CXCR4, CXCL12
Короткий адрес: https://sciup.org/170175043
IDR: 170175043
Текст научной статьи Роль микроокружения костного мозга и сигнального пути CXCR4/CXCL12 в развитии множественной миеломы
Это заболевание обычно возникает из пре-допухолевого состояния, называемого моноклональной гаммапатией неопределенного значения (M US). Клон миеломы эволюционирует от M US через тлеющую миелому к миеломе симптоматической, и состояние высокого риска, плазмоклеточной лейкемии или экстрамедуллярной миеломы являются конечными результатами клональной эволюции [1, 2].
Несмотря на успехи развития новых способов лечения, в том числе совершенствования методик трансплантации гемопоэтических стволовых клеток (ГСК), не теряет актуальности изучение взаимодействий опухоли с микроокружением.
Микроокружение КМ включает как клеточные, так и внеклеточные компоненты и регулирует пролиферацию и дифференцировку ГСК. Специализированные клетки микроокружения влияют друг на друга, как посредством клеточных контактов, так и растворимых регуляторных факторов и вся система находятся в динамическом равновесии. Такое многокомпонентное микроокружение с определенными анатомическими характеристиками называют нишей ГСК КМ. При развитии лимфопролиферативных заболеваний, в том числе ММ, микроокружение КМ может изменяться под действием контактов с опухолевыми клетками. По результатам исследований последних лет описаны так называемые опухолевые ниши, в которых микроокружение способствует пролиферации и экспансии опухоли [3–5].
Считается, что переход между стадиями заболевания ММ регулируется посредством влияния иммуносупрессивного опухолевого микроокружения, которое поддерживает рост и выживание клеток MM [1, 2, 6].
Механизмы развития лекарственной резистентности также во многом связаны с микроокружением опухолевых клеток, причем не только с выделяемыми в строму регуляторными факторами, а также с клеточными контактами с определенными клетками ниши. Так, в ряде экспериментов с культурами клеток ММ было показано, что кондиционные среды от мезенхимных стромальных клеток (МСК) не очень эффективны для защиты опухолевых клеток от апоптоза под влиянием терапии при ММ. Однако, факторы, которые выделяют МСК при непосредственном контакте с опухолевыми клетками, увеличивают пролиферативную активность последних [7].
Строение ниши костного мозга. Ниша представляет собой как структурно-анатомическую область локализации стволовых клеток, так и биохимическое окружение, необходимое для регуляции судьбы стволовых клеток. Именно ниша контролирует вхож- дение ГСК в клеточный цикл, нахождение их в состоянии покоя, регулирует развитие дочерних клеток. Концепция ниши была впервые предложена в отношении ГСК и на данный момент ГСК являются наиболее изученными стволовыми клетками организма. Первое подтверждение данной концепции было получено exter T. M. et al. и соавторами, которые показали, что стромальные клетки КМ могут поддерживать гранулопоэз in vitro [8].
В последние годы изучение ниши расширило наши представления об элементах КМ, которые участвуют в поддержании ГСК. Долгое время поддерживалась гипотеза существования 2-х ниш — эндостальной и сосудистой. После более подробного изучения сосудистой ниши предложили выделять артериолярную, синусоидальную и периваскулярную ниши по разному вкладу в поддержание ГСК [4].
Изначально предполагалось, что в зоне эндоста располагаются ГСК в состоянии покоя, в то время как в области синусоидов распределяются ГСК в фазе пролиферации [9]. Позднее было показано, что в области синусоидов располагаются не только активно делящиеся ГСК, но также и клетки в состоянии покоя, а ГСК в эндостальной нише предпочтительно локализуются рядом с микрососудами [10]. Также 3-х-мерная визуализация ГСК в КМ показала, что только незначительный процент ГСК локализуется в зоне эндоста, что достоверно не отличается от случайного распределения ГСК в этой области [11].
В экспериментальных работах на мышах было показано, что ГСК располагаются преимущественно в области кровеносных сосудов (артериол и синусоидов), взаимодействуя с МСК, перицитами и эндотелиальными клетками [12–14]. Затем были обнаружены и другие участники регуляции ГСК: Шванновские клетки, остеокласты [5]. Также в поддержании функционирования ГСК принимают участие некоторые зрелые клетки гемопоэтического ряда, что было показано для нейтрофилов, моноцитов/макрофагов, регуляторных Т-клеток и мегакариоцитов (рис. 1) [3, 9]. В связи с определенными противоречиями в данных и большим количеством клеток, участвующих в поддержании ГСК некоторые авторы предпочитают рассматривать нишу ГСК, как одно целое с множеством клеточных компонентов [15].
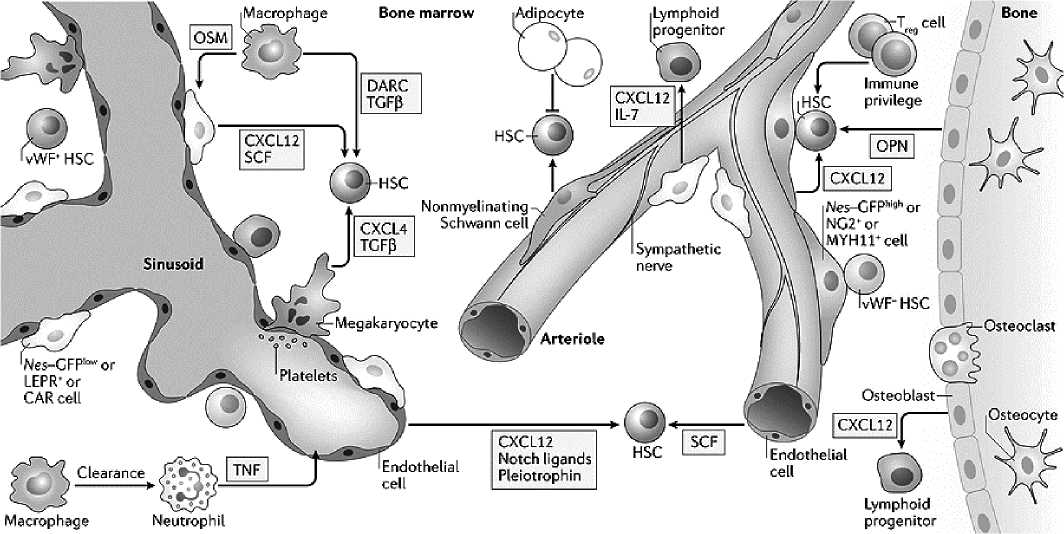
Рисунок 1. Строение ниши ГСК в КМ взрослого человека (рисунок по Pinho S. and Frenette P. S., 2019)
В КМ большое разнообразие регуляторных факторов, которые оказывают разнонаправленное влияние на ГСК, так, например, одни факторы удерживают стволовые клетки в КМ, а другие способствуют пролиферации (рисунок 2) .
В регуляции ГСК одна из главных ролей отводится ростовым факторам, таким как SCF, CXCL12 [13, 16]. SCF — фактор роста, который связывается с рецептором ГСК — c-kit (C 117). SCF участвует в миграции лейкоцитов и гемопоэтических предшественников. CXCL12 важен для поддержания ГСК и их удержания в КМ через взаимодействие с рецептором CXCR4. В КМ была обнаружена популяция клеток, экспрессирующих CXCL12 на высоком уровне, и они были названы CAR-клетками (CXCL12-abundant reticular cells), которые располагаются в периваскулярной области. CXCR4/CXCL12 сигналинг играет роль в хоминге и пролиферации ГСК, в том числе этот сигнальный путь важен для приживления ГСК после трансплантации.
При развитии гематологических заболеваний микроокружение КМ изменяется под влиянием контактов с опухолевыми клетками. Нормальное кроветворение может угнетаться, а выделяемые стромой факторы привлекают и поддерживают клетки опухолей [3, 6, 17].
Burger J. А. et al. в предположили, что взаимоотношения между опухолевыми клетками и микроокружением можно описать тремя основными паттернами, определение которых может дать ключ к будущему лечению, направленному на микроокружение [18].
Первый паттерн — потеря взаимосвязей. В основном вследствие генетических аномалий и неудержимой пролиферации клеток, что приводит к автономности опухолевого клона и независимости от сигналов микроокружения. Типичным примером является лимфома Беркитта, где практически все злокачественные В-клетки пролиферируют из-за хромосомной транслокации, которая приводит к постоянной активации гена c-myc. Соответственно, при лимфоме Беркитта микроокружение, по-видимому, играет ограниченную роль в планировании новых стратегий лечения.
Второй паттерн — дисфункциональная среда, в которой опухолевые клетки вступают в нерегулируемые взаимодействия с поддерживающей стромой, которая передает им сигналы для пролиферации и лекарственной устойчивости. Примерами являются острые лейкозы и миелодиспластические синдромы, когда лейкозные стволовые клетки избегают жестко регулируемого контроля роста и пролиферации клеток в гемопоэтических нишах
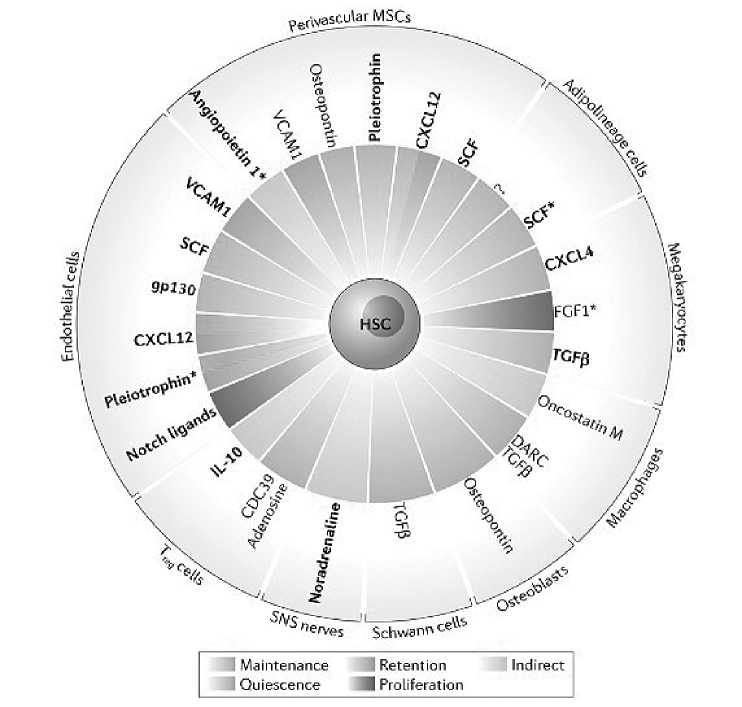
Рисунок 2. Клеточное и молекулярное разнообразие микроокружения ГСК в КМ (рисунок по Pinho S. and Frenette P. S., 2019)
и вместо этого развиваются в поддерживающем опухолевом микроокружении. В этих случаях зависимость опухолевых клеток от стромальных клеток для роста и выживания частично сохраняется и может привести к выживанию клонов, наделенных более высоким сродством к микроокружению. Соответственно, при этих заболеваниях таргетная терапия, направленная на микроокружение, оправдана как попытка нацелиться на стромально-зависимые клеточные клоны, которые выживают при традиционном лечении и приводят к рецидивам заболеваний.
Третий паттерн — дружественное микроокружение, регулируемое сосуществование опухолевых клеток и микроокружения, проявляется в некоторых В-клеточных опухолях, таких как хронический лимфоцитарный лейкоз, фолликулярная лимфома и ММ. Взаимодействия между злокачественными клетками и микроокружением в значительной степени напоминают паттерн, в котором участвуют нормальные В-клетки со своим соответствующим микроокружением. Следовательно, пролиферативный импульс злокачественных клеток, по крайней мере первоначально, в значительной степени зависит от внешних сигналов из микроокружения, таких как антигены, цитокины и межклеточные взаимодействия, и опухолевые клетки подвергаются апоптозу, если их выживание не подкрепляется этими внешними стимулами. Эти взаимодействия не являются мишенью «стандартных» методов лечения, что вероятно объясняет тот факт, почему, несмотря на значительные терапевтические достижения, некоторые злокачественные опухоли В-клеток все еще остаются неизлечимыми. Исходя из этой концепции, ожидается, что эти опухоли будут особенно чувствительны к подходам лечения, направленным на микроокружение.
Микроокружение костного мозга при ММ. ММ уже давно является основополагающей моделью для исследования роли микроокружения при гематологических неоплазиях
[1, 3, 6]. Предшественником плазматической клетки ММ является либо активированная В-клетка памяти, либо плазмобласт, генерируемый в периферических лимфоидных органах во время вторичного Т-клеточно-зависимого ответа, запрограммированный на хоминг к КМ и способный дифференцироваться в тесной ассоциации с микроокружением КМ. Злокачественные плазматические клетки (ПК) извлекают выгоду из тех же взаимодействий и стимулов, предоставляемых стромальными клетками КМ, которые обеспечивают развитие, выживание и дифференцировку нормальных лимфогемопоэтических предшественников. Злокачественные ПК ММ продуцируют ряд цитокинов, включая интерлейкин-1β, ФНО-α и моноцитарно-макрофагальный колониестимулирующий фактор, которые активируют микроокружение. В свою очередь, клетки микроокружения КМ продуцируют ряд цитокинов, имеющих отношение к росту и выживанию ПК ММ — ИЛ-6 и инсулиноподобный фактор роста- . Физический контакт между ПК ММ и стромальными клетками КМ также увеличивает выработку ИЛ-6. Стромальные клетки микроокружения в опухолях хорошо снабжены большим рядом белков адгезии и внеклеточного матрикса, которые опосредуют гомотипические и гетеротипические взаимодействия и обеспечивают места крепления клеток, избирательно подвергающихся воздействию локально высвобождаемых факторов роста [1–3, 17, 19]
В микроокружении ММ заметен ярко выраженный неоангиогенез. Плотность новообразованных микрососудов пропорциональна количеству ПК, их число увеличивается со стадией заболевания и имеет прогностическое значение [20–22]. Также в ряде работ отмечаются особенности МСК КМ — снижение пролиферативного потенциала, опухоль-ас-социированный фенотип, измененный характер экспрессии генов [17, 22, 23].
Важным свойством микроокружения ММ является то, что некоторые из цитокинов, которые функционируют как факторы роста и выживания ПК (такие как ИЛ-6 и инсулиноподобный фактор роста- ), также продуцируются в контексте ремоделирования кости, что приводит к концепции «порочного круга» между резорбцией кости и ростом опухоли. Это понятие лежит в основе целенаправленной терапии микроокружения, направленной на блокирование остеокласт-опосредован- ной резорбции кости, опосредованно подавляя последствия активности остеокластов.
Поверхностные молекулы или сигнальные пути, участвующие во взаимной передаче сигналов между злокачественными В-клетками и их микроокружением также представляют собой привлекательные терапевтические мишени [16, 17]. Особый интерес представляет сигнальный путь CXCR4/CXCL12. Комплекс рецептор-лиганд CXCR4/CXCL12 играет существенную роль в пролиферации, инвазии, распространении и лекарственной устойчивости при ММ. Помимо своего участия в хоминге, CXCR4/CXCL12 воздействует на мобилизацию ММ клеток и выход их из КМ, что коррелирует с метастазированием в отдаленные органы [24–28].
Сигнальный путь CXCR4/CXCL12 и патогенез ММ. CXCR4 (С–Х-С мотив хемокинового рецептора4)—широкоизученныйплейотроп-ный хемокиновый рецептор, который играет роль в иммунном ответе, гемопоэзе, процессах развития, имеет проопухолевую функцию [25]. CXСL12 (S F1α) — специфичеcкий эндогенный лиганд CXCR4, который в отличие от CXCR4, не экспрессируется в гемопоэтических клетках, а экспрессируется, в частности в эндотелии и строме КМ, где является хемоаттрактантом для экспрессирующих CXCR4 ГСК. Подавление взаимодействия CXCR4/ CXCL12 может высвобождать ГСК из ниши КМ в циркуляцию [26–28].
Взаимодействие CXCR4/CXCL12 активирует множество дополнительных и внутриклеточных сигнальных путей, способствуя тем самым различным жизненно важным биологическим процессам. Взаимодействие CXCR4/CXCL12 активирует различные пути сигналинга: фосфолипаза С/протеинкиназа С; NFκB; тирозинкиназа PYK2; P 3K; MAPK1/ MAPK3; JNK; JAK -STAT; ERK1/2; Ras/Raf; WNT-βcatenin; Sonic hedgehog; Notch. Все эти пути вовлечены в клеточную дифференцировку, выживание, миграцию, пролиферацию и хемотаксис [29–37]. Именно участие во многих различных сигнальных путях обеспечивает участие каскада CXCR4/CXCL12 в патогенезе злокачественных новообразований, включая ММ.
В микроокружении опухоль-ассоцииро-ванные фибробласты и МСК являются источником CXCL12, что способствует направленной миграции опухолевых клеток к сосудам или инвазивной части опухоли [28]. Рядом авторов была высказана теория о том, что опухолевый тропизм к тканям при метастазировании можно объяснить хемокиновым градиентом данной ткани для многих разновидностей опухолей. Эта теория говорит о том, что органы или ткани с высоким уровнем экспрессии определенных хемокинов могут направлять миграцию опухолевых клеток, которые экспрессируют рецепторы данных хемокинов [28, 29].
Различные факторы роста, такие как фактор роста фибробластов, VE F, эпидермальный фактор роста (E F) и гипоксические условия в микроокружении опухоли, способствуют усилению регуляции CXCR4, что в дальнейшем приводит к инвазии рака [25, 48–51]. В экспериментах также было обнаружено, что CXCR4 способствует опухолевой инвазии и метастазированию посредством подавления белка класса O Forkhead Box (FoxO3) в опухолевых клетках [52].
CXCR4 играет роль в экспансии и колонизации кости ММ ПК (2). Сигнальный путь
CXCR4/CXCL12 регулирует хоминг, адгезию, инвазию, миграцию и мобилизацию ММ клеток [53]. Было отмечено, что персистирующие хеморезистентные клоны MM ПК при минимальной остаточной болезни экспрессируют высокие уровни CXCR4, интегринов (C 11a / C 11c / C 29 / C 49d / C 49e) и молекул адгезии (C 44 / C 54), за счет чего закрепляются в микроокружении КМ [54].
Так же как нормальные ПК, клетки ММ через СXCR4 взаимодействуют с экспрессирующими CXCL12-клетками стромы костного мозга (BMSC) и мигрируют через эндотелий, выстилающий КМ, для хоминга и локализации посредством хемотаксиса [53, 54]. При взаимодействии ММ клеток и BMSC CXCL12 стимулирует собственную секрецию и через стимуляцию секреции VE F и ИЛ-6 повышает хоминг с последующей секрецией интегри-нов. Повышение внутриклеточного цАМФ с последующей активацией РКА подавляет CXCL12–опосредованную клеточную адгезию и индуцирует апоптоз в клетках ММ. Гиперактивация Notch сигналинга приводит к нарушению баланса активности остеобластов и остеокластов. CXCR4/CXCL12 взаимодействие является про-остеолитическим. CXCL12 может способствовать миграции предшественников остеокластов и повышать активность нескольких про-остеокластических генов. Предшественники остеокластов экспрессируют тирозинкиназу Брутона (ВТК), маркер ММ стволовых клеток, который вовлечен в генерацию остеокластов и их миграцию к CXCL12. Экспрессия ВТК ассоциирована с экспрессией CXCR4 в первичных клетках ММ [55].
Было показано, что повышенные уровни CXCL12, полученные из ПК, связаны с наличием обнаруживаемых на рентгене остеолитических поражений у пациентов с ММ [30]. Для дальнейшего изучения этой взаимосвязи были измерены уровни CXCL12 и betaCrossLaps, маркера потери костной массы в плазме. В экспериментах с использованием модели очагового остеолиза in vivo была выявлена сильная корреляция между уровнями CXCL12 и опосредованной отеокла-стами резорбцией кости.
Сигнальный путь NF-κB (RANK)/ RANKligand (RANKL) — другая значимая система регулирования костного ремоделирования. Было высказано предположение, что CXCL12 может усилить про-резорбтивный эффект RANKL [45, 54].
Предыдущие данные показывают, что гиперэкспрессия CXCR4 связана с плохим прогнозом заболевания [56]. Клетки ММ экспрессируют CXCR4 на высоких уровнях в периферической крови, но на низких уровнях в костном мозге. Экспрессия CXCR4 подавляется в клетках ММ из КМ в ответ на высокие уровни CXCL12. Высокий уровень CXCL12 в КМ опосредует интернализацию рецептора CXCR4 с поверхности во внутриклеточный компартмент в клетках ММ. Эта субклеточная локация CXCR4 при MM может активировать различные нисходящие пути сигнализации, такие как P 3K и ERK/MAPK [48, 53].
Одновременно существуют популяции ММ ПК с разными фенотипами, что может влиять на возникновение и прогрессирование заболевания. Популяция, названная пассивными/ молчаливыми ММ клетками, работает как инициатор опухоли. У этой популяции повышенный уровень CXCR4 и молекул адгезии, что способствует подвижности, миграции и адгезии клеток ММ к клеткам КМ. Для пролиферативных стволовых клеток ММ, которые отвечают за прогрессирование заболевания и появление эволюционных субклонов, экспрессия CXCR4 минимальна. Таким образом, вероятно экспрессия CXCR4 угнетается на более поздних стадиях [57].
В последних экспериментальных работах оценивали уровень CXCR4 в КМ в большой выборке пациентов. Было показано, что пациенты с ММ и большим количеством CXCR4 + клеток характеризовались более длительной выживаемостью. Тогда как у пациентов с ММ с CXCR4-негативными ММ ПК отмечались более высокое содержание β2-микроглобулина и поздние стадии заболевания. Кроме того, прослежена корреляция между сниженным уровнем экспрессии CXCR4 на опухолевых ПК КМ и гиперкальциемией, остеодеструктив-ным процессом, развитием экстрамедуллярных поражений [58].
Взаимодействие клеток ММ с клетками ниши на разных стадиях развития заболевания. Плазматические клетки ММ достигают ниши КМ через синусоиды и пролиферируют в благоприятном для опухоли микроокружении, иногда выходят в кровоток, вызывая экстрамедуллярное заболевание. Оказавшись внутри ниши КМ, ПК ММ трансформируют микроокружение через секрецию цитокинов и факторов роста, которые наряду с активностью стромальных клеток КМ индуцируют дополнительные механизмы, участвующие в удержании, пролиферации и лекарственной устойчивости ПК ММ. У некоторых пациентов развивается экстрамедуллярное заболевание, вызванное изменениями экспрессии или функции хемоки-новых рецепторов в плазматических клетках, а также независимостью ММ ПК от факторов выживания из ниши КМ. На рис. 3 представлены взаимосвязи клеток ММ с клетками микроокружения при различных состояниях ММ клеток [59].
Хоминг. Взаимодействие хемокина CXCL12 с его рецептором CXCR4 опосредует хоминг и удержание как нормальных, так и злокачественных ПК в КМ. Взаимодействие CXCR4/ CXCL12 повышает активность интегрина α4β1, обеспечивая высокое связывание с его лигандом VCAM-1, экспрессируемым клетками микроциркуляторного русла КМ. Другими важными молекулами адгезии, опосредующими хоминг клеток ММ в КМ, являются интегрин α4β7, рецептор MAdCAM-1 и фибронектина, а также PS L-1, который взаимодействует с Р- и Е-селектином, экспрессируемым на поверхности эндотелиальных клеток.
Выживаемость и пролиферация клеток ММ. Внутри среды КМ мезенхимальные стромальные клетки КМ (BMSC) секретируют высокие уровни CXCL12, которые наряду с ин-тегринами α4β1, α4β7 и aLβ2, а также C 44 важны для закрепления и удержания клеток ММ в нишах КМ. На этой стадии выживанию и пролиферации злокачественных ПК способствуют два основных растворимых медиатора — индуцирующий пролиферацию лиганд (APR L) и активирующий фактор В-клеток (BAFF), которые связывают антиген созревания В-клеток (BCMA) на поверхности опухолевых клеток, а также ИЛ-6, рецептор которого также экспрессируется на клетках ММ. У пациентов с ММ наблюдается патологический дисбаланс остеолинейности с уменьшением количества остеобластов в пользу остеокластов, продуцирующих литические очаги. Остеобластная ниша КМ способствует покою ММ-клеток, в то время как остеокласты индуцируют реактивацию ММ-клеток.
Экстрамедуллярное заболевание — один из вариантов конечного результата клональной эволюции ММ: опухолевые клетки становятся независимыми от микроокружения, экспрессия CXCR4 снижается, что также происходит после лечения, например, ингибиторами про-
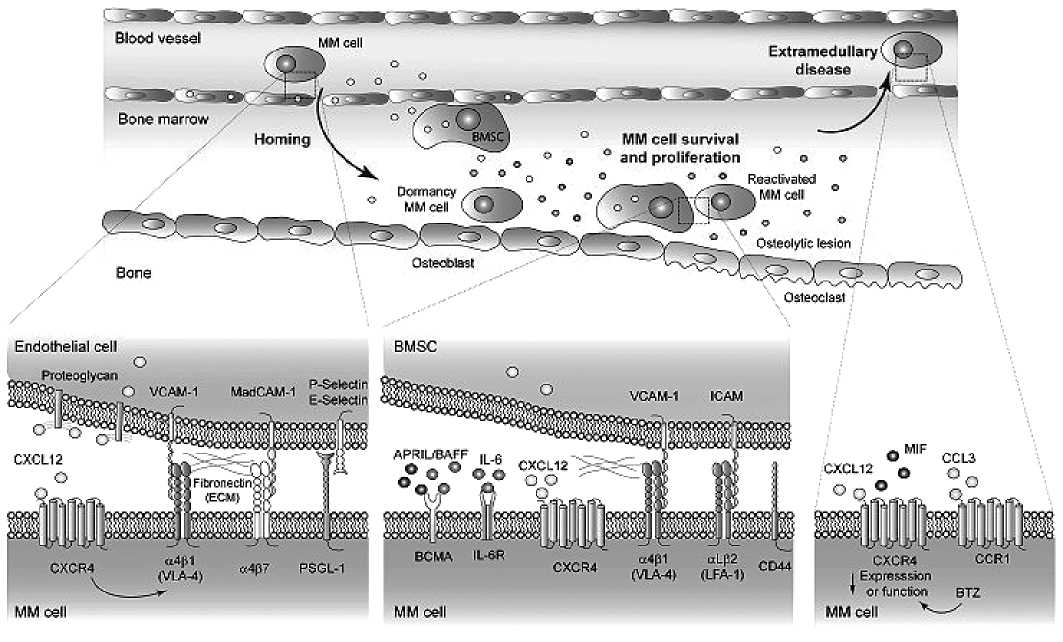
Рисунок 3. Схема взаимодействия клеток ММ с клетками микроокружения КМ при различных состояниях ММ клеток (рисунок по García-Ortiz A. et al., 2021)
теасомы. Фактор ингибирования миграции макрофагов (M F) также может связываться с CXCR4, индуцируя экспрессию молекул адгезии. Экспрессия хемокинового рецептора CCR1 связана с циркуляцией ПК ММ.
Микроокружение КМ имеет важное значение для становления и прогрессирования ММ. Движение ПК ММ и их хоминг в КМ регулируются растворимыми факторами, главным образом хемокинами, такими как CXCL12, а также прямыми межклеточными взаимодействиями через молекулы адгезии, экспрессируемые плазматическими и костномозговыми стромальными клетками.
Заключение. Таким образом, сигналинг CXCR4/CXCL12 играет патологическую роль на разных стадиях ММ, участвует в метастазировании, ангиогенезе и активации анти-апоптотических путей. Однако в литературе описаны противоречивые данные о прогностической ценности уровней экспрессии как
CXCR4, так и CXCL12. На сегодняшний день успешное лечение MM ингибиторами CXCR4 является сложной задачей, поскольку CXCR4 повсеместно экспрессируется в здоровых нормальных клетках. Вмешательство в передачу сигналов CXCR4 может влиять как на нормальное кроветворение, так и на развитие других тканей, за счет участия в важных биологических функциях, таких как апоптоз и пролиферация. Таким образом, даже несмотря на то, что ингибирование CXCR4 может иметь положительный противомиеломный эффект, оно также может нейтрализовать иммунологические и физиологические реакции.
Дальнейшее изучение этого сигнального пути в комплексе с другими особенностями микроокружения КМ перспективно с точки зрения выявления новых эффективных методов лечения и комбинирования их с существующими стратегиями.
Конфликты интересов отсутствует
Источник финансирования
Исследование не имело источника финансирования
Вклад авторов
Концепция и дизайн: все авторы
Сбор и обработка данных литературных данных : все авторы
Предоставление материалов исследования: все авторы
Анализ и интерпретация: все авторы
Подготовка рукописи: все авторы
Окончательное одобрение рукописи: все авторы
Список литературы Роль микроокружения костного мозга и сигнального пути CXCR4/CXCL12 в развитии множественной миеломы
- Бессмельцев С. С., Абдулкадыров К. М. Множественная миелома: руководство для врачей // М.: МК, 2016. — 504 с.
- Бессмельцев С. С. Множественная миелома (лечение первичных больных): обзор литературы и собственные данные. Часть 2 // Клиническая Онкогематология. — 2013. — Т. 6, № 4. — С. 379–414.
- Семенова Н. Ю., Бессмельцев С. С., Ругаль В. И. Биология ниши гемопоэтических стволовых клеток // Клиническая онкогематология. Фундаментальные исследования и клиническая практика. — 2014. — Т. 7, № 4. — С. 501–510.
- Crane G. M., Jeffery E., Morrison S. J. Adult haematopoietic stem cell niches // Nature Reviews. Immunology. — 2017. — V.17, N9. — P. 573–590.
- Méndez –Ferrer S., Michurina T. V., Ferraro F. et al. Mesenchymal and haematopoietic stem cells form a unique bone marrow niche // Nature. — 2010. — V.466, N7308. — P. 829–834.
- André T., Meuleman N., Stamatopoulos B. et al. Evidences of early senescence in multiple myeloma bone marrow mesenchymal stromal cells // PLoS ONE. — 2013. — Vol. 8, N3. — e59756.
- Nefedova Y., Landowski T. H., Dalton W. S. Bone marrow stromal –derived soluble factors and direct cell contact contribute to de novo drug resistance of myeloma cells by distinct mechanisms // Leukemia. — 2003. — V. 17. — P. 1175–1182.
- Dexter T. M., Allen T. D., Lajtha L. G. et al. Stimulation of differentiation and proliferation of haemopoietic cells in vitro // Journal of Cellular Physiology. — 1973. — V.82, N3. — P. 461–473.
- Zhang J., Niu C., Ye L. et al. Identification of the haematopoietic stem cell niche and control of the niche size // Nature. — 2003. — V.425, N6960. — P. 836–841.
- Nombela –Arrieta C., Pivarnik G., Winkel B. et al. Quantitative imaging of haematopoietic stem and progenitor cell localization and hypoxic status in the bone marrow microenvironment // Nature Cell Biology. — 2013. — V.15, N5. — P. 533–543.
- Acar M., Kocherlakota K. S., Murphy M. M. et al. Deep imaging of bone marrow shows non –dividing stem cells are mainly perisinusoidal // Nature. — 2015. —V.526, N7571. — P. 126–130.
- Ding L., Saunders T. L., Enikolopov G., Morrison S. J. Endothelial and perivascular cells maintain haematopoietic stem cells // Nature. — 2012. — V.481, N7382. — P. 457–462.
- Greenbaum A., Hsu Y –M. S., Day R. B. et al. CXCL12 in early mesenchymal progenitors is required for haematopoietic stem –cell maintenance // Nature. — 2013. — V.495, N7440. — P. 227–230.
- Kunisaki Y., Bruns I., Scheiermann C. et al. Arteriolar niches maintain haematopoietic stem cell quiescence // Nature. — 2013. — V.502, N7473. — P. 637–643.
- Pinho S., Frenette P. S. Haematopoietic stem cell activity and interactions with the niche // Nature Reviews. Molecular Cell Biology. — 2019. — V.20, N5. — P. 303–320.
- Chen K., Bao Z., Tang P., Gong W., Yoshimura T., Wang J. M. Chemokines in homeostasis and diseases // Cell Mol. Immunol. — 2018. — V.15, N4. — P. 324–334.
- Hideshima T, Mitsiades C, Tonon G, Richardson PG, Anderson KC. Understanding multiple myeloma pathogenesis in the bone marrow to identify new therapeutic targets // Nat Rev Cancer. — 2007. — V.7, N8. — P. 585–598.
- Burger J. A., Ghia P., Rosenwald A., Caligaris –Cappio F. The microenvironment in mature B –cell malignancies: a target for new treatment strategies // Blood. — 2009. — V.114, N16. — P. 3367–3375.
- Gunn W. G., Conley A., Deininger L., Olson S. D., Prockop D. J., Gregory C. A. A crosstalk between myeloma cells and marrow stromal cells stimulates production of DKK1 and interleukin –6: a potential role in the development of lytic bone disease and tumor progression in multiple myeloma // Stem Cells. — 2006. — V.24, N4. — P. 986–991.
- Vacca A., Ribatti D. Bone marrow angiogenesis in multiple myeloma // Leukemia. — 2006. — V.20, N2. — P. 193–199.
- Hose D., Moreaux J., Meissner T. et al. Induction of angiogenesis by normal and malignant plasma cells // Blood. — 2009. — V.114. — P. 128–143.
- Ругаль В. И., Бессмельцев С. С., Семенова Н. Ю. и др. Характеристика микроокружения костного мозга при множественной миеломе до и после терапии // Сибирский науч. мед. журнал. — 2019. — Т. 39, № 1. — С. 112–118.
- Чубарь А. В., Семенова Н. Ю., Ругаль В. И. и др. Мезенхимные стромальные клетки костного мозга и их роль в формировании опухолевой ниши при онкогематологических заболеваниях // Вестник гематологии. — 2019. —Т. 15, № 1. — С. 37–47.
- Alsayed Y., Ngo H., Runnels J., Leleu X., Singha U. K., Pitsillides C. M. Mechanisms of regulation of CXCR4/ SDF –1 (CXCL12) –dependent migration and homing in multiple myeloma // Blood. — 2007. — V.109, N7. — P. 2708–2717.
- Chatterjee S., Behnam Azad B., Nimmagadda S. The intricate role of CXCR4 in cancer // Adv. Cancer Res. — 2014. — V.124. — P. 31–82.
- Nazari A., Khorramdelazad H., Hassanshahi G. Biological/pathological functions of the CXCL12/CXCR4/ CXCR7 axes in the pathogenesis of bladder cancer // Int. J. Clin. Oncol. — 2017. — V.22, N6. — P. 991–1000.
- Murphy P. M., Heusinkveld L. Multisystem multitasking by CXCL12 and its receptors CXCR4 and ACKR3 // Cytokine. — 2018. — V.109. —P.2–10.
- Kucia M., Jankowski K., Reca R., Wysoczynski M., Bandura L., Allendorf D. J. CXCR4 –SDF –1 signalling, locomotion, chemotaxis and adhesion // J. Mol. Histol. — 2004. —V.35, N3. — P. 233–245.
- Xu C., Zhao H., Chen H., Yao Q. CXCR4 in breast cancer: oncogenic role and therapeutic targeting // Drug Des. Devel Ther. — 2015. — V.9. — P. 4953–4964.
- Wurth R., Bajetto A., Harrison J. K., Barbieri F., Florio T. CXCL12 modulation of CXCR4 and CXCR7 activity in human glioblastoma stem –like cells and regulation of the tumor microenvironment // Front Cell Neurosci. — 2014. —V.8. — P. 144.
- Fernandis A. Z., Prasad A., Band H., Klosel R., Ganju R. K. Regulation of CXCR4 –mediated chemotaxis and chemoinvasion of breast cancer cells // Oncogene. — 2004. — V.23, N1. — P. 157–167.
- Vila –Coro A. J., Rodriguez –Frade J. M., Martin De Ana A., Moreno –Ortiz M. C., Martinez A. C., Mellado M. The chemokine SDF –1alpha triggers CXCR4 receptor dimerization and activates the JAK/STAT pathway // Faseb. J. — 1999. — V.13, N13. — P. 1699–1710.
- Soldevila G., Licona I., Salgado A., Ramirez M., Chavez R., Garcia –Zepeda E. Impaired chemokine –induced migration during T –cell development in the absence of JAK 3 // Immunology. — 2004. — V.112, N2. — P. 191–200.
- Meng Y. M., Liang J., Wu C., Xu J., Zeng D. N., Yu X. J. Monocytes/Macrophages promote vascular CXCR4 expression via the ERK pathway in hepatocellular carcinoma // Oncoimmunology. — 2018. — V.7, N3. — e1408745
- Wang J., Cai J., Han F., Yang C., Tong Q., Cao T. Silencing of CXCR4 blocks progression of ovarian cancer and depresses canonical WNT signaling pathway // Int. J. Gynecol. Cancer. — 2011. — V.21, N6. — P. 981–987.
- Fareh M., Turchi L., Virolle V., Debruyne D., Almairac F., de –la –Forest Divonne S. The miR302–367 cluster drastically affects self –renewal and infiltration properties of glioma –initiating cells through CXCR4 repression and consequent disruption of the SHH –GLI –NANOG network // Cell Death Differ. — 2012. — V.19, N2. — P. 232–244.
- Jin Z., Zhao C., Han X., Han Y. Wnt5a promotes ewing sarcoma cell migration through upregulating CXCR4 expression // BMC Cancer. — 2012. — V.12. — P. 480.
- Meng X., Wuyi L., Yuhong X., Xinming C. Expression of CXCR4 in oral squamous cell carcinoma: correlations with clinicopathology and pivotal role of proliferation // J. Oral Pathol. Med. — 2010. — V.39, N1. — P. 63–68.
- Kodama J., Hasengaowa K. T., Seki N., Matsuo T., Ojima Y. Association of CXCR4 and CCR7 chemokine receptor expression and lymph node metastasis in human cervical cancer // Ann. Oncol. — 2007. — V.18, N1. — P. 70–76.
- Han M., Lv S., Zhang Y., Yi R., Huang B., Fu H. The prognosis and clinicopathology of CXCR4 in gastric cancer patients: a meta –analysis // Tumour Biol. — 2014. — V.35, N5. — P. 4589–4597.
- Lv S., Yang Y., Kwon S., Han M., Zhao F., Kang H. The association of CXCR4 expression with prognosis and clinicopathological indicators in colorectal carcinoma patients: a meta –analysis // Histopathology. — 2014. — V.64, N5. — P. 701–712.
- Ghanem I., Riveiro M. E., Paradis V., Faivre S., de Parga P. M., Raymond E. Insights on the CXCL12 –CXCR4 axis in hepatocellular carcinoma carcinogenesis // Am. J. Transl. Res. — 2014. — V.6, N4. — P. 340–352.
- Liang J. J., Zhu S., Bruggeman R., Zaino R. J., Evans D. B., Fleming J. B. High levels of expression of human stromal cell –derived factor –1 are associated with worse prognosis in patients with stage II pancreatic ductal adenocarcinoma // Cancer Epidemiol. Biomarkers Prev. — 2010. — V.19, N10. — P. 2598–2604.
- Guo F., Wang Y., Liu J., Mok S. C., Xue F., Zhang W. CXCL12/CXCR4: a symbiotic bridge linking cancer cells and their stromal neighbors in oncogenic communication networks // Oncogene. — 2016. — V.35, N7. — P. 816–826.
- Espinoza –Sanchez N. A., Enciso J., Pelayo R., Fuentes –Panana E. M. An NFkappaB –dependent mechanism of tumor cell plasticity and lateral transmission of aggressive features // Oncotarget. — 2018. — V.9, N42. — P. 26679–26700.
- Domanska U. M., Kruizinga R. C., Nagengast W. B., Timmer –Bosscha H., Huls G., de Vries E. G. A review on CXCR4/CXCL12 axis in oncology: no place to hide // Eur. J. Cancer. — 2013. — V.49, N1. — P. 219–230.
- Cojoc M., Peitzsch C., Trautmann F., Polishchuk L., Telegeev G. D., Dubrovska A. Emerging targets in cancer management: role of the CXCL12/CXCR4 axis // Oncol. Targets Ther. — 2013. — V.6. — P. 1347–1361.
- Guo M., Cai C., Zhao G., Qiu X., Zhao H., Ma Q. Hypoxia promotes migration and induces CXCR4 expression via HIF –1alpha activation in human osteosarcoma // PLoS One. — 2014. — V.9, N3. — e90518.
- Oh Y. S., Kim H. Y., Song I. C., Yun H. J., Jo D. Y., Kim S. Hypoxia induces CXCR4 expression and biological activity in gastric cancer cells through activation of hypoxia –inducible factor –1alpha // Oncol. Rep. — 2012. — V.28, N6. — P. 2239–2246.
- Phillips R. J., Mestas J., Gharaee –Kermani M., Burdick M. D., Sica A., Belperio J. A. Epidermal growth factor and hypoxia –induced expression of CXC chemokine receptor 4 on non –small cell lung cancer cells is regulated by the phosphatidylinositol 3 –kinase/PTEN/AKT/mammalian target of rapamycin signaling pathway and activation of hypoxia inducible factor –1alpha // J. Biol. Chem. — 2005. — V.280, N23. — P. 22473–22481.
- Zhao X. P., Huang Y. Y., Huang Y., Lei P., Peng J. L., Wu S. Transforming growth factor –beta1 upregulates the expression of CXC chemokine receptor 4 (CXCR4) in human breast cancer MCF –7 cells // Acta Pharmacol. Sin. — 2010. — V.31, N3. — P. 347–354.
- Kim C. G., Lee H., Gupta N., Ramachandran S., Kaushik I., Srivastava S. Role of Forkhead Box Class O proteins in cancer progression and metastasis // Semin. Cancer Biol. — 2018. — V.50. — P. 142–151.
- Alsayed Y., Ngo H., Runnels J., Leleu X., Singha U. K., Pitsillides C. M. Mechanisms of regulation of CXCR4/ SDF –1 (CXCL12) –dependent migration and homing in multiple myeloma // Blood. — 2007. — V.109, N7. — P. 2708–2717.
- Pandey M. K., Rastogi S., Kale V. P., Gowda T., Amin S. G. Targeting CXCL12/CXCR4 axis in multiple myeloma // Hematol. Thromboembol. Diseases. — 2014. — V.02, N05. — doi:10.4172/2329–8790.1000159
- Colombo M., Galletti S., Garavelli S., Platonova N., Paoli A., Basile A. Notch signaling deregulation in multiple myeloma: a rational molecular target // Oncotarget. — 2015. — V.6, N29. — P. 26826–26840.
- Coniglio S. J. Role of tumor –derived chemokines in osteolytic bone metastasis // Front Endocrinol. (Lausanne). — 2018. — V.9. — P. 313.
- Yaccoby S. Two states of myeloma stem cells // Clin. Lymph. Myeloma. Leuk. — 2018. —V.18, N1. — P. 38–43.
- Bao L, Lai Y, Liu Y, et al. CXCR4 is a good survival prognostic indicator in multiple myeloma patients // LeukRes. — 2013. — V.37, N9. — P. 1083–1088.
- García –Ortiz A., Rodríguez –García Y., Encinas J. et al. The role of tumor microenvironment in multiple myeloma development and progression // Cancers (Basel). — 2021. —V.13, N2. — P. 217.


