Сигнальный путь WNT при множественной миеломе
Автор: Белик Л.А., Енукашвили Н.И., Семенова Н.Ю., Мартынкевич И.С.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Клиническое наблюдение
Статья в выпуске: 1 т.19, 2023 года.
Бесплатный доступ
Множественная миелома (ММ) - на сегодняшний день неизлечимое онкогематологическое заболевание, характеризующееся трансформацией и неконтролируемой пролиферацией клональных плазматических клеток (ПК, плазмоцитов) в костном мозге (КМ). Методы и схемы терапии совершенствуются с каждым годом, в практику вводятся новые лекарственные препараты, что привело к улучшению общей выживаемости, однако всё еще часты случаи развития лекарственной резистентности, которые приводят к раннему рефрактерному рецидиву заболевания. Прогрессированию ММ, в том числе, в том числе, способствует опухолевое микроокружение, представленное изменёнными под влиянием ММ компонентами гемопоэтической ниши КМ. В нормальном микроокружении КМ важную роль в регуляции клеточных взаимодействий играют сигнальные пути WNT: канонический (β-катенин-опосредованный) и неканонические (независимые от β-катенина). При ММ нарушения WNT-сигнализации могут играть двойную роль: поддерживать жизнедеятельность клеток опухоли и, напротив, противодействовать ММ благодаря участию в остеогенезе. Ассоциированные с сигнальным каскадом WNT гены в настоящее время предлагаются как мишени для таргетной терапии. Взаимодействия между опухолевыми клетками и клетками в составе микроокружения, опосредованные WNT- сигнализацией, ещё не полностью изучены. В обзоре собраны данные, проясняющие роль сигнальных путей с участием WNT в прогрессировании ММ.
Множественная миелома, сигнальный путь wnt, гемопоэтическая ниша, мезенхимные стромальные клетки
Короткий адрес: https://sciup.org/170199719
IDR: 170199719
Текст обзорной статьи Сигнальный путь WNT при множественной миеломе
Множественная миелома (ММ) – часто встречающееся онкогематологическое заболевание, характеризующееся трансформацией и неконтролируемой пролиферацией клональных плазматических клеток (ПК, плазмоцитов) в костном мозге (КМ). Частота новых зарегистрированных случаев в России каждый год составляет приблизительно 1,9 на 100 000 человек, что составляет около 10% всех гематологических злокачественных новообразо- ваний. На сегодняшний день ММ является неизлечимым заболеванием и является причиной смерти более 10 000 человек ежегодно, однако активно разрабатываются новые схемы терапии, способные приостановить развитие заболевания и увеличить общую и беспрогрессивную выживаемость [1-2].
Жизнеспособность клеток ММ поддерживается благодаря взаимодействиям с элементами гемопоэтической ниши (ГН), образующими микроокружение опухоли. К ним относятся: остеобласты, остеокласты, клетки эндотелия, мезенхимные стромальные клетки (МСК), адипоциты и другие типы клеток; а также внеклеточные элементы: внеклеточный матрикс, растворимые факторы и белковые молекулы. МСК являются важнейшим компонентом здоровой ГН и участвуют как в обновлении стромы КМ, дифференцируясь в клетки мезенхимного происхождения, так и в гемопоэзе, регулируя дифференцировку гемопоэтических стволовых клеток (ГСК) [3].
При заболевании ГН подвергается различным перестройкам, а МСК приобретают опухоль-ассо-циированный фенотип, что способствует росту опухоли и развитию её лекарственной резистентности [7]. Кроме этого, при развитии ММ характерна аберрантная активация консервативного сигнального пути WNT, играющего ключевую роль в эмбриогенезе всех многоклеточных. Нарушения в его регуляции оказывают влияние, в том числе, на формирование лекарственной устойчивости клеток ММ и на нарушения остеогенеза. Мутации, которые могли бы быть причиной аберрантной сигнализации WNT, не были выявлены; предполагается, что причиной могут являться аутокринные и паракринные взаимодействия между клетками [4]. На сегодняшний день не вполне изучен вопрос, восстанавливается ли ГН после терапии, или изменения, проявившиеся при развитии ММ, сохраняются. Исследование характеристик ГН у пациентов с ММ, проходивших терапию, необходимо для понимания механизмов формирования лекарственной устойчивости и причин рецидива заболевания.
Целью настоящего обзора является обобщение последних достижений в изучении роли сигнального пути WNT при ММ с точки зрения поиска потенциальных терапевтических мишеней, выявленных в последние годы.
Поражение костного мозга при ММ
ММ возникает на уровне ранних предшественников B-лимфоцитов. Развитие ММ вызывает у человека злокачественную трансформацию ПК, которые начинают неконтролируемо делиться и инфильтрируют костномозговую паренхиму. Их аномальная пролиферация связана как с выраженной геномной гетерогенностью и хромосомными нарушениями, так и с изменениями в микроокружении КМ [2,5]. Клональная пролиферация ПК приводит к подавлению нормального гемопоэза и синтезу аномальных иммуноглобулинов. Развитие заболевания нарушает гистоархитектонику КМ и изменяет структурно-морфологические характеристики ГН КМ. По результатам морфологических исследований КМ выделяют пять вариантов опухолевой инфильтрации КМ: нодулярный, интерстициальный, интерстициально-эндостальный, интерстициально-нодулярный, диффузный. Нодулярный тип характеризуется наличием очагового инфильтрата в жировой ткани КМ с наличием участвующих в гемопоэзе клеток. Интерстициальный тип отличается диффузным расположением клеток инфильтрата без изменения соотношения с жировой тканью. При интерстициально-эндостальном типе миеломные клетки выявляются также на эндосте. Этот вариант инфильтрации сопровождается значительными изменениями в строме, такими как увеличение плотности микрососудов. Интерстициально-нодулярный вариант сопровождается обнаружением очагов ММ в центре КМ. Для диффузного типа характерна обширная инфильтрация КМ клональными плазмоцитами, редукция адипоцитов в жировой ткани, увеличение числа микрососудов, а также угнетение гемопоэза. Все варианты инфильтрации КМ приводят к нарушениям морфофункционального статуса КМ различной степени [6]. При увеличении объёма инфильтрации опухолевыми клетками, являющегося важным критерием диагностики ММ, снижается количество ГСК в паренхиме КМ. Увеличение количества микрососудов коррелирует с количеством ПК и с остеодеструк-тивными изменениями. Происходит нарастание и изменение структурной организации клеток эндоста [7, 8].
Гемопоэтическая ниша КМ
Важной частью КМ является его строма, состоящая из компонентов межклеточного матрикса и различных типов клеток, не относящихся к форменным элементам крови. Строма участвует в регуляции гемопоэза, выполняя роль микроокружения для гемопоэтических стволовых клеток (ГСК), составляющих паренхиму и дающих начало всем типам клеток крови [9]. ГН представляет собой совокупность элементов микроокружения, которая является не только местом локализации ГСК, но и важным регулятором их жизнедеятельности. Такое действие обусловлено специфическими структурно-анатомическими и функциональными свойствами ГН.
В состав ГН входят остеобласты, остеокласты, клетки эндотелия, МСК, ретикулярные клетки, фибробласты, хондроциты, адипоциты и другие клетки, а также симпатические нервные волокна (рисунок 1). На сегодняшний день выделяют две анатомических ГН КМ: эндостальную и периваскулярную. Эндостальная ниша расположена вблизи эндоста и образована выстилающими полость КМ клетками: остеобластами, остеокластами, клетка- ми стромы [9]. Периваскулярная ниша представлена эндотелием синусоидных капилляров, симпатическими нервами, Шванновскими клетками, перицитами и макрофагами, и CAR-клетками, экспрессирующими CXCL12 [1, 10]. МСК встречаются в составе обеих ниш.
Функция ГН включает в себя обеспечение са-моподдержания ГСК и реализацию генетической программы их дифференцировки. Вне ниши ГСК не могут осуществлять свои функции в качестве стволовых клеток в процессе гемопоэза [9]. Она обеспечивает регуляцию их пролиферативного и дифференцировочного потенциала, в том числе коммитирования в направлении B-лимфопоэза. Влияние на ГСК клетки микроокружения осущест- вляют с помощью разнообразных взаимодействий: как прямых межклеточных контактов, так и посредством выделения различных гуморальных факторов. Многие типы клеток (МСК, остеобласты, клетки эндотелия и другие) выделяют хемокин CXCL12 – один из ключевых факторов, способствующий поддержке ГСК. Он важен для их хемотаксиса, хоминга и выживания [11].
Из всего многообразия компонентов стромы КМ можно выделить отдельные элементы, осуществляющие непосредственное влияние на жизнедеятельность ГСК. К ним относятся в первую очередь остеобласты, эндотелиальные клетки и МСК [9].
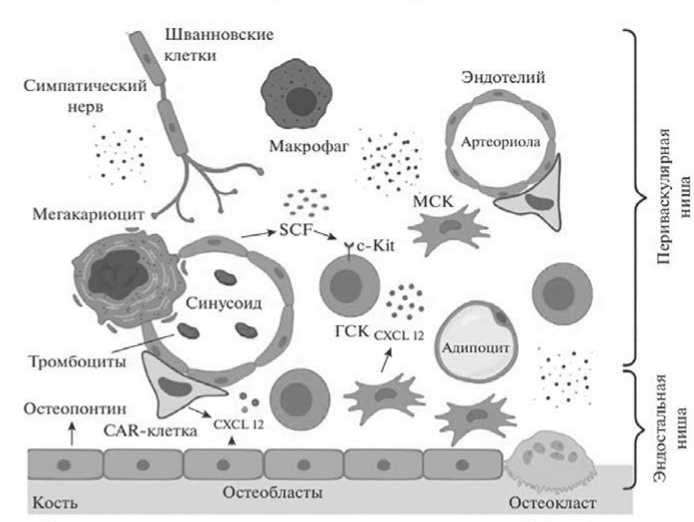
Рисунок 1 – Схема строения гемопоэтической ниши костного мозга ( Чубарь , Енукашвили , 2020)
Ключевым компонентом ГН являются МСК – фибробластоподобные клетки, дифференцирующиеся в различные клетки мезенхимного происхождения и способствующие дифференцировке ГСК. Помимо CXCL12 они выделяют такие факторы, как GM-CSF и G-CSF, воздействующие на более дифференцированных потомков ГСК [10].
Гемопоэтическая ниша при ММ
Как и при других гематологических злокачественных новообразованиях, при ММ определяются морфофункциональные нарушения не только в паренхиме, но и в строме КМ, что сопровождается угнетением нормального гемопоэза. Происходит увеличение плотности микрососудов, ретикулиновых волокон, уменьшается количество адипоцитов и плотность костных балок.
Нарушения в строении стромального микроокружения провоцируются воздействиями клеток
ММ, которые привлекаются в строму КМ гуморальными факторами, секретируемыми стромальными клетками. Миграция опухолевых клеток в строму происходит, в том числе, под влиянием хемокина CXCL12, взаимодействующего с рецептором CXCR4 на поверхности клеток ММ. Наиболее серьёзные изменения в строме были выявлены при диффузном варианте опухолевой инфильтрации [6]. При ММ внеклеточные и клеточные элементы микроокружения, в частности МСК, изменяют свои морфофункциональные характеристики и начинают поддерживать развитие опухолевых клеток и защищать их от иммунной системы. Новые морфофункциональные свойства микроокружения опухоли вызываются изменениями в генетическом профиле и биохимических процессах клеток опухоли [1]. Также происходят изменения в генетическом профиле самих клеток микроокружения. Были обнару- жены мутации в МСК стромы КМ, но их значение для развития заболеваний кроветворной системы пока что достоверно не определено [10].
Считается, что взаимодействие микроокружения и опухоли направлено в обе стороны. Действие клеток опухоли вызывает снижение пролиферации МСК и потерю их способности к дифференцировке, в результате чего они становятся МСК, ассоциированными с опухолью (ОА-МСК). Для ОА-МСК характерен синтез α-гладкомышечного актина, виментина, FSP-1. Также они начинают выделять паракринные факторы, способствующие формированию микроокружения опухоли: эпителиальный фактор роста (EGF), фактор роста гепатоцитов (HGF) и другие. ОА-МСК ремоделируют и уплотняют коллагеновый матрикс, меняя характер подвижности клеток в нем: из-за малого размера пор миграция становится возможной только за счет протеолитических механизмов [10]. Микроокружение влияет на опухоль за счёт выделения цитокинов, хемокинов, адипокинов, факторов роста (например, IL-6, IGF-1, VEGF, TNF-α и SDF-1), белков внеклеточного матрикса, лигандов к клеточным рецепторам сигнальных путей и других молекул [7]. Они способствуют росту, пролиферации и инфильтрации опухолевых клеток. Кроме этого, влияние перечисленных веществ может обеспечивать лекарственную устойчивость ММ [1]. Кроме этого, она достигается за счёт адгезии опухолевых клеток с фибробластами стромы КМ или с внеклеточным матриксом с помощью интегринов [12], а также с помощью синдекана-1 (CD138), высокая экспрессия которого является отличительной особенностью клеток ММ. Синдекан-1 также способствует усиленному ангиогенезу [5].
Миеломные клетки имеют определённые закономерности роста. На ранних стадиях заболевания они делятся экспоненциально, удвоение размеров опухоли происходит за 2-3 дня. С увеличением массы опухоли процент делящихся клеток начинает снижаться. На стадии клинических проявлений клетки в основном находятся в фазе G0 и не делятся [5].
Резорбция костной ткани при ММ
Скелетные повреждения являются одним из характерных симптомов, возникающих при развитии ММ. Они возникают в 80% случаев заболеваний. Первым симптомом ММ может быть боль в одном из отделов скелета или перелом. Первыми поражаются плоские кости и позвоночник, трубчатые кости – реже. Резорбция может проявляться в возникновении отдельных очагов лизиса костей и в развитии генерализованного остеопороза, при котором деструктивные процессы обнаруживаются во всех костях скелета. Распространённым последствием остеопороза становятся компрессионные переломы позвоночника, приводящие к различным осложнениям [5].
Деструкция скелета происходит из-за нарушения баланса процессов разрушения и восстановления в костной ткани. Это обусловлено как сильным увеличением активности остеокластов, так и подавлением деятельности остеобластов [5]. Нарушение процессов остеогенеза при ММ обусловлено в том числе снижением остеогенно-дифференциро-вочного потенциала МСК КМ [7]. Стимулировать работу остеокластов могут различные вещества, например, фактор некроза опухолей RANKL и некоторые хемокины. Ингибирование остеобластов осуществляет главным образом белок DKK-1 [5]. Разрушение костной ткани стимулирует развитие ещё более интенсивных процессов лизиса и обеспечивает его непрерывность за счёт выделяющихся цитокинов и хемоаттрактантов, воздействующих на миеломные клетки [5].
Нарушения остеогенеза
Одной из причин развития процессов резорбции костей скелета является подавление деятельности остеобластов. Остеобласты являются моно-нуклеарными клетками, происходящими из МСК. Маркером активности остеобластов является щелочная фосфатаза [13]. Они участвуют в формировании кости за счет выработки коллагена, их деятельность сопровождается выделением в кровь остеокальцина [14, 15]. При ММ в очагах лизиса не наблюдается последующей регенерации костной ткани из-за нарушения функционирования остеобластов. Из-за интенсивного синтеза цитокинов и взаимодействий с клетками ММ остеобласты начинают подвергаться апоптотической гибели. Рост и активность остеобластов подавляются ингибирующими растворимыми факторами [16]. Многие факторы осуществляют своё влияние через подавление передачи сигналов, осуществляемой каскадом белков семейства WNT, участвующих во многих процессах в организме человека, в том числе в регуляции остеогенеза. Важным фактором подавления активности остеобластов является белок Dick Kopf 1 (DKK-1), секретирующийся как остеобластами и стромальными клетками КМ, так и клетками ММ и ингибирующий активность остеобластов [16]. Он является антагонистом белков WNT, и вследствие его действия нарушается образование костной ткани. У больных ММ, имеющих очаги лизиса в костях, обнаруживается высокая экспрессия гена DKK-1 [17]. В результате высокой экспрессии DKK-1 МСК не дифференцируются в остеобласты [17]. Секретируемый белок sFRP-2 синтезируется в клетках MM и ингибирует дифференцировку остеобластов, индуцированную костным морфогенетическим белком-2 (BMP-2). Это действие он оказывает за счёт того, что препятствует связыванию WNT с рецептором Frizzled. У пациентов с ММ с резорбцией костей наблюдается повышенная экспрессия sFRP-2 в опухолевых клетках [18]. Белок склеростин, вырабатываемый остеоцитами, также снижает остеобласгогенез. Его синтез стимулируется глюкокортикоидами и угнетается паратиреоидным гормоном* Действие склеростина обусловлено тем, что он предотвращает взаимодействие WNT и ко-рецептора LRP5/ LRP6 [19].
Другой механизм подавления остеобла сто генеза обусловлен ингибированием активности фактора транскрипции Runx2/Cbfal, который очень важен для формирования и дифференцировки остеобластов. Его угнетение происходит при прямых межклеточных взаимодействиях предшественников остеобластов с клетками ММ. Их контакт обусловлен связыванием интетрина а4р1 на поверхности опухолевых клеток и молекул клеточной адгезии VCAM-1 на предшественниках остеобластов [16]. Промоторную активность Runx2/Cbfal в остеобластах снижает интерлейкин-7 [20]. Другими белками, подавляющими остеогенез через влияние на Runx2, являются фактор роста TGF-p и фактор транскрипции Gfil, связывающийся непосредственно с ДНК [16].
Активация остеокластов
Индукция остеокластов является второй причиной резорбции в костной ткани. Остеокласты представляют собой многоядерные клетки, происходящие из ГСК, коммитированных в моноцитарномакрофагальном направлении, или из моноцитов [21]. Они содержат белки, участвующие в резорбции кости, такие как тартрат-устойчивая кислая фосфатаза [TRAP], тартрат-усгойчивая тринуклеотид фосфата за, карбоангидраза [I, кальцитониновые рецепторы и катепсины [22]. Адгезия клеток ММ к стромальным клеткам КМ посредством связывания VCAM-1 с интегрином ct4|31 активирует различные факторы, которые стимулируют образование, дифференцировку и активность остеокластов, а также подавление негативных регуляторов остеокластогенеза. К таким факторам относятся ин терлейкин-6 (IL-6), IL-lft IL-lp, IL-11, макрофагальный колониестимулирующий фактор (M-CSF), факторы некроза опухоли (ФНО-ft, ФНО-р), макрофагальный воспалительный б елок-1-альфа (MIP-1ft), паратиреоидный гормон-родственный белок (РТНгР) фактор роста эндотелия сосудов (VEGF) и стромальный клеточный фактор-1-альфа (SDF-la) [23]. Эти цитокины могут продуцироваться как самими клетками ММ, так и стромальными клетками в результате взаимодействия с клетками ММ. Основную роль в остео класто генезе играет рецептор активатора NF-кВ лиганда (RANKL) и система осте-опротегерина (OPG) [16].
Сигнальный путь RANKL/OPG - это важнейший путь, регулирующий деятельность остеокластов. Остеобласты и стромальные клетки синтезируют RANKL, способствующий пролиферации и дифференцировке остеокластов. В норме его действие уравновешивает синтез теми же клетками OPG, который нейтрализует RANKL и подавляет актив ность остеокластов. Однако при заболевании ММ этот баланс нарушается, и RANKL начинает синтезироваться в больших количествах, чем OPG. В результате активность остеокластов повышается, и они разрушают костную ткань [24]. У пациентов с остеолизом выявлен более высокий уровень экспрессии RANKL на поверхности плазматических клеток, чему пациентов без остеолиза [25].
М1Р-1а - хемокин, являющийся одним из факторов остеокласте генеза. Он индуцирует поздние ста ди и ди ффе р ен ци ров ки п р едшестве нниковосте-окластов и образование остеокластов в КМ. Высокий уровень М1Р-10 обнаружен у 62 % больных с активной ММ и только в 17 % случаев при стабильном течении ММ [26].
SDF-la - хемокин, выявляющийся на эндотелии костей и стромальных клетках КМ. При ММ он также в больших количествах экспрессируется на плазматических клетках. Повышение экспрессии SDF-la коррелирует с числом очагов лизиса в костях. В ответ на SDF-lft растёт функциональная активность предшественников остеокластов, а также повышается экспрессия ассоциированных с резорбцией маркеров в остеокластах. Также SDF-la действует через рецептор CXCR4, экспрессирующийся на предшественниках остеокластов, дендритных клетках и лейкоцитах [27].
Механизм действия сигнального каскада WNT в остеогенезе
Ремоделирование костной ткани представлено совокупностью двух последовательных процессов: локального разрушения кости и последующего восстановления в том же месте. Сигнальный путь WNT осуществляет важную роль в регуляции этого процесса [28]. WNT связываются с рецептором Frizzled и его корецепторами LRP5/LRP6, что вызывает накопление р-катенина. Он проникает в ядро и стимулирует экспрессию генов-мишеней, регулирующих активность остеобластов [29]. В отсутствие сигнала WNT р-катенин фосфорилируется и разрушается протеасомой. р-катенин является основным фактором экспрессии OPG в остеобластах. Показано, что инактивация гена LRP5 приводит к синдрому остеопороза-псевдоглномы, а мутации с усилением функции в LRP5 провоцируют развитие остеопетроза (синдрома повышенной плотности костей) [30]. Регуляция сигнального пути WNT происходит с помощью внеклеточных растворимых антагонистов [31]. Белки DKK связываются с LRP5/ LRP6, а секретируемые белки sFRP - непосредственно с WNT. Оба этих взаимодействия приводят к подавлению передачи сигнала WNT и снижению функции остеобластов, а также к повышению остеокласто генеза, поскольку передача сигналов WNT в остеобластах увеличивает экспрессию OPG и подавляет экспрессию RANKL [32,33].
Сигнальный каскад WNT
Сигнальный каскад WNT является высококон- сервативным сигнальным путём и выполняет важную функцию в организме, участвуя в процессах эмбриогенеза, регуляции разнообразных клеточных процессов, а также в развитии злокачественных опухолей. Он играет ключевую роль в процессах пролиферации, дифференцировки, миграции и самообновления стволовых клеток. Его участие в малигнизации обусловлено тем, что в основе этого процесса находятся нарушения пролиферации и дифференцировки клеток [34].
Белки WNT
WNT – это семейство секретируемых гликопротеинов, кодируемых девятнадцатью генами WNT, расположенными в разных аутосомах.
Существуют разные способы передачи сигнала WNT, которые подразделяют на канонический путь, опосредованный белком β-катенином, и неканонические пути, различающихся по своим механизмам, но не зависящих от β-катенина [35]. В белках WNT не было обнаружено каких-либо специфических различий, благодаря которым происходило бы их разделение на те, что участвуют в каноническом пути передачи сигнала и в неканоническом. Тип передачи сигнала, в котором участвует белок WNT, скорее всего, обусловлен спектром рецепторов и преобразователей сигналов в данной клетке, а не внутренним свойством белка. К примеру, WNT5A может действовать в составе как канонического, так и неканонического пути. Таким образом, выяснено, что тип сигнального пути определяется в основном клеточным контекстом [36].
Канонический сигнальный путь WNT
Канонический путь основан на стабильности β-катенина, участвующего в активации транскрипционных мишеней WNT (рисунок 2).
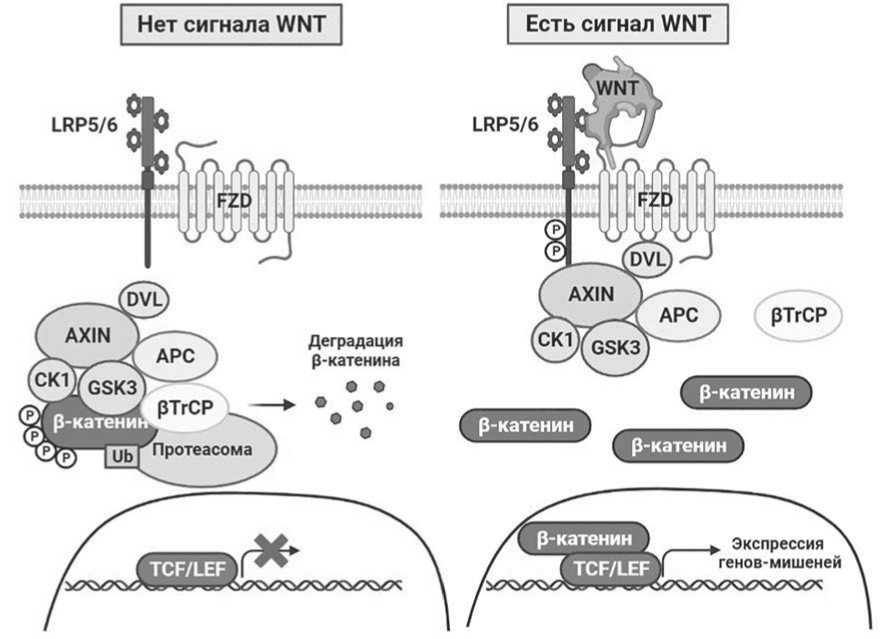
Рисунок 2 – Схема канонического сигнального пути WNT/ β - катенин
В отсутствие лигандов опухолевые супрессоры Axin и белок APC (продукт гена опухолевого супрессора) образуют так называемый «комплекс разрушения», содержащий GSK3β, который вместе с казеинкиназой-1α (CK1α) последовательно фосфорилирует β-катенин. CK1α фосфорилирует β-катенин по Ser45, инициируя последующее фосфорилирование по Thr41, Ser37 и Ser33 с помощью GSK3. Axin усиливает фосфорилирование β-катенина, помещая его вблизи GSK3. Затем домен фосфодегрон β-катенина распознаётся белком, содержащим повторы β-трансдуцина (β-TrCP), субъединицей распознавания субстрата белкового комплекса убиквитинлигазы Е3, который способствует распаду белка в протеасоме [37].
Запуск передачи сигнала происходит при взаимодействии WNT с родственным рецептором Frizzled (Fzd) и его корецепторами LRP5 и LRP6, связывающими Axin [38]. Образовавшийся ком- плекс способствует продвижению к мембране белка Disheveled (Dvl), что приводит к последующему взаимодействию Axin1-GSK3, в результате чего разрушается деструктирующий комплекс. Это позволяет стабилизировать цитоплазматический β-катенин, который затем перемещается в ядро и связывается с Т-клеточными факторами транскрипции (LEF/TCF), активирующими транскрипцию генов-мишеней WNT.
Неканонические сигнальные пути WNT
Среди неканонических способов передачи сигналов WNT исторически выделяют WNT/Ca2+ путь и путь планарной клеточной полярности (или путь клеточной поляризации) [40].
Сигнальный путь WNT/Ca2+ основан на увеличении внутриклеточной концентрации Ca2+ и последующей Ca2+-зависимой клеточной передаче сигналов [41]. Он реорганизует цитоскелет, способствует адгезии клеток и участвует в установлении дорсолатеральной асимметрии. Высвобождение кальция провоцирует деполяризацию мембран. WNT-опосредованное увеличение концентрации Ca2+ может способствовать канонической передаче сигналов WNT, облегчая транспорт крупных молекул через ядерную оболочку, таким образом увеличивая прохождение β-катенина [42].
Лиганд WNT связывается с корецепторами ROR2 и рецептором Fzd и через диссоциацию G-белка активирует фосфолипазу С (PLC). PLC высвобождает PI3, который связывается с рецепторами IP3; они функционируют как кальциевые каналы в эндоплазматическом ретикулуме и высвобождают Ca2+ [43]. Увеличение Ca2+ активирует чувствительные к кальцию ферменты. С другой стороны, Ca2+ активирует протеинкиназу C (PKC) [44]. Она в свою очередь активирует факторы транскрипции NF-κB, цАМФ-чувствительный элемент-связывающий белок (CREB) и ядерный фактор, связанный с Т-клетками (NFAT). В числе лигандов WNT, активирующих передачу сигналов WNT/Ca2+, выделяют WNT5A и WNT3A, которые также могут активировать и каноническую передачу. Как и канонический путь, Ca2+зависимый путь участвует в регуляции деятельности остеобластов и остеокластов [40].
Путь клеточной поляризации обеспечивает информацию о направлении, в котором должна происходить поляризация клеток и тканей [45]. Это особенно важно в ходе гаструляции и формирования эмбриональныхтканей. Каки Ca2+-зависимый путь, он контролирует организацию цитоскелета и адгезию клеток, а также установление клеточной полярности [40]. Ассоциированный с мембраной комплекс PCP (planar cell polarity) core состоит из шести белков, взаимодействующих друг с другом с противоположных сторон клетки. Их связь контролируется тремя трансмембранными компонентами комплекса: рецептор Fzd (в частности, Fzd3 и Fzd6), белок клеточной полярности Vangl2 и рецептор G-типа кадгерина EGF LAG (CELSR). Внутриклеточные сигналы опосредуются через Dvl, Prickle и ANKRD6 или инверсин (INVS) [40].
Сигнализация WNT при ММ
Со многими аспектами развития ММ связана деятельность сигнального пути WNT, что обусловлено его участием в регуляции пролиферации, дифференцировки и миграции клеток [4]. На сегодня доказано участие только некоторых гликопротеинов семейства WNT в развитии ММ. На данный момент пути активации каскада WNT при развитии ММ ещё не до конца выявлены и не идентифицированы конкретные генные мутации, активирующие WNT при этом заболевании. Среди предполагаемых факторов и процессов активации WNT рассматривают аберрантные уровни лиганда в микроокружении КМ, повышенную экспрессию транскрипционных кофакторов WNT и ассоциированных микро-РНК, а также нарушенные процессы эпигенетики и посттрансляционной модификации. Активация пути WNT связана с приобретенной лекарственной устойчивостью клеток ММ, опосредованной клеточной адгезией [4].
Исследования показали, что в клетках ММ путь WNT способен активироваться как самостоятельно, путём аутокринной стимуляции, так и паракринно с помощью внешних лигандов, про-дуциремых микроокружением КМ. Аутокринная стимуляция была доказана с помощью измерения уровней экспрессии лигандов WNT в клетках ММ. Паракринную передачу сигналов экзогенными лигандами Wnt смоделировали в нескольких исследований, что доказало способность клеток ММ отвечать на внешние лиганды, и, следовательно, важную роль клеток стромы КМ в развитии опухоли.
Одним из процессов, нарушающихся при изменениях WNT-сигнализации, является остеогенез (рисунок 3). В норме сигнальный путь WNT осуществляет регуляцию баланса между остеобластами и остеокластами, благодаря чему интенсивность резорбции костной ткани не превышает скорости её формирования, однако при ММ этот баланс нарушается. Клетки ММ выделяют в микроокружение антагонисты WNT, в том числе DKK1, в результате чего сигналы лигандов WNT не передаются, нарушается деятельность остеобластов, и процесс формирования кости снижает интенсивность. При этом активная деятельность остеокластов становится причиной литических процессов и приводит к резорбции костной ткани [46].
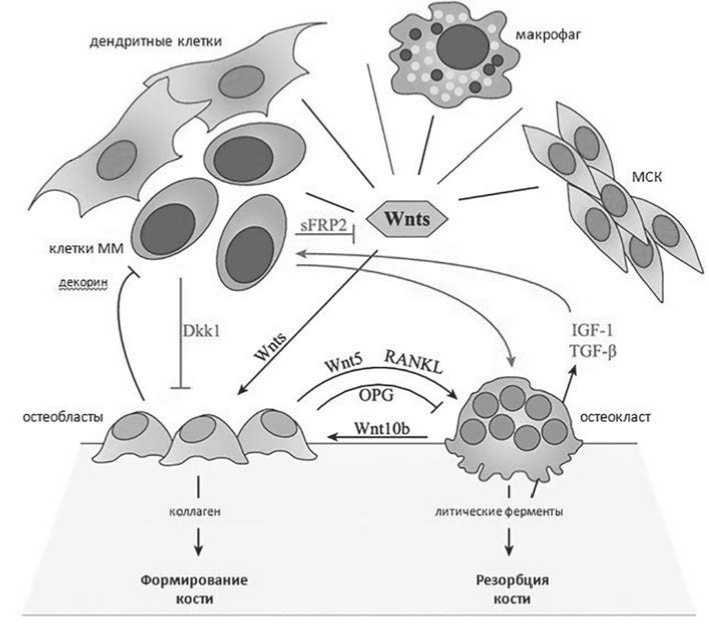
Рисунок 3 – Сигнализация WNT и гомеостаз кости при ММ (Spaan et al., 2018 ( с изменениями ) CC
BY 4.0
При остеолизисе выделяются факторы роста, содействующие выживанию и росту клеток ММ. МСК в здоровой ГН секретируют лиганды WNT, такие как WNT2, WNT4, WNT5A, WNT11 и WNT16 [47]. Остеобласты секретируют WNT5, а остеокласты – WNT10B для взаимной регуляции [48, 49]. WNT выделяют и другие клетки микроокружения. Из-за секреции опухолью антагонистов WNT передача сигналов блокируется, и межклеточная коммуникация нарушается. В большой степени это сказывается на остеобластах, у которых оказывается нарушена пролиферация, дифференцировка и выживаемость [4]. В результате развиваются остеолитические поражения костей.
Другой аспект, на который влияет WNT-сигнализация – это развитие опосредованной клеточной адгезией лекарственной устойчивости клеток ММ. Выявлена роль в этом процессе WNT3, участвующего в неканоническом пути клеточной поляризации (через активацию RhoA/ROCK), который в больших количествах экспрессируется клетками ММ [50]. Клетки ММ способны не только блокировать WNT-сигналы с помощью выделения антагонистов, но и сами секретировать лиганды WNT. Предположительно они с помощью аутокринной регуляции индуцируют собственную WNT-сигнализацию, осуществляемую через канонический путь [51, 52]. Такая передача сигналов способствует выживанию опухолевых клеток, пре- дотвращая апоптоз.
Таким образом, WNT-сигнализация, представленная несколькими различающимися по механизму действия сигнальными каскадами, при ММ действует в разнообразных направлениях, оказывая разный эффект в зависимости от клетки-источника и клетки, принимающей сигнал.
Сигнальный путь WNT/β-катенин при ММ
Первые данные, демонстрирующие процесс канонической WNT-сигнализации при ММ, показали, что большая часть клеточных линий ММ человека содержат в ядре активный β-катенин в отличие от незлокачественных плазматических клеток [53]. Последующие исследования подтверждали роль β-катенин-зависимого пути и исследовали активаторы и ингибиторы, способные влиять на изменение активности WNT-сигнализации. Изменения могут быть обусловлены непосредственным влиянием определённых молекул на различные компоненты каскада, в частности на ключевой посредник канонического пути – β-катенин. Так, SOX12 способствует пролиферации клеток ММ за счёт увеличения экспрессии β-катенина [54]. Сайленсинг гена SOX12 с помощью микроРНК miR-744-5p снижает экспрессию β-катенина, способствуя апоптозу опухолевых клеток [55]. Подавляемая при ММ miR-30-5P, также может действовать в качестве онкосупрессора: её активация ингибирует пролиферацию клеток ММ, снижая экспрессию коактиватора канонического пути BCL9 [56]. Другая микроРНК, MiR-135b, наоборот, увеличивает экспрессию β-катенина и активирует канонический путь WNT, положительно влияя на пролиферацию, миграцию и выживание клеток ММ [57]. МикроРНК-638, активируемая циклической РНК-протеинтирозинкиназой 2, оказывает аналогичный эффект [58]. Длинная некодирующая РНК HCP5 активирует WNT/β-катенин через белок PLAGL2 и повышает пролиферацию клеток ММ [59]. Белки RRM2 и PCDH10 действуют через GSK3β. Показано, что белок RRM2 повышен у пациентов с ММ, а его ингибирование снижает экспрессию β-катенина, вызывая апоптоз опухолевых клеток [60]. PCDH10 является опухолевым супрессором, при его активации экспрессия GSK3β растёт, а каскад WNT/β-катенин/BCL9 и, соответственно, пролиферация клеток ММ подавляется [61].
Помимо исследований, касающихся непосредственно опухолевых клеток, были и работы, изучавшие WNT-сигнализацию в микроокружении ММ. Так, было показано, что каноническая передача сигнала с участием WNT3A у мышей индуцирует остеогенез и снижает опухолевую нагрузку [62]. Эти данные доказывают ключевую роль канонического сигнального пути в патогенезе ММ, в частности в поддержании пролиферации опухолевых клеток и лекарственной устойчивости, но лежащие в основе нарушений сигнализации механизмы ещё предстоит полностью выяснить.
Неканонические пути WNT при ММ
Лиганд WNT3A способен активировать как канонический, так и неканонический сигнальный путь. В первых исследованиях, выявивших неканоническую WNT-сигнализацию при ММ, было показано, что WNT3A регулирует цитоскелет в клетках ММ, изменяя их форму, причём этот эффект вызывался только через активацию неканонического каскада и блокировался лишь с помощью ингибиторов неканонического каскада [63]. Позже выявили, что неканонические пути WNT способствует миграции и инвазии клеток MM, задействуя такие компоненты каскадов, как RHOA, DVL и PKC [51]. Неканоническая аутокринная передача с участием WNT3/ RHOA/ROCK в клетках ММ усиливает интегрин-опосредованную клеточную адгезию, что приводит к формированию лекарственной устойчивости опухоли к доксорубицину [50]. Более позднее исследование выявило, что активация неканонического каскада WNT5A/ROR2 противодействует развитию ММ, так как в микроокружении КМ он вовлечён в остеогенную дифференцировку МСК и ремоделирование костной ткани [64].
Роль неканонической WNT-сигнализации в развитии ММ и способы её регуляции на данный момент изучены не настолько подробно, как процессы, связанные с каноническим β-катенин-зависимым каскадом.
Стратегии терапии ММ, нацеленные на сигнальный путь WNT
В настоящий момент нет зарегистрированных клинических испытаний для лекарственных препаратов или схем терапии, нацеленной на канонический путь WNT, но в последнее время были проведены перспективные доклинические исследования. На мышах показано подавление ММ путём апоптоза её клеток с помощью ингибитора пути WNT/β-катенин AV-65, который способствует убиквитинированию и протеасомной деградации β-катенина [65]. Одновременное сочетание препаратов децитабина и бортезомиба подавляет развитие ММ клеток за счёт апоптотического эффекта бортезомиба и эпигенетического действия децита-бина, активирующего WNT-антагонисты, а также снижающего количество β-катенина [66].
Ингибитор пути WNT/β-катенин BC2059 вызывает деградацию β-катенина и апоптоз клеток ММ, при этом проявляя синергизм с бортезомибом [67]. Ингибитор β-катенина тегавивинт в комбинации с панобиностатом замедляет прогрессирование ММ in vitro и in vivo, снижая её лекарственную устойчивость к ингибиторам протеасом [68].
Природное соединение ликорин препятствует делению клеток ММ, снижая уровень β-катенина, особенно в комбинации с бортезомибом. При со-культивировании клеток ММ с МСК их пролиферация повышалась под действием WNT3A/β-катенина, однако благодаря ликорину этот эффект снижался [69].
Заключение
Механизмы аберрантной сигнализации WNT определены не до конца. Согласно обобщённым за последние годы данным, мутации генов, кодирующих компоненты каскада, при ММ обнаруживаются редко, поэтому среди основных механизмов рассматривают изменения уровней определённых лигандов WNT, действующих на клетки-мишени аутокринно или паракринно.
Исследования, подходившие с разных сторон к изучению роли WNT при ММ, демонстрируют двойную роль сигнального пути в развитии заболевания. В здоровом микроокружении КМ лиганды WNT, выделяемые клетками стромы, активируют каскады, необходимые для поддержания остеогенеза и других процессов, требующих межклеточной коммуникации. При инвазии клеток ММ изменённое микроокружение выделяет WNT-лиганды, активирующие аберрантную WNT-сигнализацию, направленную на поддержание жизнедеятельности опухоли и пролиферации и миграции её клеток. Сами опухолевые клетки также выделяют лиганды WNT, осуществляя аутокринную стимуляцию. Кроме этого, клетки ММ экспрессируют антагонисты WNT, предназначенные для ингибирования нормальной WNT-сигнализации в микроокружении и подавления формирования костной ткани, что вы- зывает остеолитическое поражение костей.
Список литературы Сигнальный путь WNT при множественной миеломе
- Ругаль В. И., Бессмельцев С. С., Семенова Н. Ю. и др. Характеристика микроокружения костного мозга при множественной миеломе до и после терапии // Сибирский научный медицинский журнал. - 2019. - Т.39, № 1. - С. 112–118.
- Бессмельцев С.С. Множественная миелома: диагностика и терапия (часть 1) // Вестник гематологии. - 2022. - Т. 18, №2. - C. 4-26
- Dazzi F., Ramasamy R., Glennie S. et al. The role of mesenchymal stem cells in haemopoiesis // Blood Rev. - 2006. - Vol. 20, № 3. - P. 161–171.
- Spaan I., Raymakers R. A., van de Stolpe A. et al. Wnt signaling in multiple myeloma: a central player in disease with therapeutic potential // J Hematol Oncol. - 2018a. - Vol. 11, № 1. - P. 67.
- Бессмельцев С. С. Множественная миелома (патогенез, клиника, диагностика, дифференциальный диагноз). Часть I // Клиническая онкогематология. - 2013b. – Т.6, № 3. - С. 237–257.
- Ругаль В. И., Бессмельцев С. С., Семенова Н. Ю. и др. Структурные особенности паренхимы и стромы костного мозга больных множественной миеломой // Medline.ru - Биомедицинский журнал Медлайн.ру [Электронный ресурс]. URL: http://www.medline.ru/public/art/tom13/art41.html.
- Семенова Н. Ю., Чубарь А. В., Енукашвили Н. И. и др. Перестройка ключевых элементов стромального микроокружения костного мозга при множественной миеломе // Вестник гематологии. - 2020. - Т. 16, № 1. - С. 15–21.
- Покровская О. С., Менделеева Л. П., Капланская И. Б. и др. Ангиогенез в костном мозге больных множественной миеломой на различных этапах высокодозной химиотерапии // Клиническая онкогематология. - 2010. - Т.3, №4. - С.347–53.
- Семенова Н. Ю., Бессмельцев С. С., Ругаль В.И. Биология ниши гемопоэтических стволовых клеток // Клиническая онкогематология. - 2014. – Т.7, № 4. - С. 501-510.
- Чубарь А. В., Енукашвили Н. И. Мезенхимные стромальные клетки: роль в формировании гематоонкологической ниши // Цитология. - 2020. - Т. 62, № 11. - С. 763–772.
- Семенова Н. Ю., Артюхина З. Е., Бессмельцев С. С. Роль микроокружения костного мозга и сигнального пути CXCR4/CXCL12 в развитии множественной миеломы // Вестник гематологии. – 2021. – Т. 17, № 1. – С. 36-46.
- Meads M. B., Gatenby R. A., Dalton W. S. Environment-mediated drug resistance: a major contributor to minimal residual disease // Nat Rev Cancer. - 2009. - Vol. 9, № 9. - P. 665–674.
- George J., Kuboki Y., Miyata T. et al. Differentiation of mesenchymal stem cells into osteoblasts on honeycomb collagen scaffolds // Biotechnol Bioeng. - 2006. - Vol. 95, № 3. - P. 404–411.
- McSheehy P.M, Chambers T.J. Osteoblast-Like Cells in the Presence of Parathyroid Hormone Release Soluble Factor that Stimulates Osteoclastic Bone Resorption // Endocrinology. - 1986. - Vol. 119, № 4. - P. 1654–1659.
- Owen T. A., Aronow M. S., Barone L. M. et al. Pleiotropic Effects of Vitamin D on Osteoblast Gene Expression Are Related to the Proliferative and Differentiated State of the Bone Cell Phenotype: Dependency upon Basal Levels of Gene Expression, Duration of Exposure, and Bone Matrix Competency in Norma // Endocrinology. - 1991. - Vol. 128, № 3. - P. 1496–1504.
- Terpos E., Christoulas D., Gavriatopoulou M. et al. Mechanisms of bone destruction in multiple myeloma // Eur J Cancer Care (Engl). - 2017. - Vol. 26, № 6. doi: 10.1111/ecc.12761.
- Tian E., Zhan F., Walker R. et al. The Role of the Wnt-Signaling Antagonist DKK1 in the Development of Osteolytic Lesions in Multiple Myeloma // New England Journal of Medicine. - 2003. - Vol. 349, № 26. - P. 2483–2494.
- Oshima T., Abe M., Asano J. et al. Myeloma cells suppress bone formation by secreting a soluble Wnt inhibitor, sFRP-2 // Blood. - 2005. - Vol. 106, № 9. - P. 3160–3165.
- Moester M. J. C., Papapoulos S. E., Löwik C. W. et al. Sclerostin: Current Knowledge and Future Perspectives // Calcif Tissue Int. - 2010. - Vol. 87, № 2. - P. 99–107.
- Giuliani N., Colla S., Morandi F. et al. Myeloma cells block RUNX2/CBFA1 activity in human bone marrow osteoblast progenitors and inhibit osteoblast formation and differentiation // Blood. - 2005. - Vol. 106, № 7. - P. 2472–2483.
- Bar-Shavit Z. The osteoclast: A multinucleated, hematopoietic-origin, bone-resorbing osteoimmune cell // J Cell Biochem. - 2007. - Vol. 102, № 5. - P. 1130–1139.
- Janckila A. J., Takahashi K., Sun S. Z. et al. Tartrate-resistant acid phosphatase isoform 5b as serum marker for osteoclastic activity // Clin Chem. - 2001. - Vol. 47, № 1. - P. 74–80.
- Mitsiades C. S., Mitsiades N. S., Munshi N. C. et al. The role of the bone microenvironment in the pathophysiology and therapeutic management of multiple myeloma: Interplay of growth factors, their receptors and stromal interactions // Eur J Cancer. - 2006. - Vol. 42, № 11. - P. 1564–1573.
- Sezer O. Myeloma bone disease // Hematology. - 2005. - Vol. 10, Sup1. - P. 19–24.
- Heider U., Langelotz C., Jakob C. et al. Expression of Receptor Activator of Nuclear Factor B Ligand on Bone Marrow Plasma Cells Correlates with Osteolytic Bone Disease in Patients with Multiple Myeloma // Clinical Cancer Research. - 2003. - Vol. 9, № 4. - P. 1436–1440.
- Abe M., Hiura K., Wilde J. et al. Role for macrophage inflammatory protein (MIP)-1α and MIP-1β in the development of osteolytic lesions in multiple myeloma // Blood. - 2002. - Vol. 100, № 6. - P. 2195–2202.
- Zannettino A. C., Farrugia A. N., Kortesidis A. et al. Elevated Serum Levels of Stromal-Derived Factor-1α Are Associated with Increased Osteoclast Activity and Osteolytic Bone Disease in Multiple Myeloma Patients // Cancer Res. - 2005. - Vol. 65, № 5. - P. 1700–1709.
- Albers J., Keller J., Baranowsky A. et al. Canonical Wnt signaling inhibits osteoclastogenesis independent of osteoprotegerin // Journal of Cell Biology. - 2013. - Vol. 200, № 4. - P. 537–549.
- Westendorf J. J., Kahler R. A., Schroeder T. M. Wnt signaling in osteoblasts and bone diseases // Gene. - 2004. - Vol. 341. - P. 19–39.
- Boyden L. M., Mao J., Belsky J. High Bone Density Due to a Mutation in LDL-Receptor–Related Protein 5 // New England Journal of Medicine. - 2002. - Vol. 346, № 20. - P. 1513–1521.
- Kawano Y., Kypta R. Secreted antagonists of the Wnt signalling pathway // J Cell Sci. - 2003. - Vol. 116, № 13. - P. 2627–2634
- Glass D. A., Bialek P., Ahn J. D. et al. Canonical Wnt Signaling in Differentiated Osteoblasts Controls Osteoclast Differentiation // Dev Cell. - 2005. - Vol. 8, № 5. - P. 751–764.
- Spencer G. J., Utting J. C., Etheridge S. L. et al. Wnt signalling in osteoblasts regulates expression of the receptor activator of NFκB ligand and inhibits osteoclastogenesis in vitro // J Cell Sci. - 2006. - Vol. 119, № 7. - P. 1283–1296.
- Zhan T., Rindtorff N., Boutros M. Wnt signaling in cancer // Oncogene. - 2017. - Vol. 36, № 11. - P. 1461–1473.
- Nusse R., Clevers H. Wnt/β-Catenin Signaling, Disease, and Emerging Therapeutic Modalities // Cell. - 2017. - Vol. 169, № 6. - P. 985–999.
- Willert K., Nusse R. Wnt Proteins // Cold Spring Harb Perspect Biol. - 2012. - Vol. 4, № 9. С. doi: 10.1101/cshperspect.a007864.
- Colozza G., Koo B. Wnt/β-catenin signaling: Structure, assembly and endocytosis of the signalosome // Dev Growth Differ. - 2021. - Vol. 63, № 3. - P. 199–218.
- Zeng X., Huang H., Tamai K. et al. Initiation of Wnt signaling: control of Wnt coreceptor Lrp6 phosphorylation/ activation via frizzled, dishevelled and axin functions // Development. - 2008. - Vol. 135, № 2. - P. 367–375.
- Day T. F., Guo X., Garrett-Beal L. et al. Wnt/β-Catenin Signaling in Mesenchymal Progenitors Controls Osteoblast and Chondrocyte Differentiation during Vertebrate Skeletogenesis // Dev Cell. - 2005. - Vol. 8, № 5. - P. 739–750.
- Lojk J., Marc J. Roles of Non-Canonical Wnt Signalling Pathways in Bone Biology // Int J Mol Sci. - 2021.- Vol. 22, № 19. - P. 10840.
- Kühl M., Sheldahl L. C., Park M. et al. The Wnt/Ca2+ pathway // Trends in Genetics. - 2000. - Vol. 16, № 7. - P. 279–283.
- Thrasivoulou C., Millar M., Ahmed A. Activation of Intracellular Calcium by Multiple Wnt Ligands and Translocation of β-Catenin into the Nucleus // Journal of Biological Chemistry. - 2013. - Vol. 288, № 50. - P. 35651–35659.
- Clapham D. E. Calcium Signaling // Cell. - 2007. - Vol. 131, № 6. - P. 1047–1058.
- Sheldahl L. C., Park M., Malbon C.C. et al. Protein kinase C is differentially stimulated by Wnt and Frizzled homologs in aG-protein-dependent manner // Current Biology. - 1999. - Vol. 9, № 13. - P. 695-698.
- Butler M. T., Wallingford J. B. Planar cell polarity in development and disease // Nat Rev Mol Cell Biol. - 2017. - Vol. 18, № 6. – P. 375–388.
- Edwards C. M., Zhuang J., Mundy G. R. et al. The pathogenesis of the bone disease of multiple myeloma // Bone. - 2008. - Vol. 42, № 6. - P. 1007–1013.
- Ling L., Nurcombe V., Cool S. M. Wnt signaling controls the fate of mesenchymal stem cells // Gene. - 2009. - Vol. 433, № 1–2. - P. 1–7.
- Maeda K., Kobayashi Y., Udagawa N. et al. Wnt5a-Ror2 signaling between osteoblast-lineage cells and osteoclast precursors enhances osteoclastogenesis // Nat Med. - 2012. - Vol. 18, № 3. - P. 405–412.
- Pederson L., Ruan M., Westendorf J.J. Regulation of bone formation by osteoclasts involves Wnt/BMP signaling and the chemokine sphingosine-1-phosphate // Proceedings of the National Academy of Sciences. - 2008. - Vol. 105, № 52. - P. 20764–20769.
- Kobune M., Chiba H., Kato J. et al. Wnt3/RhoA/ROCK signaling pathway is involved in adhesion-mediated drug resistance of multiple myeloma in an autocrine mechanism // Mol Cancer Ther. - 2007. - Vol. 6, № 6. - P. 1774–1784.
- Qiang Y.W. Wnts induce migration and invasion of myeloma plasma cells // Blood.- 2005. - Vol. 106, № 5. - P. 1786–1793.
- Sukhdeo K., Mani M., Zhang Y. et al. Targeting the β-catenin/TCF transcriptional complex in the treatment of multiple myeloma // Proceedings of the National Academy of Sciences. - 2007. - Vol. 104, № 18. - P. 7516–7521.
- Derksen P.W.B. et al. Illegitimate WNT signaling promotes proliferation of multiple myeloma cells // Proceedings of the National Academy of Sciences. - 2004. - Vol. 101, № 16. - P. 6122–6127.
- Gao Y., Li L., Hou L. et al. SOX12 promotes the growth of multiple myeloma cells by enhancing Wnt/β-catenin signaling // Exp Cell Res. - 2020. - Vol. 388, № 1. - P. 111814. doi: 10.1016/j.yexcr.2020.111814.
- Guo B., Xiao C., Liu Y. et al. miR-744-5p Inhibits Multiple Myeloma Proliferation, Epithelial Mesenchymal Transformation and Glycolysis by Targeting SOX12/Wnt/β-Catenin Signaling // Onco Targets Ther. - 2021. - Vol. 14. - P. 1161–1172.
- Zhao J.-J., Lin J., Zhu D. et al. miR-30-5p Functions as a Tumor Suppressor and Novel Therapeutic Tool by Targeting the
- Oncogenic Wnt/β-Catenin/BCL9 Pathway // Cancer Res. - 2014. - Vol. 74, № 6. - P. 1801–1813.
- Chen H., Hao Y., Zhang J. et al. Promoting effects of MiR-135b on human multiple myeloma cells via regulation of the Wnt/β-catenin/Versican signaling pathway // Cytokine. - 2021. - Vol. 142. - doi: 10.1016/j.cyto.2021.155495.
- Zhou F., Wang D., Zhou N. et al. Circular RNA Protein Tyrosine Kinase 2 Promotes Cell Proliferation, Migration and Suppresses Apoptosis via Activating MicroRNA-638 Mediated MEK/ERK, WNT/β-Catenin Signaling Pathways in Multiple Myeloma // Front Oncol. - 2021. - Vol. 11. doi: 10.3389/fonc.2021.648189.
- Liu Q., Ran R., Song M. et al. LncRNA HCP5 acts as a miR-128-3p sponge to promote the progression of multiple myeloma through activating Wnt/β-catenin/cyclin D1 signaling via PLAGL2 // Cell Biol Toxicol. - 2022. - Vol. 38, № 6. - P. 979–993.
- Liu X., Peng J., Zhou Y. et al. Silencing RRM2 inhibits multiple myeloma by targeting the Wnt/β catenin signaling pathway // Mol Med Rep. - 2019. - Vol. 20, № 3. - P. 2159-2166.
- Xu Y., Yang Z., Yuan H. et al. PCDH10 inhibits cell proliferation of multiple myeloma via the negative regulation of the Wnt/β-catenin/BCL-9 signaling pathway // Oncol Rep. - 2015. - Vol. 34, № 2. - P. 747–754.
- Qiang Y. W., Shaughnessy J. D., Yaccoby S. Wnt3a signaling within bone inhibits multiple myeloma bone disease and tumor growth // Blood. - 2008. - Vol. 112, № 2. - P. 374–382.
- Qiang Y.W., Endo Y., Rubin J. S. et al. Wnt signaling in B-cell neoplasia // Oncogene. - 2003. - Vol. 22, № 10. - P. 1536–1545.
- Bolzoni M., Donofrio G., Storti P. Myeloma cells inhibit non-canonical wnt co-receptor ror2 expression in human bone marrow osteoprogenitor cells: effect of wnt5a/ror2 pathway activation on the osteogenic differentiation impairment induced by myeloma cells // Leukemia. - 2013. - Vol. 27, № 2. - P. 451–463.
- Yao H., Ashihara E., Strovel J. W. et al. AV-65, a novel Wnt/β-catenin signal inhibitor, successfully suppresses progression of multiple myeloma in a mouse model // Blood Cancer J. - 2011. - Vol. 1, № 11. doi: 10.1038/bcj.2011.41.
- 66. Jin Y., Xu L., Wu X. et al. Synergistic Efficacy of the Demethylation Agent Decitabine in Combination with the Protease Inhibitor Bortezomib for Treating Multiple Myeloma Through the Wnt/β-Catenin Pathway // Oncology Research Featuring Preclinical and Clinical Cancer Therapeutics. - 2019. - Vol. 27, № 6. - P. 729–737.
- Savvidou I., Khong T., Cuddihy A. et al. β-Catenin Inhibitor BC2059 Is Efficacious as Monotherapy or in Combination with Proteasome Inhibitor Bortezomib in Multiple Myeloma // Mol Cancer Ther. - 2017. - Vol. 16, № 9. - P. 1765–1778.
- Savvidou I., Khong T., Whish S. et al. Combination of Histone Deacetylase Inhibitor Panobinostat (LBH589) with β-Catenin Inhibitor Tegavivint (BC2059) Exerts Significant Anti-Myeloma Activity Both In Vitro and In Vivo // Cancers (Basel). - 2022. - Vol. 14, № 3. - P. 840.
- Wang H., Gong Y., Liang L. et al. Lycorine targets multiple myeloma stem cell-like cells by inhibition of Wnt/β-catenin pathway // Br J Haematol. - 2020. - Vol. 189, № 6. - P. 1151–1164.


