Содержание и динамика в процессе лечения некоторых молекулярно-генетических маркеров в плазме крови у больных глиальными опухолями мозга по данным "жидкостной биопсии"
Автор: Регентова О.С., Щербенко О.И., Джикия Е.Л., Захаренко М.В., Сенчукова А.Л., Измайлов Т.Р., Кулинич Т.М., Боженко В.К.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Молекулярная медицина
Статья в выпуске: 2 т.20, 2020 года.
Бесплатный доступ
Диффузно растущие срединные глиомы (ДГСМ) у детей - высокозлокачественные опухоли с плохими клиническими исходами. Проведение хирургического лечения, даже в объеме стереотаксической биопсии, удается лишь в 12 -15% случаев ввиду расположении опухоли в жизненно важных структурах, а ребиопсия во время прогрессирования практически не возможна. Эти сложности можно преодолеть с помощью метода «жидкостной биопсии», который позволяет определить наличие в циркулирующей в плазме крови опухолевой ДНК (цоДНК) специфичных для глиальных опухолей молекулярно-генетических маркеров и проследить их динамику в процессе лучевой терапии с возможным использованием полученных данных в прогнозировании течения заболевания.
Глиома, диффузные опухоли ствола голосного мозга, цифровая капельная пцр (ddpcr, маркерные гены глиом idh1, циркулирующая в плазме крови опухолевая днк (цоднк)
Короткий адрес: https://sciup.org/149132123
IDR: 149132123
Текст научной статьи Содержание и динамика в процессе лечения некоторых молекулярно-генетических маркеров в плазме крови у больных глиальными опухолями мозга по данным "жидкостной биопсии"
Поиск генетических маркеров опухоли в биологических жидкостях является перспективным для разработки методов диагностики, прогнозирования, создания таргетных препаратов и персонификации методов лечения при опухолях центральной нервной системы [1]. Это особенно важно при диффузно растущих глиомах ствола мозга (ДГСМ), при которых процедуры получения образца ткани опухоли в ходе операции или биопсии связаны с опасностью развития тяжелых осложнений [2 – 4]. Эта форма опухолей остается наиболее тяжелой онкологической патологией в детском возрасте. Многолетние поиски вариантов лечения ДГСМ пока не привели к существенным сдвигам в результатах. Фактически единственным реальным методом помощи для этой категории детей остается лучевая терапия, позволяющая в 80 – 85% случаев получить уменьшение выраженности неврологических нарушений. Но у большинства больных достигаемый эффект имеет временный характер: через различные интервалы времени опухоль возобновляет рост и двухлетний срок переживают только 10 – 15% больных [5].
Достигнутые в последние годы успехи в использовании молекулярно-генетических характеристик опухоли для диагностики и прогнозирования течения эмбриональных опухолей мозга [6] дают надежду для достижения прогресса и при глиальных опухолях. Становится реальной перспектива использования информации о молекулярных особенностях глиом для прогнозирования течения, индивидуализации тактики и создания таргетных препаратов. В связи с этим нам представилось целесообразным при помощи метода «жидкостной биопсии» по циркулирующей в плазме крови опухолевой ДНК (цоДНК) изучить содержание и динамику в процессе лучевой терапии некоторых молекулярногенетических маркеров опухоли при ДГСМ и других локализациях глиом мозга у детей.
Задача исследования состояла в изучении при помощи цифровой капельной ПЦР (ddPCR) в цоДНК частоты встречаемости мутаций в маркерных генах глиом IDH1 , H3F3A , BRAF и их динамики в процессе лечения, а также в сопоставлении полученных данных об изменении концентраций этих маркеров в процессе лечения с дальнейшим течением заболевания в целях определения возможности их использования в планировании и индивидуализации лечения.
Материалы и методы
Были исследованы 146 образцов плазмы периферической крови, полученные от 60 пациентов, из них у 31 был установлен диагноз ДГСМ и у 29 – другие глиальные опухоли головного мозга. Определялось наличие или отсутствие мутаций BRAF (V600E), H3F3A (K27M) и IDH1 (R132H) в цоДНК, их концентрация и динамика в процессе лучевой терапии. Для подтверждения адекватности использования метода ddPCR в исследовании мутационного статуса опухоли, в 11 случаях результаты ddPCR сравнивались с результатами исследования мутационного статуса по гистологическим препаратам опухоли, полученных методом секвенирования нового поколения (NGS).
Высокочувствительный скрининг мутаций BRAF (V600E), H3F3A (K27M) и IDH1 (R132H) проводили методом Digital Droplet PCR (ddPCR) с использованием наборов BRAF V600Е Screening Kit (Bio-Rad, USA), ddPCR H3F3A (K28M) Screening Kit (Bio-Rad, USA) и ddPCR IDH1 (R132H) и Screening Kit (Bio-Rad, USA) и системы QX100™ Droplet Digital™ PCR System (Bio-Rad, США). Статистическую обработку результатов проводили с использованием пакета прикладных программ Microsoft Excel 2013 (Microsoft Corporation, США) и Statistica 10.0 (StatSoft Inc., США).
Результаты
При сравнении результатов исследования мутационного статуса по плазме крови 11 больных различными локализациями глиом методом ddPCR и их же гистологических препаратов, полученных в результате операции, методом NGS установлено полное совпадение как положительных, так и отрицательных данных. Это дало основание для использования метода ddPCR при оценке мутационного статуса опухоли по циркулирующей в плазме крови опухолевой ДНК.
По данным ddPCR выявлена достоверная разница в частоте обнаружения мутировавших генов при ДГСМ в сравнении с другими локализациями глиом (Табл.1).
Таблица 1. Сравнительная частота обнаружения соматических мутаций исследованных генов в плазме крови при диффузных опухолях ствола мозга и других локализациях глиом
|
Локализация опухоли |
Частота мутаций в исследованных генах (в %) |
||
|
IDH1 |
H3F3A |
BRAF |
|
|
Опухоль ствола мозга (n=31) |
58,1 |
51,6 |
61,3 |
|
Другие локализации глиом (n=29) |
20,0 |
33,3 |
33,3 |
Как видно из Табл. 1, при ДГСМ частота выявления мутаций во всех исследованных генах была почти в два раза выше, чем при других локализациях глиом.
При ДГСМ достоверно чаще, чем при глиомах других локализаций, встречалось одновременное сочетание мутаций в двух и трех генах (Табл. 2).
Таблица 2. Сочетание двух и трех мутаций в исследованных генах в зависимости от локализации опухоли
|
Локализация глиомы |
Сочетание мутаций в генах (%) |
||
|
BRAF + H3F3A |
H3F3A + IDH1 |
BRAF + IDH1 + H3F3A |
|
|
Глиомы ствола мозга |
36% |
42,4% |
32% |
|
Другие локализации глиом |
20% |
11,1% |
13,3% |
Так, сочетание мутаций в генах BRAF и H3F3A выявлено у 36% больных против 20% при других глиомах. Сочетание мутаций в генах H3F3A и IDH1 выявлено в 42,4% случаев против 11,1%. В 32% проб больных с ДГСМ имелось сочетание мутаций в трех генах, а при других глиомах это выявлено в 13,3% случаев. Скорее всего, природа такой разницы заключается в большем разнообразии гистологических форм опухолей ствола. Такие различия должны учитываться при разработке таргетных препаратов.
При сопоставлении частоты возобновления роста в объединенной группе из 47 случаев глиом всех локализаций с числом мутировавших генов установлено, что повышение частоты обнаружения мутаций гена BRAF коррелировало с более благоприятным течением процесса (Табл. 3). Однако при отдельном анализе частоты мутаций этого гена в группе больных с ДСГМ такой закономерности не обнаружено, что можно также объяснить гетерогенностью гистологических форм опухоли этой локализации.
Таблица 3. Корреляция между частотой выявления мутации BRAF(V600E) и частотой рецидивирования глиом всех локализаций
|
Возобновление роста опухоли |
Наличие мутации BRAF (V600E) (число случаев) |
Всего |
|
|
Мутации не выявлено |
Мутация выявлена |
||
|
Нет |
12 |
16 |
28 |
|
Имеется |
12 |
7 |
19 |
|
Всего |
24 |
23 |
7 |
В объединенной группе 42 больных с глиомами всех локализаций было изучена корреляция между частотой рецидивирования и частотой выявления мутации К27М в гене H3F3A (Табл.
Таблица 4. Корреляция между частотой выявления мутации K27M гена H3F3A и частотой рецидивирования глиомы всех локализаций
|
Возобновление роста опухоли |
Наличие мутации гена H3F3A (число случаев) |
Всего |
|
|
Мутации не выявлено |
Мутация выявлена |
||
|
Нет |
13 |
13 |
26 |
|
Имеется |
12 |
4 |
16 |
|
Всего |
25 |
17 |
42 |
Как видно из Табл. 4, выявляется обратная, чем в случае с геном BRAF , закономерность:
увеличение частоты выявления мутаций гена H3F3A коррелировало с худшим результатом лечения. При отдельном анализе по этому параметру больных с ДГСМ такой закономерности не обнаружено.
В целях выявления возможности прогнозирования течения заболевания по молекулярно-генетическим признакам нами было проведено исследование динамики содержания опухолевой ДНК в плазме крови больных ДГСМ в процессе лучевой терапии и после ее окончания. Для этого был проведен дискриминантный анализ, в котором в качестве переменных использованы данные о концентрации циркулирующих в плазме крови мутантных и дикого типа молекул опухолевой ДНК, а также ряд клинических данных. Было установлено, что по таким параметрам как возраст пациента, концентрация мутантной ДНК генов IDH1 и H3F3A , а также по соотношению мутантной ДНК к ДНК дикого типа с вероятностью до 92,8% можно прогнозировать вероятность раннего рецидива опухоли.
Прогностическую значимость имела также динамика концентрации в плазме крови генов с мутантной ДНК и ДНК дикого типа. Установлено, что соотношение концентрация ДНК гена BRAF с мутацией V600E у больных с более благоприятным течением опухоли увеличивается в начале курса радиотерапии и снижается к концу ее. У больных с ранним рецидивом опухоли к концу курса лечения концентрация этого мутантного гена, напротив, не изменяется или возрастает (Рис. 1).
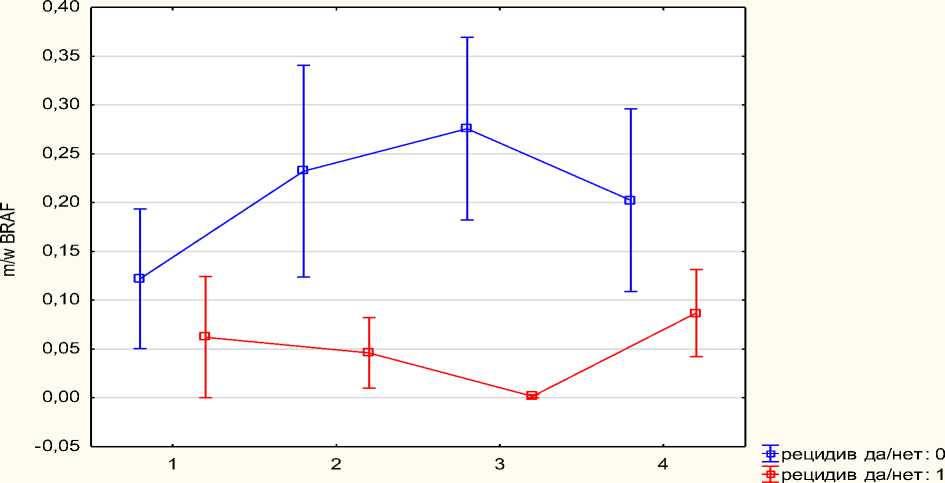
номер пробы
Рис.1. Динамика содержания мутантных форм ДНК гена BRAF в процессе лучевой терапии в зависимости от наличия или отсутствия прогрессирования опухоли.
Обсуждение
Полученные данные свидетельствуют, что с помощью метода «жидкостной биопсии» можно определить наличие в плазме крови цоДНК специфичных для глиальных опухолей молекулярно-генетических маркеров и проследить их динамику в процессе лучевой терапии с возможным использованием полученных данных в прогнозировании течения заболевания. Тот факт, что при ДГСМ, по сравнению с глиомами других локализаций, имелась более высокая частота обнаружения цоДНК можно объяснить заведомо большей гетерогенностью структуры ДГСМ, поскольку нами использовался материал от больных ДГСМ, не имевших гистологического подтверждения структуры опухоли, в отличие от группы больных с глиомами других локализаций, все из которых имели гистологическое подтверждение. Можно предположить, что в группе больных, получавших лечение по поводу ДГСМ , имели место больные не только с глиомами, но и с опухолями, имевшими другую морфологическую структуру, хотя их клинико-рентгенологическая картина полностью укладывалась в картину диффузно растущей опухоли ствола мозга. В любом случае различия в молекулярно-генетическом спектре ДГСМ требуют детализации этого спектра при разработке таргетных препаратов.
Различия в динамике содержания маркеров в процессе лучевой терапии у больных глиомами и ДГСМ могут быть также объяснены большей гетерогенностью структуры ДГСМ. Среди них, в частности, присутствуют опухоли, лучше поддающиеся ионизирующей радиации, в результате чего на первом этапе концентрация мутировавшей ДНК в плазме крови повышается, а по мере девитализации основной популяции клеток опухоли к концу курса лечения она снижается.
Анализ цоДНК методом цифровой ddPCR выявил более высокую частоту мутаций в генах BRAF , H3F3А , IDH1 по сравнению с опухолями, локализующимися в других частях мозга (p<0,05). На основании анализа динамики уровней концентрации мутантной цоДНК в процессе лечения возможно предсказание рецидива опухоли после лучевой терапии с достоверностью 96%.
Выводы
-
1. С помощью метода ddPCR возможно выявление в плазме крови ряда молекулярногенетических параметров глиом мозга, имеющих прогностическое значение.
-
2. Относительная концентрация мутаций BRAF (V600E), IDH1 (R132H), H3F3A (К27М) в плазме крови больных диффузно растущими опухолями ствола мозга выше, чем при глиомах других локализаций и отличается большим разнообразием комбинаций, что свидетельствует о большем морфологическом полиморфизме опухолей при данной локализации.
-
3. Повышение концентрации в плазме крови мутантной формы BRAF (V600E) и снижение концентрации мутантной формы гена H3F3A (К27М) коррелирует с лучшим прогнозом.
Список литературы Содержание и динамика в процессе лечения некоторых молекулярно-генетических маркеров в плазме крови у больных глиальными опухолями мозга по данным "жидкостной биопсии"
- Fontanilles M., Duran-Peña A., Idbaih A. Liquid Biopsy in Primary Brain Tumors: Looking for Stardust! Curr Neurol Neurosci Rep. 2018. V.18. No. 3. Article ID 13. 10.1007/s11910- 018-0820-z. DOI: 10.1007/s11910-018-0820-z
- Pfaff E., El Damaty A., Balasubramanian G.P., et al. Brainstem biopsy in pediatric diffuse intrinsic pontine glioma in the era of precision medicine: the INFORM study experience. Eur J Cancer. 2019. V. 114. P. 27-35. DOI: 10.1016/j.ejca.2019.03.019
- Щербенко О.И., Кумирова Э.В., Регентова О.С. "Жидкостная биопсия" при опухолях мозга. Российский журнал детской гематологии и онкологии. 2019. Т. 6. № 2. С. 61-67.
- Panditharatna E., Kilburn L.B., Aboian M.S., et al. Clinically Relevant and Minimally Invasive Tumor Surveillance of Pediatric Diffuse Midline Gliomas Using Patient-Derived Liquid Biopsy. Clin Cancer Res. 2018. V. 24. No. 23. P. 5850-5859. DOI: 10.1158/1078-0432.CCR-18-1345
- Veldhuijzen van Zanten S.E.M., Baugh J., Chaney B., et al. Development of the SIOPE DIPG network, registry and imaging repository: a collaborative effort to optimize research into a rare and lethal disease. J Neurooncol. 2017. V. 132. No. 2. P. 255-266. DOI: 10.1007/s11060-016-2363-y
- Kumar R., Liu A.P., Orr B.A., et al. Advances in the classification of pediatric brain tumors through DNA methylation profiling: From research tool to frontline diagnostic. Cancer. 2018. V. 124. No. 21. P. 4168-4180. DOI: 10.1002/cncr.31583


