Способы ручной разметки бипараметрической МРТ предстательной железы: что предпочтительней для текстурного анализа?
Автор: Васильев Ю.А., Романенко М.О., Коденко М.Р., Блохин И.А., Сидоров А.Д., Гележе П.Б., Сучилова М.М., Скоробогач И.М., Мынко О.М., Войтенко Д.А., Насибян Н.М., Решетников Р.В., Владзимирский А.В., Омелянская О.В.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Оригинальная статья. Лучевая диагностика
Статья в выпуске: 4 т.25, 2025 года.
Бесплатный доступ
Обоснование. Текстурный анализ является динамично развивающимся направлением в диагностике рака предстательной железы. Существуют различные подходы к сегментации простаты при проведении текстурного анализа. Полуавтоматические и автоматические алгоритмы сегментации патологических очагов простаты на сегодняшний день зачастую недоступны рядовому пользователю. В связи с этим есть необходимость в определении оптимального метода ручной сегментации для быстрого и воспроизводимого извлечения текстурных признаков. Цель — выбор оптимального ручного инструмента разметки бпМРТ предстательной железы для последующего текстурного анализа. Материалы и методы. В ретроспективное исследование включено 59 бпМРТ, выполненных по стандарту PI-RADS 2.1, содержащих очаги предстательной железы категорий PI-RADS 3, 4, 5. Два врача-рентгенолога независимо друг от друга сегментировали очаги предстательной железы в программном обеспечении 3D Slicer с применением инструментов: контурная кисть (Draw), обычная кисть в виде круга (Paint, ROI) и сферы (Paint, VOI). Одновременно осуществлялся подсчет времени разметки каждым методом при помощи макроса Microsoft Excel оригинальной разработки. Было рассчитано время разметки каждым способом и проведено их сравнение между собой. Последний этап исследования заключался в извлечении текстурных признаков из тестовой разметки и сравнении их с эталонными данными из ранее проведенного нами исследования. Результаты. Медиана времени разметки контурной кистью составила 34,2 (18;67,8) секунд для разметчика 1 и 31,8 (19,2;55,2) секунд для разметчика 2. При использовании кисти в виде круга время разметки составило 27 (16,8;45) секунд для разметчика 1 и 30 (18;49,8) секунд для разметчика 2, кисти в виде сферы — 16,8 (13,8;19,8) и 16,2 (10,8;19,2) секунд соответственно. Наиболее быстрым методом сегментации для обоих разметчиков стала кисть в виде сферы (p<0,05). Получено 3 текстурных признака (3%), воспроизводимых между консенсусной разметкой и разметкой, полученной с использованием инструмента «сфера». Заключение. Использование кисти в виде сферы (VOI) значительно упрощает и ускоряет процесс сегментации по сравнению с традиционной контурной кистью, при этом уменьшая количество воспроизводимых текстурных показателей. В ходе исследования определены два текстурных показателя, устойчивых к вариабельности разметки.
Магнитно-резонансная томография, очаговые изменения предстательной железы, сегментация, разметка, радиомика
Короткий адрес: https://sciup.org/149149996
IDR: 149149996 | DOI: 10.24412/1999-7264-2025-4-24-37
Текст научной статьи Способы ручной разметки бипараметрической МРТ предстательной железы: что предпочтительней для текстурного анализа?
Рак предстательной железы остаётся самым распространённым видом злокачественных опухолей у мужчин [1]. На сегодняшний день наиболее эффективным методом диагностики патологических изменений в предстательной железе является мультипараметрическая магнитно-резонансная томография (мпМРТ) с применением системы оценки PI-RADS v2.1 [2]. Согласно критериям PI-RADS v2.1, проведение мпМРТ предстательной железы требует обязательного использования динамического контрастного усиления (ДКУ). Однако у этого метода есть свои недостатки: он увеличивает время сбора данных, усложняет анализ исследований из-за требований к постобработке изображений, а также может вызывать накопление гадолиния в различных тканях и повышать риск системного нефрогенного фиброза у пациентов с почечной недостаточностью.
Значение ДКУ для детекции злокачественных новообразований предстательной железы является спорным [3-5]. Бипараметрическая МРТ (бпМРТ), в отличие от мпМРТ, не содержит в своем протоколе выполнение динамического контрастного усиления [3]. Несмотря на это, бпМРТ показала соизмеримые результаты с мпМРТ по данным целого ряда исследований. В работе Kuhl и соавт. [3] диагностическая точность мпМРТ по выявлению клинически значимого рака простаты составила 87,2 %, в то время как точность бпМРТ была равна 89,1%. По данным публикации Wallström и соавт. [4] бпМРТ также не уступала мпМРТ в обнаружении рака простаты –диагностическая точность составила 64,8% и 61,8% для мпМРТ и бпМРТ соответственно. В публикации Васильева Ю.А. и соавт. [5] диагностическая точность бмМРТ и мпМРТ для рентгенологов с различным опытом была равна 51,9-68,2% и 49-70,1% соответственно.
Роль МРТ в диагностике злокачественных новообразований предстательной железы может быть значительно увеличена благодаря использованию текстурного анализа данных МРТ-исследований [6]. Этот метод, находящийся на стыке медицинской визуализации и 26
математического моделирования, позволяет классифицировать очаги по текстурным признакам из интересующей области. При планировании текстурного анализа применяются различные подходы к сегментации органа. Ручная сегментация представляет собой процесс создания пользователем маски анатомического объекта без использования автоматических алгоритмов [7]. Однако ручная разметка изображений в медицинской визуализации имеет ряд ограничений. В первую очередь, она требует больших трудозатрат и времени, что приводит к тому, что многие клинические исследования проводятся на небольших выборках данных [8]. Кроме того, существенным недостатком ручной сегментации является значительное расхождение в масках как между разными разметчиками, так и между различными масками одного и того же разметчика [9].
Предпочтительными методами сегментации являются автоматические. Они отличаются высокой скоростью и хорошей воспроизводимостью. Под воспроизводимостью в данном контексте понимается возможность получения максимально похожих масок изображений лучевой диагностики при использовании одного и того же метода сегментации для конкретного исследования. Автоматические методы сегментации не требуют непосредственного участия человека в процессе выделения анатомических объектов. Кроме того, существуют полуавтоматические методы разметки, которые сочетают в себе элементы ручного и полуавтоматического подходов. В полуавтоматических методах пользователь задает только начальные требования к итоговой маске (например, выбирает область интереса), а дальнейшую обработку изображения осуществляет алгоритм. В настоящее время разработаны алгоритмы машинного обучения, которые могут автоматически выделять патологический участок в предстательной железе [10,11]. Однако их практическое применение в повседневной медицине ограничено, в связи с тем, что автоматизированные рабочие места врачей-рентгенологов не приспособлены для установки и запуска таких алгоритмов по нескольким причинам. К ним относятся обеспечение безопасности медицинских данных и соответствие используемого оборудования нормативным и техническим требованиям [12].
Исходя из вышесказанного, возникает необходимость в выборе оптимального метода сегментации, который бы позволял быстро и точно извлекать текстурные признаки и был бы широко доступен в повседневной практике. Это, в свою очередь, упростит проведение крупномасштабных многоцентровых исследований, направленных на повышение диагностической точности радиомических моделей [13]. В долгосрочной перспективе это приведет к более широкому распространению текстурного анализа среди лучевых диагностов и клиницистов. В нашем исследовании мы сравнили три метода ручной разметки патологических участков предстательной железы, используя открытое и бесплатное программное обеспечение 3D Slicer, на основе набора данных бпМРТ, прошедших гистологическую верификацию. Исходя из вышеизложенного, существует потребность в определении оптимального метода сегментации для быстрого и воспроизводимого извлечения текстурных признаков, который будет широко доступен в рутинной практике. Это облегчит проведение проспективных крупномасштабных многоцентровых исследований для улучшения диагностической точности радиомических моделей [13], что в перспективе позволит повысить приверженность лучевых диагностов и клиницистов к использованию текстурного анализа.
Цель исследования — выбор оптимального ручного инструмента разметки бпМРТ предстательной железы для последующего текстурного анализа.
Материалы и методы
Дизайн исследования
Данная работа является ретроспективным исследованием точности сегментации патологических очагов. Для достижения цели исследования проводили проверку ряда гипотез (Таблица 1).
Табл. 1. Нулевая (H0) и альтернативная гипотезы исследования (Ha)
H0 Ha
|
1 |
Время разметки при использовании трех методов ручной сегментации (контурная кисть, обычная кисть в виде круга, обычная кисть в виде сферы) статистически значимо не различается. |
Время разметки при использовании трех методов ручной сегментации (контурная кисть, обычная кисть в виде круга обычная кисть в виде сферы) статистически значимо различается. |
|
2 |
Время разметки одним и тем же инструментом ручной сегментации статистически значимо не различается между двумя врачами-рентгенологами. |
Время разметки одним и тем же инструментом ручной сегментации статистически значимо различается между двумя врачами-рентгенологами. |
|
3 |
Текстурные признаки статистически значимо не различаются между консенсусной* и тестовой** разметкой для инструмента «обычная кисть в виде сферы». |
Текстурные признаки статистически значимо различаются между консенсусной* и тестовой** разметкой для инструмента «обычная кисть в виде сферы». |
*Консенсусная разметка – маски анатомических объектов, сегментированные вручную двумя разметчиками с применением алгоритма достижения консенсуса [14].
** Тестовая разметка – маски патологических очагов предстательной железы, созданные двумя врачами-рентгенологами в ходе настоящего исследования с использованием трех разных методов ручной сегментации.
Критерии включения: наличие бпМРТ с Т2-ВИ, ДВИ, ИКД в аксиальной плоскости; клиническая информация об уровнях свободного и связанного простатспецифического антигена крови; проведённая таргетная МРТ/ТрУЗИ фьюжн-биопсия при соблюдении временного интервала между МРТ и биопсией не более 14 дней, наличие одного или нескольких очагов, соответствующих градации PI-RADS 3 и выше в периферической или переходной зоне предстательной железы.
Критерии невключения: технические артефакты бпМРТ; отсутствие одного или нескольких клинических маркеров; увеличенный временной интервал между проведением МРТ и биопсией; отсутствие гистологически верифицированного рака предстательной железы по данным фьюжн-биопсии.
Критерии исключения: выраженные артефакты МРТ, не позволяющие адекватно оценить исследование, а также неинформативные результаты биопсии.
Исследование выполнено в Исследовательском центре – Государственном бюджетном учреждении здравоохранения «Научно-практический клинический центр диагностики и телемедицинских технологий Департамента здравоохранения города Москвы» на клинической базе – акционерном обществе «Европейский Медицинский Центр» в период с 01.05.2024 года по 31.12.2024 года.
На проведение исследования получено согласие локального этического комитета АО «Европейский Медицинский Центр» (протокол заседания №1 от 24.04.2023 г.).
Для исследования был использован набор данных [15]. Набор данных включал в себя бпМРТ предстательной железы 126 пациентов, выполненных на томографе Siemens Aera 1,5 T 4G (Германия) с использованием катушки для тела. Протокол сканирования включал в себя следующий набор импульсных последовательностей (Табл. 2).
Табл. 2. Протокол бпМРТ предстательной железы
|
Импульсная |
Ориентация |
TE/TR |
FOV (мм) |
Размер |
Толщина |
Ориентиров |
|
последова |
срезов |
(мсек) |
пикселя |
среза/ |
очное время |
|
тельность |
(мм) |
перекрытие (мм) |
сканирован ия (мин) |
|||
|
Т2-ВИ TSE |
аксиальная |
110/3938 |
180 × 180 |
0,45 × 0,6 |
2,5/0 |
3:33 |
|
ДВИ SS-EPI |
аксиальная |
87/2425 |
160 × 160 |
1,25 × 1,32 |
3/0,3 |
6:50 |
В документации к набору данных содержалась информация о выявленных патологических очагах периферической зоны предстательной железы от PI-RADS 3 и выше. На этапе планирования исследования одним из экспертов были подготовлены референсные изображения для всех бпМРТ со схематически отмеченными патологическими очагами предстательной железы на одном срезе. В ходе подготовки изображений эксперт ориентировался на категорию PI-RADS очага и результаты фьюжн-биопсии. Данный шаг обеспечил корректное сопоставление масок очагов между двумя экспертами в случае мультицентрических форм рака. До начала настоящего исследования с момента подготовки референсных изображений прошел временной интервал более 6 месяцев, что позволило избежать предвзятости эксперта.
Первым этапом стало создание эталона сегментации патологических очагов периферической зоны предстательной железы. В роли экспертов выступили два врача-рентгенолога с опытом работы в области урогенитальной лучевой диагностики 9 и 12 лет соответственно. Используя расширение mpReview в общедоступном программном обеспечении 3D Slicer, эксперты независимо друг от друга разметили патологические очаги периферической зоны предстательной железы при помощи контурной кисти (инструмент Draw). По истечении периода забывания продолжительностью 1 месяц были получены итоговые маски (консенсусная разметка, ground truth) с помощью разработанного алгоритма достижения консенсуса [14].
Вторым этапом осуществлялась тестовая разметка двумя врачами-рентгенологами с опытом работы в урогенитальной лучевой диагностике 3 и 4 года (разметчик 1 и разметчик 2). Для разметки применялось расширение mpReview в программном обеспечении 3D Slicer. Врачи-рентгенологи независимо друг от друга, а также без предварительного ознакомления с консенсусной разметкой, выполнили оконтуривание очагов, соответствующих критериям PI-RADS 3, 4, 5, используя контурную кисть (инструмент Draw) (Рис. 1) и обычную кисть (инструмент Paint) в виде круга (region of interest – ROI) и сферы (volume of interest – VOI). Используя инструмент Paint в виде круга (ROI), рентгенолог закрашивал зону интереса на одном срезе или нескольких срезах поочередно (Рис. 2). При применении инструмента Paint в виде сферы (VOI) (Рис. 3) разметчик выбирал необходимый диаметр и выделял область интереса (Рис. 3), то есть часть очага с визуально наиболее выраженными изменениями. Если очаг имел неправильную или овоидную форму, диаметр сферы выбирался исходя из наибольшего поперечного размера очага во избежание включения окружающих неизмененных тканей в маску. В тех случаях, когда диаметр сферы был равен толщине среза, в связи с техническими ограничениями VOI заменялся ROI. На примере используемого в нашем исследовании набора данных с указанной толщиной среза (Табл. 1) пограничным диаметром сферы являлся 8 миллиметров. При наличии нескольких патологических очагов в одном исследовании сегментация очагов производилась в соответствии с референсными изображениями и осуществлялась поочередно, начиная с правой доли простаты и продвигаясь сверху вниз. Такой порядок сегментации способствовал исключению несоответствий в масках конкретного очага между двумя экспертами в случаях мультицентрических форм. Результирующая маска и серии изображений (Т2-ВИ, ДВИ, ИКД) сохранялись в формате NIfTI (.nii). Время оконтуривания очага каждым методом разметки измерялось при помощи макроса Microsoft Excel оригинальной разработки. При нажатии кнопок «Старт» и «Финиш» фиксировалось текущее время рабочей станции; время разметки вычислялось как арифметическая разница между двумя нажатиями.
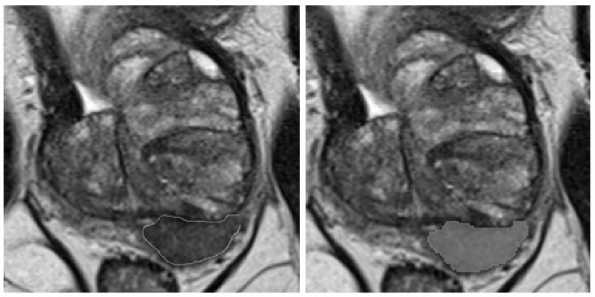
Рис. 1. Контурная кисть. Для создания маски очага разметчик выбирал инструмент Draw и поочередно оконтуривал очаг на всех срезах.
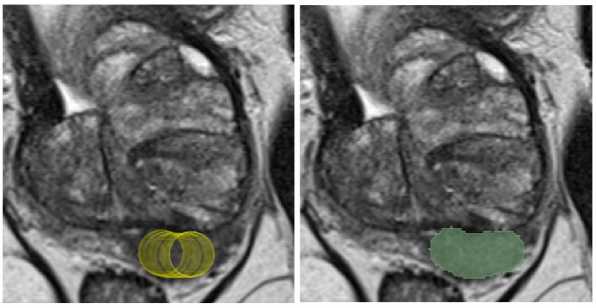
Рис. 2. Обычная кисть в виде круга (ROI). Для создания маски очага разметчик выбирал инструмент Paint в виде круга (ROI) и поочередно выделял очаг на всех срезах.
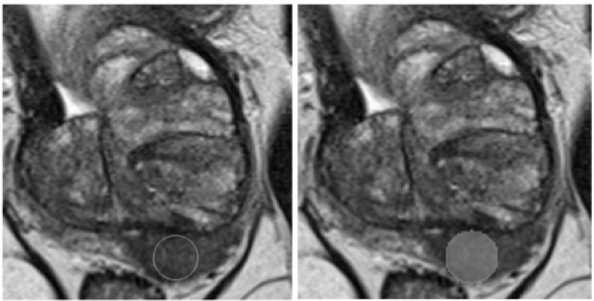
Рис. 3. Обычная кисть в виде сферы (VOI). Для создания маски очага разметчик выбирал инструмент Paint в виде сферы (VOI) и выделял область интереса.
Третий этап заключался в извлечении текстурных признаков с помощью общедоступного приложения pyRadiomics 3.1.0 [16]. Параметр binWidth был равен 25, параметр SymmetricalGLCM равен True.
Статистический анализ
Распределение данных по времени разметки тремя методами для двух рентгенологов представлено в виде медианы и межквартильного интервала (Q1; Q3). Для оценки нормальности распределения был использован тест Шапиро-Уилка. Для попарного сравнения времени разметки каждым из трех методов между двумя разметчиками использовался тест Вилкоксона с поправкой Бонферрони-Холма, с оценкой согласия между двумя экспертами (каппа Коэна). Для сравнения времени сегментации тремя методами сегментации для каждого врача-рентгенолога по отдельности был использован тест
Фридмана с поправкой Бонферрони-Холма (Т-критерий Вилкоксона). Для сравнения выборок извлеченных текстурных признаков из консенсусной и тестовой разметок применялся тест Вилкоксона с поправкой Бонферрони-Холма. Уровень значимости принятия статистических гипотез был выбран равным 0,05. Расчеты производились в программном обеспечении RStudio (версия 4.1.2).
Обоснование размера выборки
При ожидаемой разнице во времени разметки в 20%, выбранной эмпирически авторским коллективом, при использовании трех разных инструментов ручной сегментации, выборка, состоящая из 52 патологических очагов, будет достаточной для обеспечения статической мощности 80% при вероятности ошибки I рода 0,05 [17].
Результаты
Из набора данных [15] были отобраны 64 бпМРТ, выполненных по стандарту PI-RADS 2.1, содержащих 69 патологических очагов предстательной железы, соответствующих критериям PI-RADS 3, 4, 5. По техническим причинам из анализа были исключены 5 бпМРТ, содержащих 6 патологических очагов; итого получено 59 бпМРТ, содержащих 63 патологических очага (Рис. 4).

Рис. 4. Сбор данных.
Как значения времени, так и значения радиомических признаков имели распределение данных, отличное от нормального (p-value<0,05). Среднее время разметки каждым методом (контурная кисть и обычная кисть в виде круга и сферы) для двух врачей-рентгенологов отображено в таблице 3. При сравнении времени разметки тремя инструментами для каждого врача-рентгенолога время сегментации статистически значимо различалось для обоих разметчиков (p-value<0,05). Наиболее быстрым методом сегментации для обоих разметчиков стала обычная кисть в виде сферы (VOI) – медиана времени разметки для рентгенолога 1 составила 16,8 (13,8;19,8) секунд, для рентгенолога 2 – 16,2 (10,8;19,2) секунд. T-критерий Вилкоксона для данных выборок показал, что для обоих разметчиков определяется статически значимая разница (p-value<0,0001) во времени сегментации между сферой и двумя другими методами разметки.
Табл. 3. Среднее время разметки каждым методом двумя врачами-рентгенологами
|
Контурная кисть, сек |
Обычная кисть в виде круга (ROI), сек |
Обычная кисть в виде сферы (VOI), сек |
|
|
Рентгенолог 1 |
34,2 (18;67,8) |
27 (16,8;45) |
16,8 (13,8;19,8) |
|
Рентгенолог 2 |
31,8 (19,2;55,2) |
30 (18;49,8) |
16,2 (10,8;19,2) |
Примечание: результаты представлены в виде медианы и межквартильного интервала (Q1; Q3). Жирным выделены показатели, для которых наблюдали статистически значимые отличия от других подходов по скорости разметки.
Время сегментации с использованием контурной кисти и обычной кисти в виде сферы (VOI) статистически значимо различалось между двумя разметчиками (p-value<0,05) (Табл. 4) – разметчик 2 в среднем быстрее осуществлял сегментацию очаговых изменений простаты с использованием данных инструментов. При использовании разметчиками обычной кисти в виде круга (ROI) отмечалось исчезновение статистически значимой разницы во времени сегментации (p-value>0,05) (Табл. 4), что позволяет заявить об отсутствии оператор-зависимости во времени сегментации данным методом. Каппа Коэна для всех инструментов составила менее 0,05, что говорит о слабом или незначительном согласии во времени разметки между экспертами при использовании всех трех инструментов.
Табл. 4. Сравнение методов разметки попарно между двумя рентгенологами
|
Контурная кисть |
Обычная кисть виде круга (ROI) |
в Обычная кисть в виде сферы (VOI) |
|
|
p-value |
P=0,002 |
P=0,9 |
P=0,009 |
Для того, чтобы определить, существует ли набор текстурных признаков, не зависящий от оператора и метода разметки, были извлечены признаки из консенсусной [13] и тестовой разметок. Тестовая разметка включала в себя текстурные признаки, полученные из масок, сегментированных двумя рентгенологами с использованием трех инструментов. Извлечение признаков производилось изо всех импульсных последовательностей – T2-ВИ, ДВИ и ИКД. Было получено 107 признаков для каждой пары «исследование-маска». Далее проводилось попарное сравнение консенсусной разметки с каждым из наборов тестовой разметки с использованием теста Вилкоксона с поправкой Бонферрони-Холма. Дополнительно для оценки межэкспертной вариабельности происходило попарное сравнение разметки каждым инструментом между двумя экспертами.
Для инструмента «сфера» количество воспроизводимых текстурных признаков составило 3 (3%) – это original_glrlm_RunLengthNonUniformityNormalized, original_glrlm_RunPercentage и original_glszm_SmallAreaEmphasis, которые являются признаками 2-го порядка. В то же время, количество воспроизводимых признаков при использовании кисти в виде круга составило 12% (n=13), в случае контурной кисти – 20% признаков (n=22).
Среди признаков, устойчивых как к разным операторам, так и разным методам разметки, было получено 2 воспроизводимых признака (2%) (p-value>0,05) – это original_glrlm_RunLengthNonUniformityNormalized и original_glrlm_RunPercentage.
Обсуждение
Резюме основного результата исследования
В ходе исследования было проведено сравнение трех методов ручной разметки патологических очагов на исследованиях бпМРТ предстательной железы с подсчетом удельного времени сегментации. При использовании инструмента «сфера» отмечалось уменьшение времени сегментации практически в 2 раза в сравнении с контурной кистью (p<0,05). В результате сравнения выборок извлеченных текстурных признаков из консенсусной и тестовой разметки, полученной с использованием «сферы», получено 3 воспроизводимых признака (3%) – признаки 2-го порядка. При этом для инструмента контурная кисть количество воспроизводимых признаков составило 22 (20%), для кисти в виде круга – 13 (12%). Среди признаков, устойчивых как к разным операторам, так и разным методам разметки, было получено 2 воспроизводимых признака (2%). Таким образом, «сфера» является самым быстрым инструментом, но при этом уступает другим ручным инструментам по количеству воспроизводимых текстурных признаков.
Обсуждение основного результата исследования
В нашем исследовании было проведено сравнение трех методов ручной сегментации на примере очаговых изменений предстательной железы. Актуальность данной работы обусловлена тем, что ручная сегментация очагов простаты на сегодняшний день все ещё является востребованным инструментом ввиду низкой контрастности данных очагов, в особенности очагов градации PI-RADS 3. Инструменты ручной разметки широко представлены в различных программах по сегментации биомедицинских изображений, например, в открытом бесплатном программном обеспечении 3D Slicer.
Тем не менее скрупулезная ручная разметка является трудоемким процессом и требует больших временных затрат [7], сильно усложняя создание наборов данных для проведения радиомического анализа и внедрение радиомики в рутинную практику. Применение различных вариантов ручной разметки может значительно упростить процесс сегментации, потенциально не снижая при этом точность радиомической модели. В мировой литературе на сегодняшний день не представлено исследований по сравнению различных методов ручной сегментации.
В ходе нашего исследования было проведено сравнение времени сегментации тремя ручными инструментами, доступными в 3D Slicer – контурной кисти (Draw) и обычной кисти в виде круга (Paint, ROI) и сферы (Paint, VOI). Значимого ускорения процесса сегментации при использовании инструмента кисть в виде круга в сравнении со стандартной контурной кистью не отмечалось. Применение же кисти в виде сферы позволило сократить время сегментации практически в 2 раза в сравнении с контурной кистью (p<0,05).
Однако маски, созданные с помощью инструмента «сфера», могут значительно отличаться по своему объему от эталонных данных и, соответственно, по набору извлеченных текстурных показателей. В ходе нашего исследования было определено, что подавляющее большинство (97%) текстурных признаков статистически значимо различаются между консенсусной разметкой [14] и разметкой, полученной с применением «сферы», значительно уступая другим ручным инструментам.
Таким образом, инструмент кисть в виде сферы является быстрым и удобным инструментом сегментации очаговых изменений предстательной железы, основным недостатком которого является получение гораздо меньшего количества воспроизводимых текстурных признаков. В дальнейшем, при разметке очагов простаты данным инструментом, на этапе отбора радиомических признаков и редукции их числа с последующим построением диагностической модели [18], полученные нами признаки могут учитываться как наиболее устойчивые к вариабельности разметки.
Ограничения исследования
Наше исследование имеет несколько ограничений. В первую очередь, используемый метод подсчета времени разметки с помощью макроса оригинальной разработки Microsoft Excel мог приводить к увеличению временных затрат ввиду необходимости переключаться между окнами 3D Slicer и Excel. Однако, на наш взгляд, временная разница, возникавшая при переключении между окнами, была незначимой и распространялась в равной степени на все методы разметки. В будущем требуется поиск иных подходов к измерению времени разметки, например, создание дополнительного расширения для 3D Slicer с автоматическим подсчетом времени, затрачиваемого при выполнении различных действий на рабочей станции. Во-вторых, при разметке небольших очагов простаты, когда диаметр сферы был равен толщине среза, VOI автоматически заменялся ROI в связи с техническими ограничениями, что потенциально могло приводить к уменьшению количества текстурных признаков, извлеченных из данного патологического очага. В связи с тем, что разметчики выбирали область очага с наиболее выраженными изменениями, такая замена, по нашему мнению, не должна была оказывать значимого влияния на полученные текстурные показатели.
Заключение
Ручная разметка на сегодняшний день – самый доступный метод сегментации очаговых изменений предстательной железы. Применение такого инструмента, как обычная кисть в виде сферы, значительно упрощает и ускоряет процесс сегментации по сравнению с контурной кистью, при этом значительно уменьшая количество воспроизводимых признаков. При анализе текстурных показателей, извлеченных из эталонных данных и масок, сегментированных инструментом кисть в виде сферы, получено 3 устойчивых к вариабельности разметки текстурных признака, которые могут учитываться в процессе отбора текстурных признаков и дальнейшем построении радиомической модели.
Вклад авторов . Авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение поисково-аналитической работы и подготовку статьи, прочли и одобрили финальную версию перед публикацией). Наибольший вклад распределён следующим образом: Ю.А. Васильев ― концепция исследования; Романенко М.О. ― написание текста статьи, анализ данных, разметка данных; Коденко М.Р., Сидоров А.Д., Войтенко Д.А. ― статистический анализ; И.А. Блохин ― редактирование текста рукописи, анализ данных; П.Б. Гележе ― анализ данных; Сучилова М.М. ― разметка данных; Скоробогач И.М. ― разметка данных; Мынко О.И., Насибян Н.М. – анализ данных; Решетников Р.В. – редактирование текста рукописи; А.В. Владзимирский, О.В. Омелянская ― концепция исследования.
Декларация по этике. Исследование проводилось в соответствии с принципами Хельсинкской декларации. На проведение исследования получено согласие локального этического комитета АО «Европейский Медицинский Центр» (протокол заседания №1 от 24.04.2023 г.).
Источник финансирования . Данная статья подготовлена авторским коллективом в рамках НИР «Научное обоснование методов лучевой диагностики опухолевых заболеваний с использованием радиомического анализа», (№ ЕГИСУ: № 123031500005-2).


