Связь клинических проявлений остеоартроза с изменением уровня адипонектина крови
Автор: Копылова Д.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.27, 2012 года.
Бесплатный доступ
Цель исследования: оценить взаимосвязь изменения уровня адипонектина и клинических особенностей остеоартроза. Обследован 81 пациент в возрасте от 47 до 73 лет. У всех больных оценивались антропометрические показатели, длительность заболевания, степень функциональной недостаточности, уровень адипонектина, проводилось рентгенологическое исследование суставов. Определяли степень влияния изменения секреции адипонектина на характер течения остеоартроза и выраженность болевого синдрома. Пониженный уровень адипонектина ассоциировался с более тяжелыми рентгенологическими изменениями, большей функциональной недостаточностью суставов, наличием синовита и выраженным болевым синдромом. Снижение уровня адипонектина ассоциировалось с неблагоприятным течением остеоартроза.
Остеоартроз, воспаление, адипонектин
Короткий адрес: https://sciup.org/14919703
IDR: 14919703 | УДК: 616.72-002-056.25-036.1-092
Текст научной статьи Связь клинических проявлений остеоартроза с изменением уровня адипонектина крови
Остеоартроз (ОА) является серьезной медицинской проблемой из-за высокой частоты распространения среди населения большинства стран. В Российской Федерации ежегодно впервые диагностируются до 700 тыс. новых случаев воспалительных и дегенеративных заболеваний суставов [5]. Медленное, но в большинстве случаев неуклонное прогрессирование клинических и рентгенологических проявлений болезни приводит к постепенному снижению качества жизни больных [3, 4]. Кроме того, заболевание ОА сопряжено с поражением легочной и сердечно-сосудистой систем, что у женщин ведет к значительному – до 10–12 лет – сокращению продолжительности жизни [12]. Несмотря на некоторые успехи, достигнутые в понимании патогенеза остеоартроза, терапия данного заболевания зачастую остается симптоматической, а потому малоэффективной.
В ряде работ высказывается предположение о том, что адипонектин может действовать как защитный фактор при ОА [8]. Считается, что адипонектин регулирует иммунные и воспалительные механизмы, и таким образом может регулировать выраженность воспалительного про- цесса и болевой синдром, уменьшая продукцию провос-палительных цитокинов [9]. В связи с этим изучение возможного участия адипонектина в патогенезе остеоартроза представляется перспективным.
Цель исследования: оценить взаимосвязь между изменениями уровня адипонектина и клиническими проявлениями остеоартроза.
Материал и методы
На базе Городской клинической больницы № 4 Омска обследован 81 пациент в возрасте от 47 до 73 лет, из них 42 мужчины и 39 женщин. Медиана возраста составила 58 лет (53; 62).
Для верификации диагноза проводили клинические и инструментальные исследования пациентов. Диагноз синовита устанавливали на основании клинических критериев, разработанных в НИИР РАМН (1993): боль в покое и при движении, изменение ритма болей, болезненность при пальпации в проекции суставной щели, местное повышение температуры кожи над пораженным суставом, дефигурация, появление или нарастание утренней скованности в суставе, а также данных ультразвукового исследования суставов. Диагноз экссудативного синовита выставлялся при наличии жидкости в полости сустава; пролиферативного синовита – при наличии утолщения синовиальной оболочки до 2–3 мм. Выраженность болевого синдрома оценивали по Визуальной аналоговой шкале (ВАШ) по 10-балльной системе. Определяли также индекс Lequesne и индекс WOMAC (Western Ontario and McMaster University) [3]. Обследование суставов выполняли на цифровом рентгенологическом аппарате “Phillips”. Рентгенологические стадии ОА оценивали в соответствии с классификацией J.H. Kellgeren и J.S. Lawrens [7]. Клинический диагноз остеоартроза формулировали согласно критериям R. Altman [7].
Уровень адипонектина в сыворотке крови оценивали непрямым твердофазным иммуноферментным методом с использованием набора RD191016100 Human Adiponeсtin ELISA (BioVendor, Czech Republic). За нормальные значения для мужчин принимали уровень адипонек-тина 9,5 мкг/мл, для женщин –13,2 мкг/мл.
В работах ряда ученых показано, что протективные эффекты адипонектина значительно уменьшаются при снижении его концентрации ниже 2 мкг/мл [8]. В связи с этим всех пациентов, в зависимости от содержания гормона в крови, разделили на 2 группы. В I группу вошло 48 пациентов со значительно сниженным уровнем адипо-нектина (до 1,9 мкг/мл и ниже), во II – 33 пациента с более высоким уровнем (2–10,2 мкг/мл).
Критериями исключения из исследования явились: ревматоидный артрит либо другие системные заболевания соединительной ткани; онкологические, инфекционные, гематологические, метаболические, эндокринные заболевания, а также патология со стороны желудочнокишечного тракта, печени или почек; острая стадия инфаркта миокарда, тяжелые формы хронической сердечной недостаточности (III–IV стадии по классификации NYHA), любая крупная хирургическая операция в течение последних 8 недель и иные неконтролируемые и/или клинически значимые заболевания.
Статистическую обработку результатов исследования проводили с использованием пакета программ Statistica 6.0 с представлением данных в виде медианы (Me) и межквартильных интервалов Q1–Q4 (25%; 75%). Необходимый объем выборки, рассчитанный с использованием формулы Плохинского Н.А., составил 80 пациентов. Для сравнения нескольких независимых групп использовали критерий Краскела–Уоллеса; для оценки статистической значимости различий – метод четырехпольных таблиц с определением χ 2; для оценки степени корреляционных взаимосвязей – метод Спирмена. Результаты считались статистически значимыми при p<0,05.
Результаты и обсуждение
В I группе экссудативный и пролиферативный синовит диагностирован у 37 из 48 пациентов (77,1%), во II группе – у 15 пациентов (из 33 или 45,5%), тогда как отсутствовал – у 11 и 18 обследованных соответственно (χ2=8,51, p=0,003). В I группе I рентгенологическая стадия ОА установлена у 11 пациентов (22,9%), II и III стадии – у 37 (77,1%). Во II клинической группе I стадия имела место у 15 больных (45,5%), тогда как II и III стадия ОА – у 18 пациентов (54,5%), χ2=4,56, р=0,03. В I группе у подавляющего большинства – 45 чел., т.е. 93,8% – установлено поражение более 2 суставов и только у 3пациентов – 1–2. При этом во II группе поражение 1–2 суставов отмечено у 21 пациента (63,6%), более 2 суставов – у 12 чел. (36,4%), χ2=30,89, p<0,0001. Продолжительность заболевания от 1 до 4 лет установлена у 23 пациентов (47,9%) I группы, более 4 лет – у 25 (52,1%). Во II группе, напротив, анамнез от 1 до 4 лет отмечен у 8 пациентов (24,2%), более 4 – у 25 (75,8%), χ2=4,64, p=0,03.
Следует отметить, что при первичном обследовании у всех пациентов, страдавших ОА, обнаружен пониженный уровень адипонектина с медианой 1,6 мкг/мл (0,86; 4,1 мкг/мл). При сравнении уровня адипонектина в зависимости от течения остеоартроза выявлены статистически значимые различия: чем тяжелее рентген-стадия остеоартроза, тем ниже уровень адипонектина (p<0,05). Анализ уровней гормона в зависимости от тяжести клинических проявлений ОА показал, что при отсутствии синовита уровень адипонектина был выше, чем при пролиферативном синовите и, в свою очередь, выше, чем при выраженном экссудативном синовите (р<0,0001). При быстро прогрессирующем течении ОА уровень адипонек-тина оказался ниже, чем при медленно прогрессирующем характере заболевания (р<0,001).
Как видно из таблицы 1, у пациентов I группы болевой суставной синдром в клинических проявлениях ОА оказался более выражен, что соответствовало более высоким значениям индекса ВАШ при движении, индекса Lequesne и индекса WOMAC (p<0,05).
Установлена достаточно тесная отрицательная корреляционная взаимосвязь между уровнем адипонектина и индексами выраженности боли по ВАШ (r=–0,5 р<0,001), Lequesne (r=–0,61 р<0,001) и WOMAC (r=–0,6 р<0,001), рисунок 1.
Некоторые авторы определяют ОА как системную метаболическую болезнь. В работах ряда исследователей приводятся теоретические обоснования возможных механизмов взаимодействия цитокинов и течения ОА [1]. Американским ученым впервые удалось идентифицировать адипонектин как “метаболическое связующее звено”, при снижении которого происходит изменение хрящевого обмена веществ в суставах [8], а его нормальный уровень в полости сустава способствует большей устойчивости гиалинового хряща к нагрузкам. В ряде работ показано, что хондроциты имеют рецепторы к адипонек-
Таблица 1
Оценка выраженности болевого синдрома у пациентов ОА с различным уровнем адипонектина
|
Показатели |
I группа |
II группа |
|
ВАШ – в покое, см |
5 (3; 8) |
3 (2; 7) |
|
Индекс Lequesne, баллы |
7 (3,5; 9,5) |
3 (1; 4) |
|
Индекс WOMAC, мм |
422 (308; 601) |
288 (251; 327) |
|
Выраженность боли |
32 (51; 75) |
22 (30; 45) |
|
Утренняя скованность |
18 (25; 46) |
10 (21; 12) |
|
Степень функциональной |
||
|
недостаточности |
372 (232; 480) |
256 (200; 270) |
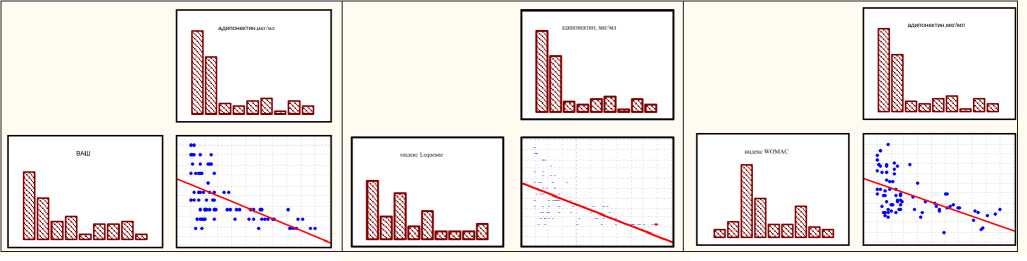
ABC
Рис. 1. Матрицы диаграмм рассеяния для значимой корреляции между уровнем адипонектина и индексом ВАШ (А, p<0,001), индексом Lequesne (Б, p<0,001) и индексом WOMAC (В, p<0,001)
тину [10]. Имеются данные, что адипонектин влияет на гомеостаз гиалинового хряща, поддерживая нормальный уровень его анаболических и катаболических процессов. Таким образом, при снижении уровня адипонектина следует ожидать деградации хряща и прогрессирования рентгенологических изменений. Действительно, нами установлено, что у пациентов I группы – со значительно сниженным уровнем адипонектина (до 1,9 мкг/мл) – преобладал полиостеоартроз с быстро прогрессирующим характером течения заболевания, более тяжелыми рентгенологической стадией (III и IV) и классом функциональной недостаточности суставов (III ФК).
Кроме того, сегодня известно, что адипонектин обладает противовоспалительным действием и уменьшает выраженность боли как спутника воспаления. Эти эффекты осуществляются посредством воздействия на активность клеток, принимающих участие в воспалении. В моноцитах идентифицированы два трансмембранных белка – Adipo R1 и Adipo R2, которые выполняют функцию рецепторов для адипонектина [9]. Экспрессия данных рецепторов индуцируется ядерными рецепторами PPAR- α и PPAR- γ [11]. Показано, что активация PPAR- α приводит к увеличению количества связывающих участков для циркулирующего адипонектина на мононуклеарах, благодаря чему уменьшается их активность, высвобождение медиаторов воспаления и боли [6]. Нами выявлена обратная корреляционная связь между уровнем адипонектина и индексами WOMAC, альгофункциональным индексом Лекена, индексом ВАШ.
Предполагается, что изменение образа жизни и некоторые варианты фармакотерапии, приводящие к повышению уровня адипонектина, могут способствовать нормализации обмена веществ в хрящевой ткани суставов, и, тем самым, снижению выраженности воспалительного процесса и болевого синдрома. В настоящее время отсутствуют препараты, непосредственно повышающие уровень адипонектина. Тем не менее, есть группы лекарств (фибраты; сартаны; глитазоны; бенфотиамин и др.), которые активируют ядерные рецепторы PPAR- α и γ [2]. В связи с этим необходим индивидуализированный подход к терапии пациентов с остеоартрозом и коморбид-ной патологией.
Полученные нами результаты подтвердили, что ади-понектин участвует в патогенезе ОА, а его сниженное со- держание в сыворотке крови может выступать маркером тяжести и прогрессирования ОА. В этой связи определение концентрации адипонектина в сыворотке крови больных ОА может также повысить качество диагностики этого заболевания.
Выводы
-
1. В сыворотке крови больных с остеоартрозом выявлено снижение концентрации адипонектина значительно ниже границ референтной нормы.
-
2. При ОА установлена статистически значимая обратная корреляционная взаимосвязь между уровнем ади-понектина и клинико-функциональными проявлениями заболевания – индексами WOMAC, ВАШ, альго-функциональным индексом Лекена.
-
3. Для больных ОА с низким уровнем адипонектина характерны более тяжелые проявления заболевания с быстро прогрессирующим полиостеоартрозом, наличием вторичного синовита, значительными рентгенологическими изменениями суставов (III–IV стадии) и III стадией их функциональной недостаточности.
Список литературы Связь клинических проявлений остеоартроза с изменением уровня адипонектина крови
- Алексеенко Е.Ю., Говорин А.В. Оценка маркеров воспаления и показателей оксидативного стресса у больных остеоартрозом в сочетании с артериальной гипертензией//Сибирский медицинский журнал (Томск). -2011. -№ 1. -С. 54-57.
- Ошорова С.Д., Андрущишина Т.Б., Морозова Т.Е. Индивиду ализированный выбор антигипертензивных лекарственных средств при метаболическом синдроме: влияние на адипокины, маркеры эндотелиальной дисфункции//Лечащий врач. -2011. -№ 2 -С. 24-29.
- Рациональная фармакотерапия ревматических заболеваний/под общ. ред. В.А. Насоновой, Е.Л. Насонова//Рациональная фармакотерапия: серия руков. для практикующих врачей. -М.: Литтерра, 2003. -Т. 3 -448 с.
- Ревматология: национальное руководство//под ред. Е.Л. Насонова, В.А. Насоновой. -М.: ГЭОТАРМедиа, 2008. -С. 573-588.
- Фоломеева О.М., Эрдес Ш.Ф. Распространенность и социальная значимость ревматических заболеваний в Российской Федерации//Научнопрактическая ревматология. -2007. -№ 10. -С. 3-12.
- Agarwal S., Long P., Seyedain A. et al. A central role for the nuclear factorkB pathway in antiinflammatory and proinflammatory actions of mechanical strain//FASEB Journal. -2003. -Vol. 17. -P. 899-901.
- Altman R., Alarcon G., Appelrouth D. et al. The American College of Reumatology criteria for the classification and reporting of osteoarthritis of the hip//Arthritis Rheum. -1991. -Vol. 34. -P. 505-514.
- Engeli S., Feldpausch M., Gorzelniak K. et al. Association between adiponectin and mediators of inflammation in obese women//Diabetes. -2003. -Vol. 52. -P. 942-947.
- Fantuzzi G. Adipose tissue, adipokines, and inflammation//J. Allergy and Clin. Immunol. -2005. -Vol. 11 (5). -P. 911-919.
- Garnero P., Delmas P.D. Biomarkers in osteoarthritis//Current Opinion in Rheumatology. -2003. -Vol. 15 (5). -P. 641-646.
- Kumar A., Takada Y., Boriek A.M. et al. Nuclear factorB: its role in health and disease//J. Molecular Medicine. -2004. -Vol. 82. -P. 434-448.
- Smith M.M., Ghosh P. Osteoarthritis: current status and future direction//APLAR J. Rheum. -2008. -Vol. 2. -P. 27-53.


