Трансформация глиом низкой степени злокачественности в высоко злокачественные глиомы головного мозга
Автор: Сарычева М.М., Важенин А.В., Мозерова Е.Я., Ложков А.А., Максимовская А.Ю., Карабут Р.Ю., Тимохина Д.М., Сабельникова Ж.Е.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Онкология
Статья в выпуске: 2 т.20, 2020 года.
Бесплатный доступ
Основной целью данной работы было определение наиболее значимых факторов, влияющих на результаты лечения у пациентов с трансформацией рецидивов глиом низкой степени злокачественности в высокозлокачественные глиомы. В данное исследование вошло 20 пациентов с морфологически подтверждённым диагнозом трансформации рецидива глиом низкой степени злокачественности в высокозлокачественную, получившие лечение с 2000 по 2019 годы в Челябинском областном клиническом центре онкологии и ядерной медицины. Озлокачествление отмечено в срок от 10 до 50 месяцев. Средний возраст пациентов составил 40 ± 9,21 лет, соотношение мужчин и женщин 2:1. Преобладали больные с первичным морфологическим заключением астроциома Grade I (n = 13), в 7 случаях диагностирована астроциома Grade II, у 1 больного был рецидиволигодендроглиомы. У 11 пациентов диагностирован рецидив с трансформацией в глиобластому, у 9 - в анапластическую астроцитому. Медиана общей выживаемости (ОВ) для всех пациентов составила 75 мес., показатели 1-летней ОВ - 100 %; 3х-летней - 94,7 %; 5-летней - 71,7%. Медиана общей выживаемости после лечения рецидива - 24 месяца.Основными факторами, влияющими на неблагоприятный прогноз, согласно нашему исследованию, были трансформация в глиобластому и возраст более 50 лет.
Злокачественная трасформация, рецидивы злокачественных глиом, темозоломид
Короткий адрес: https://sciup.org/149132135
IDR: 149132135
Текст научной статьи Трансформация глиом низкой степени злокачественности в высоко злокачественные глиомы головного мозга
Согласно классификации глиом Всемирной организации здравоохранения, выделяют 4 класса глиальных опухолей центральной нервной системы по степени злокачественности (Grade I-IV). Глиомы низкой степени злокачественности (Grade I-II), включают астроцитому, олигодендроглиому, олигоастроцитому, а также редкие типы опухолей – плеоморфную ксантоастроцитому. Субэпендимарную гигантоклеточную астроцитому, пилоидную астроцитому также относят к опухолям низкой степени злокачественности, так как они обладают менее агрессивным течением, длительным латентным периодом развития опухолевого процесса. Показатели общей 5-летней бессобытийной выживаемости в рандомизированных исследованиях варьируют для этих типов опухолей от 58% до 72% и от 37% до 55%, соответственно [1].
В настоящее время стандартом лечения пациентов с глиомами низкой степени злокачественности является выполнение хирургического лечения, с последующим проведением курса послеоперационной лучевой терапии с РОД 1,8 – 2 Гр до СОД 45 – 54 Гр [2]. Роль химиотерапии в лечении глиом низкой степени злокачественности до сих пор является спорной [3, 4] и является альтернативой в качестве начального метода лечения лишь у пациентов с большими остаточными опухолями после операции или неоперабельными опухолями, особенно при наличии коделеции 1p/19q [5]. Но, несмотря на улучшение результатов лечения больных с глиомами низкой степени злокачественности, отмеченное за последнее десятилетие, сохраняется высокая вероятность возникновения рецидива опухолевого процесса, нередко с перерождением в более злокачественную форму заболевания – глиомы WHO Grade III-IV [6 – 11]. Среднее время озлокачествления составляет 56,4 мес. Показатели 5-и 10-летней общей выживаемости колеблются от 87% до 78% [12]. Значимыми предикторами возникновения трансформации, согласно литературным данным, являются пожилой возраст, мужской пол, наличие остаточной опухоли после проведённого лечения [13, 14], однако на сегодняшний день до конца не ясно, влияют ли данные факторы на прогноз и исход лечения.
Следует отметить, что связь между возникновением трансформации и предшествующей лучевой терапии до конца не установлена [15].
Изучая вопрос о роли гистологического заключения в трансформации глиом Jung с соавторами [16] выявили, что первичное морфологическое заключение «олигодендроглиома» является одним из факторов, ассоциированных с возникновением перерождения. Согласно их исследованию, злокачественная трансформация из олигоденроглиомы была диагностирована у 13 из 86 пациентов (15%), при этом из 42 больных с диагнозом олигодендроглиома в 6 случаях зафиксировано перерождение в анапластическую олигодендроглиому, в 3-х – анапластическую астроцитому и в одном случае – в глиобластому. Вместе с тем трансформация у пациентов с изначальным гистологическим заключением астроцитома (n=32) отмечена лишь у 2-х пациентов. Также отмечена связь молекулярного генетического подтипа опухоли с процессами трансформации. Leu с совторами [17, 18], рассмотрев результаты лечения 210 больных с глиомами низкой степени злокачественности, установили, что у пациентов с мутациями генов IDH1/2 (IDHmut) имеется более высокий риск трансформации по сравнению с классом опухолей «дикого типа», без наличия IDH1/2 мутации. В молекулярной модели с комбинациями маркеров комбинированный статус IDHmut/MGMTmet (метилирование промотора гена MGMT) оказывал благоприятное влияние на общую выживаемость по сравнению с IDHwt (wt, wild type – дикий тип) (отношение рисков [HR] = 0,33, P<0,01), тройная комбинация IDHmut/MGMTmet/коделеция1p/19q была ассоциирована с еще лучшими показателями (HR = 0,18, P<0,001). Кроме того, тройная комбинация IDHmut/MGMTmet/TP53pos (TP53 иммунопозитивность) была значительным фактором риска злокачественной трансформации (HR = 2,75, P< 0,05). Таким образом, генотип опухоли, по сравнению с результатами гистологического заключения, был в большей степени ассоциирован с прогнозом для пациента, следовательно, определение молекулярногенетических характеристк опухоли предоставляет собой более надежный инструмент для стандартизации и оптимизации стратегии лечения данной категории больных.
Результаты исследования, проведенного Rotta с соавторами [19], продемонстрировали роль темозоломида в развитии трансформации. Так, согласно их заключению, практически у половины больных с рецидивами низко злокачественных глиом головного мозга была зафиксирована трасформация в более злокачественные формы, при этом у практически 60% больных была проведена адьюватная монохимиотерапии темозоломидом. Эта тема получила развитие в следующей работе автора, основанной на результатах лечения 486 пациентов, в которой применение адъювантой монотерапии темозоломидом явилось единственным модифицируемым фактором риска для злокачественной трасформации [20].
Целью нашего ретроспективного исследования была оценка влияния вышеперечисленных прогностических факторов на результаты лечения больных с трансформацией низко злокачественных глиом головного мозга в высокозлокачественные глиомы и также определение наиболее эффективных схемы лечения данной категории пациентов.
Материалы и методы
В результате ретроспективного исследования 60 пациентов с рецидивами глиом низкой степени злокачественности, находившихся на лечении в ГБУЗ «Челябинский областной центр онкологии и ядерной медицины», у 20 пациентов по данным гистологического заключения после реоперации выявлена злокачественная трансформация.
Среди всех больных с трансформацией соотношение мужчин и женщин было 2:1. Средний возраст данной когорты пациентов составил 40 ± 9,21 лет (от 22 до 55 лет). Преобладали больные с первичным морфологическим заключением астроциома Grade I (n = 13), в 7 случаях была диагностирована астроциома Grade II, у 1 больного был рецидив олигодендроглиомы. После рецидива у 55% (n = 11) пациентов зафиксирована трасформация в глиобластому и в 45 % случаев (n = 9) – в анапластическую астроцитому.
Лечение первичных опухолей было проведено согласно общепринятым стандартам лечения данной категории больных. При установке диагноза «рецидив» 7 пациентам была проведена монохимотерапия темозоломидом (в дозе 200 мг/м² с 1 по 5 день, каждые 28 дней), 13 больным был выполнен повторный курс дистанционной лучевой терапии на визуализируемые по данным МРТ рецидивные опухолевые очаги в традиционном режиме фракционирования с подведением суммарной дозы в 40 – 50 Гр (с учетом остаточной дозы от предыдущего курса лучевой терапии с расчетом по модели ВДФ) до суммарной кумулятивной дозы, не превышающей 100 Гр. Из них 3-м пациентам после завершения курса ДЛТ в адьювантном режиме проведено 6 циклов монохимиотерапии темозоломидом. Более подробно характеристика пациентов представлена в Табл. 1.
Таблица 1. Характеристика 20 пациентов, включенных в исследование
|
Признак |
Показатель, n (%) |
|
Медиана возраста, лет |
40 лет |
|
мужчины |
13 (65%) |
|
женщины |
7 (35%) |
|
Первичный морфологический вариант |
|
|
астроцитома G1 |
8 (45%) |
|
астроцитома G2 |
11 (50%) |
|
олигодендроглиома |
1 (5%) |
|
Морфологический вариант рецидива |
|
анапластическая астроцитома |
9 (45%) |
|
глиобластома |
11 (55%) |
|
Вид проведённого лечения рецидива |
|
|
ДЛТ |
10 (50 %) |
|
ДЛТ+ХТ |
3 (15%) |
|
ХТ |
7 (35%) |
В данной работе мы оценили показатели общей выживаемости, определили срок возникновения трансформации и предприняли попытку оценить влияние таких значимых для первичных опухолей головного мозга параметров, как возраст, пол, морфологическое заключение с позиции их влияния на показатели выживаемости при возникновении рецидива с перерождением в злокачественную трансформацию. Анализ результатов лечения выполнен при помощи программы IMB SPSS Statistics 20.0.
Результаты
Медиана общей выживаемости (ОВ) составила 75 мес., показатели 1-летней ОВ – 100 %; 3х-летней ОВ – 94,7 %; 5-летней ОВ – 71,7% (Рис. 1). Медиана общей выживаемости после лечения рецидива для всех пациентов – 24 месяца.
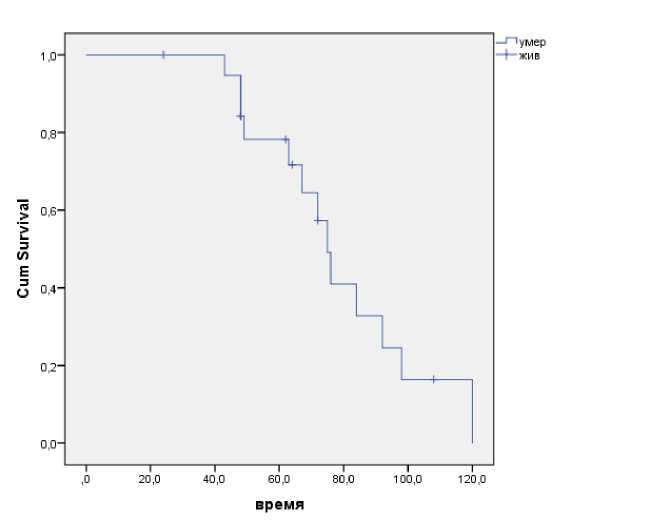
Рис. 1. Общая выживаемость пациентов.
Медиана возникновения злокачественной трансформации составила 44 месяца, что практически сопоставимо с результатами зарубежных авторов [21, 22].
Опираясь на данные современной литературы об известных факторах, приводящих к трансформации, а также на результаты, полученные в ходе обобщения и анализа нашего опыта, мы выделили следующие основные аспекты нашего исследования: определение влияния гистологического заключения, пола и возраста на показатели ОВ. Как и ожидалось, трансформация в более злокачественную форму – глиобластому (ГБ) имела более неблагоприятный прогноз и наименьшие показатели ОВ по сравнению с пациентами, у которых наблюдалось перерождение в анапластическую астроцитому (АА): 67 и 84
месяцев соответственно (тенденция, Р=0,08) (Табл. 2).
Таблица 2. Показатель выживаемости у пациентов с рецидивами низко злокачественных глиом в высоко злокачественные в зависимости от гистологического заключения
|
Повторное гистологическое заключение |
1-летняя ОВ |
3х-летняя ОВ |
5 летняя ОВ |
Медиана ОВ |
Выживаемость после повторного лечения |
|
ГБ |
100% |
83,0% |
60,1% |
67 мес. |
13 мес. |
|
АА |
100% |
87,0% |
70,0% |
84 мес. |
24 мес. |
Медиана общей выживаемости у женщин была значительно выше в сравнении с мужчинами, и составила 92 против 72 месяцев, но данные недостоверны (Р=0,96), и, вероятнее всего, это связано с изначальным преобладанием в нашем исследовании мужчин (Рис. 2).
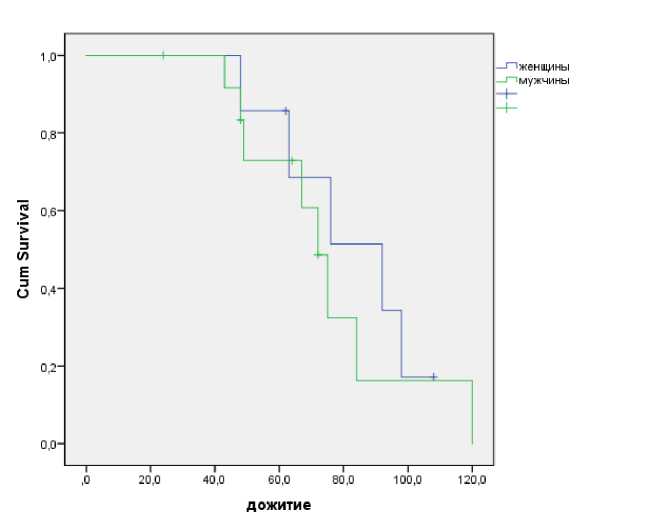
Рис. 2. Показатели общей выживаемости пациентов в зависимости от пола.
Еще одним из основных и независимых прогностических факторов является возраст.
Так, медиана общей выживаемости была выше в возрастной группе до 50 лет в сравнении с более старшей возрастной группой: 84 и 72 месяца, хотя результаты также недостоверны (Р=0,9) (Рис. 3).
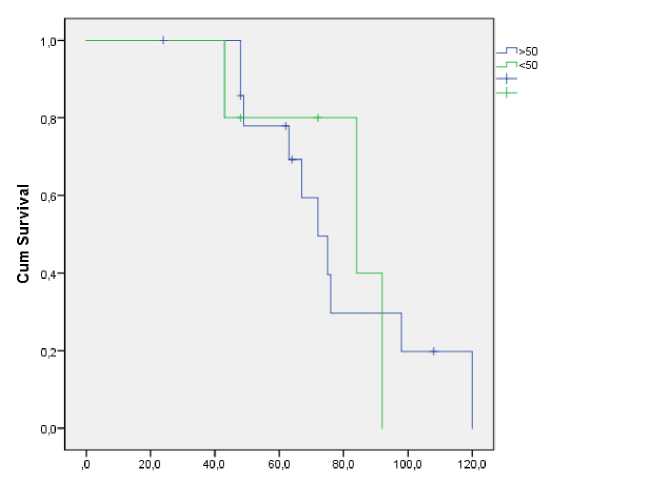
дожитие
Рис.3. Показатели общей выживаемости пациентов в зависимости от возраста.
Не менее значимым вопросом, на наш взгляд, стало определение дальнейшей тактики лечения данной категории пациентов: необходимо ли проводить рекомендованные для больных рецидивами глиом низкой степени злокачественности курсы химиотерапии темозоломидом, или все таки лечение должно быть более агрессивным и предусматривать проведение повторного курса ДЛТ наряду с химиотерапевтическим компонентом, как при первичных высокозлокачественных глиомах? Мы не получили однозначного ответа ввиду малого количества больных, вошедших в исследование, но отметили некоторое увеличение метод-специфической ОВ у пациентов, которым была проведена повторная лучевая терапия с последующим добавлением в схему лечения темозоломида в сравнении с пациентами, кому проведена только повторная лучевая терапия – 38 месяцев и 24 месяцев, соответственно (Р=0,7) (Табл. 3).
Таблица 3. Показатели выживаемости у пациентов с рецидивами низкозлокачественных глиом в высокозлокачественные глиомы в зависимости от варианта лечения
|
Вариант лечения |
1-летняя ОВ |
3-летняя ОВ |
5-летняя ОВ |
Медиана ОВ |
Выживаемость после повторного лечения |
|
ХТ |
100% |
83,3% |
62,5% |
67 мес. |
12 мес. |
|
ДЛТ |
100% |
87,5% |
56,3% |
75 мес. |
24 мес. |
|
ДЛТ+ ХТ |
100% |
90,0% |
72,0 % |
88 мес. |
38 мес. |
Для более глубокого анализа выбора нужной стратегии лечения больных со злокачественной трансформацией необходимо проведения дальнейших исследований в данной области.
Заключение
Результаты проведённого нами исследования позволяют сделать некоторые частные выводы. Наиболее неблагоприятными факторами, влияющими на дальнейший прогноз у пациентов с трансформацией, являются трансформация в глиобластому и возраст более 50
лет. Лечение данной категории больных, на наш взгляд, должно проводится как при первичных глиомах высокой степени злокачественности, а именно, с проведением комплексной химиолучевой терапии.
Список литературы Трансформация глиом низкой степени злокачественности в высоко злокачественные глиомы головного мозга
- Aghi M.K., Nahed B.V., Sloan A.E., et al. The role of surgery in the management of patients with diffuse low grade glioma: A systematic review and evidence-based clinical practice guideline. J Neurooncol. 2015. V. 125. No. 3. Article ID 503. doi: 10.1007/s11060-015-1867-1.
- Ryken T.C., Parney I., Buatti J., et al. The role of radiotherapy in the management of patients with diffuse low grade glioma: A systematic review and evidence-based clinical practice guideline. J Neurooncol. 2015. V. 125. No. 3. P. 551-583. doi: 10.1007/s11060-015-1948-1.
- Ziu M., Kalkanis S.N., Gilbert M., et al. The role of initial chemotherapy for the treatment of adults with diffuse low grade glioma: A systematic review and evidence-based clinical practice guideline. J Neurooncol. 2015. V. 125. No. 3. P. 585-607. doi: 10.1007/s11060-015-1931-x.
- Jhaveri J., Liu Y., Chowdhary M., et al. Is less more? Comparing chemotherapy alone with chemotherapy and radiation for high-risk grade 2 glioma: An analysis of the National Cancer Data Base. Cancer. 2018. V. 15. P. 1169-1178. doi: 10.1002/cncr.31158.
- Soffietti R., Baumert B.G., Bello L., et al. Guidelines on the Management of Low-Grade Gliomas: EANO Task Force Report. Eur J Neurol. 2010. V. 17. No. 9. P. 1124-1133.
- Древаль О.Н., Белохвостов А.С., Фениксов В.М. Клинические и цитогенетические факторы прогноза при глиальных опухолях головного мозга. Вопросы нейрохирургии им. академика Н.Н. Бурденко. 2009. № 4. С. 7-12.
- Мацко М.В., Исаев А.А., Асеева А.С. Злокачественная трансформация GI-II глиом головного мозга и зависящие факторы. Сборник тезисов «Мечниковские чтения». СПб. 2018. С. 303.
- Мацко М.В. Прогностические и предиктивные маркеры в нейроонкологии значение различных методов исследования. Современные подходы в клинико-морфологической диагностике и лечении заболеваний человека. Сборник научных трудов всероссийской конференции с международным участием. 3-е научные чтения, посвященные памяти член-корр. РАМН, проф. О.К. Хмельницкого. СПб. 2013. С. 219-221.
- Jung T.Y., Jung S., Moon J.H., et al. Early prognostic factors related to progression and malignant transformation of low-grade gliomas. Clin Neurol Neurosurg. 2011. V. 113. No. 9. P. 752-757.
- Majchrzak K., Kaspera W., Bobek-Billewicz B., et al. The assessment of prognostic factors in surgical treatment of low-grade gliomas: a prospective study. Clin Neurol Neurosurg. 2012. V. 114. No. 8. P. 1135-1144.
- Prabhu V.C., Khaldi A., Barton K.P., et al. Management of diffuse low-grade cerebral gliomas. Neurol Clin. 2010. V. 28. No. 4. P. 1037-1059.
- Tom M.C., Park D.Y., Yang K., et al. Malignant Transformation of Molecularly Classified Adult Low-Grade Glioma. Int J Radiat Oncol Biol Phys. 2019.V.105. No. 5. P.1106-1112. doi: 10.1016/j.ijrobp.2019.08.025.
- Murphy E.S., Leyrer C.M., Parsons M., et al. Risk Factors for Malignant Transformation of Low-Grade Glioma. Int J Radiat Oncol Biol Phys. 2018. V. 100. No. 4. P.965-971. doi: 10.1016/j.ijrobp.2017.12.258.
- Rees J., Watt H., Jäger H.R., et al. Volumes and growth rates of untreated adult low-grade gliomas indicate risk of early malignant transformation. Eur J Radiol. 2009. V. 72. No. 1. P. 54-64. http://doi.org/10.1016/j.ejrad.2008.06.013.
- Vertosick F.T., Selker R.G., Arena V.C. Survival of patients with well differentiated astrocytomas diagnosed in the era of computed tomography. Neurosurgery. 1991. V. 28. No. 4. P.496-501.
- Jung T.Y., Jung S., Moon J.H., et al. Early prognostic factors related to progression and malignant transformation of low-grade gliomas. Clin Neurol Neurosurg. 2011. V. 113. No. 9. P. 752-757.
- Leu S., von Felten S., Frank S., et al. IDH mutation is associated with higher risk of malignant transformation in low-grade glioma. J Neurooncol. 2016. V. 127. No. 2. P. 363-372. doi: 10.1007/s 11060-015-2048-y.
- Leu S., Felten S., Frank S., et al. IDH/MGMT-driven molecular classification of low-grade glioma is a strong predictor for long-term survival. Neuro Oncol. 2013. V. 15. No. 4. P. 469-479. doi: 10.1093/neuonc/nos317.
- Rotta J.M., Oliveira M.F., Reis R.C. Malignant transformation of low-grade gliomas in patients undergoing adjuvant therapy. Acta Neurol Belg. 2017. V. 117. No. 1. P. 235-239. doi: 10.1007/s13760-016-0657-7.
- Pham T.H.A. Risk Estimation toward a Natural History Model for Low Grade Glioma Patients. Theses and Dissertations. 2016. 1562 p. http://scholarworks.uark.edu/etd/1562.
- Chaichana K.L., McGirt M.J., Laterra J., et al. Recurrence and malignant degeneration after resection of adult hemispheric low-grade gliomas. J Neurosurg. 2010. V. 112. No. 1. P. 10-17.
- Rotariu D., Gaivas S., Faiyad Z., et al. Malignant transformation of low grade gliomas into glioblastoma: a series of 10 cases and review of the literature. Romanian Neurosurgery. 2010. V. 17. No. 4. P. 403-412.


