Влияние биологической активности воды на рост и показатели крови комет (Carassius gibelio forma Auratus (Bloch, 1782))
Автор: Ализаде Г.Э., Кулакова Т.С., Фомина Л.Л., Маслова Т.Ф.
Журнал: Молочнохозяйственный вестник @vestnik-molochnoe
Рубрика: Сельскохозяйственные и ветеринарные науки
Статья в выпуске: 2 (54), 2024 года.
Бесплатный доступ
В статье представлены результаты по изучению ответных реакций комет (разновидностей золотых рыбок) на воду, прошедшую специальную подготовку. За время исследований (60 дней) большинство гидрохимических параметров соответствовало нормативным значениям содержания рыб. За период проведения опыта кометам контрольной и опытной групп было скормлено одинаковое количество корма - по 60 г. На протяжении всего периода исследований у рыб обеих групп наблюдался хороший аппетит, поедаемость гранул была высокой. За время наблюдений масса комет в контрольной группе снизилась на 8,1% и составила 163,8±15,6 г, в опытной группе данный показатель снизился на 8,5% и достиг 164,0±9,2 г к концу эксперимента, что связано с переводом комет на нормированное потребление корма. Биохимические показатели сыворотки крови рыб опытной и контрольной групп достоверных различий не имели. Все это указывает на отсутствие отрицательного влияния качественных показателей воды, прошедшей специальную подготовку, на интерьерные значения крови комет. В то же время клинико-морфологические показатели крови исследуемых рыб (лимфопения, нейтрофилия, увеличение бластных форм) указывают на их стрессовое состояние, возможно связанное с хэндлинг-стрессом и забором крови, но некоторые показатели (увеличение гемоглобина, эритроцитов, количества зрелых нейтрофилов) могут указывать на состояние интоксикации и кислородного голодания, более выраженного у рыб опытной группы.
Гидробионты, рыбы, комета, кормление рыбы, рост, кровь
Короткий адрес: https://sciup.org/149145833
IDR: 149145833 | УДК: 574.24 | DOI: 10.52231/2225-4269_2024_2_10
Текст научной статьи Влияние биологической активности воды на рост и показатели крови комет (Carassius gibelio forma Auratus (Bloch, 1782))
Вода играет важную роль во всех жизненных процессах. Главным фактором негативного воздействия не только на биоту водных экосистем, но и на человека является токсическое загрязнение. Именно с ним связано появление ряда экологических проблем в водных экосистемах, например, таких как проблема чистой воды, снижение биоразнообразия гидробионтов, резкое снижение уловов рыбы, доли ценных промысловых видов.
Для оценки уровня загрязнения, в том числе токсичными химическими веществами, в настоящее время в мониторинге поверхностных вод суши используется триада методических подходов [5, 13, 19], среди которых ведущая роль принадлежит методу биотестирования. Биотестирование, наряду с биоиндикацией, является обязательным элементом современной системы контроля качества вод [3, 15, 16, 20, 26].
Известно, что химический анализ тесно связан с биотестированием, так как установленные законодательно нормативы рыбохозяйственных ПДК основаны на анализе биологических эффектов химических веществ, выявляемых с помощью биотестирования с использованием тест-объектов различной систематической принадлежности и трофических уровней. Известно, что количественный анализ какого-либо вещества в воде сам по себе не дает ответ на главный вопрос о ее опасности для биоты. Токсичность можно определить только с привлечением живых организмов методом биотестирования.
Биотестирование, наряду с физико-химическими методами, широко используется в мировой практике мониторинга вод. Разработаны международные и национальные стандарты на методы биотестирования – биотесты на дафниях, водорослях, рыбах и других гидробионтах. Их назначение и область применения в России сформулированы в руководствах и ряде руководящих документов и рекомендаций [2].
Таким образом, выделение биологически важных антропогенных нагрузок основывается на реакции живых организмов. Из этого следует, что использование при оценивании среды предполагает выбор тех представителей флоры и фауны, у которых появляется резкая реакция на какой-либо тип раздражителя [8, 10, 18].
Приемы биоиндикации в совокупности с соответствующими организмами-индикаторами в специальной обстановке могут выполнять качественную и количественную оценку (исключая степень загрязненности) эффекта природного и антропогенного воздействия на окружающий мир.
Рыбы являются удобными модельными объектами, позволяющими проследить изменения в окружающей среде под воздействием различных факторов [6].
Гидробионты очень чувствительны к изменяющимся факторам среды, в том числе к качеству воды. Чем выше загрязнение среды ксенобиотиками, тем в большей степени они накапливаются в крови и тканях рыб, нарушая нормальную жизнедеятельность. Учитывая неприхотливость золотых рыбок к условиям содержания, в качестве тест-объекта были выбраны их разновидности – кометы.
Цель исследования – изучить ответные реакции комет на воду, прошедшую специальную подготовку.
Материалы и методы
Исследования проводились на базе Регионального центра развития аквакультуры Вологодской области «АкваБиоЦентр» ФГБОУ ВО Вологодская ГМХА в период с февраля по апрель 2024 г. В качестве объекта исследований использовали комету (Carassius gibelio forma auratus (Bloch, 1782)). Предметом исследования послужила вода, прошедшая специальную подготовку. Контроль качества воды проходил в Испытательной лаборатории ФБУЗ «Центр гигиены и эпидемиологии в Вологодской области и в Испытательной лаборатории в ООО «Рацио», г. Вологда. Экспресс-тестирование воды в аквариумах проводилось с помощью набора тестов WaterTestSetPlus фирмы Tetra. Рыбоводные показатели темпов роста кометы выполнялись по общепринятым методикам [21]. Биохимические показатели крови комет определяли в БУ ветеринарии Вологодской области «Вологодская областная ветеринарная лаборатория» согласно общепринятым методикам. Содержание гемоглобина в крови рыб определяли цианметгемоглобиновым методом [17]. Морфологическую картину крови описывали при помощи подсчета абсолютного количества эритроцитов, лейкоцитов и тромбоцитов, а также лейкоцитарной формулы. Подсчет эритроцитов проводили в камере Горяева. Количество тромбоцитов, лейкоцитов и их состав определяли в мазках крови, окрашенных по Паппенгейму. Клетки идентифицировали согласно атласу клеток крови рыб Н.Т. Ивановой [11]. В каждом мазке определяли относительное количество лимфоцитов, моноцитов, молодых и зрелых нейтрофилов с помощью световой микроскопии [7, 12]. В нашем эксперименте показателем нормы крови для рыб считались значения контрольной группы рыб. Для оценки биохимических показателей крови комет в качестве референсных значений использовали показатели крови серебряного карася (Carassius gibelio (Bloch, 1782) [22, 23], так как кометы и серебряный карась относятся к одному роду. Статистическая обработка данных проведена с использованием программного пакета Microsoft Excel по общепринятым методам вариационной статистики.
Результаты
Гидрохимический состав воды должен обеспечивать комфортные условия обитания гидробионтов. Важными показателями воды при содержании рыбы являются: температура, растворённый кислород, рН, нитриты, нитраты, углекислый газ. На протяжении всего периода эксперимента основные параметры среды обитания гидробионтов соответствовалиоптимальнымзначениям, допустимымдлявыращивания рыбы (таблица 1).
Таблица 1 – Результаты экспресс-тестирования воды
|
Показатели воды |
Нормативные значения |
В начале исследований |
В конце исследований |
||
|
контрольная группа |
опытная группа |
контрольная группа |
опытная группа |
||
|
Температура воды, °С |
20–24 |
22 |
22 |
22 |
22 |
|
рН (Tetra Test pH) |
6–8 |
7 |
7 |
7 |
7 |
|
Кислород, O2, мг/л |
>4 |
5 |
5 |
5 |
5 |
|
Нитриты, NO2-, мг/л |
<0,3 |
0,2 |
0,2 |
0,2 |
0,2 |
|
Нитраты, NO3-, мг/л |
<10 |
2 |
2 |
2 |
2 |
|
Фосфаты, PO4, мг/л |
<2 |
0,5 |
0,5 |
0,5 |
0,7 |
|
Углекислый газ, CO2 мг/л |
5–15 |
3 |
3 |
4 |
5 |
Для питания гидробионтов использовали комбикорм Pond Sticks фирмы «Tetra» в виде плавающих палочек, длиной 3–5 мм (содержание сырого протеина – 28%, сырого жира – 3,5% и сырой клетчатки – 2,0%). Корм в воде быстро размягчался и легко съедался гидробионтами.
Рост рыбы в большой степени зависит от качества воды, характера рациона и плотности посадки. Результаты выращивания кометы в воде, прошедшей специальную подготовку, а также особей контрольной группы, представлены на рисунке 1.
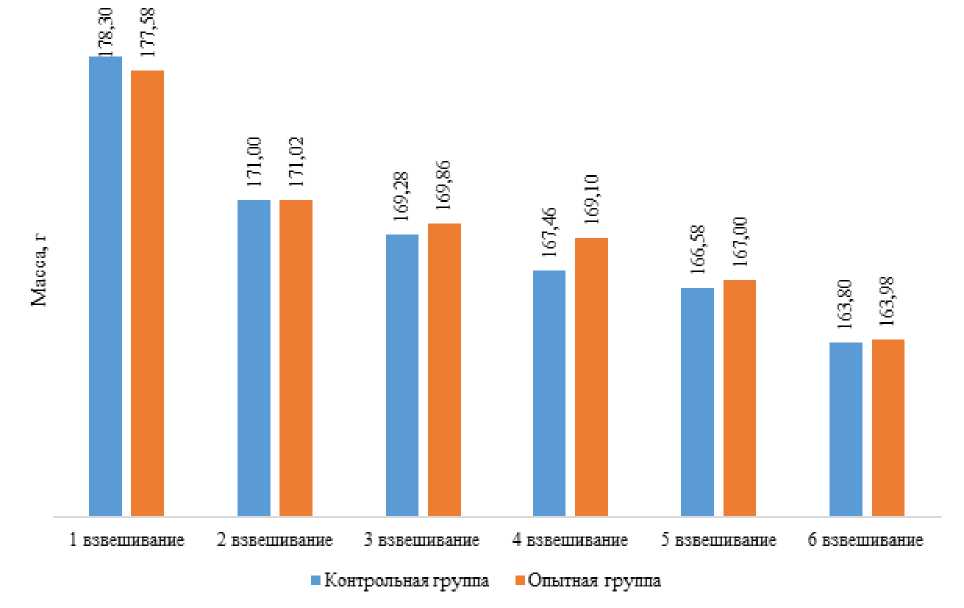
Рисунок 1 – Динамика прироста массы тела рыбы, г
На начало исследований в группах средняя масса тела одной рыбы была практически одинаковой – 178,3±16,2 г в контрольной группе и 177,58±10,5 г в опытной группе.
За время наблюдений (60 дней) масса комет в контрольной группе по сравнению с изначальным значением снизилась на 8,1% и составила 163,8±15,6 г, в опытной группе данный показатель снизился на 8,5% и достиг 164,0±9,2 г к концу эксперимента. Разница по данному показателю недостоверна.
Снижение массы тела рыб можно объяснить тем, что изначально, находясь в условиях пруда Ботанического сада, гидробионтов кормили вволю. Корм давали несколько раз в день как сотрудники данного учреждения, так и его и посетители. Бесконтрольное ненормированное скармливание гранул приводило к тому, что часть рыб погибала, скорее всего, от жирового перерождения печени, что обычно связано с перееданием. В условиях АкваБиоЦентра комет перевели на нормированное потребление корма, вследствие этого рыбы снизили массу тела и постепенно стали приобретать ту форму, которая является оптимальной.
Оценить состояние организма рыб в условиях опыта можно по физиолого-биохимическим показателям крови, которые выступают в качестве специфических индикаторов и отражают функциональное состояние организма.
Показатели биохимического исследованиякровикометыприведены в таблице 2 . При анализе полученных данных необходимо отметить отсутствие достоверных различий в показателях контрольной и опытной групп до эксперимента.
Таблица 2 – Динамика биохимических показателей крови кометы в ходе эксперимента
|
До начала эксперимента |
В конце эксперимента |
|||
|
Показатель |
контрольная группа (n=5) |
опытная группа (n=5) |
контрольная группа (n=5) |
опытная группа (n=5) |
|
Общий белок, г/% |
5,73±0,29 |
5,05±0,43 |
8,3±0,04 *** |
8,2±0,03 *** |
|
Альбумины, г/л |
62,07±1,77 |
59,9±1,55 |
36,9±5,0 ** |
36,7±4,7 ** |
|
α-глобулины, % |
13,38±2,39 |
20,72±3,01 |
29,1±4,4 * |
21,2±3,9 |
|
β-глобулины, % |
14,81±3,64 |
11,17±2,28 |
8,8±2,3 |
13,8±2,4 |
|
γ-глобулины, % |
9,74±1,58 |
8,21±1,67 |
28,1±6,8 * |
31,2±3,2 *** |
|
Белковый коэффициент (индекс) |
1,66±0,12 |
1,51±0,10 |
0,64±0,16 *** |
0,62±0,12 *** |
|
Глюкоза, ммоль/л |
3,73±0,36 |
4,24±0,50 |
3,11±0,7 |
4,5±0,8 |
|
Примечание. Различия со значением аналогичной группы в конце эксперимента достоверны (*р ≤ 0,05, **р ≤ 0,01, ***р ≤ 0,001). |
||||
В доступной литературе мы не нашли данные по содержанию биохимических и клинико-морфологических показателей крови у золотых рыбок – комет. В связи с этим можно предположить, что данные исследования проводятся впервые.
Анализируя динамику показателей в течение эксперимента, можно констатировать, что в контрольной группе повысились относительно изначального следующие показатели: содержание общего белка сыворотки – на 44,9% (***р ≤ 0,001), α-глобулины – в 2,17 раза (**р ≤ 0,01), γ-глобулины – в 2,9 раз (*р ≤ 0,05). Снизилось содержание таких показателей, как концентрация альбуминов – в 1,7 раза (**р ≤ 0,01), β-глобулины – на 40,6%, белковый индекс – в 2,6 раза (***р ≤ 0,001), глюкоза – на 16,6% (рисунок 2).
Контрольная группа
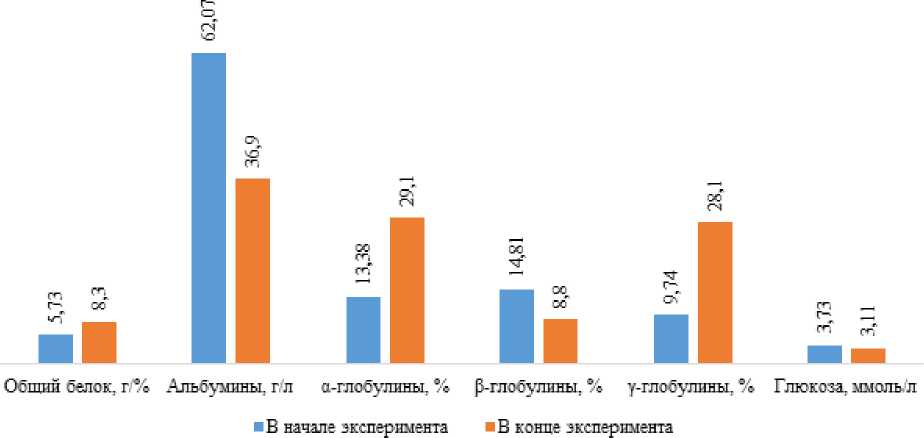
Рисунок 2 – Динамика биохимических показателей крови комет в контрольной группе
В опытной группе практически все фракции крови претерпели изменения по сравнению с изначальными показателями. Содержание общего белка повысилось на 62,4% (***р ≤ 0,001), α-глобулинов – на 2,4%, β-глобулинов – на 23,5%, γ-глобулинов – в 3,8 раза (***р ≤ 0,001), глюкозы – на 6,1%. Имеет место снижение альбуминов – в 1,6 раза (**р ≤ 0,01) и белкового индекса – в 2,4 раза (***р ≤ 0,001) (рисунок 3) .
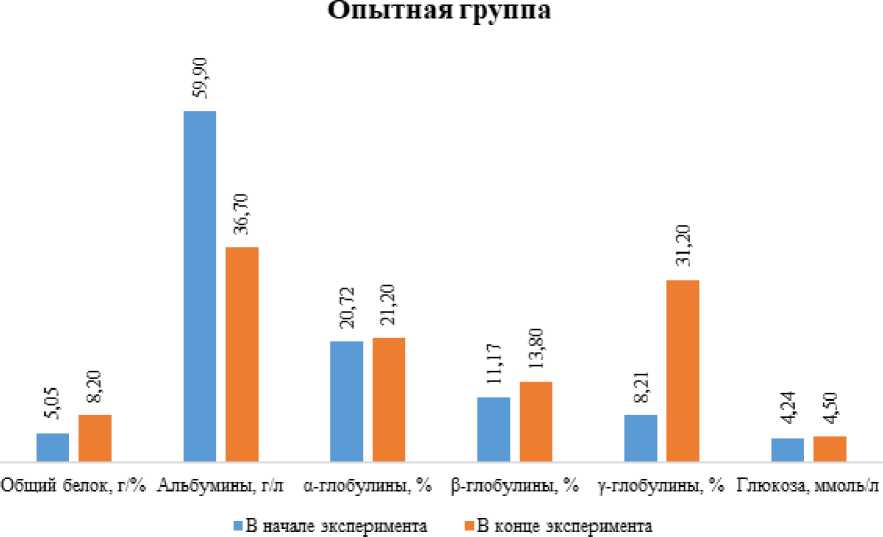
Рисунок 3 – Динамика биохимических показателей крови комет в опытной группе
Содержание белка и его фракций (альбумины и глобулины) в сыворотке крови наиболее часто используется в качестве индикатора общего состояния здоровья рыб.
Содержание и соотношение фракций белков сыворотки крови во многом являются видоспецифичными показателями [9]. Изоморфизм белков рыб рассматривают, с одной стороны, как следствие внутрипопуляционной изменчивости, а с другой – как результат влияния различных внешних факторов [14], в том числе и качественный состав воды. Следовательно, содержание общего белка и его фракций в крови рыб, могут служить одним из показателей при экомониторинге, наряду с другими параметрами.
Исследования содержания общего белка в крови рыб как контрольной, так и опытной групп повысились на 44,9–62,4% соответственно, что можно рассматривать, как положительный аспект. Высокое содержание белка в пределах установленных норм является благоприятным признаком. Сравнение данного показателя со средними значениями у серебряного карася свидетельствует о том, что он не выходит за пределы нормативных показателей (36,6–60,1).
Основным белком плазмы крови является альбумин. Его содержание варьирует от 5 до 60% от общего количества белка в плазме рыб. Основная роль альбумина заключается в поддержании коллоидноосмотического (онкотического) давления плазмы и объема циркулирующей крови, а также в транспорте и депонирование различных веществ.
В наших исследованиях содержание альбуминов уменьшилось в 1,7–1,6 раза соответственно по группам и стало соответствовать средним значениям у серебряного карася (18,2–35,4).
Глобулины сыворотки крови участвуют в транспортировке липидов, гормонов, витаминов и ионов металлов, образуют важные компоненты системы свертывания крови, антитела иммунной системы.
Основная функция белков, относящихся к α-глобулинам, – перенос различных липидов, стероидных гормонов, витаминов и других жироподобных веществ.
По результатам нашего исследования концентрация α-глобулина в крови рыб контрольной группы возросла в 2,17 раз, в то время как у сверстников опытной группы данный показатель практически не изменился. Увеличение содержания α-глобулинов может наблюдаться при острых воспалительных процессах, так как в состав данной фракции входят так называемые белки острой фазы.
β-глобулины – самая богатая липидами фракция общего белка. Основной функцией белков данной фракции, как и α-глобулинов, является перенос различных липидов, жирорастворимых гормонов, витаминов и других жироподобных веществ.
Данный показатель у особей контрольной группы понизился на 40,6%, а у комет опытной группы повысился на 23,5%. Согласно литературным данным, уменьшение фракции β-глобулинов отмечается редко. Подобное явление может быть обусловлено дефицитом трансферрина, что сопровождается развитием железодефицитной анемии.
Увеличениефракцииβ-глобулиновнаблюдаетсяпригиперлипемиях, при хронических заболеваниях, сопровождающихся повышенной продукцией иммуноглобулинов.
Основное количество белков с электрофоретической подвижностью γ-глобулинов составляют иммуноглобулины A, G, М, обладающие свойствами антител.
В нашем исследовании содержание γ-глобулинов увеличилось в обеих группах: в контрольной – в 2,6 раза, в опытной – в 2,4 раза. Увеличение фракции γ-глобулинов обнаруживают при патологических состояниях, сопровождающихся интенсивным развитием иммунных процессов: при хронических инфекциях, хроническом гепатите и циррозе печени, аллергических заболеваниях.
При оценке физиологического состояния большое диагностическое значение имеет белковый индекс (коэффициент) – показатель количественного отношения альбуминов к глобулинам.
Белковый индекс (коэффициент) в наших исследованиях снизился в 2,6 раза у гидробионтов контрольной группы и составил 0,64, и в
2,4 раза – у особей опытной группы (0,62). Уменьшение белкового индекса (коэффициента) может встречаться при нарушениях работы печени, сопровождающейся снижением её метаболической активности. Референсные значения у серебряного карася составляют от 0,51 до 1,43 единиц. Данный показатель к концу эксперимента стабилизировался и стал соответствовать оптимальным параметрам.
Глюкоза является основным углеводом плазмы крови и основным энергетическим материалом для организма. Все ткани организма постоянно используют глюкозу или для энергетических целей, или для синтеза других метаболитов – гликогена, пентоз, липидов, аминокислот. Концентрация глюкозы в крови зависит от многих факторов, и её уровень в определённый момент времени – это баланс между её поступлением в кровь и выходом из кровяного русла.
Согласно литературным данным, уровень глюкозы у карасей в среднем составляет 3,9–4,6 ммоль/л. По результатам нашего исследования концентрация глюкозы у рыб контрольной группы на начало опыта составляла 3,73±0,36 ммоль/л, в конце эксперимента данный показатель несколько снизился и составил 3,11±0,7 ммоль/л. У особей опытной группы уровень глюкозы на начало исследований соответствовал 4,24±0,50 ммоль/л, к концу опыта содержание глюкозы увеличилось на 6,1% и составило 4,5±0,8 ммоль/л. Полученный уровень глюкозы входит в диапазон физиологических норм. Небольшие изменения уровня глюкозы контрольной и опытной групп связаны с обменом веществ и определяются характером питания.
При сравнении показателей опытной группы с контрольной группой по окончании эксперимента различия оказались недостоверны (рисунок 4) .
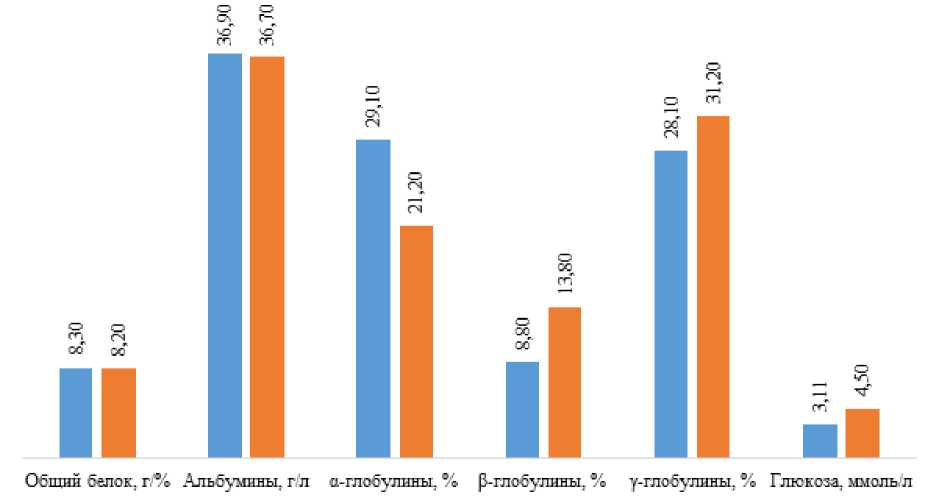
■ Контрольная группа ■ Опытная группа
Рисунок 4 – Динамика биохимических показателей крови комет подопытных групп по окончании эксперимента
Кровь, как наиболее лабильная ткань живого организма, активно реагирует на действие различных факторов и приводит к восстановлению равновесия между организмом и средой. Результаты клинико-морфологического исследования крови рыб представлены в таблице 3.
Таблица 3 – Динамика клинико-морфологических показателей крови комет в ходе эксперимента
|
Показатель |
До начала эксперимента |
В конце эксперимента |
||
|
контрольная группа (n=5) |
экспериментальная группа (n=5) |
контрольная группа (n=5) |
экспериментальная группа (n=5) |
|
|
RBC, 1012 /л |
2,28±0,16* |
2,15±0,14* |
1,78±0,30 |
2,79±0,27 |
|
WBC,109 /л |
50,91±8,17* |
36,73±4,27 |
33,58±9,41 |
29,17±1,053 |
|
PLT,109/л |
41,23±9,69 |
45,16±11,71 |
30,17±11,55 |
50,79±6,74# |
|
Лимфоциты, % |
72,36±4,71 |
78,60±7,31 |
63,74±6,11 |
63,70±6,83 |
|
Моноциты, % |
9,08±2,63 |
4,52±2,21# |
13,36±2,90 |
7,60±2,43 |
|
Миелоциты, % |
1,40±0,60 |
0,64±0,30* |
1,67±1,31 |
7,00±0,81# |
|
Метамиелоциты, % |
2,40±1,17 |
0,64±0,30* |
4,72±1,77 |
4,38±1,70 |
|
Палочкоядерные нейтрофилы, % |
4,36±0,51 |
6,50±2,06 |
7,12±0,58 |
5,64±1,37 |
|
Сегментоядерные нейтрофилы, % |
10,40±2,47* |
9,10±2,65 |
5,58±1,48 |
11,68±4,14# |
|
Гемоглобин, г/л |
78,95±7,39 |
80,12±3,23* |
80,99±13,63 |
103,64±15,08# |
|
# Различия с контрольной группой достоверны (р≤0,05) * Различия со значением аналогичной группы в конце эксперимента достоверны (р≤0,05) |
||||
Изучение морфологических изменений элементов крови, оценка цитофизиологических особенностей и изменений клеток крови является необходимым элементом наблюдения за состоянием популяций рыб как в рыбоводной практике, так и при прогнозировании динамики популяций в естественных условиях [4].
Наблюдая за количественной динамикой клеток крови комет (рисунок 5), можно отметить снижение трех популяций клеток (эритроцитов, лейкоцитов и тромбоцитов) у рыб контрольной группы (на 22, 34 и 27% соответственно) и снижение лейкоцитов в крови рыб опытной групп (на 21%), но в то же время отличающуюся динамику эритроцитов и тромбоцитов. У рыб опытной группы их количество увеличилось на 30 и 12,5% соответственно.
Контр о льнля груп пя ^пьгт няя ГР У пп я
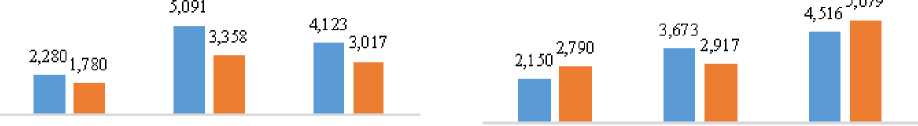
Эршроциы Лейкощпы Трсмбсцты Эритроциты Лейкозы Тромбоциты
В ™е эксперта i В кощ; зкшер™ -В начата эксперимента . В кшще эксперимента
Эритроциты, 10й /л; Лейкоциты, 109 /л*10; Тромбоциты, 10s* /л*10
Рисунок 5 – Динамика количественных показателей клеток крови комет в контрольной и опытной группах
Снижение количества клеток крови можно объяснить её потерей при отборе на анализы, но увеличение их количества можно связать только со с стимулирующим гемопоэз факторами.
Одновременно с увеличением количества эритроцитов в крови рыб опытной группы произошло и значительное увеличение количества гемоглобина с 80,99±13,63г/л до 103,64±15,08 г/л (на 30%) (рисунок 6).
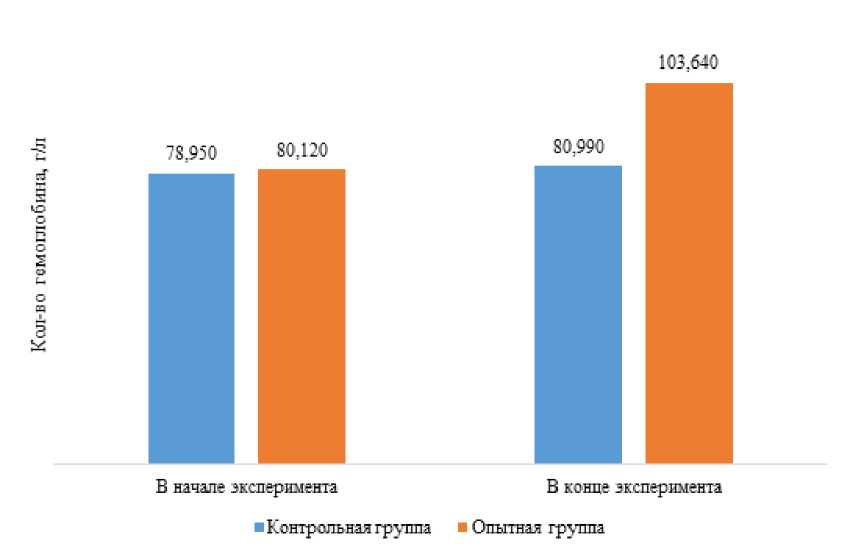
Рисунок 6 – Динамика гемоглобина в крови комет контрольной и опытной групп
Причины повышения эритроцитов и гемоглобина обычно связывают с компенсаторной реакцией организма на дефицит кислорода, но, в связи с отсутствием данных о референсных интервалах клиникоморфологических показателей крови комет, мы можем высказать только предположение.
Одним из главных физиологических показателей крови для рыб является лейкограмма, так как процентное соотношение разных типов клеток крови отражает функциональное состояние организма [24, 25]. Лейкоциты комет представлены в основном лимфоцитами, но встречаются и другие клетки белой крови (рисунок 7).
Рисунок 7 – Лейкоциты в крови кометы
Анализируя динамику различных видов лейкоцитов в крови рыб контрольной и опытной групп, можно отметить аналогичные изменения количества лимфоцитов, моноцитов и молодых форм нейтрофилов в обеих группах, указывающие на стрессовое состояние рыб (рисунок 8).
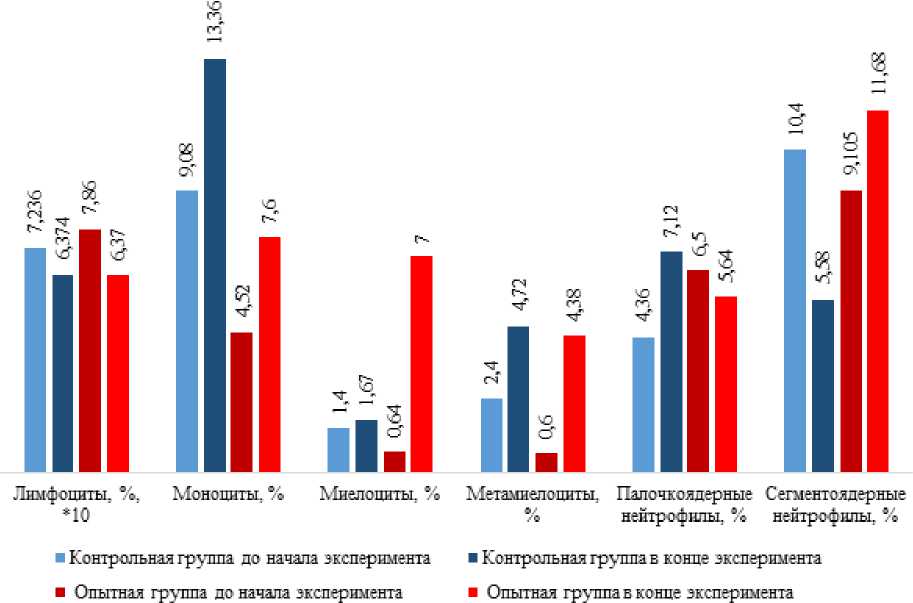
Рисунок 8 – Динамика показателей лейкограммы в крови комет контрольной и опытной групп
Рыбы на воздействие стрессов в большинстве случаев реагируют снижением доли содержания лимфоцитов, или лимфопенией, и увеличением моноцитов. Лимфопения является неблагоприятным для здоровья и адаптации рыб признаком, отражающим снижение эффективной работы иммунной системы [1].
ПоданнымЛ.В. Балабановой, стресс-маркеромявляетсяувеличение бластных клеток в крови рыб после воздействия гормонов стресса [1]. В нашем исследовании количество молодых форм нейтрофилов, в том числе миелоцитов, увеличилось в крови рыб обеих групп, но в крови опытных рыб их число выросло в 7–10 раз, что значительно выше, чем в крови контрольной группы. В то же время, количество зрелых сегментоядерных нейтрофилов уменьшилось в два раза в крови рыб контрольной группы, но увеличилось на 30% у подопытных рыб. Основной функцией нейтрофилов является иммунная активность против бактерий.
Таким образом, при изучении ростовых значений, биохимических и клинико-морфологических показателей крови комет опытной группы по сравнению с особями из контрольной группы достоверных различий получено не было. В связи с этим можно предположить, что вода, прошедшая специальную подготовку, не оказала отрицательного влияния на здоровье изучаемых гидробионтов.
Список литературы Влияние биологической активности воды на рост и показатели крови комет (Carassius gibelio forma Auratus (Bloch, 1782))
- Балабанова, Л.В. Реакция лейкоцитов карпа Cyprinus carpto L. на гормоноиндуцированный стресс / Л.В. Балабанова, Д.В. Микряков, В.Р. Микряков // Биология внутренних вод. - 2009. - № 1. - С. 91-93.
- Бакаева, Е.Н. Гидробионты в оценке качества вод суши / Е.Н. Бакаева, А.М. Никаноров; Российская акад. наук, Ин-т водных проблем. - Москва: Наука, 2006 (СПб.: Типография «Наука»). - 237с.
- Бакаева, Е.Н. Исследование состояния поверхностных вод на основе комплекса биологических методов / Е.Н. Бакаева, Н.А. Игнатова. URL: https://watermagazine.ru/nauchnye-stati2/novye-stati/23151-issledovanie sostoyaniya-poverkhnostnykh-vod-na-osnove-kompleksa-biologicheskikh-metodov.html?ysclid = lv0piaurhq528437522 (дата обращения: 09.04.2024).
- Березина, Д.И. Динамика уровня фибриногена в крови рыб под влиянием стресса / Д.И. Березина, Л.Л. Фомина // Молочнохозяйственный вестник. - 2018. - № 3 (31). - С. 8-15.
- Биохимическая индикация состояния рыб. URL: https:// ecoportal.su/public/bio/view/1973.html/ (дата обращения: 09.04.2024).
- Влияние температурного фактора на показатели коагуляции крови продуктивных животных и рыб in vitro / Л.Л. Фомина, Д.И. Березина, Т.С. Кулакова, К.Э. Моданова // Вестник Ульяновской государственной сельскохозяйственной академии. - 2023. - № 4 (64). - С. 85-90. - DOI: 10.18286/1816-4501-2023-4-85-90
- Головина, Н.А. Лабораторный практикум по физиологии рыб: учебное пособие / Н.А. Головина, Н.Н. Романова. - Санкт-Петербург: Лань, 2019. - 136 с.
- Григоренко, А.А. Изучение биологического загрязнения с помощью водных объектов / А.А. Григоренко // Молодые исследователи - регионам: материалы Международной научной конференции. В 3-х томах. Вологда, 20-21 апреля 2021 года / глав. ред. С.Ф. Митенева. Т. 1. - Вологда: Вологодский государственный университет, 2021. - С. 413-414.
- Гулиев, Р.А. Некоторые биохимические показатели крови рыб дельты Волги / Р.А. Гулиев, Э.И. Мелякина // Вестник АГТУ. Серия: Рыбное хозяйство. - 2014. - № 2. - С. 85-91.
- Захаров, И.С. Методы и средства микробиотестирования токсичности водных сред / И.С. Захаров, И.В. Алешин // Фундаментальная и прикладная гидрофизика. - 2015. - Т. 8. № 2. - С. 75-95.
- Иванова, Н.Т. Атлас клеток крови рыб (сравнительная морфология и классификация форменных элементов крови рыб) / Н.Т. Иванова. - М.: Легкая и пищевая промышленность, 1982. - 184 с.
- Иванова, Н.Т. Система крови / Н.Т. Иванова. - Ростов-на-Дону, 1995. - 155 с.
- Кадермас, И.Г. Экологическая токсикология: учеб. пособ. / И.Г. Кадермас, А.В. Синдирева. - Омск: Издательский центр Кан, 2021. - 80 с.
- Кулакова, Т.С. Эффективность использования гранулированной пивной дробины в кормлении нильской тиляпии при выращивании в УЗВ: отчет о НИР / Т.С. Кулакова; ФГБОУ ВО Вологодская ГМХА. -2022. - 50 с.
- Кулакова, Т.С. Гидробиологический мониторинг водоемов, как элемент учебно-полевой практики по зоологии / Т.С. Кулакова, Т.Ф. Маслова // Передовые достижения науки в молочной отрасли: сб. науч. трудов по результатам работы IV Международной научно-практической конференции, посвящ. дню рождения Н.В. Верещагина, Вологда-Молочное, 25 октября 2022 года. Т. 2. - Вологда; Молочное: Вологодская государственная молочнохозяйственная академия им. Н.В. Верещагина, 2022. - С. 175-178.
- Мельцова, Т.С. Биоиндикация как метод оценки сапробности воды / Т.С. Мельцова, Т.С. Кулакова // НИРС - Первая ступень в науку: Международная научно-практическая конференция, посвящ. 80-летию зооинженерного факультета, Вологда-Молочное, 17-21 мая 2010 года. - Вологда; Молочное: Вологодская государственная молочнохозяйственная академия им. Н.В. Верещагина, 2010. - С. 5355.
- Методические указания по проведению гематологического обследования рыб №13-4-2/1487 от 02.02.99 г. - М.: Минсельхозпрод, 1999.
- Молчатский, С.Л. Эколого-аналитический контроль состояния окружающей среды: учеб. пособ. / С.Л. Молчатский, Е.Г. Нелюбина. -Москва: Ай Пи Ар Медиа, 2023. - 166 с.
- Нестеров, С.С. Использование методов биоиндикации и химического анализа воды для мониторинга экологического состояния и уровня сапробности водоемов / С. С. Нестеров // Молодой ученый. - 2022. - № 19 (414). - С. 39-46. - URL: https://moluch.ru/archive/414/91467/ (дата обращения: 09.04.2024).
- Осипова, И.В. Определение качества вод методом биотестирования / И.В. Осипова // Лучшая исследовательская работа 2022: сборник статей III Международного научно-исследовательского конкурса, Петрозаводск, 23 ноября 2022 года. - Петрозаводск: Международный центр научного партнерства «Новая Наука» (ИП Ивановская И.И.), 2022. - С. 177-182.
- Правдин, И.Ф. Руководство по изучению рыб (преимущественно пресноводных) / И.Ф. Правдин. - 4-е изд., перераб. и доп. - Москва: Пищевая промышленность. 1966. - 267 с.
- Сергеев, М.О. Гематологические и биохимические особенности крови карася (Carassius) из озера Маян Челябинской области, содержащегося в искусственных условиях / М.О. Сергеев, К.А. Корляков // Вестник совета молодых ученых и специалистов Челябинской области. - 2021. - Т. 1. № 3 (34). - С. 9-16.
- Сергеев, М.О. Биохимические особенности крови карасей (Carassius), содержащегося в искусственных и естественных условиях обитания / М.О. Сергеев, К.А. Корляков // Вестник совета молодых ученых и специалистов Челябинской области. - 2022. - Т. 2. № 2 (37). - С. 4-11.
- Особенности естественной резистентности и физиолого-био-химического статуса у телят с признаками диареи / Е.С. Ткачева, Ю.Л. Ошуркова, Л.Л. Фомина, Ю.А. Воеводина // Молочнохозяйственный вестник. - 2019. - № 3 (35). - С. 51-61.
- Фомина, Л.Л. Влияние различных факторов среды обитания на гематологические показатели рыб: отчет о НИР / Л.Л. Фомина; ФГБОУ ВО Вологодская ГМХА, 2018. - 47 с.
- Хасанова, А.Д. Гидробионты в качестве биоиндикатора водной экосистемы / А.Д. Хасанова, А.В. Шамраев, Г.П. Алехина // Университетский комплекс как региональный центр образования, науки и культуры: сборник материалов Всероссийской научно-методической конференции, Оренбург, 26-27 января 2023 года. - Оренбург: Оренбургский государственный университет, 2023. - С. 4506-4509.


