Влияние ценных компонентов биомассы Chlorella sorokiniana на жизнедеятельность дрожжей Saccharomyces cerevisiae
Автор: Кузнецова Т.А., Иванченко О.Б.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Технология продовольственных продуктов
Статья в выпуске: 11, 2019 года.
Бесплатный доступ
Цель исследования - изучение влияния дезинтегрированной биомассы микроводоросли Сhlorella sorokiniana на активность дрожжей при брожении. Материал исследования - воздушно-сухая биомасса, полученная при культивировании прекультуры С. sorokiniana (штамм 211-8k), сухие хлебопекарные дрожжи S. cerevisiae. Необходимым технологическим этапом является предварительная подготовка биомассы С. sorokiniana путем дезинтеграции. Наиболее часто используют способы дезинтеграции ультразвуковой, микроволновой дезинтеграции и с помощью высокочастотного гомогенизатора. Дезинтегрированная биомасса была внесена в питательную среду в количестве 20 мг%. Подготовленную водную суспензию с биомассой хлореллы использовали в качестве дополнительного компонента питательной среды на стадии внесения чистой культуры дрожжей. В качестве питательной среды использовали квасное сусло. В 100 мл квасного сусла вносили 10 мл суспензии с содержанием биомассы хлореллы 20 мг. Масса внесенных лиофилизированных дрожжей составляла 0,1 г/100 мл питательной среды...
Сhlorella sorokiniana, дезинтеграция биомассы, активирование метаболизма, биодоступность, биологически активные вещества
Короткий адрес: https://sciup.org/140245595
IDR: 140245595 | УДК: 663.12 | DOI: 10.36718/1819-4036-2019-11-151-157
Текст научной статьи Влияние ценных компонентов биомассы Chlorella sorokiniana на жизнедеятельность дрожжей Saccharomyces cerevisiae
Введение. Повышение эффективности технологических процессов на бродильных производст-
Вестник КрасГАУ. 2019. № 11 вах, а также повышение качества готовой продукции является в настоящее время важным вопросом. Его решение связано с увеличением метаболической активности дрожжей-сахаромицетов. С целью регуляции обменных процессов в дрожжевой клетке сегодня широко используются препараты, способствующие стимулированию размножения и роста клеток, повышению их активности, улучшению транспорта питательных веществ, более полному сбраживанию экстрактивных веществ, увеличению устойчивости к стрессовым факторам, включая высокие концентрации спирта, низкие температуры, микоцины и др. [1].
Большинство подкормок для дрожжей, разрешенных в РФ, производят за рубежом. Наряду с подкормками применяют различные стимуляторы, для их приготовления используют растительное сырье (в том числе гидробионты), реже сырье животного происхождения [2]. В последнее время были предложены способы активации дрожжей с применением микроводоросли Spirulina platensis [3, 4]. Активацию дрожжей проводят путем внесения водоросли в готовую питательную среду или в экспоненциальной фазе роста дрожжей в сухом измельченном виде или в виде водной суспензии. Отмечено возрастание ферментативной активности, в особенности комплекса гидролитических ферментов. Клеточная оболочка спирулины легко разрушается под действием гидролитических ферментов в отличие от клеточных оболочек эукариотических водорослей, в том числе и Chlorella [3].
Проблема доступности ценных компонентов в микроводорослях может решаться предварительной дезинтеграцией клеточных оболочек различными способами, наиболее широко используются механические способы под действием силы сдвига твердого тела (бисерная мельница, высокоскоростной гомогенизатор) или силы сдвига жидкости (гомогенизация под давлением, микрофлюидизация) [4, 5]; также при ультразвуковой обработке и под действием электромагнитного излучения в сантиметровом диапазоне (СВЧ) [6].
C. sorokiniana – перспективный, быстро растущий в биореакторах вид. В сухой биомассе содержится в среднем 40 % протеинов, 30–38 % углеводов, 18–22 % липидов [7]. Большой интерес представляют антиоксиданты хлорофилл (3,5 % от сухой биомассы) [8]; каротиноиды, ко- торые составляют до 0,69 % в пересчете на сухую биомассу [7]. В белке хлореллы находятся все незаменимые аминокислоты, необходимые для роста дрожжей. В 1 г массы сухого вещества водоросли содержится витамина В1 – 2– 18 мкг; В2 – 21–28; В6 – 9; С – 1300–1500; К – 6; РР – 110–180; Е – 10–350; пантотеновой кислоты – 12–17; фолиевой кислоты – 485; биотина – 0,1; лейковорина – 22 мкг [9].
Биомасса хлореллы богата хлорофиллом, в состав порфириновой группы которого входит ион магния. Магний необходим как для энергетического, так и конструктивного обмена дрожжей, так как он является кофактором многих ферментов (гексокиназа, глюкозофосфатизомераза, перуватфосфокиназы, фосфотрансферазы и др.) и активатором гликолиза. Магний также является активатором пируватдекарбоксилазы и необходим для спиртового брожения [10]. Ион магния участвует во многих метаболических процессах и повышает эффективность брожения [11].
Цель исследования : изучение влияния дезинтегрированной биомассы микроводоросли Сhlorella sorokiniana на активность дрожжей при брожении.
В соответствии с целью исследования поставлены задачи :
– определить показатели бродильной активности – спиртообразующую способность, экстрактивность, видимую степень сбраживания, а также интенсивность почкования дрожжевых клеток;
– определить наилучший способ дезинтеграции биомассы хлореллы, позволяющий усилить бродильную активность дрожжей ( Saccharomyces cerevisiae ).
Материалы и методы исследования . Для исследования была использована воздушносухая биомасса, полученная при культивировании прекультуры С. sorokiniana (штамм 211-8k) [12], сухие хлебопекарные дрожжи S. cerevisiae (производство ООО «САФ-НЕВА», г. Санкт-Петербург). В использованной воздушно-сухой биомассе С. sorokiniana содержание влаги не превышало 2,5 %.
Для приготовления водной суспензии биомассу предварительно подвергали механической гомогенизации, заливали водой и подвергали различным способам дезинтеграции: механический способ заключен в измельчении биомассы с помощью высокоскоростного гомогенизатора Silent Crusher М (IKA® Werke, T25 Basic)
в режиме 10 000 об/мин в течение 2 мин; ультразвуковой способ заключается в воздействии на суспензию биомассы хлореллы ультразвука (40 кГц в течение 30 мин при 45 °С) на приборе WUC-A01H DAIHAN [13]; микроволновая дезинтеграция заключалась в воздействии на суспензию биомассы хлореллы СВЧ (с частотой 2,450 МГц, в течение 5 мин), при этом температура превышала 100 °С (микроволновая печь BBK 17MWS-781M/W). В качестве контроля использовали дрожжи без добавки дезинтегрированной биомассы хлореллы в питательную среду их культивирования.
Подготовленную водную суспензию с биомассой хлореллы использовали в качестве дополнительного компонента питательной среды на стадии внесения чистой культуры дрожжей. В качестве питательной среды использовали квасное сусло (плотность 1,030 г/мл, экстрактивность 8,5 %), с содержанием сахаров 6 г/100 мл. В 100 мл квасного сусла вносили 10 мл суспензии с содержанием биомассы хлореллы 20 мг. Масса внесенных лиофилизированных дрожжей составляла 0,1 г/100 мл питательной среды.
Брожение проводили в течение 6 ч при температуре 32±2 °С. Содержание спирта, видимую степень сбраживания определяли с помощью анализатора «Колос-2». Концентрацию дрожжевых клеток в суспензии определяли путем подсчета в камере Горяева [14].
Морфофизиологические характеристики дрожжевых клеток были определены при анализе прижизненных препаратов с помощью микроскопа «Микмед-5», микрофотографии сделаны с помощью цифровой видеокамеры для микроскопа IS-500, анализ и измерение микроскопических объектов проводились с помощью компьютерной программы Levengik. Для морфофизиологического анализа дрожжевых клеток в популяции их ранжировали на «основные», подвергшиеся репликации (по форме более округлые); «молодые» клетки, которые достигли площади проекции основных, но имели более вытянутую форму. Объем и площадь дрожжевых клеток были найдены по формулам для эллипсоида [15], для этого находили длинную и короткую ось клеток:
K =
S _ 4 n [ ( 2 apb p + b2p ) /з ] 1/ p
V~ 4 a
—x n x a x b x c
где К – коэффициент формы дрожжевой клетки, мкм-1; S - площадь эллипса, мкм2; V – объем дрожжевой клетки, мкм3; π - число (3,1415), a -длина большой полуоси, мкм; b - длина малой полуоси, мкм; p = 1,6075.
Количество клеток, измеренных в популяции в каждой группе, – 50.
Результаты исследования и их обсуждение. Бродильная активность дрожжей зависит от их физиологического состояния, штаммовых особенностей, спиртообразующей способности и полноценности питания дрожжей. Как показало исследование, наиболее интенсивное спир-тообразование наблюдается в образце с добав- ками биомассы хлореллы, подвергшейся микроволновой (СВЧ) и механической дезинтеграции. Содержание спирта превышает контроль в среднем на 43,45 и 5,17 % соответственно (табл. 1).
Видимая степень сбраживания – показатель, определяемый отношением видимого экстракта напитка брожения к экстрактивности начального сусла, выраженный в процентах. Этот показатель также возрастает относительно контрольного образца наиболее существенно (на 39,2 %) в варианте с применением биомассы С. sorokiniana , подвергшейся микроволновой дезинтеграции.
Таблица 1
|
Показатель брожения |
Квасное сусло |
Контроль |
Способы дезинтеграции биомассы хлореллы |
||
|
ВГ |
УЗВ |
СВЧ |
|||
|
Экстрактивность, % |
8,5 |
5,1±0,26 |
4,9±0,25 |
5,2±0,30 |
4,5±0,23 |
|
Плотность, г/мл |
1,0301 |
1,0170± 0,0509 |
1,0160± 0,0508 |
1,0176± 0,0510 |
1,0141± 0,0450 |
|
Объемная доля спирта, об% |
0 |
0,93±0,03 |
1,07±0,04 |
0,90±0,03 |
1,30±0,04 |
|
Видимая экстрактивность, % |
7,9 |
4,7±0,2 |
4,5±0,2 |
4,8±0,2 |
3,9±0,2 |
|
Видимая степень сбраживания |
2,0 |
28,6±1,4 |
32,5±1,6 |
26,3±1,3 |
39,8±1,9 |
Примечание : ВГ – высокочастотный гомогенизатор; УЗВ – ультразвуковое воздействие; СВЧ – микроволновая дезинтеграция.
Физико-химические показатели брожения дрожжей при их активировании биомассой
Согласно полученным данным (рис. 1), внесение биомассы хлореллы способствует интенсификации деления клеток дрожжей в варианте с микроволновой дезинтеграцией биомассы.
Максимальное число клеток на конец брожения в образце с добавлением биомассы хлореллы, подвергшейся микроволновому воздействию, на 31 % превышает контроль. Положительно влияние на накопление дрожжевой биомассы добавки микроводоросли Chlorella (в концентрации 20 мг%) отмечено в сходных исследованиях [16], однако предварительная обработка биомассы в настоящем исследовании способствует усилению эффекта.
Известно, что размер и форма клеток одного и того же штамма могут варьировать в определенных пределах в зависимости от условий культивирования. Накопление питательных веществ и ферментов, удвоение ДНК происходит в интерфазу, почкование происходит при достижении материнской клеткой критического размера.
После отделения почки на материнской клетке образуется рубец – дочерний шрам. Реплик-тивное старение сопровождается утолщением клеточной стенки, клетка приобретает округлую форму в отличие от молодых клеток, имеющих более удлиненную форму [14, 15].
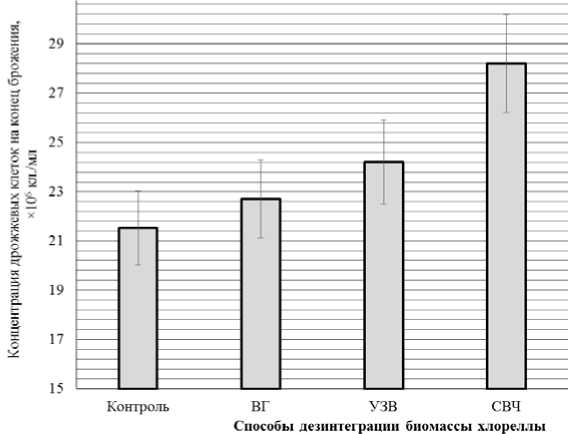
Рис. 1. Количество дрожжевых клеток в суспензии на конец брожения, ×106 кл. / мл: ВГ – высокоскоростной гомогенизатор; УЗВ – ультразвуковое воздействие;
СВЧ – микроволновая дезинтеграция
Наиболее информативными морфофизиологическими показателями дрожжевых клеток является отношение площади поверхности клетки к ее объему (рис. 2).
Репликативное старение сопровождается снижением этого показателя. На рисунке 2 пред- ставлены значения коэффициента формы для популяций дрожжей в вариантах с добавками биомассы С. sorokiniana, подвергшейся различным способам дезинтеграции.
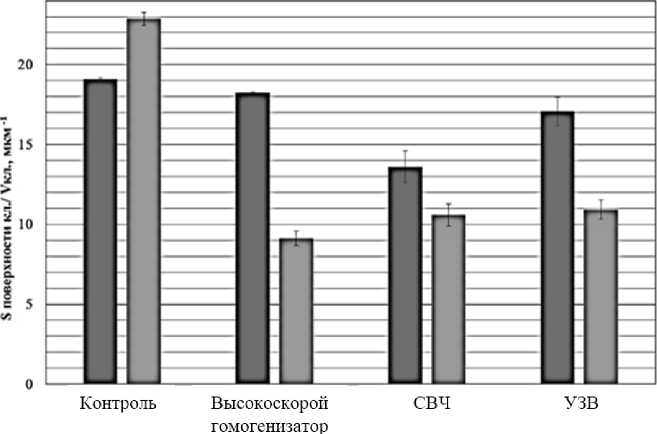
II - «основные» клетки; НН - «молодые» клетки
Рис. 2. Отношение площади поверхности к объему ранжированных по возрасту дрожжевых клеток при влиянии биомассы хлореллы, подвергшейся разным способам дезинтеграции:
ВГ – высокоскоростной гомогенизатор, УЗВ – ультразвуковое воздействие;
СВЧ – микроволновая дезинтеграция
Показатель был найден для двух возрастных групп в каждой популяции: для молодых и основных клеток. Отношение площади поверхности к ее объему при добавлении биомассы хлореллы имеет тенденцию к снижению, наиболее существенное снижение наблюдается в варианте, где биомасса подвергалась СВЧ-дезинтеграции. Интенсификация почкования приводит к быстрому репликативному старению клеток в популяции, что связано с изменением формы клеток.
Выводы. Биомасса С. sorokiniana (количество вносимой биомассы 20 мг на 100 мл питательной среды), подвергшаяся предварительно СВЧ-дезентеграции, усиливает бродильную активность дрожжей. При этом увеличивается спиртообразующая способность дрожжей (на 43,5 %) и видимая степень сбраживания (на 39,2 %), интенсивность почкования (количество дрожжевых клеток в популяции увеличивается на 31,0 %) по сравнению с вариантом без добавления биомассы. Ультразвуковая и механическая дезинтеграции биомассы микроводоросли менее эффективны для активирования S. cerevisiae .
Проблема регулирования метаболических процессов дрожжей на бродильных производствах остается актуальной, поэтому ведется поиск дешевых, эффективных натуральных препаратов, позволяющих интенсифицировать процессы брожения и улучшить качество готовой продукции. Использование микроводорослей сопряжено с решением проблемы повышения биодоступности ценных компонентов из них и использование их в качестве стимуляторов жизненной активности дрожжей.
Список литературы Влияние ценных компонентов биомассы Chlorella sorokiniana на жизнедеятельность дрожжей Saccharomyces cerevisiae
- Пермякова Л.В. Классификация стимуляторов жизненной активности дрожжей // Техника и технология пищевых производств. - 2016. - № 3 (42).- С. 46-55.
- Пермякова Л.В. Совершенствование технологии получения пива путем предварительной подготовки дрожжей // Инновации в пищевой биотехнологии: сб. тр. междунар. симпозиума / под общ. ред. А.Ю. Просекова. - Кемерово, 2018. - С. 486-489.
- Пат. РФ № 2 145 351 C1. Способ активации дрожжей / Гернет М.В., Лаврова В.Л., Корнеев А.Д., Лямин М.Я., Зайцев С.И., Кузнецова Л.В., Иванов А.А., Воробьева В.В. - Заявл. 24.08.1999; опубл. 10.02.2000.
- Сафина Д.Р., Халимов М.Н., Турсунов Ф.Р., Решетник О.А. Способы повышения бродильной активности хлебопекарных дрожжей // Integral. - 2019. - № 1. - С. 94-119.
- Patras D., Moraru C.V., Socaciu C. Screening of bioactive compounds synthesized by microalgae: a progress overview on extraction and chemical analysis // Studia UBB chemia. - 2018. - LXIII, 1. - Pp. 21-35.
- Jaeschke D.P., Rech R., Ferreira Marczak L.D., Mercali G.D. Ultrasound as an alternative technology to extract carotenoids and lipids from Heterochlorella luteoviridis // Bioresource Technology. - 2017. - 224. - Рр. 753-757.
- Lizzul A. M., Lekuona-Amundarain A., Purton S. and Campos L.C. Characterization of Chlorella sorokiniana, UTEX 1230 / Alessandro Marco Lizzul, Aitor Lekuona-Amundarain, Saul Purton and Luiza Cintra Campos // Biology. - 2018. - № 7. - Pp. 1-25.
- Bazarnova Y., Kuznetsova T., Boysen H.E. Мethods for concentrating the cell suspension of сhlorella microalgae for obtaining pigment complex // International Journal of Civil Engineering and Technology. - 2018. - Т. 9, № 10. - С. 340-350.
- Состав хлореллы. - URL: http://algobiotehno-logia.com/shop/?gid=98.
- Меледина Т.В., Давыденко С.Г. Дрожжи Saccharomyces cerevisiae. Морфология, химический состав, метаболизм: учеб. пособие. - СПб., 2015. - 88 с.
- Udeh H.O., Kgatla T.E. Role of magnesium ions on yeast performance during very high gravity fermentation // Journal of Brewing and Distilling. - 2017. - Vol. 4(2). - Pp. 19-45.
- Патент на изобретение RUS. 2668162 Способ культивирования микроводоросли Chlorella / Политаева Н.А., Базарнова Ю.Г., Смятская Ю.А., Кузнецова Т.А., Трухина Е.В. - Опубл. 06.12.2017.
- Базарнова Ю.Г., Кузнецова Т.А., Смятская Ю.А. Способ получения пигментного комплекса из биомассы одноклеточных водорослей рода Chlorella: патент на изобретение РФ. 2695879. - Опубл. 29.07.2019.
- Кузнецова Т.А., Иванченко О.Б., Калинкин Н.С. Влияние компонентов шиповника на морфофизиологическое состояние клеток дрожжей // Международный научно-исследовательский журнал. - 2017. - № 8-2 (62). - С. 16-20.
- Боргоякова А.С., Кузнецова Т.А. Морфофизиологическая оценка стрессовых реакций клеток Saccharomyces cerevisiae на токсическое влияние спирта // Неделя науки СПбПУ: мат-лы науч. конф. с междунар. участием. - СПб., 2017. - С. 8-10.
- Моргунова Е.М., Нефёдов Л.И., Назарова Ю.С. Влияние микроскопической водоросли хлореллы на интенсивность роста дрожжей Saccharomyces cerevisiae // Пищевая промышленность: наука и технологии. - 2013. - № 4 (22). - С. 65-69.


