Влияние источника углерода на накопление биомассы целлюлозолитических микроорганизмов - продуцентов кормовой добавки
Автор: Новикова Т.В., Воеводина Ю.А., Рыжакина Т.П.
Журнал: Молочнохозяйственный вестник @vestnik-molochnoe
Статья в выпуске: 4 (60), 2025 года.
Бесплатный доступ
В статье представлены результаты исследования по подбору компонентов и оптимизации состава питательных сред для культивирования целлюлозолитических микроорганизмов. Методом спектрофотометрии была оценена эффективность накопления микробной массы 19 штаммов в трех вариантах питательных сред, отличающихся по источнику углерода. Установлено, что среда с труднодоступным источником углерода обеспечивает медленный, но стабильный рост, тогда как среда с легкодоступным источником вызывает быстрый, но неустойчивый рост с последующим метаболическим истощением. Наиболее эффективной оказалась комбинированная среда, которая обеспечивает как высокую начальную скорость роста за счет легкодоступной лактозы, так и длительную стабильность за счет трудногидролизуемой КМЦ, что делает ее оптимальной для культивирования целлюлозолитических микроорганизмов.
Целлюлозолитические микроорганизмы, питательные среды, культивирование, карбоксиметилцеллюлозна (КМЦ), лактоза, рубцовый фильтрат, рост микробной биомассы, оптическая плотность, спектрофотометрия
Короткий адрес: https://sciup.org/149150046
IDR: 149150046 | УДК: 636.085.3 | DOI: 10.52231/2225-4269_2025_4_207
Текст научной статьи Влияние источника углерода на накопление биомассы целлюлозолитических микроорганизмов - продуцентов кормовой добавки
Рост и размножение биомассы микроорганизмов в рубце происходит лишь при оптимальных условиях: рН (6,3-6,8 близкой к нейтральной), постоянной температуре (39-40°С), определенном газовом составе (низкое содержание кислорода – анаэробиоз) [1].
Внастоящеевремяразработанобольшоеколичестворазнообразных сред для культивирования целлюлозолитических микроорганизмов. Они могут содержать различные компоненты: синтетические, естественно-биологические или их сочетание [2,3,4,5,6]. Среда должна обеспечивать культуры всеми необходимыми питательными компонентами, способствовать быстрому накоплению микробной массы и обеспечивать сохранение свойств культур.
Углерод. Входит в состав органических соединений, образующих клеточную стенку, а также в состав цитоплазмы. Углерод составляет 40...60% сухого веса микробной клетки.
Водород. Структурный и функциональный элемент. Входит в состав всех органических соединений. В грибной клетке содержится 6...8% от веса сухого мицелия. Входит в состав свободной и связанной воды.
Азот. Входит в состав белков. Микроорганизмы испытывают потребность в аммонийном или аминном (органическом) азоте, также могут быть высоко чувствительны к недостатку азота [7,8,9].
Сера. Входит в состав серосодержащих аминокислот, таких как метионин, цистеин, ферментов, тиамина, биотина. Положительное влияние серы на рост показан в ряде опытов [10,11].
Фосфор. Является компонентом ДНК, РНК, АТФ. АТФ -нуклеозидтрифосфат имеющий большое значение в обмене энергии и веществ в организмах, универсальный источник энергии для всех биохимических процессов, протекающих в живых системах, в частности для образования ферментов. Источниками фосфора в питательных средах могут быть органические и минеральные соединения[12].
Железо. Входит в состав ферментов, важных для метаболизма: цитохромов, цитохромоксидаз, каталазы и др.
Магний (сернокислый магний). Энергия связывания фосфатных групп с активными центрами ферментов снижает энергию активации и увеличивает специфичность ферментативных реакций.
Сахар. Важным источником питания являются углеводные субстраты, в частности целлюлоза - линейный гомополимер состоящий из сотен или десятков тысяч остатков D-глюкозы. Сложное строение делает ее доступной для утилизации только микроорганизмами обладающими определенным набором ферментов. Наличие ее в питательной среде обеспечивает сохранение активности целлюлозолитических микроорганизмов и, являясь единственным источником углеводов, может препятствовать росту других микроорганизмов [13,14].
Важность поддержания буферности растворов (рН). Буферные растворы - растворы с определённой устойчивой концентрацией водородных ионов, рН которых мало изменится при прибавлении к ним небольших количеств сильного основания или сильной кислоты, а также при разбавлении и концентрировании. При добавлении в систему сильной кислоты, она протонирует основание, входящее в буферную смесь, а добавление сильного основания связывает протоны и смещает второе равновесие в сторону продуктов, при этом в итоге концентрация Н + в растворе меняется незначительно. Такие смещения происходят при жизнедеятельности микроорганизмов [15,16].
Таким образом, важным является подбор компонентов среды обеспечивающих оптимальные условия для накопления микроорганизмов.
Материалы и методы
Нами была изучена эффективность накопления микробной массы у тестируемых культур в жидких питательных средах, отличающихся по источнику углерода:
-
- среда Гетчинсона, содержащая в качестве источника углерода карбоксиметилцеллюлозу, состав среды (г/л): K2HPO4 — 1,0; СaCl2*4 H2O — 0,1; MgSO4*H2O — 0,3; NaCl — 0,1; FeCl*6H2O — 0,01; NaNO3 — 2,5; агар-агар — 20,0; дистиллированная вода; рН среды — 7,2-7,3, КМЦ 1%;
-
- питательная среда на основе среды Гетчинсона, содержащая рубцовый фильтрат в количестве 10% и в качестве источника углерода - лактозу 2% (легкодоступный источник);
-
- питательная среда, на основе среды Гетчинсона с рубцовым экстрактом до 10% и содержащая в качестве источника углерода КМЦ 1% (труднодоступный источник) и лактозу 2% (легкодоступный источник).
Оценена активность нарастания микробной массы у 19 штаммов, посуточно, с применением спектрофотометра. Измерение оптической плотности суспензии клеток осуществляли с помощью спектрофотометра ПЭ - 5400УФ (Россия) в кювете с длиной оптического пути 10 мм при длине волны света 550 нм (ОП550), выражали в единицах оптической плотности. Измерения проводили ежедневно в течение пяти дней. Изменение оптической плотности через определенные интервалы времени позволило характеризовать их рост в заданных условиях культивирования, с определением стадии роста культуры.
Турбидиметрия характеризуется быстротой и отсутствием негативного воздействия на клетки, так же является наиболее распространенным аналитическим инструментом для мониторинга роста чистых бактериальных культур [17,18,19,20].
Концентрация микроорганизмов на спектрофотометре определяется по оптической плотности. Она обусловлена поглощением света биологическими молекулами (белками, нуклеиновыми кислотами, липополисахаридами), входящими в состав клеток, и светорассеянием клеток в видимом диапазоне.
В диапазоне от 400 до 900 нм спектр поглощения напрямую зависит от концентрации клеток микроорганизмов в суспензии.
При длине волны 500-650 нм поглощение света компонентами клеток практически отсутствует, и оптическая плотность суспензии клеток обусловлена только светорассеянием. Оптическая плотность, измеренная в этом диапазоне, отражает концентрацию клеток микроорганизмов в суспензии. Оптическая плотность (OD) используется в качестве быстрого косвенного измерения концентрации взвешенной биомассы. Фактически, измерение OD является наиболее распространенным измерением, используемым в микробиологических лабораториях для оценки роста микроорганизмов. OD часто используется для определения стадии роста при индукции культуры, инокуляции. Оптическая плотность напрямую коррелирует с биомассой (закон Бира-Ламберта), таким образом, OD может использоваться для мониторинга биомассы клеток. [21,22,23].
Результаты исследований
Результаты исследований по оценке эффективности для культивирования питательной среды, содержащей труднодоступные углеводы визуализированы в тепловой карте прироста: цветовая шкала позволяет быстро и наглядно оценить эффективность роста микроорганизмов в различных условиях. Цветовое кодирование процента прироста для каждого штамма и каждого дня позволяет отследить общие закономерности и аномалии.
Таблица 1 – Оценка эффективности накопления микробной массы в среде Гетчинсона с КМЦ 1% (тепловая карта)
|
№ штамма |
День 2 День 3 День 4 День 5 Процент прироста микробной массы |
|||
|
1 |
17,6 |
15,0 |
17,4 |
9,8 |
|
2 |
12,9 |
52,4 |
-10,7 |
14,3 |
|
3 |
22,0 |
6,7 |
6,3 |
8,9 |
|
4 |
2,20 |
2,0 |
4,2 |
8,1 |
|
5 |
29,7 |
9,8 |
0,0 |
4,4 |
|
6 |
15,0 |
22,6 |
38,4 |
5,5 |
|
7 |
12,0 |
3,6 |
19,2 |
20,0 |
|
8 |
45,0 |
69,0 |
2,8 |
9,8 |
|
9 |
17,0 |
0,0 |
0,0 |
13,9 |
|
10 |
8,0 |
8,1 |
22,6 |
20,0 |
|
11 |
17,0 |
42,5 |
31,3 |
5,6 |
|
12 |
54,0 |
12,2 |
6,0 |
17,0 |
|
13 |
11,0 |
43,7 |
7,2 |
8,1 |
|
14 |
4,0 |
15,4 |
26,6 |
7,8 |
|
15 |
21,0 |
13,5 |
7,5 |
4,2 |
|
16 |
9,9 |
39,5 |
7,5 |
4,2 |
|
17 |
15,0 |
36,9 |
4,7 |
0,0 |
|
18 |
31,0 |
9,3 |
11,8 |
1,5 |
|
19 |
7,3 |
38,6 |
4,9 |
0,0 |
|
Среднее значение прироста |
18,51 |
7,38 |
7,61 |
6,49 |
|
Стандартное отклонение |
12,99 |
3,31 |
4,51 |
2,52 |
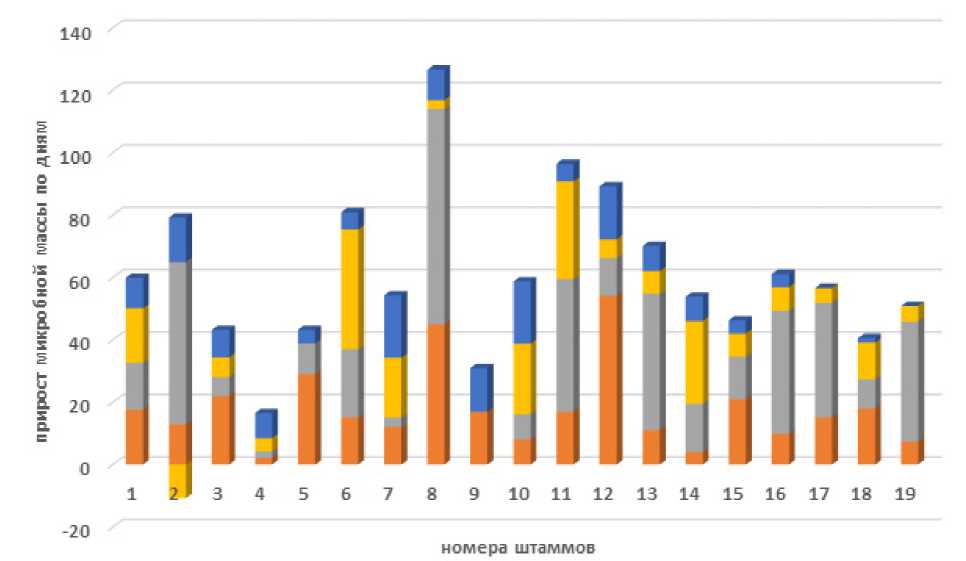
■ День 2 (%) ■ День 3 (%) I День 4 (%) вДень 5 (%)
Рисунок 1 – Посуточная эффективность накопления микробной массы в среде с труднодоступным источником углерода
Анализируя таблицу 1 и диаграмму (рисунок 1), можно отметить следующие изменения в течение периода наблюдения по дням:
-
- большинство штаммов активно накапливают с первых до третьих суток культивирования (это свидетельствует о начальной фазе активного роста), после 3 суток темпы накопления биомассы снижаются, к 5-м суткам все штаммы сохраняют положительную динамику роста;
-
- у всех штаммов можно отметить медленные темпы начального роста. Классификация штаммов по типу роста показывает, что 2 штамма проявляют высокий прирост на 2-3 сутки (>50% массы), медленный, но устойчивый рост демонстрируют 3 штамма; низкие темпы роста (<10% в среднем) также демонстрируют три штамма.
При анализе метаболических паттернов установлено, что:
фаза адаптации (1-2 сутки) - средний прирост 18.5%;
фаза логарифмического роста (2-3 сутки) - средний прирост 26.8%;
фаза стабилизации (4-5 сутки) - средний прирост 8.2%.
Штамм №12 показал наибольший прирост на второй день (54,2%), а также значительный прирост на пятый день (17%). Штамм №8 продемонстрировал очень большой прирост на третий день (69%).
Среднее значение прироста на второй день составляет примерно
17%, что подтверждает общий тренд на начальную активизацию роста. Средний прирост на третий и последующие дни колеблется, но остается положительным, что указывает на продолжающийся рост большинства штаммов.
Данные таблицы свидетельствуют о том, что исследуемые штаммы микроорганизмов проходят через фазы активного роста в первые – третьи сутки, после чего накопление микробной массы протекает с незначительной скоростью. Некоторые штаммы, такие как №12 и №8, демонстрируют экстремально высокие уровни активности на определенных этапах, тогда как другие, например, №4 и №9, растут медленнее.
Среда Гетчинсона с КМЦ обеспечивает медленный, но стабильный рост: средний прирост бактериальной массы на 2-е сутки ~20%, на 3-и сутки ~25%. Отсутствуют резкие спады биомассы (только 2 случая отрицательного прироста).
Таблица 2 – Оценка эффективности накопления микробной массы в питательной среде с рубцовым фильтратом и лактозой(тепловая карта)
|
№ штамма |
День 2 (%) День 3 (%) День 4 (%) Д(е%нь)5 Процент прироста микробной массы |
|||
|
1 |
90,0 |
1,1 |
2,0 |
2,9 |
|
2 |
74,0 |
8,9 |
7,0 |
5,9 |
|
3 |
106,0 |
14 |
5,0 |
-4,7 |
|
4 |
72,0 |
5,2 |
0,0 |
-9,8 |
|
5 |
196,0 |
-12,5 |
0,0 |
-6,4 |
|
6 |
66,0 |
43 |
6,0 |
0,0 |
|
7 |
100,0 |
-8,9 |
-1,7 |
0,0 |
|
8 |
240,0 |
-5,8 |
-2,6 |
1,6 |
|
9 |
74,0 |
-15,4 |
-11,8 |
2,5 |
|
10 |
109,0 |
2,2 |
-1,4 |
0,0 |
|
11 |
120,0 |
11,1 |
1,2 |
2,4 |
|
12 |
119,0 |
-8,8 |
8,8 |
3,6 |
|
13 |
47,0 |
65,1 |
4,6 |
0,5 |
|
14 |
93,0 |
17 |
0,0 |
1,8 |
|
15 |
162,0 |
29 |
-4,7 |
-2,9 |
|
16 |
178,0 |
-3,8 |
-2,5 |
-6,5 |
|
17 |
138,0 |
-7,1 |
-5,4 |
2,3 |
|
18 |
125,0 |
4,6 |
-1,6 |
-3,3 |
|
19 |
129,0 |
-10,5 |
-2,7 |
3,4 |
|
Среднее значение прироста |
117,78 |
6,75 |
0,01 |
-0,35 |
|
Стандартное отклонение |
48,74 |
20,49 |
4,90 |
4,14 |
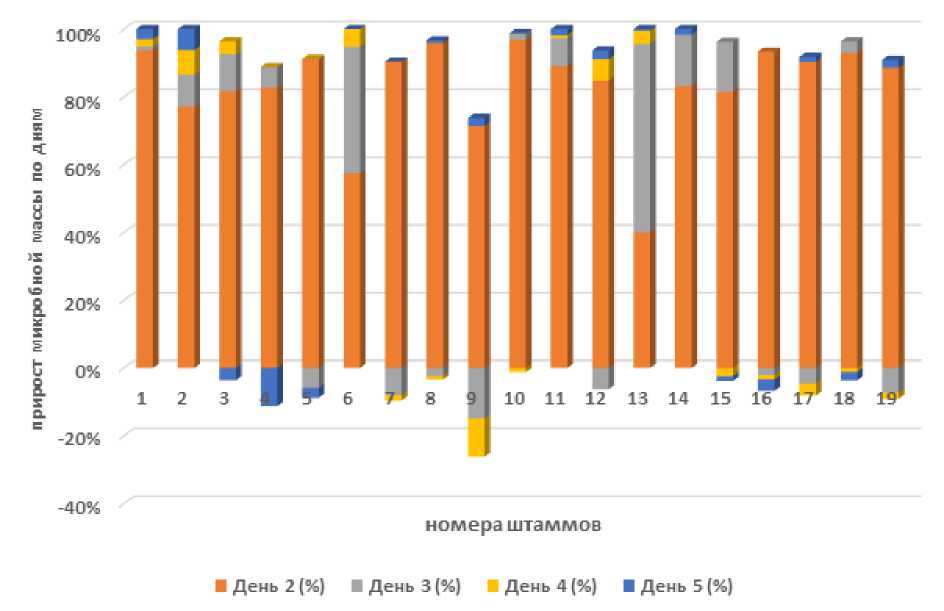
Рисунок 2 – Посуточная эффективность накопления микробной массы в среде с легкодоступным источником углерода
Из представленных материалов видно, что большинство штаммов демонстрируют быстрое и значительное накопление массы в первые сутки культивирования, что свидетельствует о начальной фазе активного роста (см. таблицу 2 и рисунок 2).
Многие штаммы после вторых-третьих суток начинают показывать снижение активности роста, вплоть до отрицательных значений или стабилизацию показателей.
Штамм №5 показал наибольший прирост массы на второй день (196,3%), но также и значительное снижение на третий день (-12,5%) культивирования. Штамм №8 имел максимальный прирост биомассы на первый день (240%) среди всех штаммов. Штаммы №4, №9, №15 и №16 показали заметное снижение активности ближе к пятому дню.
Среднее значение прироста бактериальной массы по всем штаммам на второй день составляет около 50%, что подтверждает общий тренд на начальную активизацию роста.
Данные таблицы свидетельствуют о том, что исследуемые штаммы микроорганизмов проходят через фазы активного роста в первые – вторые сутки культивирования, после чего их активность начинает снижаться или стабилизироваться. При этом некоторые штаммы, такие как №5 и №8, демонстрируют экстремально высокие уровни активности на ранних этапах, тогда как другие, например, №6 и №7, быстрее приходят к состоянию стабильности.
Большинство штаммов демонстрируют очень активный рост в первые сутки, а затем происходит стабилизация и снижение концентрации. Микроорганизмы быстро достигают пика своей активности за счет доступности углеводов лактозы, быстрая утилизация лактозы приводит к замедлению роста, гибели части клеток, из-за отсутствия источника углерода.
Среда с лактозой вызывает взрывной, но неустойчивый рост с последующей стабилизацией или снижением биомассы. На 2-е сутки: 17 из 19 штаммов показывают прирост массы более 65%, но на 3-5 сутки: только 6 штаммов сохраняют положительную динамику. К 5-м суткам культивирования 7 штаммов демонстрируют отрицательные значения прироста. Лактоза - эффективный стимулятор быстрого роста, но непригодна для длительного культивирования. Пик метаболической активности приходится на 2-е сутки для большинства штаммов.
Тепловая карта наглядно покажет метаболическое истощение после начального взрывного роста на испытуемой среде.
Таблица 3 – Оценка эффективности накопления микробной массы в питательной среде с рубцовым фильтратом, КМЦ и лактозой (тепловая карта)
|
№ штамма |
День 2 (%) День 3 (%) День 4 (%) День 5 (%) Процент прироста микробной массы |
|||
|
1 |
137,0 |
22,0 |
78,0 |
1,5 |
|
2 |
109,0 |
49,0 |
8,0 |
20,0 |
|
3 |
219,0 |
19,0 |
1,0 |
0,0 |
|
4 |
94,0 |
12,0 |
4,0 |
5,0 |
|
5 |
196,3 |
0,0 |
0,5 |
4,0 |
|
6 |
135,0 |
19,0 |
4,0 |
6,0 |
|
7 |
168,0 |
0,0 |
0,0 |
0,0 |
|
8 |
120,0 |
18,0 |
0,0 |
6,0 |
|
9 |
39,0 |
13,0 |
0,9 |
5,0 |
|
10 |
68,0 |
1,0 |
1,8 |
2,0 |
|
11 |
121,0 |
6,0 |
22,5 |
10,0 |
|
12 |
124,0 |
1,5 |
4,0 |
5,0 |
|
13 |
128,0 |
27,0 |
10,0 |
0,5 |
|
14 |
132,0 |
10,0 |
13,0 |
8,0 |
|
15 |
185,0 |
25,0 |
0,0 |
1,7 |
|
16 |
142,0 |
18,0 |
1,0 |
1,6 |
|
17 |
191,0 |
3,6 |
1,0 |
4,0 |
|
18 |
163,0 |
13,3 |
2,0 |
4,0 |
|
19 |
187,0 |
12,4 |
0,0 |
4,4 |
|
Среднее значение прироста |
140,21 |
13,3 |
7,98 |
4,66 |
|
Стандартное отклонение |
45,92 |
12,21 |
17,90 |
4,57 |
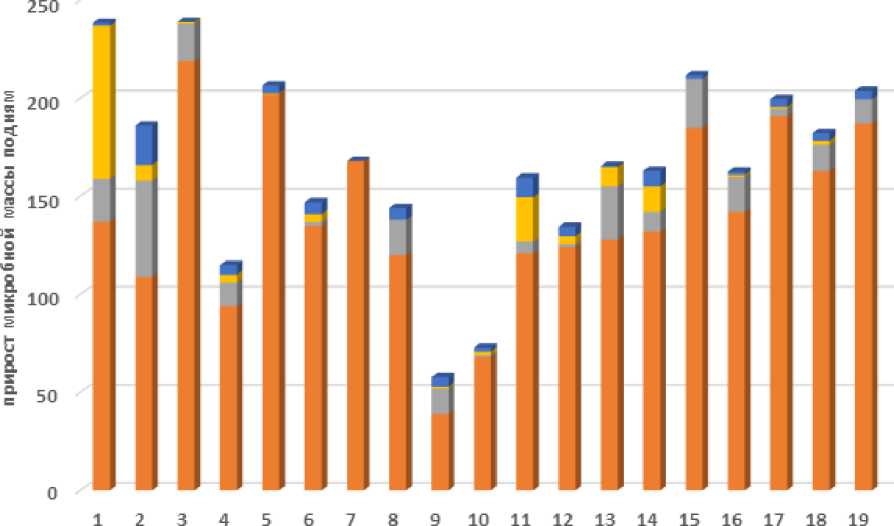
номера штаммов
■ День 2(%) «День 3(%) ■ День 4(%) ■ День 5(%)
Рисунок 3 – Посуточная эффективность накопления микробной массы в среде сдвумя типами источников углерода
Анализируя данные таблицы 3 и рисунок 3, можно заметить следующие изменения по дням и темпам роста штаммов: максимальные значения наблюдаются чаще всего на третий или четвертый день. Некоторые штаммы показывают стабильный рост, вплоть до пятого дня, но большинство штаммов замедляют свой рост к концу периода наблюдений.
Штамм №5 демонстрирует самый высокий прирост на второй день (+196,3%), однако затем следует резкое снижение (-12,5%).
Штаммы №6, №7 и №10 показывают стабильность на последних днях наблюдений (процентные изменения близки к нулю), что говорит об установлении равновесия в росте этих микроорганизмов. Несколько штаммов (№4, №9, №15, №16) имеют отрицательный прирост на последние дни, что указывает на спад активности.
Данные указывают на общую тенденцию увеличения активности микроорганизмов в начале периода наблюдений с последующим стабилизацией или снижением интенсивности накопления биомассы.
Таким образом, наиболее перспективными являются среды, содержащие комплекс источников углерода: труднодоступные и легкодоступные. Это позволяет получить быстрый рост микробной массы, а в дальнейшем медленное ее накопление и сохранение.
Комбинированная среда демонстрирует быстрый стартовый рост с последующей стабилизацией, показывая эффективность синергии источника быстрых и медленных углеводов.
Штаммы №2, №12, №15 –демонстрируют максимальную продуктивность и стабильность. Штаммы №1, №11, №13 - перспективны для ферментации сложных субстратов.
Штамм №1 - демонстрирует второй пик активности на 4-е сутки (+78,6%) после замедления, что указывает на адаптацию к КМЦ после утилизации легких субстратов.
Штамм №2 - показывает ускорение на финальной стадии (+20% на 5-е сутки), свидетельствуя о поздней метаболической активации.
Штамм №11 - имее т W-образную динамику: 121% → 6,1% → 22,5% → 10,5%, что говорит о сложной стратегии утилизации субстратов.
Заключение
Питательная среда с труднодоступным источником углерода демонстрирует среднее значение прироста бактериальной массы -на второй день составляет примерно 17%, что подтверждает общий тренд на начальную активизацию роста. Средний прирост на третий и последующие дни колеблется, но остается положительным, что указывает на продолжающийся рост большинства штаммов. Среда Гетчинсона с КМЦ обеспечивает медленный, но стабильный рост: средний прирост бактериальной массы на 2-е сутки ~20%, на 3-и сутки ~25%. Отсутствуют резкие спады биомассы.
На питательной среде с легкодоступным источником углерода микроорганизмы быстро достигают пика своей активности, быстрая утилизация лактозы приводит к замедлению роста, гибели части клеток, из-за отсутствия источника углерода. Среда вызывает взрывной, но неустойчивый рост с последующей стабилизацией или снижением биомассы. На 2-е сутки: 17 из 19 штаммов показывают прирост массы более 65%, но на 3-5 сутки: только 6 штаммов сохраняют положительную динамику. К 5-м суткам культивирования 7 штаммов демонстрируют отрицательные значения прироста. Лактоза - эффективный стимулятор быстрого роста, но непригодна для длительного культивирования. Пик метаболической активности приходится на 2-е сутки для большинства штаммов. Тепловая карта наглядно покажет метаболическое истощение после начального взрывного роста на испытуемой среде.
На комбинированной среде штаммы демонстрируют быстрый стартовыйростспоследующейстабилизацией,показываяэффективность синергии источника быстрых и медленных углеводов.
Таким образом, наиболее перспективными являются среды, содержащие комплекс источников углерода: труднодоступные и легкодоступные. Это позволяет получить быстрый рост микробной массы, а в дальнейшем медленное ее накопление и сохранение.


