Влияние катехоламинов на осмотическую хрупкость эритроцитов рыб в условиях индуцированного стресса
Автор: Фомина Любовь Леонидовна, Березина Дарья Игоревна, Моданова Карина Эдуардовна, Моисеев Александр Рустамович
Журнал: Молочнохозяйственный вестник @vestnik-molochnoe
Рубрика: Сельскохозяйственные и ветеринарные науки
Статья в выпуске: 1 (45), 2022 года.
Бесплатный доступ
В современной ветеринарии ведется активный поиск чувствительных и дешевых инструментов для лабораторной диагностики стрессового состояния рыб, поэтому актуальной является работа по оценке влияния катехоламинового ответа на осмотическую резистентность эритроцитов тиляпий в условиях индуцированного стресса. Установлено, что катехоламиновый ответ тиляпий на модуляцию стресса был неоднозначным, а вариативность показателей у разных рыб была слишком высокая за счет чувствительности этих гормонов. В то же время, изменения в осмотической резистентности эритроцитов (ОРЭ) при воздействии кортизола достаточно заметны и достоверны, а также тесно связаны с уровнем адреналина в крови тиляпий, и этот показатель возможно использовать для диагностики стрессового состояния рыб как дешевый и наиболее доступный в лабораторной диагностике болезней рыб. В работе использовались гематологические, биохимические и статистические методы исследования.
Рыбы, тиляпия, стресс, катехоламины, эритроциты, осмотическая резистентность
Короткий адрес: https://sciup.org/149140621
IDR: 149140621 | УДК: 639.3:612.1 | DOI: 10.52231/2225-4269_2021_3_128
Текст научной статьи Влияние катехоламинов на осмотическую хрупкость эритроцитов рыб в условиях индуцированного стресса
Гематологические методы диагностики традиционно являются самыми массовыми видами лабораторных исследований в ветеринарии. Состав крови изменяется при некоторых физиологических состояниях, позволяет получить лабораторную информацию о состоянии организма, применять её в интересах диагностики заболеваний, контроля за лечением больных животных. Почти всякий патологический процесс вызывает в картине периферической крови (гемограмме) изменения – сдвиги показателей [1].
Определение осмотической резистентности эритроцитов (ОРЭ) является одним из наиболее доступных в лабораторной диагностике методом оценки физико-химических свойств мембран эритроцитов. Изменения ОРЭ наблюдаются при ряде заболеваний у млекопитающих, так при гемолитических анемиях значения этого показателя снижаются, при гемоглобинопатиях, механической желтухе – повышаются [2].
На осмотическую устойчивость эритроцитов рыб влияет множество факторов: стадия их зрелости, температура, питание, состав корма, наличие токсинов в воде [3 ‒ 6], в том числе и стрессовое состояние [7, 8].
Первичной реакцией на воздействие стрессора у рыб являются эндокринные изменения, включающие, прежде всего, выработку катехоламинов (адреналин и норадреналин) и глюкокортикоидов [9, 10, 11].
При этом предполагается существование четырех степеней стрес-сорной реакции: полная стрессорная реакция, включающая повышенное образование катехоламинов и кортизола; частичная с повышенным образованием либо катехоламинов, либо кортизола, и реакции нарушения гомеостаза, которые рыба не воспринимает как стресс и не связанные ни с катехоламинами, ни с кортизолом [11]. В результате возникают вторичные метаболические, осмотические и другие изменения [12, 13, 14].
Ввиду большой трудоемкости процесса определения уровня катехоламинов крови у рыб, изучение механизма осмотических изменений при воздействии стресс-факторов и взаимосвязь этих изменений с содержанием адреналина и норадреналина в крови может дать чувствительный и дешевый инструмент для лабораторной диагностики стрессового состояния рыб.
Цель работы состоит в оценке влияния катехоламинового ответа на осмотическую резистентность эритроцитов тиляпий в условиях индуцированного стресса.
Материалы и методы исследования
Работа выполнена на кафедре ВНБ, хирургии и акушерства факультета ветеринарной медицины и биотехнологий Вологодской ГМХА имени Н. В. Верещагина.
Опыты проводили в аквариумных условиях на 18 нильских тиляпиях (Oreochromis niloticus L.), выращенных в условиях «АкваБиоЦентра» Вологодской ГМХА, которых предварительно разделили на три группы по 6 особей (табл. 1).
Таблица 1 ‒ Характеристика групп рыб в эксперименте .
|
Группа |
Воздействие |
Модель |
|
Контрольная (n=6) |
интактная |
контроль |
|
I экспериментальная (n=6) |
инъекция раствора дексаметазон-фосфата (4 мг/мл) в дозе 0,2 мл/ особь однократно |
острый стресс |
|
II экспериментальная (n=6) |
инъекция суспензии бетаметазона (2,63 мг+6,43 мг/мл) в дозе 0,5 мл/ особь однократно |
хронический стресс |
Животных I экспериментальной группы однократно обрабатывали дексаметазоном (Эллара, Россия), который метаболизируется в течение 4 часов, путем парентеральных инъекций в дозе 0,2 или 0,8 мг активного вещества дексаметазон фосфата на особь.
Рыбы II экспериментальной группы после адаптации подвергались хроническому стрессу (применяли суспензию бетаметазона (2,63 мг бетаметазона натрия фосфата + 6,43 мг бетаметазона дипропиона-та/мл), период выведения которого более 10 дней. Рыбам инъецирова- ли Дипроспан (Schering-Plough Labo N.V., Бельгия) по 0,5 мл на особь, что соответствует 3,5 мг активного вещества.
Данные синтетические гормоны обладают аналогичным кортикостероидам эффектом [12, 15].
Контрольная группа оставалась интактной.
Рыбы содержались в условиях с обеспечением непрерывной циркуляции воды между аквариумами с принудительной аэрацией при температуре 27 - 30°C (рис. 1) . Для кормления использовали гранулированный корм (режим – 1 раз в сутки).

Рисунок 1 — Экспериментальная установка с обеспечением непрерывной циркуляции воды
Забор крови для определения осмотической устойчивости эритроцитов проводили у рыб с разницей в 21 день шприцом из хвостовой вены в стеклянные пробирки, содержащие 3,8% раствор цитрата натрия в соотношении 1:9, для анализа катехоламинов ‒ в пластиковые пробирки с гепарином и пластиковые пробирки с активатором свертывания и разделительным гелем. Перед отбором проб крови рыб анестезировали при помощи добавления в воду гвоздичного масла в дозе 0,033 мл/л [16] с последующей выдержкой в ней 15 минут.
Оценку состояния функциональных сдвигов в состояние мембран эритроцитов проводили, используя модификацию метода определения осмотической резистентности эритроцитов М.А. Горшковой, Д.А Миллер, Е.Н. Егоровой, Т.А. Федотовой [2].
При исследовании ОРЭ в первую пробирку помещали 2,5 мл дистиллированной воды, во вторую - 2,5 мл изотонического (0,9%) рас- твора натрия хлорида, в третью – по 1,25 дистиллированной воды и изотонического раствора натрия хлорида (для получения 0,45 % раствора NaCl).
Затем во все пробирки добавляли по 0,01 мл крови. Перемешивали и центрифугировали в течение 10 минут при 2000 оборотов в минуту. Измеряли оптическую плотность надосадочных жидкостей трех проб на спектрофотометре при длине волны 414 нм в кювете с длиной поглощающего слоя 1 см против дистиллированной воды. ОРЭ оценивали по степени гемолиза эритроцитов в растворах с разной концентрацией натрия хлорида по сравнению со степенью гемолиза в образце с дистиллированной водой, который принимали за 100%. Степень гемолиза рассчитывали дважды в образцах с 0,9 и 0,45% растворами натрия хлорида по формуле:
H = 100 X Еоп. /Ек. , где H – степень гемолиза (%),
100 – степень гемолиза в образце с дистиллированной водой,
Еоп. - оптическая плотность надосадочной жидкости в образце,
Ек. - оптическая плотность надосадочной жидкости в пробирке с дистиллированной водой [2, 17, 18].
Концентрацию катехоламинов в сыворотке крови устанавливали методом высокоэффективной жидкостной хроматографии в лаборатории ООО «Центр лабораторных исследований».
Полученный в ходе исследования цифровой материал обрабатывался с помощью програмного обеспечения Microsoft Excel и STATISTICA 6.0. Результаты представлены в виде средней величины и стандартной ошибки средней. Сравнение данных проводилось с применением U-критерия Манна-Уитни для независимых групп. Для оценки различий в зависимых выборках с нормальным распределением использовали t-критерий Стьюдента для зависимых выборок.
Результаты исследования
Стресс приводит к массивному высвобождению катехоламинов из хромаффинных клеток, за которым следуют быстрое изменение некоторых функций основных физиологических систем: дыхательной и сердечно-сосудистой [19]. Необходимое количество катехоламинов для проявления этих воздействий редко известно, поскольку химическое определение количеств адреналина и норадреналина затруднительно и требует больших объемов плазмы крови из-за их низкой концентрации [20] .
Количественное содержание адреналина и норадреналина в крови рыб представлено в таблице 2 .
Таблица 2 ‒ Катехоламины тиляпий в ходе эксперимента.
|
До обработки |
21-й день |
|||||
|
Наименование показателя |
га с о. |_ га ® X II л с *--о о. i-X о 2 |
К га га А 1-1 |
га га X с а *—- m i-i |
с га 2 |
га га m i-i |
к га га Е II X с а - V m i-i |
|
Адреналин, |
11315,5± |
3149,33± |
7117,0± |
83,50± |
65,25± |
92,50± |
|
пг/мл |
11097,5 |
3066,87 |
6041,44 |
23,50 |
4,23* |
14,50 |
|
Норадреналин, |
1628,5± |
728,0± |
2219,0± |
132,50± |
140,25± |
172,50± |
|
пг/мл |
1486,5 |
603,03 |
1723,65 |
17,50 |
15,91 |
57,50 |
|
* Различия с показателем второй экспериментальной группы достоверны (p ≤ 0,05). |
||||||
Содержание адреналина и норадреналина между рыбами одной группы очень сильно варьировалось (для адреналина 65 ‒ 22500 пг/ мл, для норадреналина 115 ‒ 5500 пг/мл), однако их уровни претерпели резкое снижение: адреналина ‒ на 97,9 ‒ 99%, норадреналина ‒ на 80 ‒ 92,2% у всех групп рыб к 21 дню эксперимента. Возможно, в результате анестезии и кратковременного хэндлинг-стресса (венепункция) произошел всплеск катехоламинов у исследованных нами тиляпий, о чем говорит динамика к последнему дню эксперимента не только экспериментальных, но и контрольных значений. В связи с этим можно также предположить, что к концу эксперимента организм исследуемых животных адаптировался к кратковременным стрессовым условиям, или по каким-либо другим причинам, на что указывает падение уровня основных катехоламинов (адреналина и норадреналина) относительно первоначального у всех групп рыб [20].
У всех позвоночных имеет место разнокачественность эритроцитов по резистентным характеристикам (осмотической и кислотной), которая формируется в результате действия на организм внешних и внутренних факторов. У человека в норме гемолиз эритроцитов на- чинает происходить в 0,46–0,42%-ном растворе NaCl, полный гемолиз ‒ в 0,32–0,3%-ном NaCl. Снижение осмотической резистентности эритроцитов происходит вследствие изменений структурных и функциональных свойств мембран эритроцитов, возникающих при старении организма, заболеваниях, обусловленных накоплением скрытых структурных повреждений в белково-липидном каркасе мембран низко- и высокостойких эритроцитов [21, 22].
Степень гемолиза эритроцитов человека, полученная с использованием унифицированного метода М.А. Горшковой, составила в норме 1,61±0,23% в 0,9% растворе натрия хлорида и 25,16±1,83% в 0,45% растворе натрия хлорида [2].
Степень гемолиза эритроцитов рыб, полученная с помощью этого же метода, оказалась значительно ниже, чем эритроцитов человека (табл. 3) , хотя, по данным некоторых авторов, эритроциты рыб по осмотической резистентности уступают таковым у млекопитающих: признаки гемолиза у них могут появляться уже при небольших разведениях физиологического раствора (0,9–0,81%-ный NaCl), массовый гемолиз эритроцитов половозрелых рыб происходит, как правило, при 0,63–0,54%-ном NaCl [23].
Таблица 3 ‒ Степень гемолиза эритроцитов рыб в изотоническом и гипотоническом растворах до стресса, %.
|
Концентрация раствора |
Контрольная группа (n=6) |
I эксперимен тальная (n=6) |
II эксперимен тальная (n=6) |
|
|
0,9%-ный натрия |
хлорид |
0,22±0,06 |
0,19±0,06 |
0,13±0,02 |
|
0,45%-ный натрия |
хлорид |
0,30±0,01 |
0,40±0,04 |
0,32±0,06 |
В 0,45%-ном (гипотоническом) растворе хлорида натрия гемолиз происходил значительно интенсивнее, чем в 0,9-ном (изотоническом). Различия в осмотической устойчивости эритроцитов рыб в группах-аналогах не были достоверными.
Острый стресс у рыб обеспечивает адаптацию организма к стрессовым условиям, что сопровождается активацией многих систем организма. Это требует активной работы всех клеток организма и их мембран соответственно [24]. Хронический стресс в свою очередь отрицательно влияет на здоровье организма и снижает устойчивость клеток эритроцитарного ряда к гемолизу [25], но полученные нами результаты оценки ОРЭ рыб спустя 21 день после воздействия гормонов, инду- цирующих острый и хронический стресс, отличаются от данных, полученных у человека (табл. 4).
Таблица 4 ‒ Степень гемолиза эритроцитов рыб в изотоническом и гипотоническом растворах после индуцированного стресса, %.
|
Концентрация раствора |
Контрольная группа (n=6) |
I эксперимен тальная (n=6) |
II эксперимен тальная (n=6) |
|
0,9%-ный хлорид натрия |
0,06±0,01 |
0,04±0,01 |
0,02±0,001 |
|
0,45%-ный хлорид натрия |
0,88±0,38* |
0,78±0,39* |
0,44±0,04 |
|
* Различия с показателем второй экспериментальной группы достоверны (p≤0,05). |
|||
Анализируя данные исследования, можно отметить значительное превышение степени гемолиза эритроцитов в 0,45%-ном растворе хлорида натрия у рыб контрольной и I экспериментальной групп над эритроцитами рыб II экспериментальной группы, что можно связать с продолжающимся воздействием хронического стресса у рыб этой группы. В изотоническом растворе натрия хлорида достоверных различий в ОРЭ эритроцитов выявлено не было.
Изучая динамику показателей осмотической устойчивости эритроцитов рыб в гипотоническом растворе, мы получили результаты, представленные на рисунке 2 .
Гемолиз эритроцитов рыб в 0,45% растворе натрия хлорида, %
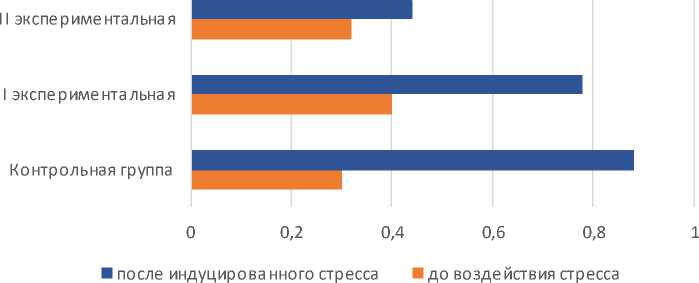
Рисунок 2 — Динамика степени гемолиза эритроцитов рыб в гипотоническом растворе хлорида натрия до и после гормониндуцированного стресса.
Во всех группах исследуемых рыб эритроциты снизили устойчивость к гемолизу, но наиболее выражен гемолиз в крови рыб контрольной группы. Осмотическая устойчивость эритроцитов рыб, находящихся под воздействием хронического стресса, оказалась в два раза выше таковой рыб контрольной группы. Таким образом, можно заключить, что кортизол влияет на эритроциты рыб, повышая их устойчивость к гемолизу, что возможно связано с нарушением функции их мембран и требует дальнейшего изучения с помощью атомно силовой микроскопии.
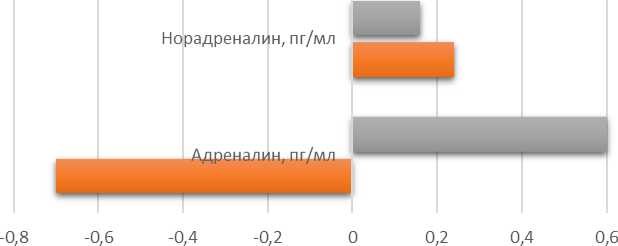
Оценивая влияние катехоламинов на осмотическую устойчивость эритроцитов рыб по шкале Чеддока, можно отметить заметную связь между содержанием адреналина и степенью гемолиза эритроцитов, причем до воздействия гормониндуцированного стресса эта связь была отрицательная, а после воздействия - положительная (рис. 3).
Корреляционная зависимость ОРЭ тиляпий от содержания катехоламинов
■ после индуцированного стресса ■ до воздействия стресса
Рисунок 3 — Динамика степени гемолиза эритроцитов рыб в гипотоническом растворе хлорида натрия до и после гормониндуцированного стресса
Заключение
Катехоламиновый ответ тиляпий на модуляцию стресса был неоднозначным, а вариативность показателей у разных рыб была слишком высокая за счет чувствительности этих гормонов, в связи с чем установление интенсивности стресса по данным показателям в рыбоводстве сомнительно и экономически не целесообразно. Поскольку изменения в ОРЭ при воздействии кортизола достаточно заметны и достоверны, а также тесно связаны с уровнем адреналина в крови тиляпий, этот показатель возможно использовать для диагностики стрессового состояния рыб, как дешевый и наиболее доступный в лабораторной диагностике болезней рыб.
Список литературы Влияние катехоламинов на осмотическую хрупкость эритроцитов рыб в условиях индуцированного стресса
- Амиров, Д.Р. Клиническая гематология животных: учебное пособие / Д.Р. Амиров, Б.Ф. Тамимдаров, А.Р. Шагеева. - Казань: Центр информационных технологий КГАВМ, 2020. - 134 с.
- Патент № 2328741 Рос. Федерация, МПК G01N 33/49. Способ определения осмотической резистентности эритроцитов / М.А. Горшкова, Д.А. Миллер, Е.Н. Егорова, Т.А. Федотова; патентообладатель Государственное бюджетное образовательное учреждение высшего профессионального образования «Тверская государственная медицинская академия» Министерства здравоохранения и социального развития Российской Федерации (RU)- № 2007116258/15; заявл. 28.04.2007; опубл. 10.07.2008, Бюл. № 19
- Иванов, А. А. Физиология рыб: учеб. пособ. / А. А. Иванов. -2-е изд., стер. - СПб.: Лань, 2021. - 288 с.
- Serpunin, G.G. Use of the ichthyohaematological studies in ecological monitoring of the reservoirs / G.G. Gorissen, O.A. Likhatchyova // Acta Vet. Brno, 1998. - Vol. 67. - P. 339-345
- Messager, J. L. Effects of dietary oxidized fish oil and antioxidant deficiency on histopathology, haematology, tissue and plasma biochemistry of sea bass Dicentrarchus labrax / J. L. Messager, G.Stephan, C. Quentel, F. Baudin-Laurencin // Aquat. Living Resour. Vivantes Aquat, 1992. -Vol. 5. - P. 205-214.
- Obach, A. Eff ect of alpha-tocopherol and dietary oxidized fi sh oil on the immune response of sea bass / A. Obach, C. Quentel, F. B Lau-rencin // Dis. Aquat. Org, 1993. - Vol. 15. - P. 175-185.
- Pages, T. Eff ects of daily managements stress on haematology and blood rheology of the gilthead seabream / T. Pages, E. Gomez, O. Sun-er, G. Viscor, L. Tort // J. Fish Biol, 1995. - Vol. 46. - P. 775-786.
- Микряков, Д.В. Изменение морфофизиологических показателей иммунокомпетентных органов карпа Cyprinus carpio под влиянием гормона стресса / Д.В. Микряков, В.Р. Микряков, Н.И. Силкина // Вопросы ихтиологии. - 2007. - Т. 47. - № 2. - С. 418-424.
- Gorissen, M. The endocrinology of the stress response in fish: an adaptation-physiological view / M. Gorissen, G. Flik // Fish physiology. -Academic Press, 2016. - Vol. 35. - P. 75-111.
- Schreck, C.B. The concept of stress in fish / C.B. Schreck, L. Tort // Fish physiology. - Academic Press, 2016. - Vol. 35. - P. 1-34.
- Smith, L. S. Introduction to fish physiology [Текст] / L. S. Smith. - TFH, 1982. - 352 p.
- Barton, B.A. Physiological changes in fish from st ress in aquaculture with emphasis on the response and effects of corticosteroids / B.A. Barton, G.K. Iwama // Annual Review of fish diseases. - 1991. - Vol. 1. -P. 3-26.
- Mazeaud, M.M. Primary and secondary effects of stress in fish: some new data with a general review / M.M. Mazeaud, F. Mazeaud, E.M. Donaldson // Transactions of the American Fisheries Society. - 1977. -Vol. 106. - № 3. - P. 201-212.
- Pickering, A. D. Stress and fish / A.D. Pickering. - London: Academic Press, 1981. - Pp. 367.
- Gamperl, A.K. Experimental control of stress hormone levels in fishes: techniques and applications / A.K. Gamperl, M.M. Vijayan, R.G. Boutilier // Reviews in Fish Biology and Fisheries. - 1994. - Vol. 4. - № 2. - P. 215-255.
- Hamackova, J. Clove oil as an anaesthetic for different freshwater fish species [Текст] / J. Hamackova, J. Kouril, P. Kozak, Z. Stupka // Bulgarian Journal of Agricultural Science. - 2006. - Vol. 12. - № 2. - P. 185-194.
- Моданова, К.Э. Изучение осмотической резистентности рыб при остром стрессе / К.Э. Моданова, Л.Л. Фомина // Молодые исследователи агропромышленного и лесного комплексов - регионам. Т. 3. Ч. 2. Биологические науки. - Вологда-Молочное: ФГБОУ ВО Вологодская ГМХА, 2021. - С. 64-67. - URL: https://molochnoe.ru/resources/files/nauka/sborniki/sbornik_332_2021. pdf
- Моисеев А.Р. Влияние хронического стресса на осмотическую резистентность эритроцитов рыб / А.Р. Мрисеев, Л.Л. Фомина // Молодые исследователи агропромышленного и лесного комплексов - регионам. Т. 3. Ч. 2. Биологические науки.-Вологда-Молочное: ФГБОУ ВО Вологодская ГМХА,2021. - С. 68-71. - URL: https://molochnoe.ru/ resources/files/nauka/sborniki/sbornik_332_2021.pdf
- Perry, S. F. The acute humoral adrenergic stress response in fish: facts and fiction / S. F. Perry, N. J. Bernier// Aquaculture. - 1999. -Vol. 177. - №1-4. - P. 285-295.
- Березина, Д.И. Изменение концентрации катехоламинов в крови в условиях экспериментальной модели стресса как биомаркер у тиляпий / Д. И. Березина, Л.Л. Фомина // Актуальные вопросы вет. биологии. - 2021. - Т. 51. - № 3. - С. 9-13
- Сравнительный анализ осмотической резистентности эритроцитов у различных по экологии teleostei / А.М. Андреева, И. П. Рябцева, И. И. Руднева, В. Г. Шайда, Н. Е. Ламаш, А. Э. Дмитриева// Вестник Санкт-Петербургского университета. - 2013. - Сер. 3. - Вып. 4. - С. 3-13.
- Попова, И.Е. Изучение структурных свойств эритроцитов крови новорожденных при оксидативном стрессе, вызванном гипоксией: специальность 03.00.02: диссертация на соискание ученой степени кандидата биол. наук / И.Е. Попова. - Воронеж, 2007. - 250 с.
- Андреева, А.М. Адаптации дыхательной функции крови у пресноводных костистых рыб / А.М. Андреева, И.П. Рябцева, В.В. Лукьяненко // Матер. 28-й Междунар. конф. «Биол. рес. Белого моря и внутренних водоемов европейского Севера». - Петрозаводск: КарНЦ РАН. -2009. - С. 33-39.
- Фомина, Л.Л. Влияние кортизола на некоторые иммунологические показатели карпов / Л.Л. Фомина, Д.И. Березина, Е.А. Пересто-ронина // Молочнохозяйственный Вестник. - 2019. - № 2. - С. 41-52.
- Гасасаева, Р.М. Изменения состояния мембран эритроцитов у студентов, переживающих экзаменационный стресс / Р.М. Гасасаева // Успехи современного естествознания. - 2019. - № 8. - С. 15-17.


