Возможности перфузионной компьютерной томографии в дифференциальной диагностике продолженного роста и постлучевого некроза глиобластом головного мозга
Автор: Капишников Александр Викторович, Баландина Анна Валерьевна
Рубрика: Клиническая медицина
Статья в выпуске: 5-4 т.16, 2014 года.
Бесплатный доступ
Проведен анализ результатов перфузионной компьютерной томографии (ПКТ) и магниторезонансной томографии (МРТ) у 40 пациентов с глиобластомой после операции и лучевой терапии в дозе 60 грей. Данные МРТ не позволили дифференцировать рецидив опухоли и постлучевой некроз у 72,5% пациентов. Рецидивирующие опухоли показали более высокие значения CBV, CBF и низкий МТТ по сравнению с лучевым некрозом. Чувствительность параметров ПКТ в отношении продолженного роста опухоли составила от 0,818 до 0,909.
Компьютерная томография, магнитно-резонансная томография, нейроонкология, глиобластома головного мозга, постлучевой некроз, перфузия головного мозга
Короткий адрес: https://sciup.org/148101925
IDR: 148101925 | УДК: 616.831-006.484-089.12
Текст научной статьи Возможности перфузионной компьютерной томографии в дифференциальной диагностике продолженного роста и постлучевого некроза глиобластом головного мозга
Глиобластома – наиболее частая первичная опухоль ЦНС, её распространенность составляет от 10 до 20% всех интракраниальных опухолей [1, 2]. Являясь самым агрессивным [3, 4] злокачественным глиальным новообразованием головного мозга, она отличается способностью к инфильтрации тканей и активной генерацией сосудов [5, 6]. Лучевая терапия является одним из обязательных компонентов лечения больных с первичными злокачественными опухолями головного мозга. У части пациентов в различные сроки после облучения наблюдается развитие лучевых повреждений, в том числе лучевого некроза [7].
Данные клинического обследования, картина КТ и МРТ при лучевом некрозе, в целом, неспецифичны. Прогрессия опухоли и формирования зоны лучевого повреждения мозга в большинстве случаев имеют сходные визуальные признаки [8, 9]. Выявление «корона-эффекта» во время контрастирования не облегчает диагностическую задачу, так как и некротические изменения и продолженный рост глиобластомы сопровождает появление таких кольцевидных структур. Затрудняет дифференцировку при мониторинге с помощью томографических методов
то обстоятельство, что очаг некроза может увеличиваться в размере, имитируя опухоль с продолженным ростом.
В последние годы появились новые технологии компьютерной реконструкции трансфера рентгеноконтрастных веществ, в частности, перфузионная КТ (или КТ-перфузия), которые значительно расширили возможности оценки кровотока в ткани мозга и опухолях [10]. Ряд исследований указывают на возможность использования перфузионных биомаркеров для оценки прогрессии злокачественной опухоли и выявления постлучевых некротических изменений ткани мозга [11, 12]. Таким образом, разграничение продолженного роста глиобластомы и лучевого некроза является важнейшей проблемой нейроонкологии, а её решение играет ключевую роль при выработке правильной тактики лечения пациента со злокачественной опухолью головного мозга.
Цель работы: улучшение дифференциальной диагностики продолженного роста глиобластом головного мозга и постлучевого некроза опухоли на основе перфузионной компьютерной томографии (ПКТ).
Материал и методы. Обследовано 40 пациентов с диагнозом глиобластома G4 после оперативного лечения и лучевой терапии в дозе 60 Гр. МРТ проводилась на томографе Signa 1,5T(GE). Для контрастного усиления использовалось внутривенное введение парамагнитного препарата Магневист® в дозе 0,2 мл/кг массы тела. Получены изображения супра- и субтенториальных отделов головного мозга в аксиальной, коронарной и сагиттальной проекциях, в режимах Т1-, Т2 – взвешенные изображения (ВИ), FLAIR, DWI, SWAN. Компьютерная томография выполнена на 256-срезовом рентгеновском томографе Discovery CT750 HD (GE). Для перфузионного сканирования вводили 50 мл изоосмо-лярного неионного контрастного вещества (КВ) Визипак-320® внутривенно с помощью автоматического инъектора со скоростью 4-5 мл/с. Сканирование проводилось через 5 секунд после инъекции (80 кВ; 400 мА). Толщина среза 2,5 мм с последующей реконструкцией срезов по 5 мм. Эффективная доза составляла 100-110 мЗв. Референтным тестом являлось гистологическое и гистохимическое исследование.
Анализ перфузии головного мозга путем КТ базировался на динамической регистрации рентгеновской плотности в процессе трансфера рентгеноконтрастного вещества и получении математических функции для расчета перфузионных параметров [13]. Использованы следующие перфузионные параметры: 1) CBV (cerebral blood volume) – общий объём мозгового кровообращения в заданном участке мозгового вещества, включая капилляры, артерии, артериолы, венулы и вены, измеряется в мл крови на 100 грамм мозгового вещества (мл/100 г); 2) СBF (сerebral blood flow) – объёмная скорость мозгового кровотока – скорость прохождения определенного объема крови через фиксированный объем ткани мозга за единицу времени; измеряется в миллилитрах крови на 100 грамм мозгового вещества в минуту (мл/100 г*мин.); 3) MTT (mean transit time) – среднее время циркуляции – время, за которое кровь проходит по сосудистому руслу выбранного участка мозговой ткани; измеряется в секундах (с). Локальный анализ перфузиии мозга проводился путем выбора зон интереса (ROI, region of interest).
Результаты. У 29 из 40 обследованных пациентов (72,5%) результаты, полученные при МРТ, не позволяли дифференцировать продолженный рост опухоли и лучевой некроз. Проявления глиобластом на полученных МР-томограммах разнообразны. На Т1 взвешенных изображениях обнаружены плохо отграниченные объемные образования, что является признаком инфильтрирующего роста злокачественных опухолей. В данном режиме МРТ для глиобластомы был характерен смешанный сигнал, нередко наблюдался центральный некроз. Признаки опухоли в режимах Т2-ВИ и Т2-FLAIR также различны с участками гетерогенного сигнала, некроза, образованием кист и кровоизлияний. Появление обширного «масс-эффекта» и отёк белого вещества не зависел от объема глиобластомы и часто сопровождал небольшие по размерам опухоли. Для большинства обнаруженных глиобластом типично значительное гетерогенное контрастирование. Использование повышенных дозировок контрастного препарата и отсроченное проведение МРТ увеличивало возможность визуализации инфильтративной части образования, широко уходящей в мозговую ткань.
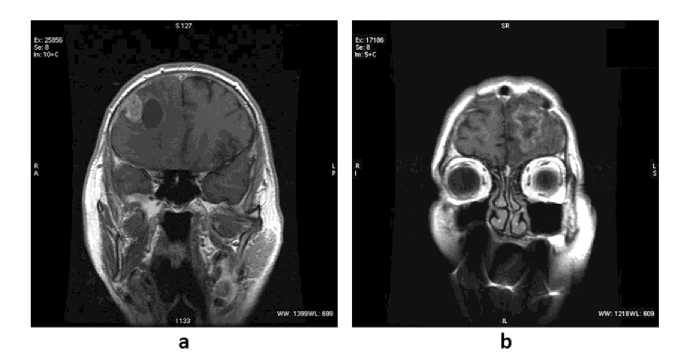
Рис. 1. МРТ с контрастным усилением при глиобластоме G4 пациентов Т.,62 лет (a) и К., 72 лет (b)
Результаты МРТ пациентов после оперативного лечения и лучевой терапии глиобластомы G4 представлены на рис. 1. В правой лобной области одного из пациентов (рис. 1a) определяется зона патологического уровня МР-сигнала неправильной формы, размерами 33х28 мм, гетерогенной структуры, с наличием кистозного компонента (до 24 мм). Усиление контрастирования вышеописанной зоны на постконтрастных сканах преобладает в латеральных отделах. Перифокально определяется отек мозгового вещества. Данные МРТ другого пациента, представленные на рис. 1b, показывают наличие в левой лобной области пациента зоны патологического уровня МР-сигнала неправильной формы, размерами 38х30 мм, гетерогенной структуры, с наличием кистозного компонента (до 28 мм в максимальном аксиальном сечении). На постконтрастных сканах отмечается патологическое усиление МР-сигнала вышеописанной зоны преимущественно по переферии. Перифокальный отек мозгового вещества. Боковые желудочки умеренно расширены до 13 мм в области тел.
Представленные на рис. 1 томограммы двух пациентов имеют сходную МР-семиотику – размеры и форму опухолей, гетерогенную структуру очагов с кистозным перерождением и перифокальный отек. Однако референтный тест (гистохимическое исследование) в первом наблюдении свидетельствует о наличии постлучевого некроза, тогда как во втором случае установлен продолженный рост опухоли, который не удалось дифференцировать от некротических изменений с помощью МРТ.
ПКТ с построением перфузионных карт проведена у 29 пациентов с неопределенным исходом лечения опухоли. Для продолженного роста опухоли при ПКТ во всех случаях установлено повышение обьёма кровотока (CBV) и среднего времени транзита (MTT) при понижении скорости кровотока (CBF) в опухолевой ткани. Характерное для лучевого некроза отсутствие изменений показателей перфузии в регионе злокачественной опухоли по сравнению с «зеркальной» ROI установлено у 7 пациентов. Признаки продолженного роста по данным ПКТ установлены у 22 пациентов. При сравнении с референтным тестом чувствительность CBV, CBF и MTT составила 90,9%, 86,4% и 81,8% соответственно.
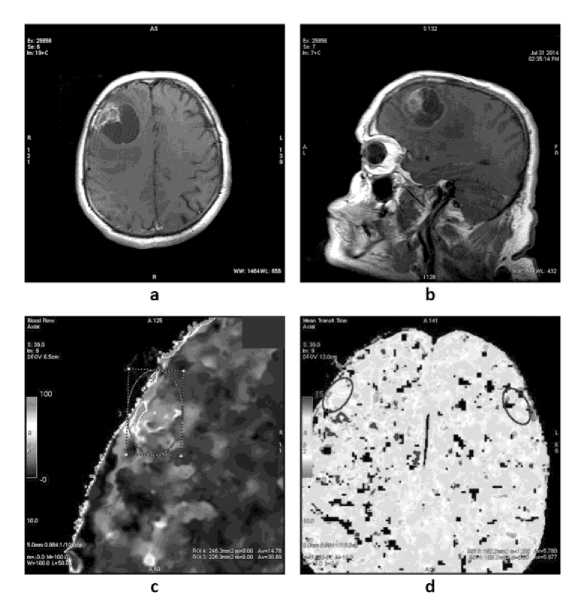
Рис. 2. МРТ с контрастным усилением (a, b) и перфузионные карты ПКТ (c, d) пациента М., 62 лет через 4 месяца после оперативного лечения и завершения лучевой терапии. Диагноз: глиобластома G4 правой лобной доли
Дифференциальные возможностей МРТ и ПКТ сопоставлены на рис. 2. В правой лобной области (рис. 2 a,b), определяется зона патологического уровня МР-сигнала, размерами 33х28 мм, гетерогенной структуры с наличием кистозного компонента, признаками выраженного контрастного усиления в латеральных отделах очага; перифокальный отек мозгового вещества наиболее заметен в режимах FLAIR, T2-BИ и DWI. При ПКТ с постронением перфузионных карт (рис. 2 c,d) отмечается повышение объема кровотока (СВV) в зоне патологического очага, выявленного при МРТ, и 5-кратное повышение среднего времени циркуляции крови (МТГ) в сравнении с «зеркальной» стороной левого полушария. Значительное изменение объемного и циркуляторного параметров кровотока позволило распознать продолженный рост опухоли в зоне оперативного вмешательства и лучевого воздействия.
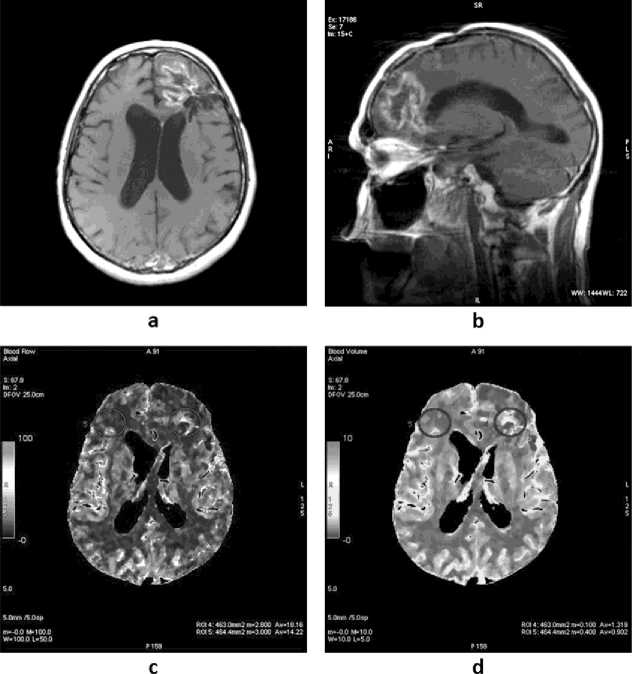
Рис. 3. МРТ с контрастным усилением (a, b) и перфузионные карты ПКТ (c, d) пациента П., 72 лет через 3 месяца после оперативного лечения и проведения лучевой терапии. Данные иммуногистохимического исследования: глиобластома G4 правой лобной доли
На рис. 3 показаны результаты комплексного исследования, характерные для постлучевого некроза, что позволило исключить продолженный рост глиобластомы. Зона патологического уровня МР-сигнала гетерогенной структуры с наличием кистозного компонента имеет размеры 38х30 мм и определяется в левой лобной области (рис. 3 a,b). Контрастное усиление показало фрагментарное патологическое повышение уровня МР-сигнала преимущественно по периферии обнаруженного новообразования. Определяется перифокальный отек мозгового вещества, наиболее выраженный в режимах Т2-ВИ, FLAIR, и DWI. Желудочковая система головного мозга умеренно расширена. Субарахноидальные конвекситальные пространства гемисфер большого мозга и мозжечка симметрично расширены. На перфузионных картах (рис. 3 c,d) параметры кровотока (CBV, МТТ, CBF) не изменены по сравнению с показателями перфузии «зеркальной» зоны интереса в правом полушарии. Таким образом, данные ПКТ свидетельствуют об отсутствии продолженного роста опухоли в области оперативного вмешательства.
Выводы: сравнительный анализ различных методов томографической визуализации с применением контрастирования показал, что изолированное применение МРТ не позволило дифференцировать рецидив опухоли и постлучевой некроз у 72,5% пациентов с глиобластомами головного мозга. Продолженный рост злокачественной опухоли показывает более высокие значения CBV, CBF и низкое значение МТТ по сравнению с лучевым некрозом. ПКТ глиобластом может предоставить дополнительную информацию о физиологии и гемодинамике, которая недоступна при обычной морфологической визуализации. Объективные количественные параметры ПКТ обладают значительным потенциалом в качестве инструмента для мониторинга опухолей мозга после оперативного лечения и лучевой терапии.
Список литературы Возможности перфузионной компьютерной томографии в дифференциальной диагностике продолженного роста и постлучевого некроза глиобластом головного мозга
- Orisson, W. Intraaxial brain tumors/W. Orisson, B. Hart//Neuroimaging. -Philadelphia: Saunders, 2000. P. 583-611.
- Osborn, A.G. Diagnostic imaging: Brain/A.G. Osborn, K.L. Salzman, G. Katzman et al. -Salt Lake City: Amirsys, 2004. 992 p.
- Furnari, F.B. Malignant astrocytic glioma: genetics, biology, and paths to treatment/F.B. Furnari, T. Fenton, R.M. Bachoo et al.//Genes. Dev. 2007. V. 21. P. 2683-2710.
- Yan, W. Oncogene addiction in gliomas: implications for molecular targeted therapy/W. Yan, W. Zhang, T. Jiang//J. Exp. Clin. Cancer Res. 2011. V. 30. P. 58.
- Folkman, J. The role of angiogenesis in tumor growth//Semin. Cancer Biol. 1992. V. 3. P. 65-71.
- Law, M. Gliomas: predicting time to progression or survival with cerebral blood volume measurements at dynamic susceptibility-weighted contrast-enhanced perfusion MR imaging/M. Law, R.J. Young, J.S. Babb et al.//Radiology. 2008. V. 247. P. 490-498.
- Hohwieler, M.L. Brain necrosis after radiotherapy for primary intracerebral tumor/M.L. Hohwieler, T.C. Lo, M.L. Silverman et al.//Neurosurgery. 1986. V. 18(1). P. 67-74.
- Henson, J.W. Brain tumor imaging in clinical trials/J.W. Henson, S. Ulmer, G.J. Harris//Am. J. Neuroradiol. 2008. V. 29(3). P. 419-424.
- Mullins, M.E. Radiation necrosis versus glioma recurrence: conventional MR imaging clues to diagnosis/M.E. Mullins, G.D. Barest, P.W. Schaefer et al.//Am. J. Neuroradiol. 2005. V. 26(8). P. 1967-1972.
- Jain, R. Quantitative estimation of permeability surface-area product in astroglial brain tumors using perfusion CT and correlation with histopathologic grade/R. Jain, S.K. Ellika, L. Scarpace et al.//Am. J. Neuroradiol. 2008. V. 29. P. 694-700.
- Purdie, T.G. Functional CT imaging of angiogenesis in rabbit VX2 soft-tissue tumour/T.G. Purdie, E. Henderson, T.Y. Lee//Phys. Med. Biol. 2001. V. 46. P. 3161-3175.
- Lee, T.Y. CT imaging of angiogenesis/T.Y. Lee, T.G. Purdie, E. Stewart//Q. J. Nucl. Med. 2003. V. 47. P.171-187.
- Hoeffner, E.G. Cerebral perfusion CT: technique and clinical applications/E.G. Hoeffner, I. Case, R. Jain et al.//Radiology. 2004. V. 231 (3). P. 632-644.


