Возможности текстурного анализа изображений (коэффициента структурной гетерогенности и карт исчисляемого коэффициента диффузии) в дифференциальной диагностике метастатического поражения костей по данным магнитно-резонансной томографии
Автор: Иозефи Д.Я., Сергеев Н.И., Солодкий В.А., Винидченко М.А.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Лучевая диагностика
Статья в выпуске: 3 т.22, 2022 года.
Бесплатный доступ
Дополнительный анализ медицинских изображений с помощью современных компьютерных приложений является актуальной и перспективной темой в лучевой диагностике. С помощью текстурного анализа авторами разработан новый интегральный показатель, чувствительный к микроструктуре ткани метастазов в кости, отражающий числовое значение внутриопухолевой гетерогенности, оцененной по данным магнитно- резонансной томографии. Использование значений интенсивности на Т2ВИ, ADC-картах и коэффициента структурной гетерогенности позволяет повысить эффективность дифференциальной диагностики между физиологическими состояниями костного мозга и патологическими изменениями, такими как различные типы метастатического поражения, а также гемангиомы.
Мрт, adc, t2, dwi, гетерогенность, метастазы, костный мозг, текстурный анализ
Короткий адрес: https://sciup.org/149142246
IDR: 149142246
Текст научной статьи Возможности текстурного анализа изображений (коэффициента структурной гетерогенности и карт исчисляемого коэффициента диффузии) в дифференциальной диагностике метастатического поражения костей по данным магнитно-резонансной томографии
Метастатические очаги злокачественных опухолей в костном мозге вызывают различные изменения, которые варьируются в зависимости от гистотипа первичной опухоли и набора мутаций в пуле циркулирующих опухолевых клеток, обладающих метастатическим потенциалом [1]. Опухоли выделяют примерно 3,2 × 106 клеток на грамм ткани в сутки, однако только 0,01% этих клеток выживают в условиях системного кровообращения и развиваются в метастазы [2, 3]. Фиксация опухолевых клеток в костном мозге на начальном этапе приводит к его перитрабекулярной инфильтрации, а в дальнейшем, по мере пролиферации, к развитию литического или пластического компонентов, морфология которых может также меняться из-за эффектов лечения и вторичного ремоделирования кости [4, 5]. Известно, что медиана выживаемости после диагностики явных скелетных метастазов составляет примерно 2–3 года, но также зависит от многочисленных факторов прогноза [6]. Раннее выявление пациентов с костными метастазами имеет решающее значение, если необходимо наилучшим образом использовать варианты лечения для смещения баланса от паллиативного лечения к профилактике осложнений (сдавления спинного мозга и патологических переломов), тем самым поддерживая качество жизни пациентов [7].
Для обнаружения метастазов в костях доступно множество современных методов медицинской визуализации, таких как остеосцинтиграфия, ПЭТ-КТ, КТ и мультипараметрическая МРТ [8–10]. Однако стоимость, доступность и опыт могут варьироваться в зависимости от региона, а это означает, что пациенты могут не иметь доступа к регулярному высокочувствительному скринингу [11]. При этом отсутствие четких границ поражения, наличие параллельно идущих патологических процессов резорбции и костеообразования, наличие смежных хронических изменений опорно-двигательного аппарата, затрудняет диагностику метастазов в кости на всех этапах. Доказанная высокая эффективность МРТ в выявлении костных метастазов при отсутствии ионизирующего излучения заложила основу для широкого использования этого метода в диагностике костных изменений, и данная методика продолжает совершенствоваться [12, 13]. Значительный интерес сегодня представляет углубленный детальный анализ структуры кости, основанный на оценке воксельных карт изображений при различных патологиях по данным КТ и МРТ исследований [14, 15]. Предварительные исследования и эмпирический опыт показали, что на Т2ВИ отмечается большое разнообразие интенсивности МР-сигнала, что представляет значительный клинический и научный интерес, поскольку этот параметр, как и рестрикция диффузии выглядит повторяющимся в различных метастатических очагах из сходных первичных опухолей, а значит может быть использован как своеобразный перспективный комплексный МР-биомаркер. Анализ изображений по шкале градиента с последующей его математической и статистической обработкой показывает многообещающие результаты в первичной и дифференциальной диагностике изменений, однако наряду с этим содержат ряд нерешенных проблем, требующих разработки новых подходов, проведение большого количества исследований.
Цель исследования: изучить сигнальные характеристики метастазов в стандартных МР-протоколах в сопоставлении с коэффициентом структурной гетерогенности (КСГ) и коэффициентом диффузии (ADC) в аспекте ранней бездозовой диагностики метастатического поражения.
Материалы и методы
В исследование включены 86 соматически сохранных (индекс Карновского от 70% до 100%) онкологических больных с бессимптомным или малоболезненным (до 4 баллов по 10-бальной шкале) поражением костных структур с верифицированным злокачественным первичным новообразованием молочной железы (40 случаев), предстательной железы (15
случаев), рака почки (11 случаев), рака сигмовидной кишки (7 случаев), рака мочевого пузыря (4 случая), рака прямой кишки (3 случая), другие (6 случаев). Общие количество анализируемых метастатических очагов составило 86. Характер поражений был разделен по степени выраженности измененного сигнала патологического компонента, из них 15 случаев остеобластного поражения, 19 случаев преимущественно остеобластного, 26 случаев смешанного, 12 случаев преимущественно остеолитического и 14 случаев остеолитического поражения костных структур. Размеры метастазов, включенных в исследование, были от 7 мм до 30 мм. Также для расчёта показателей специфичности в качестве группы сравнения в исследование были включены 30 случаев неопухолевых изменений: 5 случаев реконверсии костного мозга, 15 случаев нормальной структуры костного мозга и 10 случаев жировой дегенерации костного мозга.
Методика анализа МР-сигнала заключалась в выделении зоны интереса ROI стандартной площадью 0,24–0,26 см2 с отображением значений в абсолютных безразмерных величинах уровня сигнала в режиме Т2ВИ. Измеряемый коэффициент диффузии (ИКД) измерялся по параметрам b=0–1000 с/мм2. Пример измерения представлен на рисунке 1.
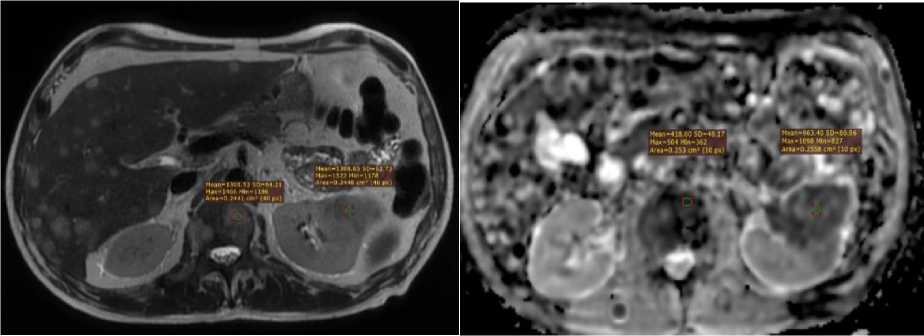
А Б
Рис. 1. Измерение коэффициента диффузии. (А) Зона интереса (ROI) на Т2ВИ в очаге метастатического поражения L1- позвонка при раке почки. (Б) Измерение интенсивности сигнала и квадратического отклонения (SD) на ADC- картах для расчета коэффициента структурной гетерогенности (КСГ).
Для повышения точности анализа текстуры мы предлагаем использовать дополнительный оригинальный показатель – коэффициент структурной гетерогенности (КСГ), который представляет собой отношение среднего квадратического отклонения интенсивности сигнала к самой интенсивности сигнала:
квадратическое отклонение КСГ= интенсивность сигнала
Физический смысл этого параметра заключается в том, что каждый пиксель плоского или воксель объемного изображения имеет сигнал, обусловленный свойствами ткани, а точнее химическим микроокружением протонов. Известно, что для различных тканей это микроокружение и количество протонов в единице объема различно. В ходе подготовки к исследованию установлено, что измерения интенсивности сигнала в отдельных участках изображения, а следовательно, и параметр КСГ на рабочей станции GE и в среде комплекса RadiAnt DICOM Viewer идентичны.
Исследования выполнялись на томографе Signa GE 1,5 Тл с использованием программного комплекса RadiAnt DICOM Viewer. Различия между значениями интенсивности сигнала в Т2 и карты ADC нормальной ткани и ткани поражения были проверены между контрольной группой (неметастатическими изменениями) и пациентами с вторичным поражением костных структур с использованием непарных t-тестов. Статистическая значимость была установлена на уровне p <0,05.
Результаты исследования
Общее количество полученных в исследовании измерений интенсивности сигнала при метастатическом поражении составило 86, в контрольную группу включены 30 измерений сигнала от костного мозга различных отделов скелета. Диапазон значений в Т2ВИ составил от 205 при остеобластическом типе поражения до 1483 при остеолитическом, диапазон значений ИКД составил от 0,49 при остеобластном типе поражения до 1,1 при преимущественно остеолитическом. Коэффициент структурной гетерогенности находился в диапазоне от 0,07 при смешанном типе до 0,23 при преимущественно остеобластом типе поражения. Усредненные параметры сигнальных характеристик в Т2 и ADC сведены в таблицу 1.
Таблица 1. Усредненные параметры измерений КСГ, ADC и интенсивности сигнала от метастазов
|
Тип метастаза или ткань |
Число измерений |
ИС в Т2 |
ADC x 10 -3 мм 2 /с |
КСГ |
|
Остеобластный |
15 |
227 |
0,51 |
0,14 |
|
Преимущественно остеобластный |
19 |
467 |
0,72 |
0,23 |
|
Смешанный |
26 |
653 |
1,03 |
0,11 |
|
Преимущественно остеолитический |
12 |
1071 |
1,13 |
0,14 |
|
Остеолитический |
14 |
1293 |
0,92 |
0,11 |
Обращает на себя внимание градиентное распределение значений интенсивности сигнала от остеобластных метастазов к остеолитическим, некоторая вариабельность значений ИС по Т2 при одинаковом типе поражения и первичной локализации ЗНО. Также интересным представляется тот факт, что одинаковые по типу поражения очаги при различных локализациях ЗНО имеют различия в параметрах ИС-Т2ВИ, ИКД и КСГ и узкий диапазон значений для жировой дегенерации костного мозга (Табл. 2).
Таблица 2. Усредненные параметры измерений КСГ, ADC и интенсивности сигнала от костного мозга
|
Тип метастаза или ткань |
Число измерений |
ИС в Т2 |
ADC 10-3мм2/с |
КСГ |
|
Реконверсия, красный костный мозг |
5 |
511 |
0,51 |
0,09 |
|
Нормальный костный мозг |
5 |
441 |
0,48 |
0,28 |
|
костей черепа |
||||
|
Нормальный костный мозг костей таза |
5 |
604 |
0,52 |
0,26 |
|
Нормальный костный мозг губчатых костей |
5 |
959 |
0,61 |
0,128 |
|
Желтый костный мозг костей черепа |
5 |
1138 |
0,48 |
0,1 |
|
Желтый костный мозг костей таза |
2 |
1061 |
0,51 |
0,004 |
|
Желтый костный мозг позвонков |
2 |
1199 |
0,54 |
0,003 |
|
Желтый костный мозг крестца |
1 |
1394 |
0,31 |
0,003 |
Гетерогенность и интенсивность сигнала от различных состояний костного мозга представлены на рисунке 2.
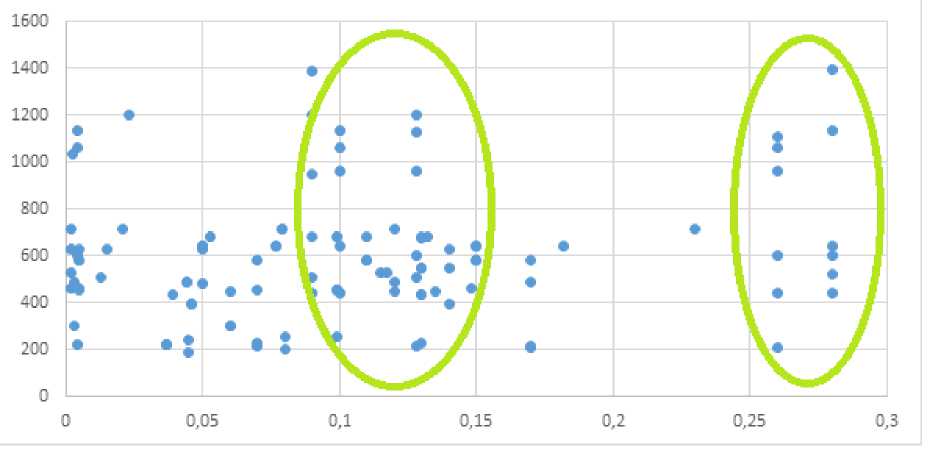
Рис. 2. Гетерогенность и интенсивность сигнала метастазов и костного мозга. По горизонтальной оси – интенсивность сигнала, по вертикальной – гетерогенность. В выделенных зеленым овалом областях сконцентрированы измерения от непораженного костного мозга.
В центральной части по оси гетерогенности на уровне 0,1–0,15 группируются измерения от красного костного мозга. На уровне 0,25–0,3 расположены значения от желтого костного мозга. Области группирующихся измерений интенсивности сигнала в левой части рисунка в координатах интенсивности от 200 до 550 представлены остеобластными метастазами; от 550 до 800 группируются измерения от смешанных метастатических очагов; от 1000 до 1400 определяются измерения от остеолитических метастазов.
Таким образом, структурная гетерогенность для различных типов метастатического поражения различна и становится наибольшей в группе пациентов со смешанными и остеолитическими метастатическими очагами. Они выстраиваются по интенсивности сигнала в градиент от гипоинтенсивных остеобластных, сгруппированных в области низкой интенсивности (от 200 до 550), до остеолитических очагов в области высоких значений интенсивности сигнала в Т2 (от 1000 до 1400). Наибольшую гетерогенность (0,28) демонстрирует здоровый красный костный мозг, а наименьшую (0,02) – мономорфная структура смешанного метастаза.
Гетерогенность и степень рестрикции диффузии от различных состояний костного мозга (Рис. 3) позволяют соотнести группу ограничивающих диффузию остеобластных и смешанных очагов в некоторый диапазон значений 0,49-1,1 х 10-3мм 2 /с. Медианное значение ADC для метастазов 0,77 х 10-3мм 2 /с, а медиана рестрикции для костного мозга 0,504 х 10 — 3мм2/с. Значение t-критерия Стьюдента: t Эмп = 6,6. Различия статистически значимы. Критическое значение t-критерия Стьюдента = 2,61, при уровне значимости p ≤0.01. Различия по коэффициенту структурной гетерогенности между метастазами и костным мозгом также статистически значимы, t Эмп = 3,2. Также выявлено достоверное различие между интенсивностью сигнала от метастазов и костного мозга, t Эмп = 8.4.
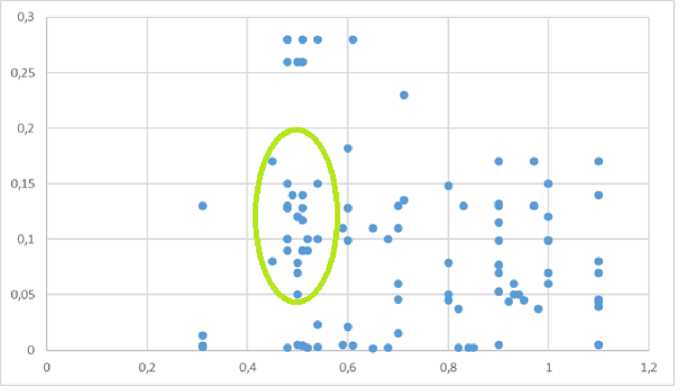
Рис. 3. Гетерогенность и степень рестрикции диффузии метастазов и костного мозга. Значения КСГ отложены на вертикальной оси. ADC отложен на горизонтальной оси. В выделенной зеленым овалом области сконцентрированы измерения от не поражённого костного мозга.
Распределение параметров различных видов метастазов представлено на рисунке 4. Распределение отражает низкие значения исчисляемого коэффициента рестрикции диффузии (ADC) в остеобластных метастазах с его повышением и нарастанием коэффициента структурной гетерогенности в направлении преимущественно остеолитических и смешанных очагов. Измерения интактного костного мозга расположены вокруг значений по шкале ADC на уровне 0,504 х 10-3мм2/с.
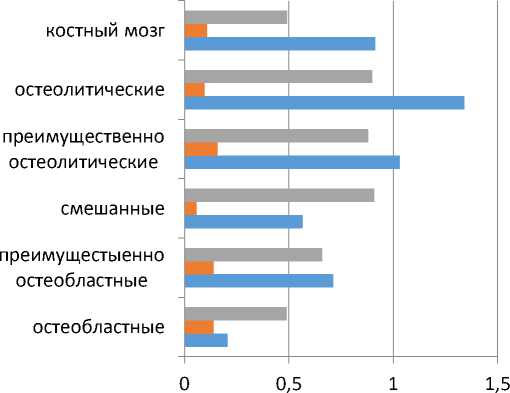
ADC
КСГ интенсивность сигнала
Рис. 4. Параметры различных состояний костного мозга в режимах измерения ADC и интенсивности сигнала, ADC в размерности 1 х 10 -3 мм2/с, интенсивность сигнала в 10 3 единиц, коэффициент структурной гетерогенности в долях от единицы.
Чистые типы метастазов (остеолитические и остеобластные) достоверно отличаются по сигнальным характеристикам между собой и от костного мозга. Таким образом, при расчете единого среднего показателя от всех исследованных метастазов и интактного костного мозга, можно прийти к следующим измеряемым параметрам, сведенным в таблицу 3.
Таблица 3. Суммарные усредненные параметры измерений КСГ, ADC и интенсивности сигнала от костного мозга и метастазов
|
Состояние |
ИС в Т2 |
ADC х 10 -3 мм2/с |
КСГ |
|
Костный мозг |
877,033 |
0,504 |
0,1413 |
|
Метастазы |
501,08 |
0,772 |
0,0874 |
Из показателей, приведенных в таблице 3 следует, что метастазы чаще гипоинтенсивны в Т2 в сравнении с костным мозгом, имеют несколько более высокие значения ADC, чем костный мозг и значительно отличаются по параметру КСГ за счет разрушения трабекулярных структур опухолевой тканью. Средний объем метастазов, включенных в исследование, составил 1,8 см3, что с учетом бессимптомности поражений и высокого функционального индекса Карновского у включенных в исследование пациентов, позволяет считать полученные данные перспективными для формирования также модели ранней диагностики. По результатам измерений наибольшей гетерогенностью обладают остеолитические метастазы с высокими значениями интенсивности сигнала в Т2, несколько меньшей – смешанные и остеобластные очаги. Диагностические показатели методики составили: чувствительность 81,82%, специфичность метода 90,03%, при этом точность достигла 87,1%; доверительный интервал (95%) от 79,89% до 92,44%. По мере накопления эмпирических данных мы ожидаем дальнейшего улучшения диагностических возможностей за счёт уточнения прогностической ценности метода комплексной оценки коэффициента структурной гетерогенности ADC и интенсивности сигнала в Т2, в также уточнение диагностической применимости методики.
Обсуждение
Особенностью нашего исследования является высокий вес в выборке метастазов рака сигмовидной кишки, который может быть скорректирован при увеличении выборки. Согласно крупному исследованию Roth с соавторами [16], ни у одного пациента с раком сигмовидной кишки не развились метастазы в кости без метастазов в печень и/или легкие. У 5,5% больных раком толстой кишки выявлялись костные метастазы на том или ином этапе. Это редкое, но не казуистическое явление для нашей выборки, так как большинство первично выявляемых случаев направляются на обзорные КТ и МРТ брюшной полости и полости таза. Несмотря на некоторые выявленные ограничения предлагаемой нами технологии (относительно большое количество измерений и вычислений, требовательность к внимательному выбору зон измерения сигнальных характеристик и ответственному выполнению расчетов), исследование продемонстрировало достаточно высокие показатели диагностической эффективности. При сравнении аналогичных работ с использованием магнитно-резонансной томографии в диагностике метастазов в кости, следуя данным метаанализа 15 исследований, включавших 1032 участника [17], объединенная оценка чувствительности составила 90,6%, а соответствующая объединенная оценка специфичности – 95,4%. По данным 7 исследований (723 участника) объединенная оценка чувствительности КТ для костных метастазов составила 72,9% (95% ДИ от 66,6 до 78,6%), а соответствующая объединенная оценка специфичности –94,8% (95% ДИ от 92,4 до 96,6%). Традиционная остеосцинтиграфия при костных метастазах также уступает методике с измерением структурной гетерогенности и ADC: суммарная оценка чувствительности – 86,0%, а соответствующая объединенная оценка специфичности – 81,4%; что также соотносится и с выполненными нами ранее исследовательскими работами и эмпирическими данными наблюдений авторов [18].
При внедрении автоматических систем для расчета КСГ в DICOM–инструменты возможно создание систем поддержки принятия решений рентгенологом на основе ADC и
КСГ, определяющих очаги поражения, их площадь, стратифицирующих риски патологического перелома в автоматическом режиме.
Выводы
Суммарный анализ количественных значений интенсивности Т2ВИ, ADC и КСГ может быть инструментом, предоставляющим условные радиологические биомаркеры для дифференциации доброкачественных изменений и злокачественных тканей. Введение коэффициента структурной гетерогенности и ADC демонстрирует воспроизводимый показатель, который можно использовать в рутинной практике и клинических испытаниях для оценки ответа на лечение без существенных дополнительных затрат. Сочетание измерения коэффициента структурной гетерогенности, измеряемого коэффициента диффузии и интенсивности сигнала в Т2-взвешенных изображениях позволяет дополнить нативное исследование ценными данными для интерпретации процессов, происходящих в костном мозге при метастатическом поражении.
Список литературы Возможности текстурного анализа изображений (коэффициента структурной гетерогенности и карт исчисляемого коэффициента диффузии) в дифференциальной диагностике метастатического поражения костей по данным магнитно-резонансной томографии
- Holen I., Nutter F., Wilkinson J.M., et al. Human breast cancer bone metastasis in vitro and in vivo: A novel 3D model system for studies of tumour cell-bone cell interactions. Clin Exp Metastasis. 2015. V. 32. P. 689-702. DOI: 10.1007/s10585-015-9737-y.
- Butler T.P., Gullino P.M. Quantitation of cell shedding into efferent blood of mammary adenocarcinoma. Cancer Res. 1975. V. 35. No. 3. P. 512-516.
- Schilling D., Todenhofer T., Hennenlotter J., et al. Isolated, disseminated and circulating tumour cells in prostate cancer. Nat Rev Urol. 2012. V. 9. No. 8. P. 448-463. DOI: 10.1038/nrurol.2012.136.
- Сергеев Н. И, Котляров П. М., Солодкий В. А. Стандарты анализа метастатического поражения костных структур по данным современных методов лучевой диагностики. Сибирский онкологический журнал. 2018. Т. 17. № 1. С. 5-10. DOI:10.21294/1814-4861-2018-17-1-5-10.
- Алиев М.Д., Степанова А.М., Мусаев Э.Р. и др. Метастатическое поражение позвоночника у больных раком молочной железы. Факторы прогноза. Сибирский онкологический журнал. 2015. Т. 1. № 3. С. 61-67.
- Jehn C.F., Diel I.J., Overkamp F., et al. Management of metastatic bone disease algorithms for diagnostics and treatment. Anticancer Res. 2016. V. 36. No. 6. P. 2631-2637.
- Padalkar P, Tow B. Predictors of survival in surgically treated patients of spinal metastasis. Indian J Orthop. 2011. V. 45. No. 4. P. 307-313. DOI: 10.4103/0019-5413.82333.
- Сергеев Н.И., Котляров П.М., Тепляков В.В., Солодкий В.А. Особенности применения методов диагностической визуализации в оценке результатов лечения метастазов в кости, Российский электронный журнал лучевой диагностики. 2021. Т.11. № 4. С. 8493. DOI: 10.21569/2222-7415-2021-11-4-84-93.
- Bratu A.M., Raica V.P., Salcianu I.A., et al. MRI differential diagnosis: bone metastases versus bone lesions due to malignant hemopathies. Romanian Journal of Morphology and Embryology - Revue Roumaine de Morphologie et Embryologie. 2017. V. 58. No. 4. P. 1217-1228.
- O'Sullivan G.J., Carty F.L., Cronin C.G. Imaging of bone metastasis: an update. World J Radiol. 2015. V. 7. No. 8. P. 202-211. DOI: 10.4329/wjr.v7.i8.202.
- Иозефи Д.Я., Джанелидзе Т.Д., Виндченко М.А. МРТ, СРКТ, рентгенография, ультрасонодоплерография в диагностике метастазов различных отделов скелета в оценке эффективности консервативной противоопухолевой терапии. Главврач Юга России. 2016. № 1 (48). С. 19-24.
- Oprea-Lager D.E., Cysouw C.F., BoellaardR., et al. Bone Metastases Are Measurable: The Role of Whole-Body MRI and Positron Emission Tomography. Front Oncol. 2021. V. 11. Article ID 772530. D0I:10.3389/fonc.2021.772530.
- Sollmann N., Baum T. Spine Imaging: Novel Image Acquisition Techniques and Analysis Tools. Diagnostics (Basel). 2022. V. 12. No. 6. Article ID 1361. DOI: 10.3390/diagnostics 12061361.
- Рипп В.О., Березовская Т.П., Иванов С.А. Объективные критерии МРТ-оценки эффективности лечения метастазов в кости у больных раком предстательной железы и раком молочной железы: систематический обзор и метаанализ. Digital Diagnostics. 2021. Т. 2. No. 3. С. 289-300. DOI: 10.17816/DD77311.
- Sollmann N., Becherucci E.A., Boehm C., et al. Texture Analysis Using CT and Chemical Shift Encoding-Based Water-Fat MRI Can Improve Differentiation Between Patients With and Without Osteoporotic Vertebral Fractures. Front Endocrinol (Lausanne). 2022. V. 4. Article ID 778537. DOI: 10.3389/fendo.2021.778537.
- Roth E.S., Fetzer D.T., Barron B.J., et al. Does colon cancer ever metastasize to bone first? a temporal analysis of colorectal cancer progression. BMC Cancer. 2009. V. 9. Article ID 274. DOI: 10.1186/1471-2407-9-274.
- Yang H.L., Liu T., Wang X.M., et al. Diagnosis of bone metastases: a meta-analysis comparing 18FDG PET, CT, MRI and bone scintigraphy. 2011. V. 21. No. 12. P. 26042617. DOI: 10.1007/s00330-011-2221-4.
- Сергеев Н.И., Фомин Д.К., Котляров П.М., Солодкий В.А. Сравнительное исследование возможностей офэкт/кт и магнитно-резонансной томографии всего тела в диагностике костных метастазов. Вестник Российского научного центра рентгенорадиологии. 2015. Т. 15. № 3. Адрес доступа http://vestnik.rncrr.ru/vestnik/v15/papers/sergeev v15-3.htm (дата доступа 20.08.22).


